文档内容
第四章 第一节 原子结构与元素周期表——高一化学人教版(2019)
必修第一册洞悉课后习题
学校:___________姓名:___________班级:___________考号:___________
一、填空题
1、在 中:
(1)______和______互为同位素;
(2)______和______的质量数相等,但不能互称同位素;
(3)______和______的中子数相等,但质子数不等,所以不是同一种元素。
2、下表显示了元素周期表中短周期的一部分,①~⑥代表6种短周期元素。
① ② ③
④ ⑤ ⑥
已知③与氢元素能组成生活中最常见的化合物X。请填写下列空白。
(1)与⑤同族的下一周期元素的原子结构示意图为________。
(2)④的单质与X反应的离子方程式为________。
(3)⑥的单质与X反应的化学方程式为________。
(4)①、②、③分别与氢元素组成含 10个电子的分子的化学式分别为________、
________、________。
3、在元素周期表中找到金、银、铜、铁、锌、钛的位置(周期和族),并指出这些元
素的核电荷数。
4、查阅元素周期表,从每个方格中可以得到哪些信息?以一种元素为例,将你获得的
信息用图表示出来。
5、寻找你家中的食品、调味品、洗涤剂及清洁剂等,查找标签或说明书,看一看成分
表中有哪些元素,找到这些元素在周期表中的位置。查阅哪些物品中含有钠元素和钙
元素,并试着向你的家人描述它们的一些性质或在食品中的作用。
6、根据下列叙述,写出元素名称并画出原子结构示意图。
信息 元素名称 原子结构示意图
A元素原子核外M层电子数
是L层电子数的一半B元素原子最外层电子数是次
外层电子数的1.5倍
C元素+1价离子 的电子层
排布与Ne相同
D元素原子次外层电子数是最
外层电子数的
7、画出下列元素的原子结构示意图:
(1)某原子核内没有中子的元素:_________________。
(2)质量数为23,中子数为12的原子:___________________。
(3)某元素的原子L层电子数是M层电子数的2倍:_____________。
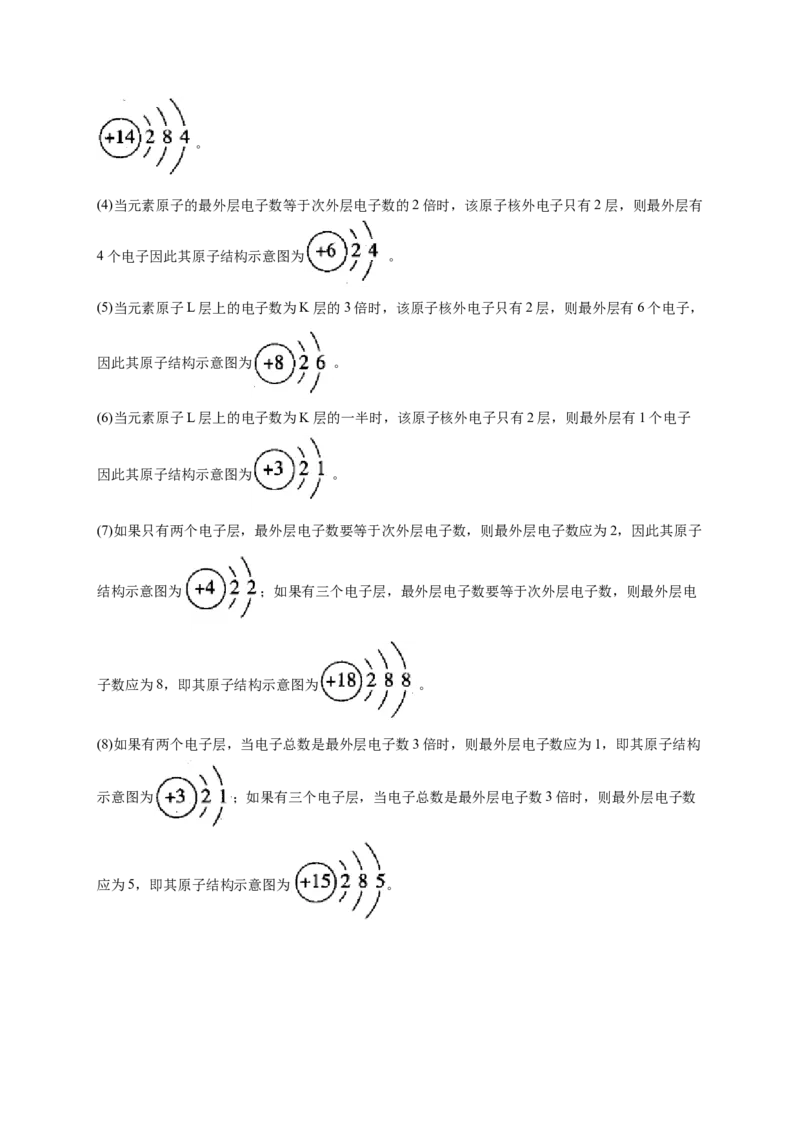
(4)某元素原子的最外层电子数等于次外层电子数的2倍:_________________。
(5)某元素原子L层上的电子数为K层的3倍:___________________。
(6)某元素原子L层上的电子数为K层的一半:_________________。
(7)某元素原子的最外层电子数等于次外层电子数:_______________。
(8)电子总数是最外层电子数3倍的原子:___________________。
8、结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
(2)表中所列元素,属于短周期元素的有_______________,属于主族元素的有_______________;g
元素位于第_____________周期______________族;i元素位于第_________________周期第
________________族。
(3)元素f是第___________周期第_____________族元素,请在如下方框中按氦元素的式样写出该元
素的原子序数、元素符号、元素名称、相对原子质量。(4)元素在元素周期表中的位置与元素原子结构的关系为___________________。
二、单选题
9、考古学上常用 来测定文物的年代。 的原子核内中子数是( )。
A.6 B.8 C.14 D.20
10、下列关于F、Cl、Br、I的比较,不正确的是( )。
A.它们的原子核外电子层数随核电荷数的增加而增多
B.单质的氧化性随核电荷数的增加而减弱
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的颜色随核电荷数的增加而加深
11、2016年IUPAC将第117号元素命名为Ts(中文名“ ”,音tion),Ts的最外
层电子数是7。下列说法中,不正确的是( )。
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts,其核素符号是
12、“碳达峰”“碳中和”成为全国两会的热词。下列有关 和 的说法中正确的是( )
A. 和 的质子数相同,互称为同位素
B. 和 的质量数相同,互称为同位素
C. 和 的质子数相同是同一种核素
D. 和 的核外电子数相同,中子数不同,不能互称为同位素
13、我国“玉兔”号月球车用 作为热源材料。关于 的叙述正确的是( )
A.质量数是94
B.质子数是145
C.中子数为239
D.核外电子数94
14、下列各组微粒具有相同的质子数和电子数的是( )
A.
B.
C.
HCl、F、H S
D. 2 2
15、下列说法中正确的是( )A.某单核微粒的核外电子排布为 ,则该微粒一定是氩原子
B.最外层只有3个电子的元素一定是金属元素
C. 与H O 具有相同的质子数和电子数
3
D.最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子
16、下列关于元素周期表的说法正确的是( )
A.每一周期都从碱金属元素开始,最后以稀有气体元素结束
B.第35号元素的单质在常温常压下是气体
C.元素周期表有7个横行,即7个周期,16个纵列,即16个族
D.元素周期表中第9列没有非金属元素
17、W、X、Y、Z为原子序数依次增大的短周期主族元素, 与Ne原子的电子层
结构相同,W、X、Y在元素周期表中的相对位置如图所示。下列有关叙述中正确的是
( )
W
X Y
A.W、Y形成的化合物与水反应生成的一定是强酸
B.元素Y、Z形成的简单离子电子层数相同
C.含元素Z的化合物都具有漂白性
D.W、X形成的化合物易溶于水
18、依据已知信息,下列对元素性质的预测或推理不合理的是( )
编号 已知信息 预测或推理
A 钠在空气中燃烧生成
锂在空气中燃烧生成
B 碘单质在常温下是固体 砹单质在常温下是固体
C NaOH是强碱 CsOH是更强的碱
D 钠在自然界中以化合态存在 Rb在自然界中以化合态存在
A.A B.B C.C D.D
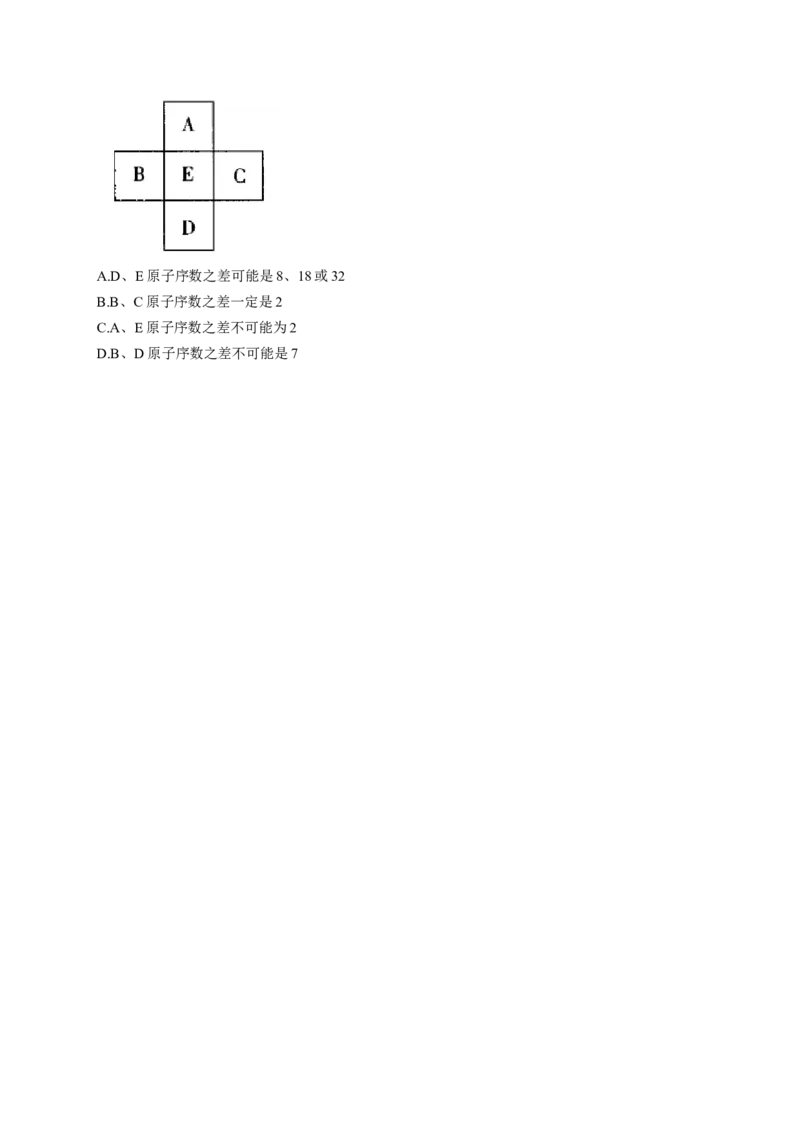
19、如图,A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和锕系)。下列说法不正
确的是( )A.D、E原子序数之差可能是8、18或32
B.B、C原子序数之差一定是2
C.A、E原子序数之差不可能为2
D.B、D原子序数之差不可能是7参考答案
1、
(1)答案: ;
解析:
(2)答案: ;
解析:
(3)答案: ;
解析:
【解析】
质子数相等而中子数不同的同一元素的不同原子互为同位素;质量数=质子数+中子数。
2、
(1)答案:
解析:
(2)答案:
解析:
(3)答案:
解析:
(4)答案:
;NH ;H O
3 2
解析:
【解析】
生活中最常见的含氢化合物为 ,则③为O。由元素在周期表中的相对位置关系可
推知,①为C,②为N,④为Na,⑤为Mg,⑥为Cl。
3、答案:
元素名称 金 银 铜 铁 锌 钛
在周期表 第六周期 第五周期 第四周期 第四周期 第四周期 第四周期
中的位置 第ⅠB族 第ⅠB族 第ⅠB族 第Ⅷ族 第ⅡB族 第ⅣB族核电荷数 79 47 29 26 30 22
解析:
4、答案:可获取的信息主要有元素在周期表中的位置、元素符号、元素名称、原子序
数、相对原子质量等。示例如图所示。
解析:
5、答案:提示:食品、调味品中含有的非金属元素主要有C、H、O、N、Cl等;金
属元素可能有Na、K、Fe、Ca等。洗涤剂、清洁剂中含有的元素主要有C、H、O、
Na等。
解析:
6、答案:硅; ;硼; ;钠; ;氧;
解析:L层有8个电子,则M层有4个电子,故A元素为硅元素,原子结构示意图为
。当次外层为K层时,B元素原子最外层电子数为3,是硼元素,原子结构示意
图为 ;当次外层为L层时,B元素原子最外层电子数为1.5×8=12,违背了
排布规律,故不可能。C元素原子的质子数为10+1=11,故为钠元素,原子结构示意图为
。当次外层为K层时,D元素为氧元素,原子结构示意图为 ;
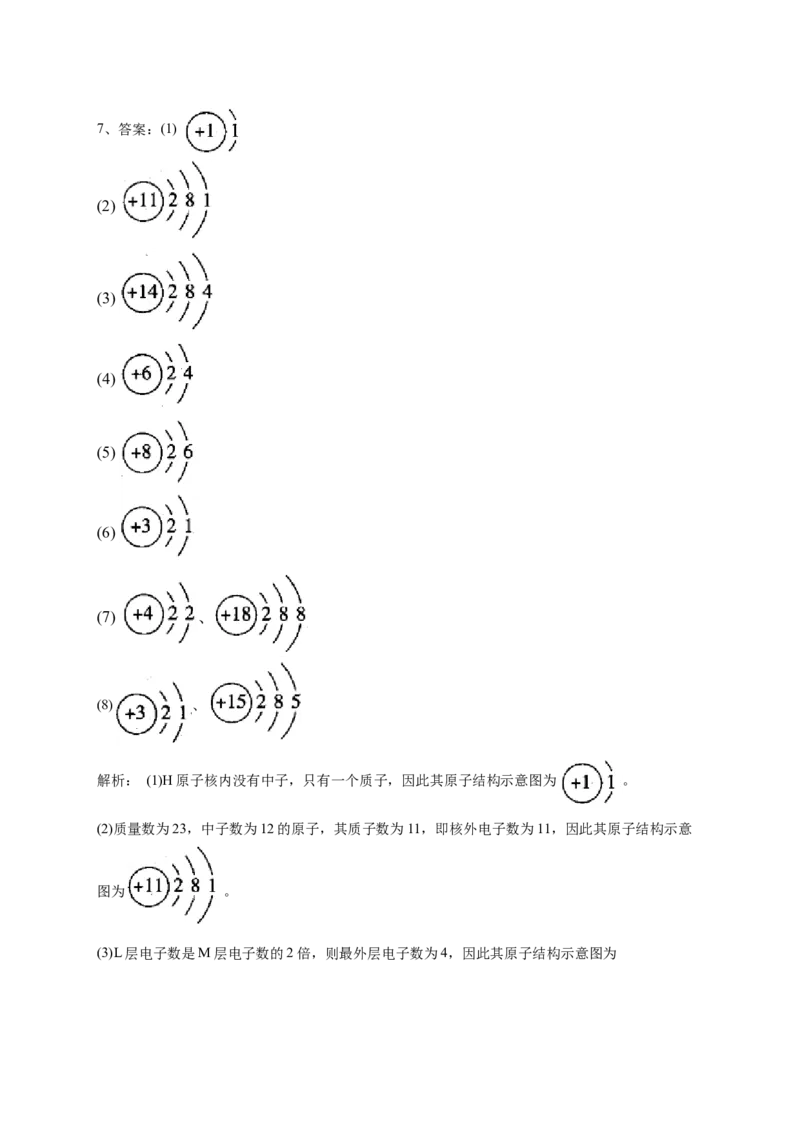
当次外层为L层时,最外层有24个电子,故不可能。7、答案:(1)
(2)
(3)
(4)
(5)
(6)
(7) 、
(8) 、
解析: (1)H原子核内没有中子,只有一个质子,因此其原子结构示意图为 。
(2)质量数为23,中子数为12的原子,其质子数为11,即核外电子数为11,因此其原子结构示意
图为 。
(3)L层电子数是M层电子数的2倍,则最外层电子数为4,因此其原子结构示意图为。
(4)当元素原子的最外层电子数等于次外层电子数的2倍时,该原子核外电子只有2层,则最外层有
4个电子因此其原子结构示意图为 。
(5)当元素原子L层上的电子数为K层的3倍时,该原子核外电子只有2层,则最外层有6个电子,
因此其原子结构示意图为 。
(6)当元素原子L层上的电子数为K层的一半时,该原子核外电子只有2层,则最外层有1个电子
因此其原子结构示意图为 。
(7)如果只有两个电子层,最外层电子数要等于次外层电子数,则最外层电子数应为2,因此其原子
结构示意图为 ;如果有三个电子层,最外层电子数要等于次外层电子数,则最外层电
子数应为8,即其原子结构示意图为 。
(8)如果有两个电子层,当电子总数是最外层电子数3倍时,则最外层电子数应为1,即其原子结构
示意图为 ;如果有三个电子层,当电子总数是最外层电子数3倍时,则最外层电子数
应为5,即其原子结构示意图为 。8、答案:(1)
(2) a 、d、e、f、g;a、b、c、d、e、f;三;0;四;ⅡB
(3) 三;ⅥA;如图。
(4)元素所在周期序数等于其原子的电子层数,元素所在的主族序数等于原子的最外层电子数
(或同一周期元素原子的电子层数相同,同一主族元素原子的最外层电子数相同)
解析:(1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期有8种元素,分列于第
1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列,由此可画出周期表的边界。
(3)第三周期第ⅥA族元素为硫,原子序数为16,相对原子质量为32。
9、答案:B
解析:
10、答案:C
解析:F、Cl、Br、I均属于卤素,随着核电荷数的递增,氢化物的稳定性逐渐减弱。
11、答案:D
解析:A对,117号元素位于第七周期,最外层电子数是7,位于第ⅦA族;B对,同
位素原子具有相同的质子数和电子数;C对,Ts是卤素中原子序数最大的非金属元素,
同族元素原子序数越大,元素的非金属性越弱;D错,中子数为176的Ts,其核素符
号为 。
12、答案:A
解析: 和 的质子数相同(核外电子数也相同),中子数不同,二者互为同位素,A正确、
D错误;二者的质量数分别为12和14,即质量数不相同,B错误;二者质子数相同,但中子数不
同,不是同一种核素,C错误。
13、答案:D解析: 的质量数为239,质子数为94,中子数为239-94=145,核外电子数=质子数=94。
14、答案:D
解析: 和 的质子数为9、电子数为10, 的质子数和电子数均为10,A错误; 的质
子数与电子数均为10, 的质子数为11、电子数为10, 的质子数为9,电子数为10,B错
误; 的质子数为11、电子数为10, 的质子数为11、电子数为10, 的质子数为9,
电子数为10,C错误; 的质子数和电子数均为18,D正确。
15、答案:C
解析:该单核粒子的核电荷数未知,不一定是氩原子,也可能为 等,A
错误;最外层只有3个电子的元素可能为非金属元素硼,B错误; 与 的质子
数均为11,电子数均为10,C正确;最外层电子数是次外层电子数2倍的元素为碳元
素,最外层有4个电子,既难得电子也难失电子,D错误。
16、答案:D
解析:第一周期从氢元素(非金属元素)开始,A错误;35号为溴元素, 常温下
为红棕色液体,B错误;元素周期表有18个纵列,16个族,C错误;元素周期表中第
9列属于过渡元素,都是金属元素,D正确。
17、答案:B
解析: 与Ne原子的电子层结构相同,则W为O;根据位置可知Y为S,X为
Al;W、X、Y、Z为原子序数依次增大的短周期主族元素,则Z为Cl。W、Y分别为
O、S,二者形成的化合物与水反应得到的不一定是强酸,如 与水反应生成 ,
是弱酸,A错误;Y、Z分别为S、Cl, 均有3个电子层,B正确;Z为
Cl,含有Cl的化合物不一定有漂白性,如NaCl无漂白性,C错误;W、X分别为O、
Al,二者形成的化合物为 , 难溶于水,D错误。
18、答案:A
解析:A钠金属性强于锂,锂在空气中燃烧生成 ,A错误;随着核电荷数增大,卤族元素的
单质熔、沸点逐渐升高,碘单质常温下是固体,则砹单质常温下也是固体,B正确;Cs的金属性
强于Na,CsOH是比NaOH更强的碱,C正确;Rb的金属性强于Na,钠元素在自然界中以化合态
存在,则Rb在自然界中也以化合态存在,D正确。
19、答案:A
解析:若A位于ⅢB元素之左,则A不可能是第二周期的Li、Be元素,因为若A为Li,则不存在
B,若A为Be,则不存在C,A不是第二周期元素,则E不是第三周期元素,由序数之差及只有第二、三两周期含8种元素知,D、E原子序数之差不可能为8,D、E原子序数之差可以是18或
32,若A位于ⅢB元素右侧,D、E原子序数之差也不可能为8,A项错误;B、C之间仅隔有一个
E元素,故其原子序数之差定为2,B项正确;由题给五种元素的位置关系可以看出,若A为氢元
素则其为周期表中最左侧一族,那么就不应有B,说明A不是氢元素,则A、E原子序数之差不可
能为2,C项正确;由于D、E原子序数之差可能是18或32,B、E相差1,且在E的左侧,因此
B、D原子序数之差为19或33,不可能相差7,D项正确。