文档内容
必修第一册 第四章 第三节 化学键 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 北京大学和中国科学院的化学工作者已成功研制出碱金属与 C 形成的球碳盐KC ,实验测知
60 3 60
该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A.KC 中只有离子键 B.KC 中不含共价键
3 60 3 60
C.该晶体在熔融状态下能导电 D.C 与12C互为同素异形体
60
2. 下列化学用语或命名正确的是( )
A.次氯酸的结构式:H—Cl—O B.含有10个中子的氧原子的符号:O
8
C.S2-的结构示意图: D.NH Cl的电子式:
4
3.下列过程中化学键没有被破坏的是( )
A.金刚石加热融化;NaCl颗粒被粉碎
B.NaOH、HCl、蔗糖溶于水
C.水电解得到氧气与氢气;NH HCO 中闻到了刺激性气味
4 3
D.水→冰;干冰和I 的升华
2
4.下列关于离子键、共价键的叙述中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl)中
2
C.在共价化合物分子内,一定不存在离子键
D.由多种元素组成的多原子分子里,一定只存在极性键
5. 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N 气体分子。N 分子结构如
4 4
图所示,下列说法正确的是
A.N 分子属于一种新型的化合物
4
B.N 分子中只含有非极性键
4
C.1 mol N 分子所含共价键数为4N
4 A
D.N 沸点比P(白磷)高
4 4
6. 反应NH Cl+NaNO ===NaCl+N↑+2HO放热且产生气体,可用于冬天石油开采。下列表示
4 2 2 2
反应中相关微粒的化学用语正确的是( )
A.中子数为18的氯原子:Cl B.N 的结构式:N==N
2
C.Na+的结构示意图: D.HO的电子式:
2
7. 氢化铵(NH H)与氯化铵的结构相似,又知它与水反应有气体生成。下列关于氢化铵叙述不正确的
4
是( )
A.是离子化合物,含有离子键和共价键
1
学科网(北京)股份有限公司B.电子式是
C.与水反应时,是还原剂
D.固体投入少量的水中,有两种气体产生
8. 在NH 和NH Cl存在的条件下,以活性碳为催化剂,用HO 氧化CoCl 溶液来制备化工产品
3 4 2 2 2
[Co(NH )]Cl ,下列表述正确的是( )
3 6 3
A.中子数为32,质子数为27的钴原子:Co
B.HO 的电子式:
2 2
C.NH 和NH Cl化学键类型相同
3 4
D.[Co(NH )]Cl 中Co的化合价是+3
3 6 3
9. 近年来,科学家合成了一系列具有独特化学性质的氢铝化合物(AlH ) ,常用作还原剂。已知最
3 n
简单的氢铝化合物的化学式为Al H ,它的熔点为150 ℃且熔融状态不导电,燃烧时放出大量
2 6
的热量。Al H 的球棍模型如图所示。下列说法正确的是( )
2 6
A.Al H 中Al元素为-3价,H元素为+1价
2 6
B.Al H 中含有离子键和极性共价键
2 6
C.Al H 为离子化合物
2 6
D.Al H 在空气中完全燃烧,产物为氧化铝和水
2 6
10. 一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、
Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF 中原子均为8电子稳定结构
3
二、填空题(本题包括5个小题,共60分)
11.(10分)下面是同学们熟悉的物质:①O ②金刚石 ③NaBr ④HSO ⑤NaCO
2 2 4 2 3
⑥NH Cl ⑦NaHSO ⑧Ne ⑨NaO ⑩NaOH
4 4 2 2
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含
有离子键的是________;不存在化学键的是________。
(2)属于共价化合物的是________;属于离子化合物的是________。
(3)将NaHSO 溶于水,破坏了NaHSO 中的________,写出其电离方程式__________________;
4 4
NaHSO 在熔融状态下电离,破坏了________,写出其电离方程式______________________。
4
12.(14分)过氧化氢(H O)又叫双氧水,其水溶液可用于制备工业上的漂白剂、特殊环境里
2 2
2
学科网(北京)股份有限公司燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化钠(Na O)可用于制备工业上的
2 2
漂白剂、实验室里的制氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团“O”由2个氧原子共
2
用1对电子形成。
(1)分别写出HO、NaO 的电子式:__________________、__________________。
2 2 2 2
(2)①HO、HO 中化学键的不同点是_________________________________。
2 2 2
②NaO、NaO 中化学键的不同点是_______________________________。
2 2 2
③HO 的化合物类型是________________(填“共价化合物”或“离子化合物”)。
2 2
(3)分别写出HO、NaO 作供氧剂的化学方程式:
2 2 2 2
HO:___________________________________________。
2 2
NaO:__________________________________________。
2 2
13.(14分)A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,
A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数
是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是________。
(3)A与B形成的三原子分子的电子式是________,B与D形成的原子个数比为1∶1的化合物
的电子式是________。
(4)A元素某氧化物与D元素某氧化物反应生成单质的化学方程式是 。
14. (10分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元
素可组成XH 、HZ和HW共价化合物;Y与氧元素可组成离子化合物YO和YO。
3 2 2 2 2
(1)Y O 中含有的化学键是________。
2 2
(2)用电子式表示YO的形成过程:____________________________。
2
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是________(填化
学式)。
(4)XH 、HZ和HW三种化合物,其中一种与另外两种都能反应的是________(填化学式)。
3 2
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水
可生成一种具有漂白性的化合物,试写出反应的化学方程式:_______________________________。
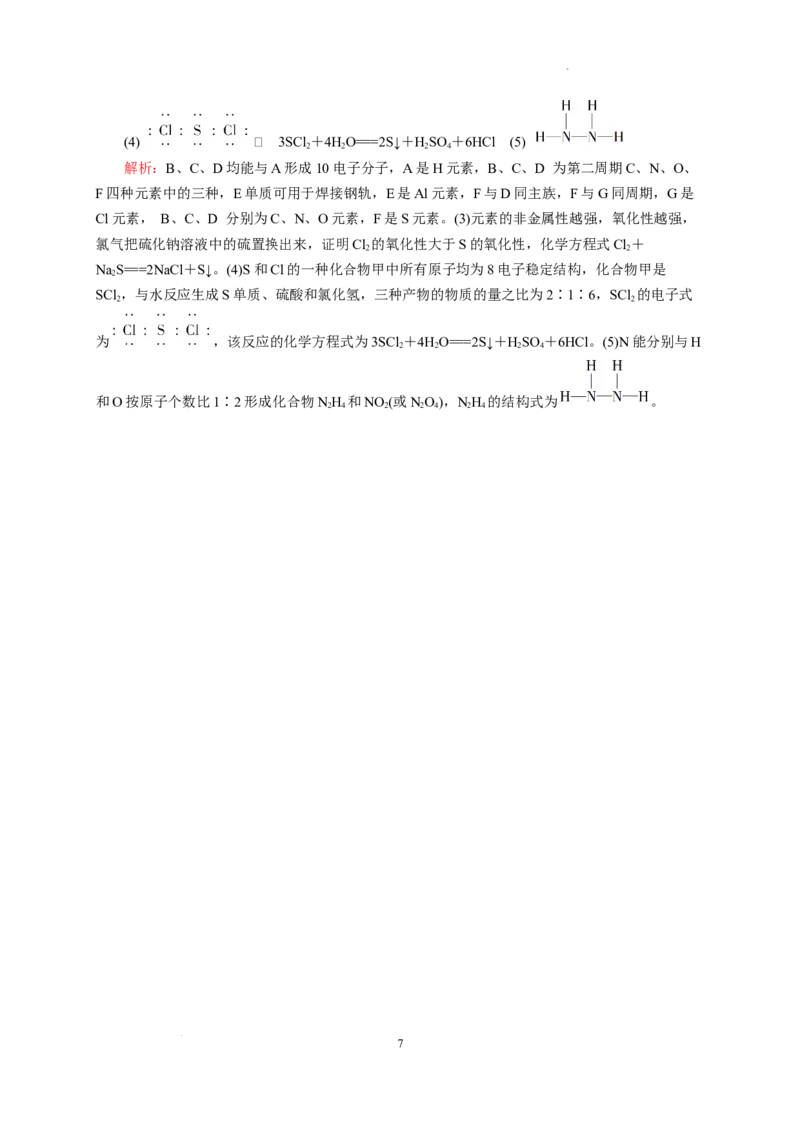
15.(12分)A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均
能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)F的离子结构示意图为________________。
(2)D、E、F的离子半径由大到小的顺序为_________________________(填离子符号)。
(3)写出能证明G比F非金属性强的一个化学方程式:_______________________。
3
学科网(北京)股份有限公司(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F
的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为____________,
该反应的化学方程式为_______________________________________。
(5)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为________________。
1.解析:选C C 中两个碳原子之间含有共价键,A、B项错误;C项,该晶体属于离子化合
60
物,熔融状态下能够导电,正确;D项,同素异形体研究的对象是单质,12C是原子,故错误。
2.解析:选B 次氯酸分子中含有1个H—O键和1个O—Cl键,其正确的结构式为H—O—
Cl,故A错误;氧原子的质子数为8,含有10个中子的氧原子的质量数为18,其表示方法为8O,
故B正确; 为硫原子结构示意图,S2-的质子数为16,核外电子数为18,各层电子数分别为
2、8、8,硫离子正确的结构示意图为 ,故C错误;氯化铵是离子化合物,由铵根离子与氯离
子构成,其电子式为
3.解析:选D 金刚石中的碳原子之间以共价键结合,加热融化,破坏共价键;NaCl是离子
晶体,在离子晶体中,阳离子周围有一定数目的阴离子,阴离子周围同样有一定数目的阳离子,在
阴阳离子间存在着离子键,NaCl颗粒被粉碎,断裂的晶面之间原来是靠大量离子键维系着的,现
在破裂了,破坏了离子键,故A不符合题意。NaOH中存在离子键和共价键,HCl中存在共价键,
NaOH溶于水发生电离,生成钠离子和氢氧根离子,破坏了离子键,HCl溶于水形成了盐酸,破坏
了共价键,蔗糖溶于水没有电离,没有破坏化学键,故B不符合题意。水电解得到氧气与氢气,水
分子中的共价键发生了断裂;NH HCO 中闻到了刺激性气味,是NH HCO 分解生成氨气、水和二
4 3 4 3
氧化碳,NH HCO 是离子晶体,在阴阳离子间存在着离子键,NH HCO 分解铵根离子和碳酸氢根
4 3 4 3
离子间的离子键发生了断裂,生成氨气、水和二氧化碳时共价键都发生了断裂,故 C不符合题意。
水、干冰、I 都是由分子构成的,水→冰;干冰和I 的升华破坏的是分子间作用力,化学键没有被
2 2
破坏,故D符合题意。
4. 解析:选C A项,NH Cl中存在共价键;B项,如HO 、CHCH 等分子中存在非极性键;
4 2 2 3 3
C项,共价化合物一定不含离子键;D项,HO、C H 等分子中存在非极性键。
2 2 2 6
5.解析:选B N 是单质不是化合物,A项错误;由同种元素原子形成的共价键为非极性键,
4
B项正确;由图可知,1 mol N 中含有6 mol N—N键,所以含有6N 个共价键,C项错误;相
4 A
同条件下,气体的沸点比固体低,故沸点P>N ,D项错误。
4 4
6.解析:选D A项,中子数为18的氯原子应表示为Cl,错误;B项,N 分子中N与N之间
2
形成三键,结构式为N≡N,错误;C项,Na+的结构示意图为 ,错误;D项,HO为共价化
2
4
学科网(北京)股份有限公司合物,每个H原子和O原子之间共用一个电子对,正确。
7.解析:选B 解析 对比NH Cl的结构可知,NH H的电子式应为 ,存在H—
4 4
N极性共价键和离子键,属于离子化合物;氢元素的化合价可标为NH+1H-1,所以NH H有很
4 4
强的还原性,可与HO发生反应:NH H+HO===NH·H O+H↑,若水少量,可放出NH 。
2 4 2 3 2 2 3
8.解析:选D A项,中子数为32,质子数为27的元素,质量数为27+32=59,表示为
Co,错误;B项,HO 为共价化合物,电子式为 ,错误;C项,NH 中只存在共价
2 2 3
键,NH Cl中既存在离子键又存在共价键,二者化学键类型不同,错误;D项,[Co(NH )]Cl 中,
4 3 6 3
NH 整体为0价,Cl为-1价,所以Co的化合价为+3,正确。
3
9.解析:选D 在Al H 中Al元素为+3价,H元素为-1价,A项错误;Al H 中含有的化学
2 6 2 6
键都是极性共价键,B项错误;Al H 为共价化合物,C项错误;Al H 在空气中完全燃烧,根据原
2 6 2 6
子守恒可知燃烧产物为氧化铝和水,D项正确。
10.解析:选D 一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素 W、
X、Y、Z的原子序数依次增大,且总和为24,根据图示,W为1价形成共价键,W为氢,Z为+1
价阳离子,Z为Na,Y为3价,Y为N,24−1−11−7=5,X为B元素。该化合物中,H、B、N之间
均以共用电子对形成共价键,故A正确;Na单质既能与水反应生成氢氧化钠和氢气,也能与甲醇
反应生成甲醇钠和氢气,故B正确;N的最高价氧化物的水化物HNO 为强酸,故C正确;B的氟
3
化物BF 中B原子最外层只有6个电子,达不到8电子稳定结构,故D错误;故选D。
3
11.答案 (1)①②④ ③ ⑤⑥⑦⑨⑩ ⑧
(2)④ ③⑤⑥⑦⑨⑩
(3)离子键和共价键 NaHSO===Na++H++SO
4
离子键 NaHSO===Na++HSO
4
解析 O 、金刚石中只含有共价键;HSO 只含有共价键,是共价化合物;NaBr中只含有离子
2 2 4
键,是离子化合物;NaCO 、NH Cl、NaHSO 、NaO 、NaOH中都是既含有离子键又含有共价
2 3 4 4 2 2
键的离子化合物;稀有气体Ne是单原子分子,不含任何化学键。NaHSO 溶于水电离时,Na+
4
与HSO之间的离子键被破坏,HSO中H+与SO之间的共价键也被破坏;而在熔融状态电离时
只断裂离子键。
12.答案 (1)HOOH Na+[OO]2-Na+
(2)①HO中没有非极性键,HO 中有非极性键
2 2 2
5
学科网(北京)股份有限公司②NaO中没有共价键,NaO 中有共价键(或非极性键)
2 2 2
③共价化合物
(3)2H O=====2HO+O↑
2 2 2 2
2NaO+2HO===4NaOH+O↑或2NaO+2CO===2Na CO+O
2 2 2 2 2 2 2 2 3 2
解析 HO 与NaO 中都含有过氧基“—O—O—”。题中告知“—O—O—”由2个O共用1对电
2 2 2 2
子形成,又知H的化合价为+1,则H与O之间共用1对电子,这样就可以写出HO 的电子式。
2 2
比较HO 与NaO ,Na的化合价也是+1,但Na与O之间的化学键应是离子键而不是共价键,
2 2 2 2
则NaO 是由“O”与“Na+”构成的。
2 2
回想HO、NaO的电子式,比较HO与HO、NaO与NaO 的电子式,可顺利完成有关问题。
2 2 2 2 2 2 2 2
13.答案 (1)C O Si Na (2)H O>CH>SiH
2 4 4
(4)2CO +2NaO===2Na CO+O
2 2 2 2 3 2
解析 已知A、B同一周期,A、C同主族,原子半径D>C>A>B,所以A、B、C、D在周期表
中相对位置如图所示。
A B
D C
又因为C原子最外层上的电子数是D原子最外层电子数的4倍,所以C为第三周期ⅣA族,D
为第三周期ⅠA族,从而可知C为硅,D为钠,进而可推知,A为碳。由于C原子核内质子数
等于A、B原子核内质子数之和,14=6+B,因此B为8,即为氧。
14. 答案 (1)离子键、共价键
(2)
(3)HNO (4)NH (5)NCl +3HO===3HClO+NH
3 3 3 2 3
解析 根据短周期元素Y可形成YO和YO 两种离子化合物可判断,Y为Na,由分子式XH 、
2 2 2 3
HZ和HW可知,X、Z、W分别属于第ⅤA、ⅥA、ⅦA三个主族,再由原子序数的关系判断,
2
X、Z、W分别为N、S、Cl。
15.答案:(1) (2)S2->O2->Al3+
(3)Cl +HS===2HCl+S↓(或Cl+NaS===2NaCl+S↓)
2 2 2 2
6
学科网(北京)股份有限公司(4) 3SCl +4HO===2S↓+HSO +6HCl (5)
2 2 2 4
解析:B、C、D均能与A形成10电子分子,A是H元素,B、C、D 为第二周期C、N、O、
F四种元素中的三种,E单质可用于焊接钢轨,E是Al元素,F与D同主族,F与G同周期,G是
Cl元素, B、C、D 分别为C、N、O元素,F是S元素。(3)元素的非金属性越强,氧化性越强,
氯气把硫化钠溶液中的硫置换出来,证明Cl 的氧化性大于S的氧化性,化学方程式Cl+
2 2
NaS===2NaCl+S↓。(4)S和Cl的一种化合物甲中所有原子均为8电子稳定结构,化合物甲是
2
SCl ,与水反应生成S单质、硫酸和氯化氢,三种产物的物质的量之比为2∶1∶6,SCl 的电子式
2 2
为 ,该反应的化学方程式为3SCl +4HO===2S↓+HSO +6HCl。(5)N能分别与H
2 2 2 4
和O按原子个数比1∶2形成化合物NH 和NO (或NO),NH 的结构式为 。
2 4 2 2 4 2 4
7
学科网(北京)股份有限公司8
学科网(北京)股份有限公司