文档内容
选择性必修1 第四章 第三节 金属的腐蚀与防护 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应:2Fe+O+2HO == 2Fe(OH)
2 2 2
B.钢构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
C.采用外加电流法时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
2. 下列关于金属腐蚀的说法正确的是( )
A.金属在潮湿空气中腐蚀的实质是M+nHO===M(OH) +H↑
2 n 2
B.金属化学腐蚀的实质是M-ne-===Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀
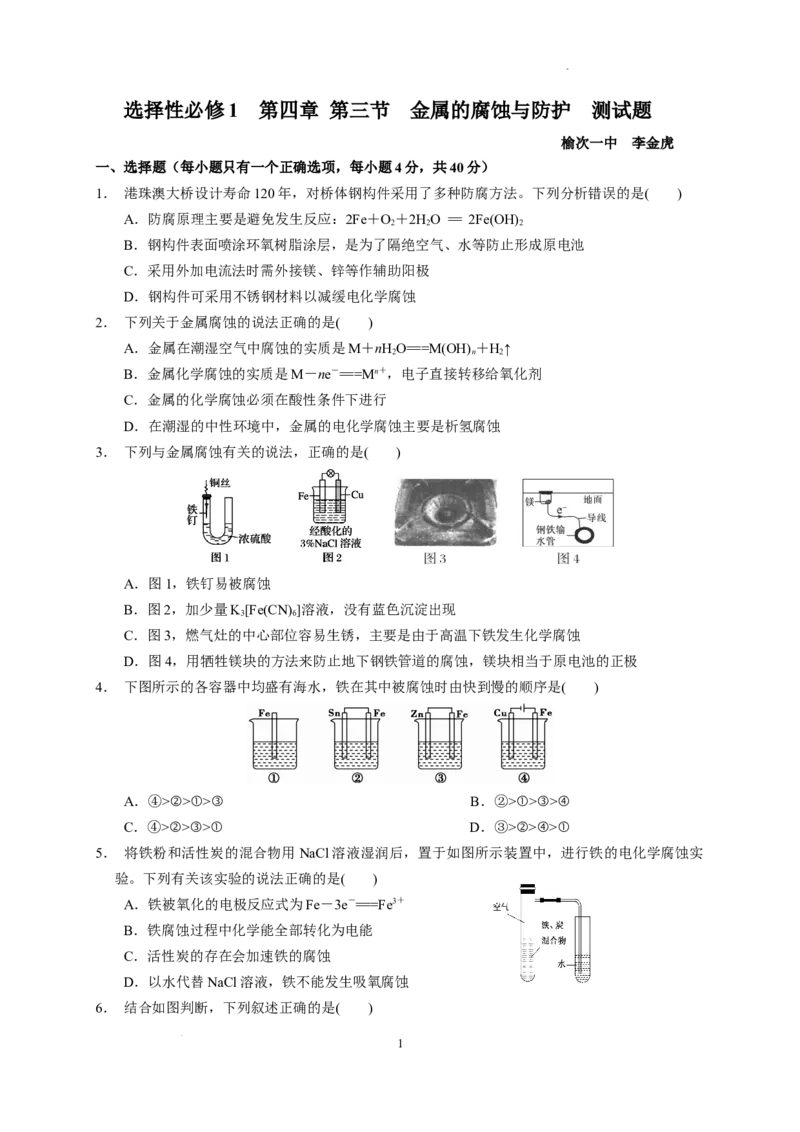
3. 下列与金属腐蚀有关的说法,正确的是( )
A.图1,铁钉易被腐蚀
B.图2,加少量K[Fe(CN) ]溶液,没有蓝色沉淀出现
3 6
C.图3,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
4. 下图所示的各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A.④>②>①>③ B.②>①>③>④
C.④>②>③>① D.③>②>④>①
5. 将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实
验。下列有关该实验的说法正确的是( )
A.铁被氧化的电极反应式为Fe-3e-===Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.活性炭的存在会加速铁的腐蚀
D.以水代替NaCl溶液,铁不能发生吸氧腐蚀
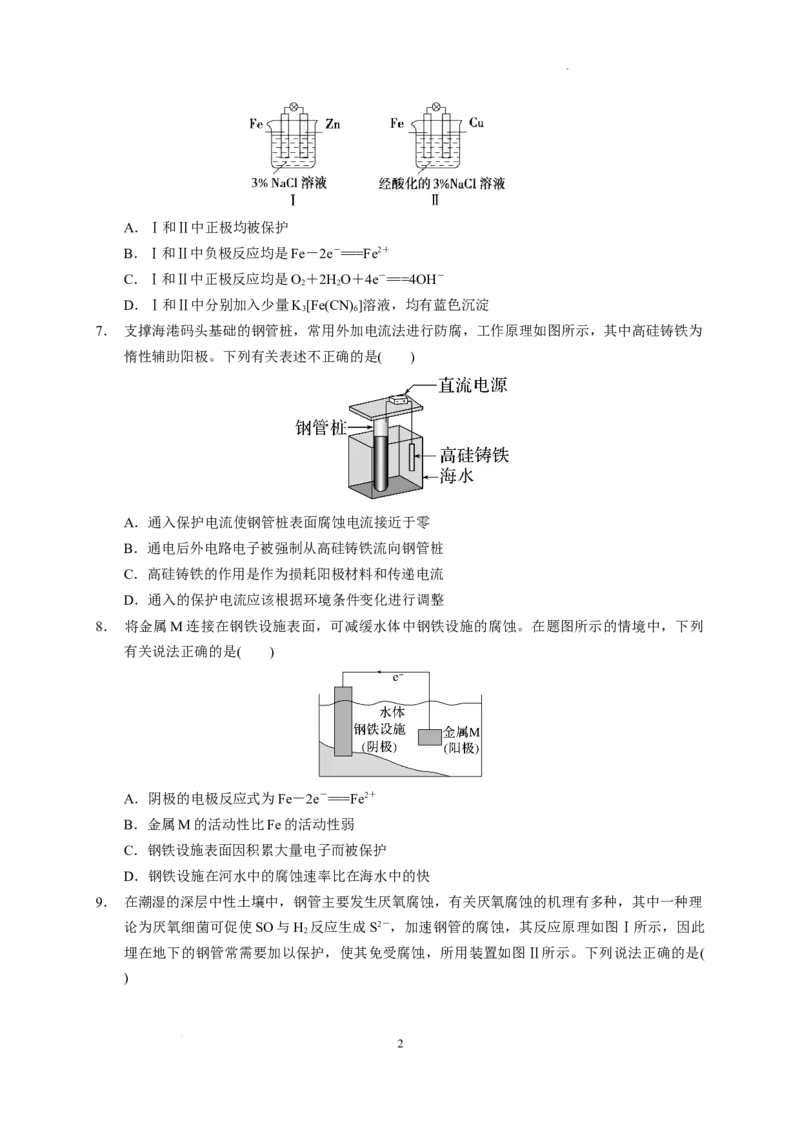
6. 结合如图判断,下列叙述正确的是( )
1
学科网(北京)股份有限公司A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+
C.Ⅰ和Ⅱ中正极反应均是O+2HO+4e-===4OH-
2 2
D.Ⅰ和Ⅱ中分别加入少量K[Fe(CN) ]溶液,均有蓝色沉淀
3 6
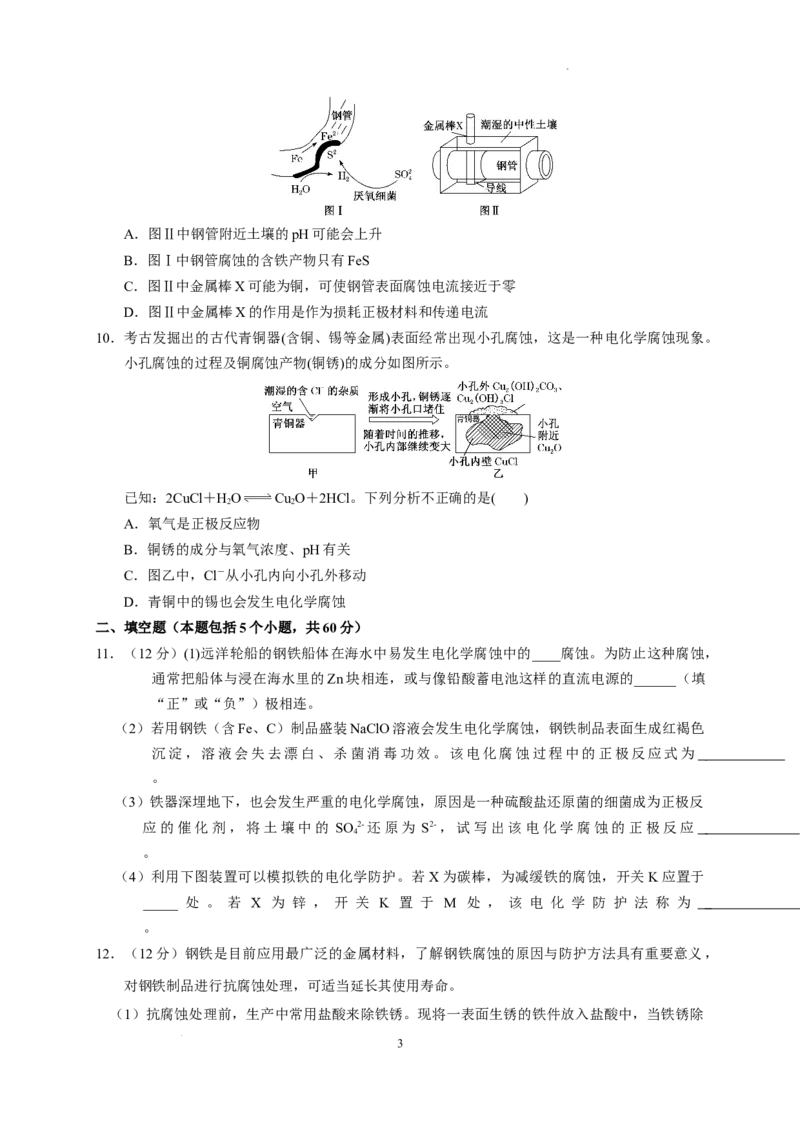
7. 支撑海港码头基础的钢管桩,常用外加电流法进行防腐,工作原理如图所示,其中高硅铸铁为
惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
8. 将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列
有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
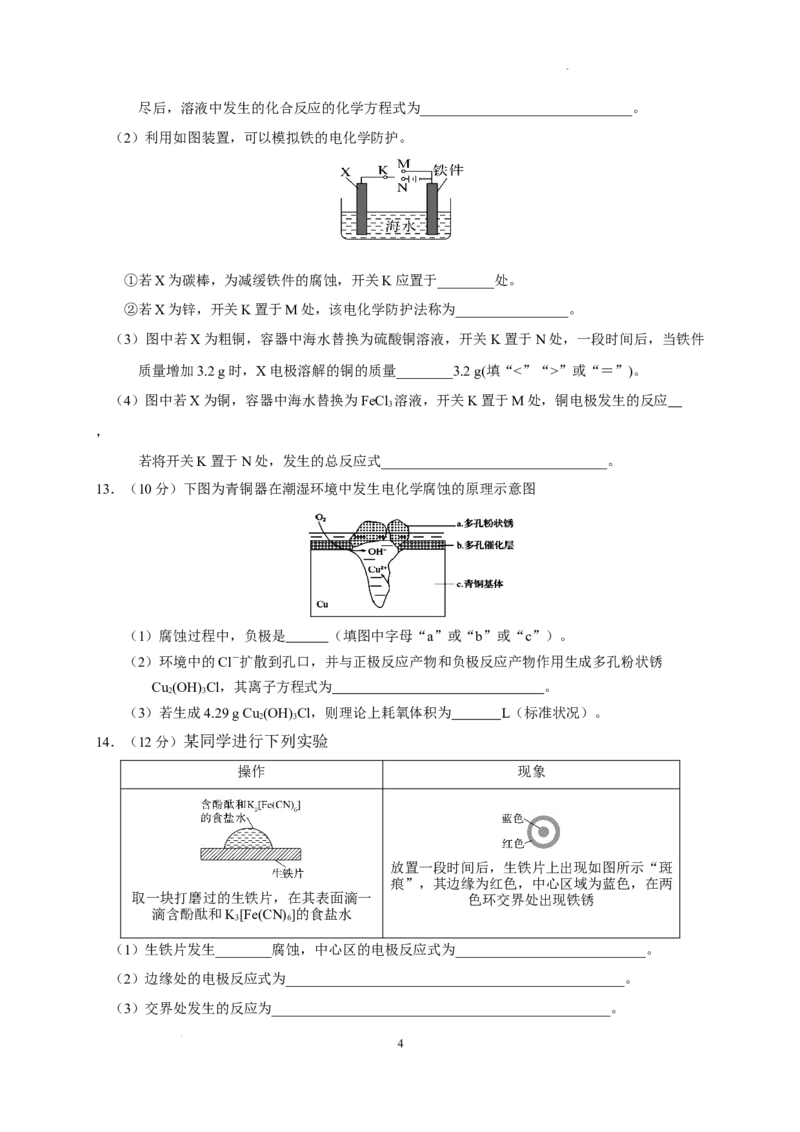
9. 在潮湿的深层中性土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理
论为厌氧细菌可促使SO与H 反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此
2
埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是(
)
2
学科网(北京)股份有限公司A.图Ⅱ中钢管附近土壤的pH可能会上升
B.图Ⅰ中钢管腐蚀的含铁产物只有FeS
C.图Ⅱ中金属棒X可能为铜,可使钢管表面腐蚀电流接近于零
D.图Ⅱ中金属棒X的作用是作为损耗正极材料和传递电流
10.考古发掘出的古代青铜器(含铜、锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。
小孔腐蚀的过程及铜腐蚀产物(铜锈)的成分如图所示。
已知:2CuCl+HO Cu O+2HCl。下列分析不正确的是( )
2 2
A.氧气是正极反应物
B.铜锈的成分与氧气浓度、pH有关
C.图乙中,Cl-从小孔内向小孔外移动
D.青铜中的锡也会发生电化学腐蚀
二、填空题(本题包括5个小题,共60分)
11.(12分)(1)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的____腐蚀。为防止这种腐蚀,
通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填
“正”或“负”)极相连。
(2)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色
沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中的正极反应式为
。
(3)铁器深埋地下,也会发生严重的电化学腐蚀,原因是一种硫酸盐还原菌的细菌成为正极反
应的催化剂,将土壤中的 SO 2-还原为 S2-,试写出该电化学腐蚀的正极反应
4
。
(4)利用下图装置可以模拟铁的电化学防护。若 X为碳棒,为减缓铁的腐蚀,开关K应置于
_____ 处 。 若 X 为 锌 , 开 关 K 置 于 M 处 , 该 电 化 学 防 护 法 称 为
。
12.(12分)钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,
对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除
3
学科网(北京)股份有限公司尽后,溶液中发生的化合反应的化学方程式为______________________________。
(2)利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________________。
(3)图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件
质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。
(4)图中若X为铜,容器中海水替换为FeCl 溶液,开关K置于M处,铜电极发生的反应
3
,
若将开关K置于N处,发生的总反应式________________________________。
13.(10分)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图
(1)腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”)。
(2)环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈
Cu (OH) Cl,其离子方程式为 。
2 3
(3)若生成4.29 g Cu (OH) Cl,则理论上耗氧体积为 L(标准状况)。
2 3
14.(12分)某同学进行下列实验
操作 现象
放置一段时间后,生铁片上出现如图所示“斑
痕”,其边缘为红色,中心区域为蓝色,在两
取一块打磨过的生铁片,在其表面滴一 色环交界处出现铁锈
滴含酚酞和K[Fe(CN) ]的食盐水
3 6
(1)生铁片发生________腐蚀,中心区的电极反应式为___________________________。
(2)边缘处的电极反应式为________________________________________________。
(3)交界处发生的反应为________________________________________________。
4
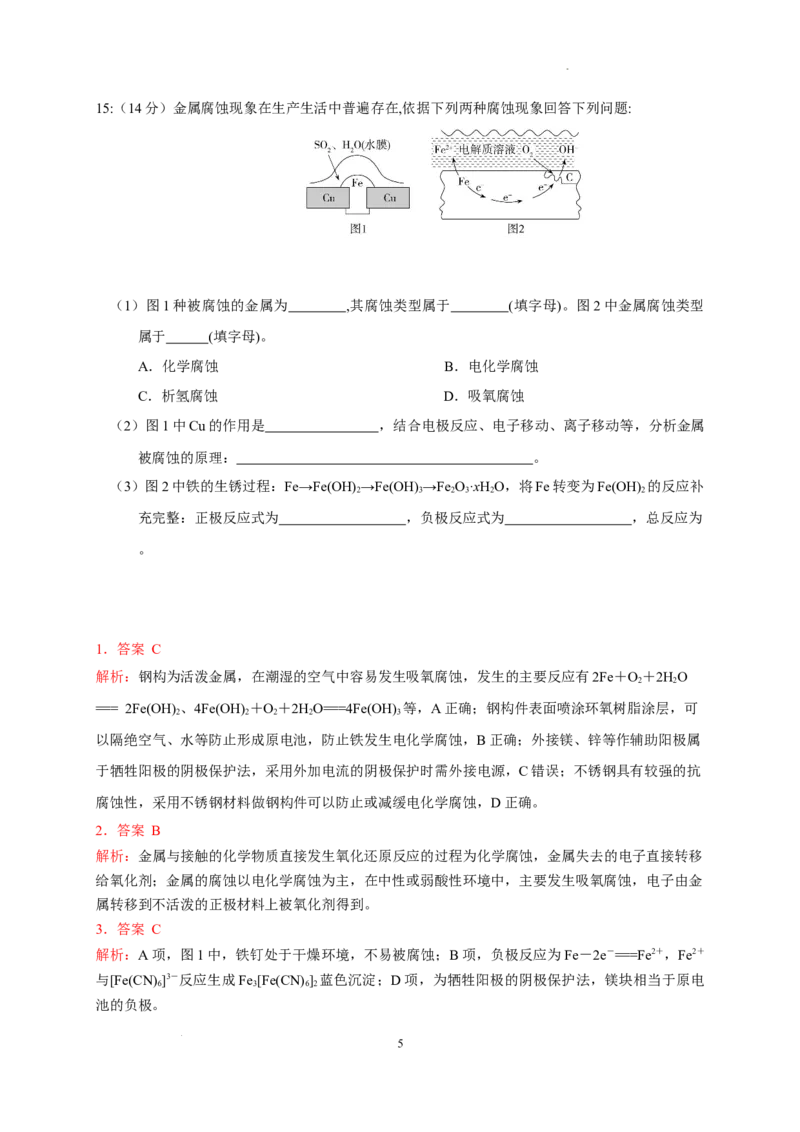
学科网(北京)股份有限公司15:(14分)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
(1)图1种被腐蚀的金属为 ,其腐蚀类型属于 (填字母)。图2中金属腐蚀类型
属于 (填字母)。
A.化学腐蚀 B.电化学腐蚀
C.析氢腐蚀 D.吸氧腐蚀
(2)图1中Cu的作用是 ,结合电极反应、电子移动、离子移动等,分析金属
被腐蚀的原理: 。
(3)图2中铁的生锈过程:Fe→Fe(OH) →Fe(OH) →Fe O·xHO,将Fe转变为Fe(OH) 的反应补
2 3 2 3 2 2
充完整:正极反应式为 ,负极反应式为 ,总反应为
。
1.答案 C
解析:钢构为活泼金属,在潮湿的空气中容易发生吸氧腐蚀,发生的主要反应有2Fe+O+2HO
2 2
=== 2Fe(OH) 、4Fe(OH) +O+2HO===4Fe(OH) 等,A正确;钢构件表面喷涂环氧树脂涂层,可
2 2 2 2 3
以隔绝空气、水等防止形成原电池,防止铁发生电化学腐蚀,B正确;外接镁、锌等作辅助阳极属
于牺牲阳极的阴极保护法,采用外加电流的阴极保护时需外接电源,C错误;不锈钢具有较强的抗
腐蚀性,采用不锈钢材料做钢构件可以防止或减缓电化学腐蚀,D正确。
2.答案 B
解析:金属与接触的化学物质直接发生氧化还原反应的过程为化学腐蚀,金属失去的电子直接转移
给氧化剂;金属的腐蚀以电化学腐蚀为主,在中性或弱酸性环境中,主要发生吸氧腐蚀,电子由金
属转移到不活泼的正极材料上被氧化剂得到。
3.答案 C
解析:A项,图1中,铁钉处于干燥环境,不易被腐蚀;B项,负极反应为Fe-2e-===Fe2+,Fe2+
与[Fe(CN) ]3-反应生成Fe [Fe(CN) ] 蓝色沉淀;D项,为牺牲阳极的阴极保护法,镁块相当于原电
6 3 6 2
池的负极。
5
学科网(北京)股份有限公司4.答案 A
解析:铁在海水中的腐蚀属于电化学腐蚀,当铁与比它活泼性差的 Sn相连时,Fe被腐蚀的速率增
大(比①大),与活泼性比其强的锌相连时,锌作负极,被腐蚀,铁被保护,其腐蚀的速率要比①小;
④为电解装置,Fe为阳极,发生氧化反应,铁腐蚀的速率最快。
5.答案 C
解析:根据实验所给条件可知,本题铁发生的是吸氧腐蚀,负极反应为Fe-2e-===Fe2+,正极反应
为O+2HO+4e-===4OH-,据此解题。在铁的电化学腐蚀中,铁单质失去电子转化为二价铁离子,
2 2
即负极反应式为Fe-2e-===Fe2+,故A错误;铁的腐蚀过程中化学能除了转化为电能,还有一部
分转化为热能,故B错误;活性炭与铁混合,在氯化钠溶液中构成了许多微小的原电池,加速了铁
的腐蚀,故C正确;以水代替氯化钠溶液,水也呈中性,铁在中性条件下易发生吸氧腐蚀,故D错
误。
6.答案 A
解析:两个装置均为原电池,负极都是活泼金属,根据原电池原理可知,原电池的正极金属受到保
护,A项正确;Ⅰ中负极为活泼金属Zn,B项错误;Ⅱ中是酸性溶液,电极反应中不能有OH-生
成,C项错误;Ⅰ中无Fe2+生成,不能生成铁氰化亚铁沉淀,D项错误。
7.答案 C
解析:钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁(阳极)
流向正极,从负极流向钢管桩(阴极),A、B正确;题给信息高硅铸铁为“惰性辅助阳极”不损耗,
C错误。
8.答案 C
解析:阴极得电子,A错误;金属M失电子,其活动性应比铁强,B错误;M失去的电子流入钢铁
设施表面,因积累大量电子而被保护,C正确;海水中所含电解质的浓度远大于河水中的,因此钢
铁设施在海水中腐蚀的速率快,D错误。
9.答案 A
解析:选A 题图Ⅱ中没有外加电源,采用的是牺牲阳极的阴极保护法,根据原电池原理,金属棒
X应作负极,金属棒X的活泼性应大于铁,才能保护钢管,使其免受腐蚀,若金属棒X是铜,则形
成FeCu原电池,会加速铁的腐蚀;题图Ⅱ中钢管作正极,正极上HO发生还原反应生成H ,电极
2 2
反应式为2HO+2e-===2OH-+H↑,故钢管附近土壤中的c(OH-)会增大,pH可能会上升,A正
2 2
确,C错误。题图Ⅰ钢管腐蚀的过程中,负极上Fe失去电子发生氧化反应生成的Fe2+与正极周围
的S2-和OH-反应分别生成FeS和Fe(OH) ,B错误。由上述分析可知,金属棒X应作负极,D错
2
误。
0.答案 C
解析:青铜器中含铜、锡等金属,也含有其他金属及非金属杂质,由于物质金属性不同,周围存在
电解质溶液,形成了原电池,由于电解质溶液显中性,发生吸氧腐蚀,正极上氧气发生得电子的还
原反应生成OH-,因此氧气是正极反应物,A正确;根据图乙可知,在锈蚀小孔外铜锈成分为
Cu (OH) CO 、Cu (OH) Cl,Cu元素化合价为+2价,在小孔附近铜锈是Cu O,小孔内壁铜锈成分
2 2 3 2 3 2
是CuCl,Cu元素化合价为+1价,小孔外氧气浓度大,Cu元素价态高,小孔内氧气浓度小,Cu元
6
学科网(北京)股份有限公司素价态低,铜锈成分与氧气浓度有关,在溶液酸性较强时可逆反应2CuCl+HOCu O+2HCl的
2 2
平衡逆向移动,铜锈成分主要是CuCl,若溶液酸性弱,平衡正向移动,铜锈成分主要是 Cu O,可
2
见铜锈成分也与溶液的pH有关,B正确;由CuCl是在小孔内壁生成,可知Cl-会从小孔外向小孔
内移动,C错误;由于Sn的金属性比Cu强,与Cu构成原电池时,Sn作负极,被氧化而发生电化
学腐蚀,D正确。
11.答案:(1)吸氧腐蚀 负
(2)ClO-+HO+2e-===Cl-+2OH-
2
(3)SO+8e-+4HO===S2-+8OH-
2
(4)N 牺牲阳极的阴极保护法
解析:(1)海水呈弱碱性,故轮船的钢铁船体在海水中易发生吸氧腐蚀,钢铁与外接电源负极相
连,充当电解池的阴极,得到保护。
(2)ClO-在正极得电子生成Cl-和OH-,故正极电极反应式为ClO-+HO+2e-==2OH-+Cl
2
-。
(3)硫酸根在阴极的电子的方程式为SO+8e-+4HO===S2-+8OH-
2
(4)若X为碳棒,则只能用外加电源的阴极保护法,此时 K应置于N处。若X为Zn, K
置于M处,其保护原理称为牺牲阳极的阴极保护法。
12. 答案 (1)Fe+2FeCl ===3FeCl
3 2
(2)①N ②牺牲阳极的阴极保护法
(3)<
(4)2Fe3++2e-===2Fe2+ Cu+2Fe3+===2Fe2++Cu2+
解析: (1)铁锈的成分为Fe O ,能和盐酸反应生成FeCl 和水,当铁锈除尽后,溶液中发生的化
2 3 3
合反应的化学方程式为Fe+2FeCl ===3FeCl 。
3 2
(2)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极即连接电源的负
极,故K连接N处。②若X为锌,开关K置于M处,Zn为阳极被腐蚀,Fe为阴极被保护,该防
护法称为牺牲阳极的阴极保护法。
(3)若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加
3.2 g时,由于粗铜中有杂质参加反应,所以X电极溶解的铜的质量<3.2 g。
(4)若X为铜,容器中海水替换为FeCl 溶液,开关K置于M处,此时构成原电池装置,铜电极为
3
正极,发生的反应式:2Fe3++2e-===2Fe2+;若将开关K置于N处,此时构成电解池装置,铜为阳
极,铜本身被氧化而溶解,阴极铁离子被还原,发生的总反应式:Cu+2Fe3+===2Fe2++Cu2+。
13.答案: (1)c
(2)2Cu2++3OH-+Cl-===Cu (OH) Cl↓
2 3
(3)0.448
解析:(1)铜为负极被腐蚀生成Cu2+,正极氧气得电子生成OH-。
7
学科网(北京)股份有限公司(2)正极反应产物为OH-,负极反应产物为Cu2+,与Cl-作用生成Cu (OH) Cl。
2 3
14.答案:(1)吸氧 Fe-2e-===Fe2+
(2)O+2HO+4e-===4OH-
2 2
(3)4Fe(OH) +O+2HO===4Fe(OH) 、2Fe(OH) ===Fe O·xHO+(3-x)H O
2 2 2 3 3 2 3 2 2
15.答案 (1)铁或Fe BC BD
(2)作正极材料,导电 铜作正极,氢离子在内电路移向正极,得到电子,生成氢气;铁作
负极,失去电子,电子从负极移向正极,金属铁被腐蚀生成亚铁离子。
(3)O +4e-+2H O 4OH- 2Fe-4e- 2Fe2+ 2Fe+O +2H O 2Fe(OH)
2 2 2 2 2
解析: (1)析氢腐蚀发生条件为较强酸性环境,图1中水膜为二氧化硫的水溶液,酸性较强,铁发生析
氢腐蚀;图2中发生吸氧腐蚀。
(3)图2发生吸氧腐蚀,正极氧气得电子,电极反应式为O+4e-+2H O 4OH-,负极为铁失电子,电极
2 2
反应式为2Fe-4e- 2Fe2+,总反应为2Fe+O +2H O 2Fe(OH) 。
2 2 2
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司