文档内容
第四章 第三节 金属的腐蚀与防护 测试题
榆次一中 李金虎
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
1. 下列有关金属腐蚀的说法正确的是( )
A.金属腐蚀是指不纯金属接触电解质溶液进行化学反应而损耗的过程
B.电化学腐蚀是指在外加电流的作用下,不纯金属发生化学反应而损耗的过程
C.钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气最终转化为铁锈
D.电化学腐蚀伴有电流产生
2. 以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁芯(几乎为纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌长期放置后其奖牌的表面变暗
3. 下列有关金属保护的说法中正确的是( )
A.快餐杯表面有一层搪瓷,搪瓷层破损后仍能起到防止铁生锈的作用
B.白铁(镀锌铁)镀层破损后,铁皮的腐蚀速率很小
C.轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阴极的阳极保护法
D.钢铁制成的暖气管道外常涂有一层沥青,这是利用了钢铁的电化学保护法
4. 钢铁生锈过程发生如下反应:
①2Fe+O+2HO===2Fe(OH) ;
2 2 2
②4Fe(OH) +O+2HO===4Fe(OH) ;
2 2 2 3
③2Fe(OH) ===Fe O+3HO。
3 2 3 2
下列说法正确的是( )
A.反应①②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
5. 为了防止钢铁锈蚀,下列防护方法中正确的是( )
A.在精密机床的铁床上安装铜螺钉
B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中
C.在海轮舷上用铁丝系住锌板浸在海水里
D.在地下输油的铸铁管上接直流电源的正极
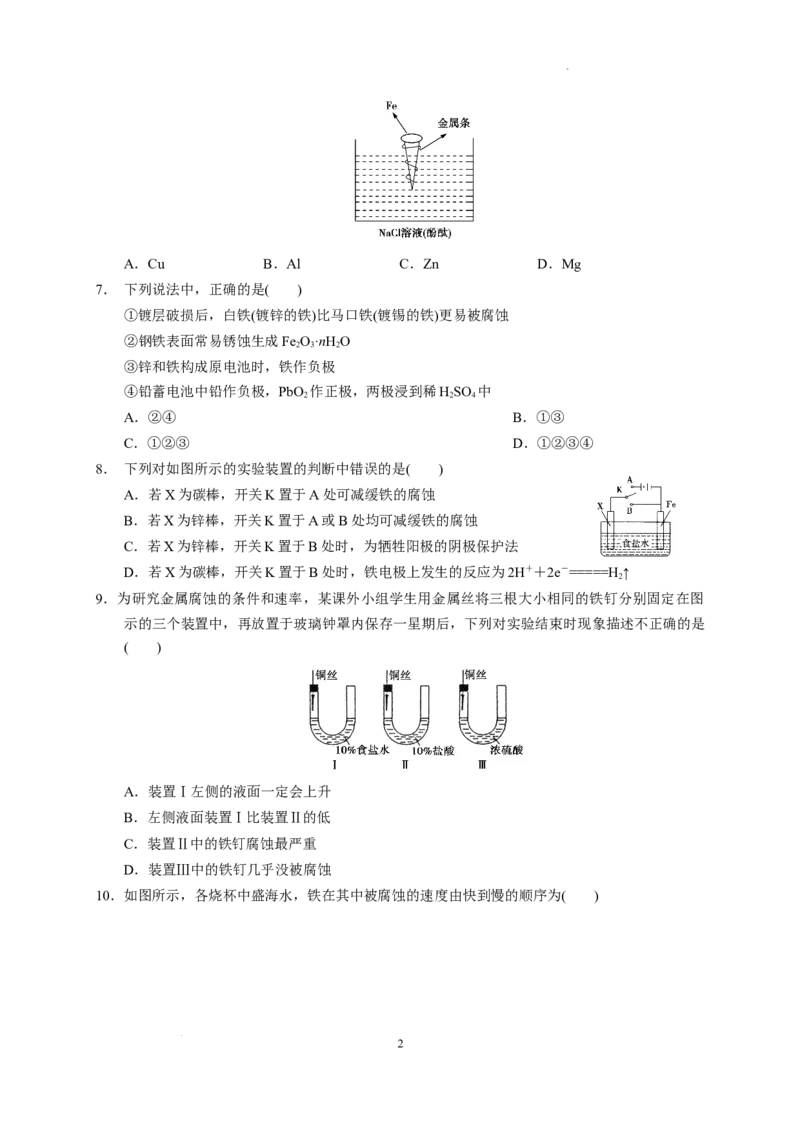
6.如图,拴上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到贴近金属条一边的溶液出现粉
红色,该金属条可能是( )
1
学科网(北京)股份有限公司A.Cu B.Al C.Zn D.Mg
7. 下列说法中,正确的是( )
①镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀
②钢铁表面常易锈蚀生成Fe O·nHO
2 3 2
③锌和铁构成原电池时,铁作负极
④铅蓄电池中铅作负极,PbO 作正极,两极浸到稀HSO 中
2 2 4
A.②④ B.①③
C.①②③ D.①②③④
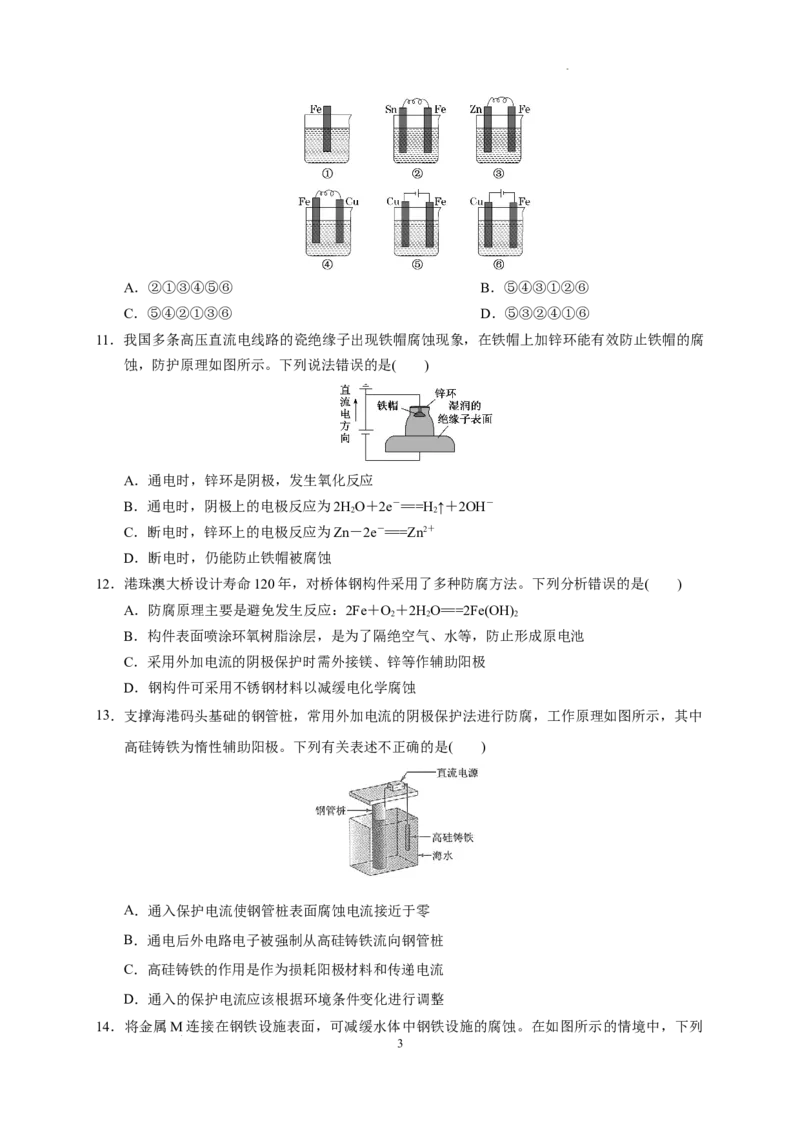
8. 下列对如图所示的实验装置的判断中错误的是( )
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=====H↑
2
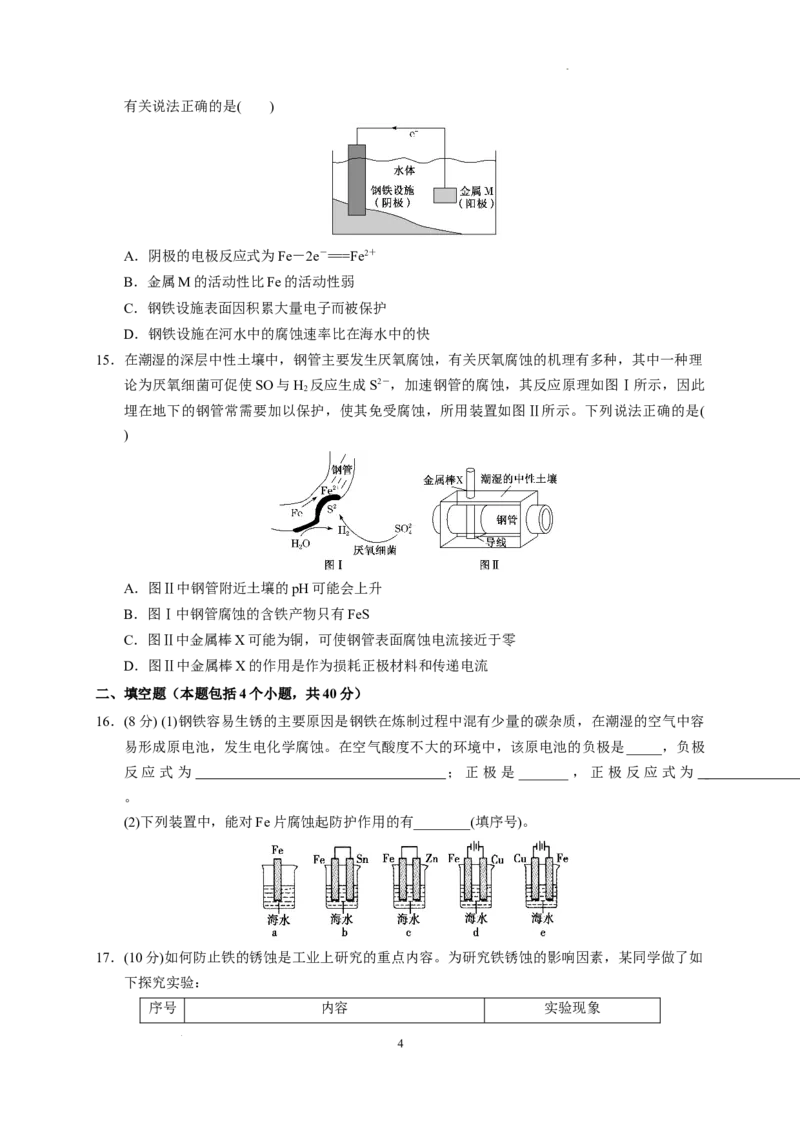
9.为研究金属腐蚀的条件和速率,某课外小组学生用金属丝将三根大小相同的铁钉分别固定在图
示的三个装置中,再放置于玻璃钟罩内保存一星期后,下列对实验结束时现象描述不正确的是
( )
A.装置Ⅰ左侧的液面一定会上升
B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀
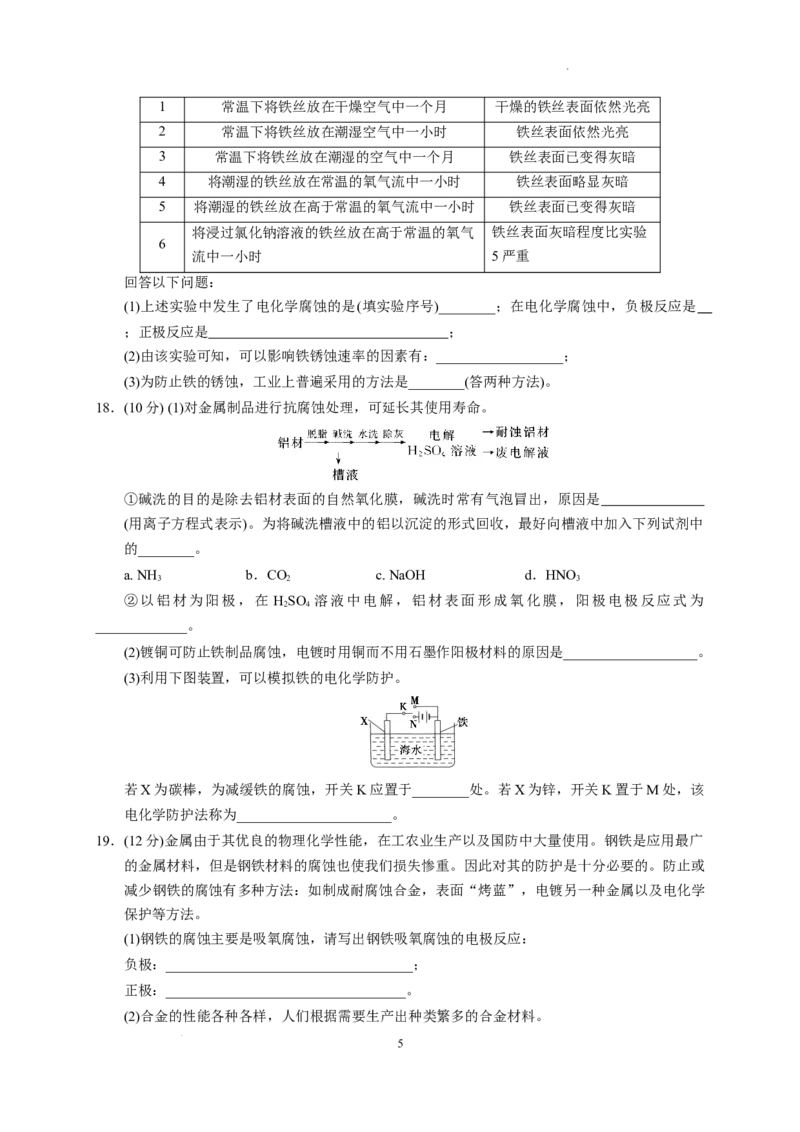
10.如图所示,各烧杯中盛海水,铁在其中被腐蚀的速度由快到慢的顺序为( )
2
学科网(北京)股份有限公司A.②①③④⑤⑥ B.⑤④③①②⑥
C.⑤④②①③⑥ D.⑤③②④①⑥
11.我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐
蚀,防护原理如图所示。下列说法错误的是( )
A.通电时,锌环是阴极,发生氧化反应
B.通电时,阴极上的电极反应为2HO+2e-===H ↑+2OH-
2 2
C.断电时,锌环上的电极反应为Zn-2e-===Zn2+
D.断电时,仍能防止铁帽被腐蚀
12.港珠澳大桥设计寿命120年,对桥体钢构件采用了多种防腐方法。下列分析错误的是( )
A.防腐原理主要是避免发生反应:2Fe+O+2HO===2Fe(OH)
2 2 2
B.构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等,防止形成原电池
C.采用外加电流的阴极保护时需外接镁、锌等作辅助阳极
D.钢构件可采用不锈钢材料以减缓电化学腐蚀
13.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中
高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
14.将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列
3
学科网(北京)股份有限公司有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
15.在潮湿的深层中性土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理
论为厌氧细菌可促使SO与H 反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此
2
埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是(
)
A.图Ⅱ中钢管附近土壤的pH可能会上升
B.图Ⅰ中钢管腐蚀的含铁产物只有FeS
C.图Ⅱ中金属棒X可能为铜,可使钢管表面腐蚀电流接近于零
D.图Ⅱ中金属棒X的作用是作为损耗正极材料和传递电流
二、填空题(本题包括4个小题,共40分)
16.(8分) (1)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容
易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,该原电池的负极是_____,负极
反应式为 ;正极是_______,正极反应式为
。
(2)下列装置中,能对Fe片腐蚀起防护作用的有________(填序号)。
17.(10分)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如
下探究实验:
序号 内容 实验现象
4
学科网(北京)股份有限公司1 常温下将铁丝放在干燥空气中一个月 干燥的铁丝表面依然光亮
2 常温下将铁丝放在潮湿空气中一小时 铁丝表面依然光亮
3 常温下将铁丝放在潮湿的空气中一个月 铁丝表面已变得灰暗
4 将潮湿的铁丝放在常温的氧气流中一小时 铁丝表面略显灰暗
5 将潮湿的铁丝放在高于常温的氧气流中一小时 铁丝表面已变得灰暗
将浸过氯化钠溶液的铁丝放在高于常温的氧气 铁丝表面灰暗程度比实验
6
流中一小时 5严重
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号)________;在电化学腐蚀中,负极反应是
;正极反应是 ;
(2)由该实验可知,可以影响铁锈蚀速率的因素有:__________________;
(3)为防止铁的锈蚀,工业上普遍采用的方法是________(答两种方法)。
18.(10分) (1)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是
(用离子方程式表示)。为将碱洗槽液中的铝以沉淀的形式回收,最好向槽液中加入下列试剂中
的________。
a. NH b.CO c. NaOH d.HNO
3 2 3
②以铝材为阳极,在 HSO 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为
2 4
_____________。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极材料的原因是___________________。
(3)利用下图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。若X为锌,开关K置于M处,该
电化学防护法称为______________________。
19.(12分)金属由于其优良的物理化学性能,在工农业生产以及国防中大量使用。钢铁是应用最广
的金属材料,但是钢铁材料的腐蚀也使我们损失惨重。因此对其的防护是十分必要的。防止或
减少钢铁的腐蚀有多种方法:如制成耐腐蚀合金,表面“烤蓝”,电镀另一种金属以及电化学
保护等方法。
(1)钢铁的腐蚀主要是吸氧腐蚀,请写出钢铁吸氧腐蚀的电极反应:
负极:___________________________________;
正极:__________________________________。
(2)合金的性能各种各样,人们根据需要生产出种类繁多的合金材料。
5
学科网(北京)股份有限公司请回答:①作为建筑材料的铝合金利用了该合金的哪些特性(至少回答两点)?
________________________________________________________________________。
②由于人体摄入较多的Al,对人的健康有害,所以现在不主张使用铝制炊具。你认为生产炊
具的材料最好是________,理由是___________________________________________。
(3)钢铁表面常电镀一层Cr而达到防腐蚀的目的,这是由于Cr具有优良的抗腐蚀性能。请回答:
电镀过程中,阴极是________,电解质一定含有________离子,阳极材料是________;电镀
Cr时,不能使用CrO2-或Cr O2-作为镀液,请说明原因:
4 2 7
________________________________________________________________________。
1.答案:D
解析:金属腐蚀分为化学腐蚀和电化学腐蚀,化学腐蚀是指直接发生化学反应的腐蚀,电化学腐蚀
是指形成原电池的腐蚀,不需要外加电流,故A、B错误;钢铁腐蚀最普遍的是吸氧腐蚀,正极吸
收氧气形成氢氧根离子,C错误。
2.答案:D
解析:A项黄铜发生电化学腐蚀时,被腐蚀的金属应是金属性较活泼的锌而不是铜;B项生铁中含
较多的碳,比软铁芯在电解质作用下更容易形成原电池而生锈;C项铁质器件附有铜质配件时,接
触电解质溶液,铁作负极,易被腐蚀生成铁锈;D项银质奖牌久置后表面生成硫化银而变暗,属化
学腐蚀,与电化学腐蚀无关。
3.答案:B
解析:A项中搪瓷层破损后,铁直接暴露在空气中,因而搪瓷层破损后不能起到防止铁生锈的作
用,错误;B项中镀层破损后,锌与铁构成原电池,由于锌的金属性比铁的强,锌作负极,保护铁
不被腐蚀,正确;C项是牺牲阳极的阴极保护法,错误;D项是用沥青作涂层的涂层保护法,错误。
4.答案:A
解析:反应①②中消耗O 的量相等,两个反应也仅有O 作为氧化剂,故转移电子数是相等的,A
2 2
项正确,B项错误;铜和钢构成原电池,钢制水管腐蚀速率加快,C项错误;钢铁是铁和碳的混合
物,在潮湿的空气中易发生吸氧腐蚀,属于电化学腐蚀,故D项错误。
5.答案:C
解析:A、B中形成的原电池都是铁作负极,加速钢铁腐蚀;D中铸铁管作阳极,加速腐蚀;C中
锌比铁活泼,铁作正极,故选C。
6.答案:A
解析:溶液出现粉红色是铁发生吸氧腐蚀生成OH-导致的。
7.答案:A
解析:镀层破损后,白铁形成原电池时,因为锌比铁活泼,易失电子,从而保护了铁,而马口铁破
6
学科网(北京)股份有限公司损后,因为形成原电池时,铁比锡活泼,铁被腐蚀,所以在镀层破损后,马口铁比白铁更易被腐蚀,
①说法错误。钢铁无论发生析氢腐蚀或吸氧腐蚀,铁都是失电子变成Fe2+,吸氧腐蚀更普遍,O 得
2
电子变成OH-,与Fe2+结合生成Fe(OH) ,Fe(OH) 在空气中很易被氧化成Fe(OH) ,因此铁锈的成
2 2 3
分常用Fe O·nHO表示,②说法正确。锌和铁构成原电池时,锌比铁活泼,应该是锌作负极,③
2 3 2
说法不正确。④说法正确。故A为正确选项。
8.答案:A
解析:A选项,若X为碳棒,开关K置于A处可减缓铁的腐蚀,这是外加电流的阴极保护法,正
确;B选项,若X为锌棒,开关K置于A处时形成电解池,Fe作阴极被保护,置于B处时形成原
电池,这是牺牲阳极的阴极保护法,B、C选项正确;若X为碳棒,开关K置于B处时,铁电极上
发生的反应为Fe-2e-=====Fe2+,D错误。
9.答案:B
解析:Ⅰ中铁钉发生吸氧腐蚀,左端液面上升;Ⅱ中盐酸挥发,和铁钉反应生成H ,腐蚀最严重,
2
Ⅱ中左端下降;Ⅲ中浓硫酸吸水,而铁钉在干燥空气中几乎不腐蚀。
10.答案:C
解析:①是Fe为负极,杂质碳为正极的原电池腐蚀,是铁的吸氧腐蚀,腐蚀较慢;②③④均为原
电池,③中Fe为正极,被保护,②④中Fe为负极,均被腐蚀,但Fe和Cu的金属活动性差别大于
Fe和Sn的,故FeCu 原电池中Fe被腐蚀的较快;⑤是Fe接电源正极作阳极,Cu接电源负极作阴
极的电解腐蚀,加快了Fe的腐蚀;⑥是Fe接电源负极作阴极、Cu接电源正极作阳极的电解池,防
止了Fe的腐蚀。根据以上分析可知铁在其中被腐蚀由快到慢的顺序为⑤>④>②>①>③>⑥。
11.答案:A
解析:通电时,锌环与电源正极相连,锌环作阳极,锌失电子发生氧化反应,故A错误;铁帽为阴
极,阴极上H+得到电子生成氢气,阴极电极反应为2HO+2e-===H ↑+2OH-,故B正确;断电时,
2 2
锌铁形成原电池,锌失电子生成Zn2+,锌环上的电极反应为Zn-2e-===Zn2+,Fe作正极被保护,
仍能防止铁帽被腐蚀,故C、D正确。
12.答案:C
解析:铁为活泼金属,在潮湿的空气中容易发生吸氧腐蚀,发生的主要反应有 2Fe+O +
2
2HO===2Fe(OH) 、4Fe(OH) +O +2HO===4Fe(OH) 等,A正确;钢构件表面环喷涂环氧树脂涂
2 2 2 2 2 3
层,可以隔绝空气、水等,防止形成原电池,防止铁发生电化学腐蚀,B正确;外接镁、锌等作辅
助阳极属于牺牲阳极的阴极保护法,采用外加电流的阴极保护时需外接电源,C错误;不锈钢具有
较强的抗腐蚀性,采用不锈钢材料做钢构件可以防止或减缓电化学腐蚀,D正确。
13.答案:C
解析:本题使用的是外加电流的阴极保护法,钢管柱与电源的负极相连,被保护。A.外加强大的
电流可以抑制金属电化学腐蚀产生的电流,从而保护钢管柱,A正确;B.通电后,被保护的钢管
柱作阴极,高硅铸铁作阳极,因此外电路电子被强制从高硅铸铁流向钢管桩,B正确;C.高硅铸
铁为惰性辅助阳极,所以高硅铸铁不损耗,C错误;D.通过外加电流抑制金属电化学腐蚀产生的
电流,因此通入的保护电流应该根据环境条件变化进行调整,D正确。答案选C。
7
学科网(北京)股份有限公司14.答案:C
解析:根据题图知金属M失电子,为原电池的负极,钢铁设施为原电池的正极。该装置中阴极发
生还原反应,A项错误;金属M被氧化,即金属活动性:M>Fe,B项错误;钢铁设施为原电池的
正极,表面积累大量电子而被保护,C项正确;海水中含有大量的NaCl等电解质,而河水中电解
质较少,故钢铁设施在河水中的腐蚀速率比在海水中的慢,D项错误。
15.答案:A
解析:题图Ⅱ中没有外加电源,采用的是牺牲阳极的阴极保护法,根据原电池原理,金属棒X应作
负极,金属棒X的活泼性应大于铁,才能保护钢管,使其免受腐蚀,若金属棒X是铜,则形成Fe-
Cu原电池,会加速铁的腐蚀;题图Ⅱ中钢管作正极,正极上HO发生还原反应生成H ,电极反应
2 2
式为2HO+2e-===2OH-+H↑,故钢管附近土壤中的c(OH-)会增大,pH可能会上升,A正确,C
2 2
错误。题图Ⅰ钢管腐蚀的过程中,负极上Fe失去电子发生氧化反应生成的Fe2+与正极周围的S2-和
OH-反应分别生成FeS和Fe(OH) ,B错误。由上述分析可知,金属棒X应作负极,D错误。
2
16.答案:(1)Fe Fe-2e-===Fe2+ C O+2HO+4e-===4OH- (2)cd
2 2
解析:(1)在空气酸度不大的环境中,钢铁发生吸氧腐蚀,负极是铁,发生反应 Fe-2e-===Fe2+,
正极是C,发生反应O +2HO+4e-===4OH-,(2)c是牺牲阳极的阴极保护法,d是外加电流的阴
2 2
极保护法。
17.答案:(1)3、4、5、6 Fe-2e-===Fe2+ (或2Fe-4e-===2Fe2+)2H O+O+4e-===4OH-
2 2
(2)湿度、温度、O 的浓度、电解质溶液存在
2
(3)电镀、喷油漆等表面覆盖保护层,牺牲阳极的阴极保护法等
解析:(1)不纯的金属与电解质溶液接触,因发生原电池反应,较活泼的金属失电子而被氧化,分析
题中实验可知,3、4、5、6发生了电化学腐蚀。负极反应Fe-2e-===Fe2+,正极反应O +2HO+
2 2
4e-===4OH-。(2)1和3可得出湿度增大,可使铁锈蚀速率加快;对比实验3、4可知增大O 浓度可
2
加快铁锈蚀的速率;对比实验4、5可知升高温度可加快铁锈蚀的速率;对比实验 5、6可知电解质
溶液的存在会使铁锈蚀的速率加快。第(3)题,为防止铁的锈蚀,根据铁锈蚀的类型,可采用牺牲阳
极的阴极保护法、外加电流的阴极保护法,还可把铁制成不锈钢(合金)、亦可采用喷油漆、涂油脂、
电镀、表面钝化等方法使铁与空气、水等物质隔离,以防止金属腐蚀。
18.答案:(1)①2Al+2OH-+2HO===2AlO+3H↑ b ②2Al+3HO-6e-===AlO+6H+
2 2 2 2 3
(2)阳极Cu可以发生氧化反应生成Cu2+,使电解质溶液中的Cu2+保持不变
(3)N 牺牲阳极的阴极保护法
解析:(1)①冒气泡的原因是Al与NaOH发生反应,离子方程式为:2Al+2OH-+2HO===2AlO+
2
3H↑;使AlO转变成Al(OH) 沉淀,最好是通入CO ,若加HNO 沉淀容易溶解。②阳极是Al发生
2 3 2 3
氧化反应,要生成氧化膜还必须有HO参加,故电极反应式为:2Al+3HO-6e-===AlO+6H+。
2 2 2 3
(2)电镀时,阳极Cu可以发生氧化反应生成Cu2+。(3)铁被保护,可以是作原电池的正极,或者电解
池的阴极,故若X为碳棒,开关K应置于N处,Fe作阴极受到保护;若X为锌,开关K置于M处,
铁作正极,称为牺牲阳极的阴极保护法。
19.答案:(1)2Fe-4e-===2Fe2+ O+2HO+4e-===4OH-
2 2
(2)①主要利用了合金的强度较高、密度小、耐腐蚀等特点
8
学科网(北京)股份有限公司②不锈钢 不锈钢强度高、耐腐蚀,无有害健康的离子进入食物
(3)镀件 Cr3+ 纯铬
由于CrO、Cr O均带有负电荷,电镀过程中向阳极移动,不能在阴极上放电析出Cr
2
解析:根据原电池反应原理,不难回答问题(1),对于(2)注意联系日常生活接触到的铝和不锈钢知
识。问题(3)考查电解电镀原理,阴极发生的是还原反应,故可以使 Cr3+还原成Cr而析出,由于电
解液中的Cr3+不断消耗,因此要有阳极溶解补充。故阳极应为 Cr。同时要掌握电解过程中阴阳离
子的定向移动问题。
9
学科网(北京)股份有限公司10
学科网(北京)股份有限公司