文档内容
高中化学人教版(2019)选择性必修1 第四章第二节 电解池
一、单选题
1.下列与电化学相关的叙述中正确的是( )
A. 原电池中正极发生氧化反应
B. 电解池中与电源负极相连的是阳极
C. 电镀液中应含有镀层金属阳离子 D. 电解氯
化钠溶液可制备金属钠
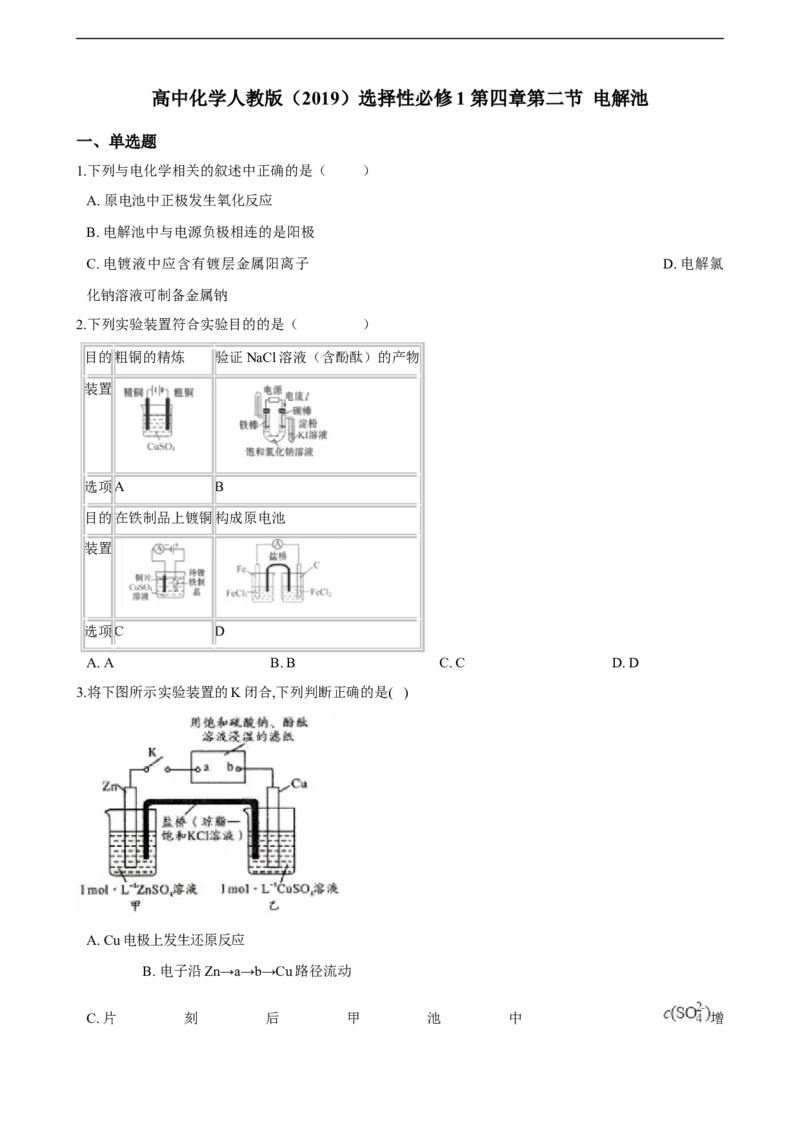
2.下列实验装置符合实验目的的是( )
目的粗铜的精炼 验证NaCl溶液(含酚酞)的产物
装置
选项A B
目的在铁制品上镀铜构成原电池
装置
选项C D
A. A B. B C. C D. D
3.将下图所示实验装置的K闭合,下列判断正确的是( )
A. Cu电极上发生还原反应
B. 电子沿Zn→a→b→Cu路径流动
C. 片 刻 后 甲 池 中 增大 D. 片刻后可观察到滤纸b
点变红色
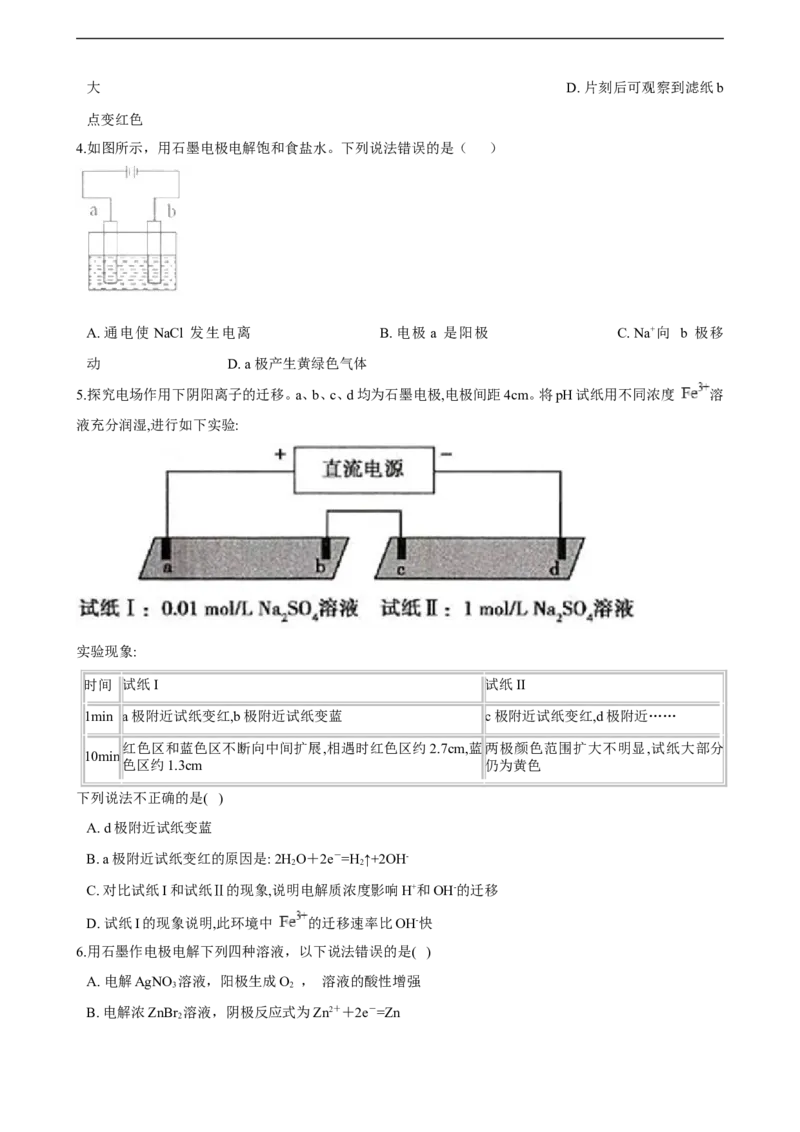
4.如图所示,用石墨电极电解饱和食盐水。下列说法错误的是( )
A. 通电使 NaCl 发生电离 B. 电极 a 是阳极 C. Na+向 b 极移
动 D. a 极产生黄绿色气体
5.探究电场作用下阴阳离子的迁移。a、b、c、d均为石墨电极,电极间距4cm。将pH试纸用不同浓度 溶
液充分润湿,进行如下实验:
21·cn·jy·com
实验现象:
时间 试纸I 试纸II
1min a极附近试纸变红,b极附近试纸变蓝 c极附近试纸变红,d极附近……
红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝两极颜色范围扩大不明显,试纸大部分
10min
色区约1.3cm 仍为黄色
下列说法不正确的是( )
A. d极附近试纸变蓝
B. a极附近试纸变红的原因是: 2H O+2e-=H ↑+2OH-
2 2
C. 对比试纸I和试纸Ⅱ的现象,说明电解质浓度影响H+和OH-的迁移
D. 试纸I的现象说明,此环境中 的迁移速率比OH-快
【来源:21·世纪·教育·网】
6.用石墨作电极电解下列四种溶液,以下说法错误的是( )
A. 电解AgNO 溶液,阳极生成O , 溶液的酸性增强
3 2
B. 电解浓ZnBr 溶液,阴极反应式为Zn2++2e-=Zn
2C. 电解AlCl 溶液,总反应的离子方程式:2HO+2Cl- 2OH-+Cl↑+H↑
3 2 2 2
D. 电解Pb(NO ) 和CuCl 的混合溶液,可明显分为三个阶段
3 2 2 www-2-1-cnjy-com
7.镁一空气电池是一种能被水激活的一次性储备电池,原理如图所示。下列说法错误的是( )
A. 放电时,外电路电子由多孔碳材料电极流向镁电极
B. 放电时,正极的电极反应式为O+4e-+2H O=4OH-
2 2
C. 理论上,外电路中流过2mol电子时,负极质量增加34g
D. 电池反应产物Mg(OH) 经过灼烧与还原可制成镁从而循环利用
2 【来源:21cnj*y.co*m】
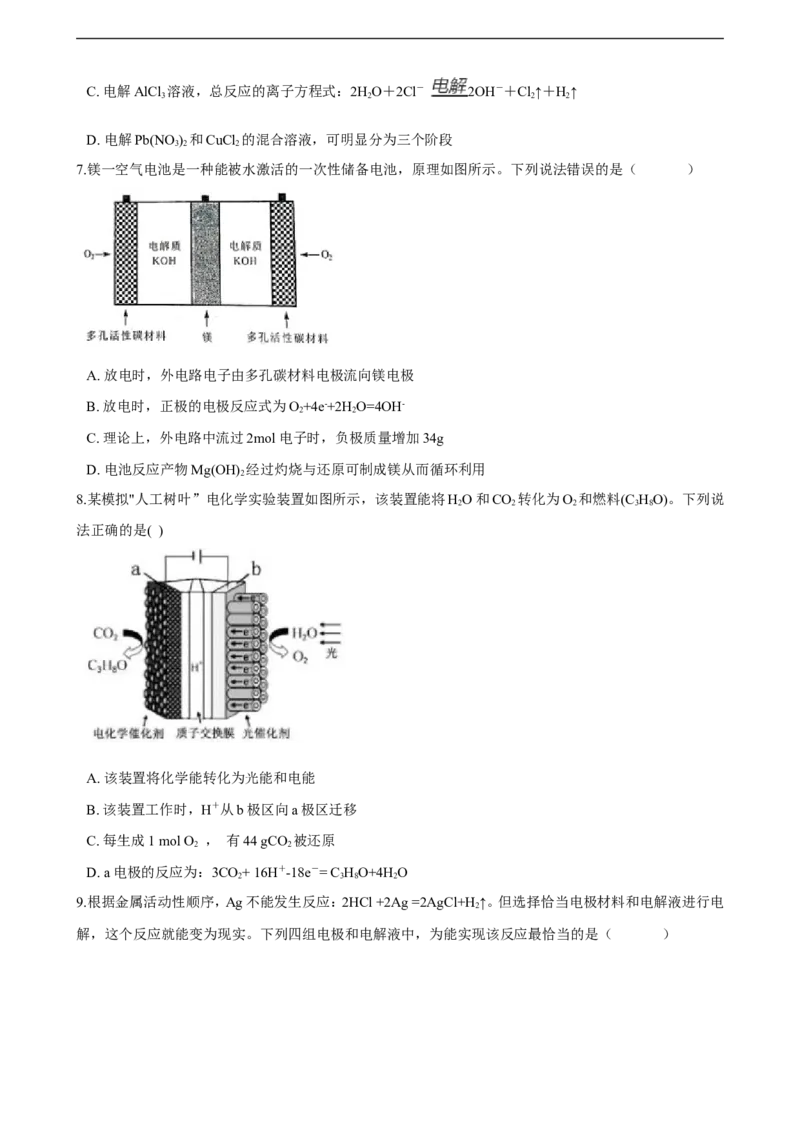
8.某模拟"人工树叶”电化学实验装置如图所示,该装置能将HO和CO 转化为O 和燃料(C HO)。下列说
2 2 2 3 8
法正确的是( )
21教育名师原创作品
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O , 有44 gCO 被还原
2 2
D. a电极的反应为:3CO+ 16H+-18e-= C HO+4HO
2 3 8 2
9.根据金属活动性顺序,Ag不能发生反应:2HCl +2Ag =2AgCl+H↑。但选择恰当电极材料和电解液进行电
2
解,这个反应就能变为现实。下列四组电极和电解液中,为能实现该反应最恰当的是( )A. B. C. D.
10.如图a、b、c、d均为铂电极,供选择的电解质溶液如下表( )
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;
②b、c两极放电离子的物质的量相等。则应选用的电解液是
组 A B C D
甲槽NaOH Cu(NO ) KCl NaSO
3 2 2 4
乙槽CuSO NaCl AgNO NaNO
4 3 3
A. A B. B C.
C D. D
二、综合题
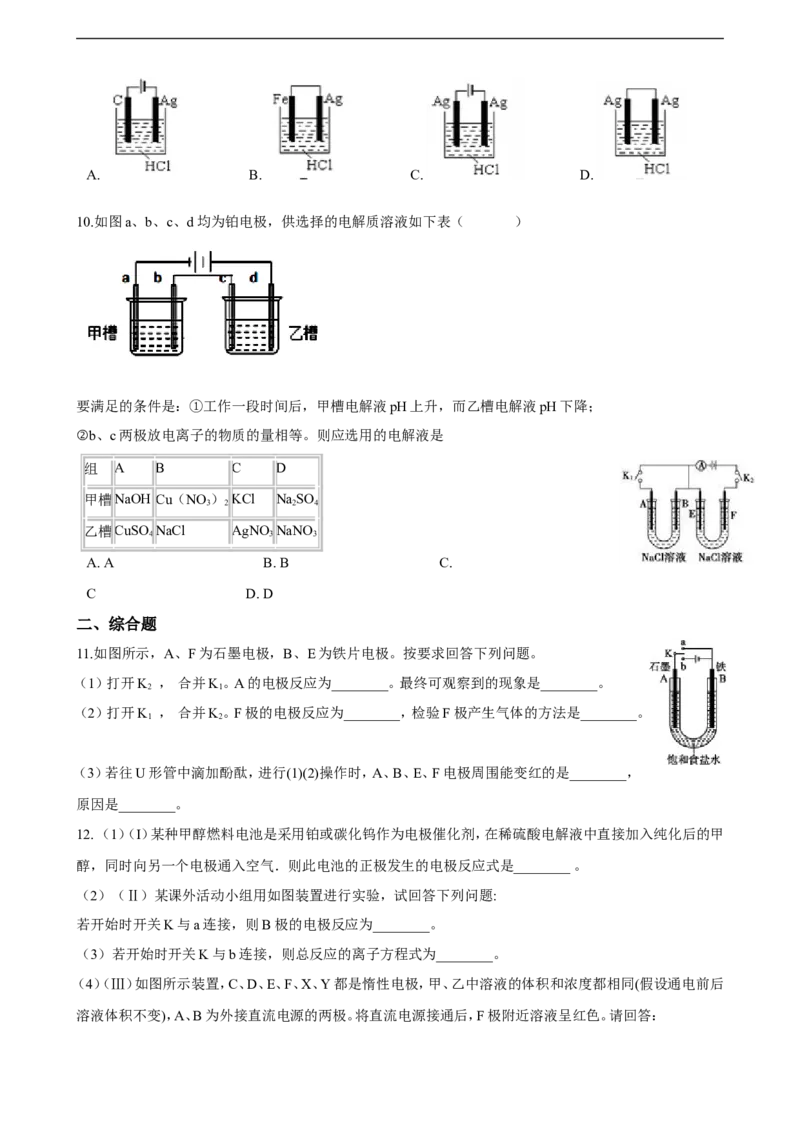
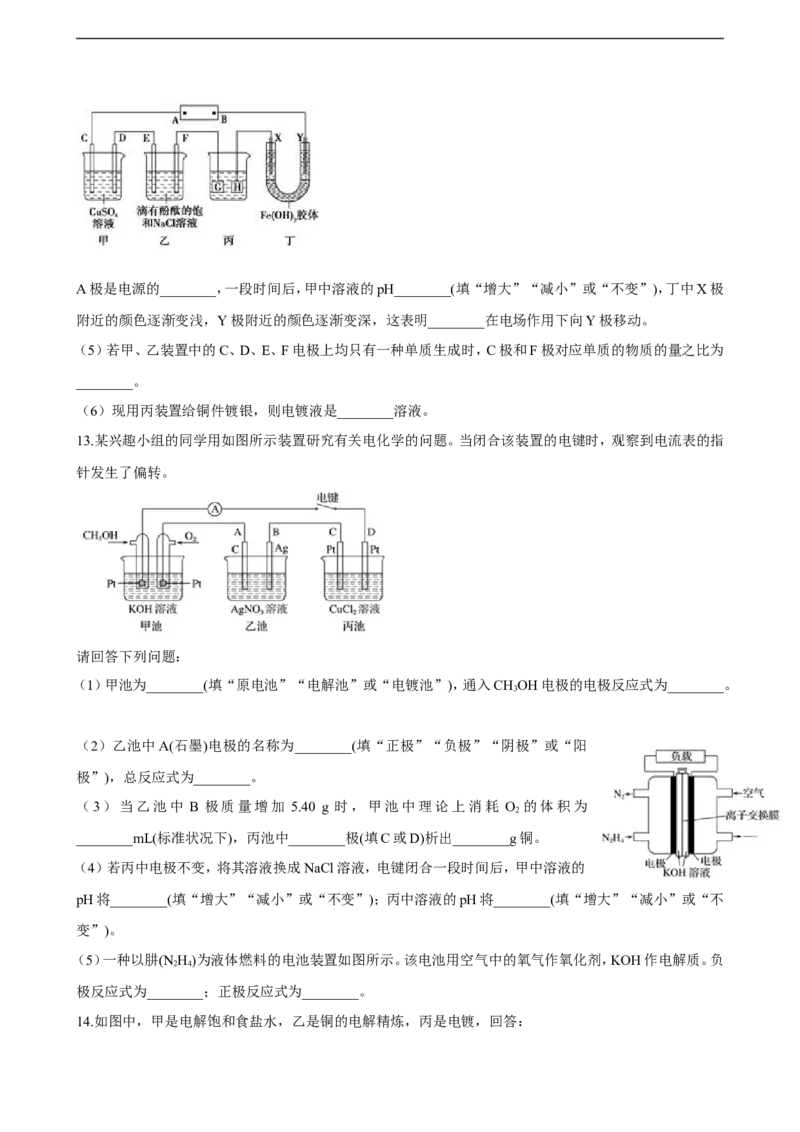
11.如图所示,A、F为石墨电极,B、E为铁片电极。按要求回答下列问题。
(1)打开K , 合并K。A的电极反应为________。最终可观察到的现象是________。
2 1
(2)打开K , 合并K。F极的电极反应为________,检验F极产生气体的方法是________。
1 2
(3)若往U形管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是________,
原因是________。
12. ( 1)(Ι)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲
醇,同时向另一个电极通入空气.则此电池的正极发生的电极反应式是________ 。
(2)(Ⅱ)某课外活动小组用如图装置进行实验,试回答下列问题:
若开始时开关K与a连接,则B极的电极反应为________。
(3)若开始时开关K与b连接,则总反应的离子方程式为________。
(4)(Ⅲ)如图所示装置,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后
溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近溶液呈红色。请回答:
21世纪教育网版权所有
A极是电源的________,一段时间后,甲中溶液的pH________(填“增大”“减小”或“不变”),丁中X极
附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明________在电场作用下向Y极移动。
(5)若甲、乙装置中的C、D、E、F电极上均只有一种单质生成时,C极和F极对应单质的物质的量之比为
________。
2·1·c·n·j·y
(6)现用丙装置给铜件镀银,则电镀液是________溶液。
13.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指
针发生了偏转。
请回答下列问题:
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CHOH电极的电极反应式为________。
3
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳
极”),总反应式为________。
(3)当乙池中 B 极质量增加 5.40 g 时,甲池中理论上消耗 O 的体积为
2
________mL(标准状况下),丙池中________极(填C或D)析出________g铜。
(4)若丙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的
pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不
变”)。
(5)一种以肼(N H)为液体燃料的电池装置如图所示。该电池用空气中的氧气作氧化剂,KOH作电解质。负
2 4
极反应式为________;正极反应式为________。
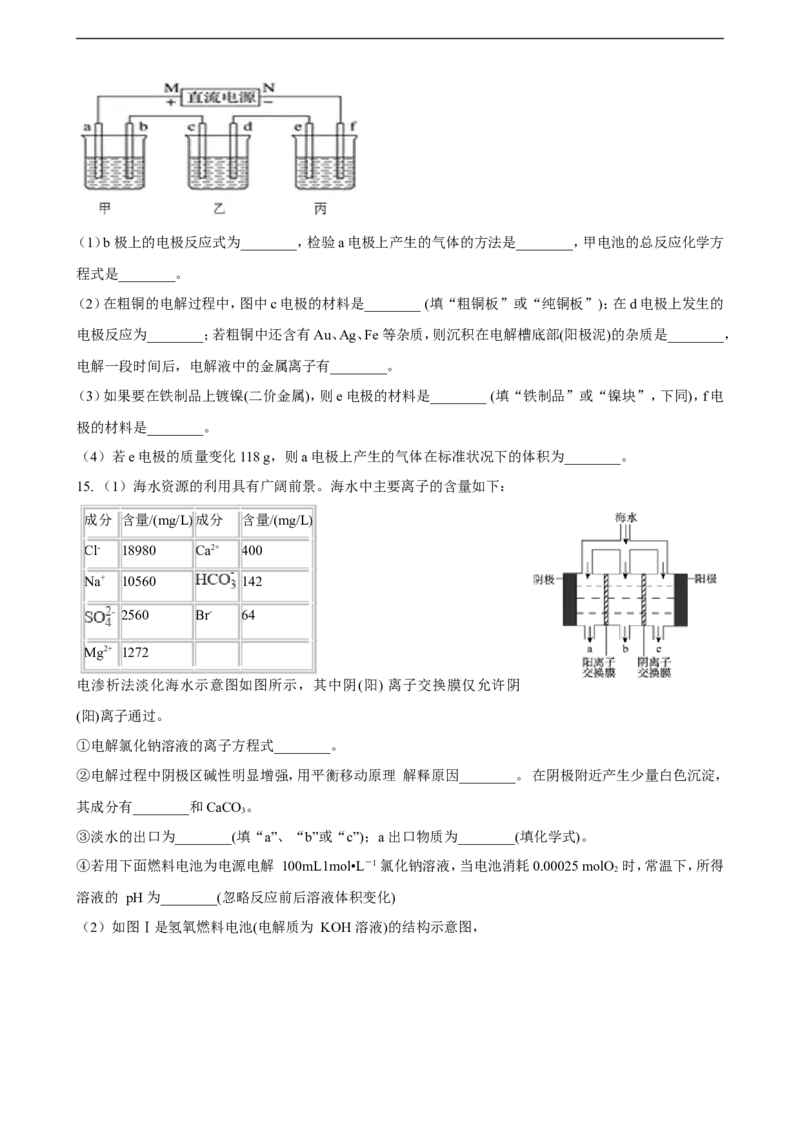
14.如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:(1)b极上的电极反应式为________,检验a电极上产生的气体的方法是________,甲电池的总反应化学方
程式是________。
(2)在粗铜的电解过程中,图中c电极的材料是________ (填“粗铜板”或“纯铜板”);在d电极上发生的
电极反应为________;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是________,
电解一段时间后,电解液中的金属离子有________。
(3)如果要在铁制品上镀镍(二价金属),则e电极的材料是________ (填“铁制品”或“镍块”,下同),f电
极的材料是________。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为________。
15. (1)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 含量/(mg/L)成分 含量/(mg/L)
Cl- 18980 Ca2+ 400
Na+ 10560 142
2560 Br- 64
Mg2+ 1272
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴
(阳)离子通过。
①电解氯化钠溶液的离子方程式________。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因________。 在阴极附近产生少量白色沉淀,
其成分有________和CaCO 。
3 21cnjy.com
③淡水的出口为________(填“a”、“b”或“c”);a 出口物质为________(填化学式)。
21·世纪*教育网
④若用下面燃料电池为电源电解 100mL1mol•L-1 氯化钠溶液,当电池消耗0.00025 molO 时,常温下,所得
2
溶液的 pH 为________(忽略反应前后溶液体积变化)
2-1-c-n-j-y
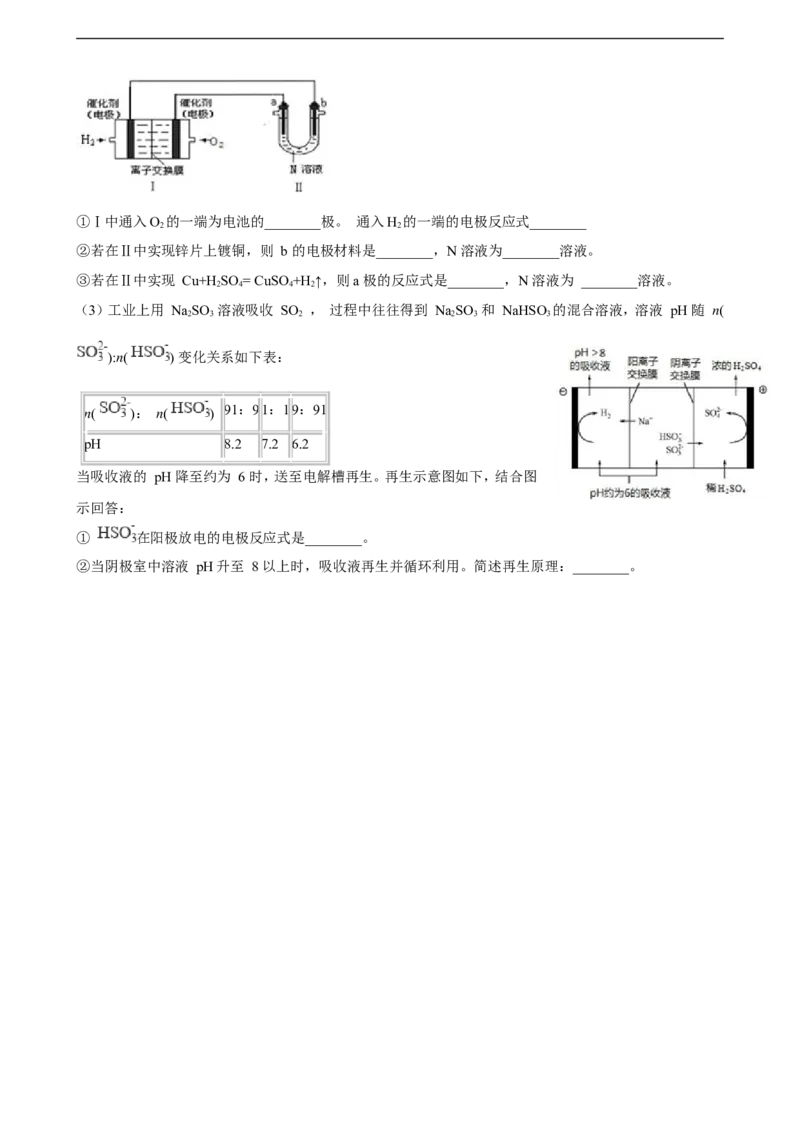
(2)如图Ⅰ是氢氧燃料电池(电解质为 KOH 溶液)的结构示意图,①Ⅰ中通入O 的一端为电池的________极。 通入H 的一端的电极反应式________
2 2
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是________,N 溶液为________溶液。
③若在Ⅱ中实现 Cu+H SO = CuSO +H ↑,则a 极的反应式是________,N 溶液为 ________溶液。
2 4 4 2
(3)工业上用 NaSO 溶液吸收 SO , 过程中往往得到 NaSO 和 NaHSO 的混合溶液,溶液 pH 随 n(
2 3 2 2 3 3
):n( ) 变化关系如下表:
【版权所有:21教育】
n( ): n( ) 91:91:19:91
pH 8.2 7.2 6.2
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图
示回答:
① 在阳极放电的电极反应式是________。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:________。答案解析部分
一、单选题
1. C
解析:A. 原电池中正极得到电子,发生还原反应,A不符合题意;
B. 电解池中阴极得到电子与电源负极相连,B不符合题意;
C. 电镀液中应含有镀层金属阳离子,金属阳离子在阴极得到电子,覆盖在阴极表面,C符合题意;
D. 电解氯化钠溶液可制备氢氧化钠溶液、氢气和氯气,得不到钠单质,D不符合题意。
故答案为:C。
原电池中正极得到电子,发生还原反应,负极失去电子,发生氧化反应;电解池中阳极失去电子,发生氧化
反应,阴极得到电子,发生还原反应。
21*cnjy*com
2. B
解析:A.铜的电解精炼,阳极为粗铜,阴极为粗铜,故A不符合题意
B.根据电流流向可判断电源的正负极,左边为阴极产生氢气故用向下排空气法收集左边U型管可看到溶液
变红,右边U型管为阳极,生成氯气,淀粉KI变蓝,故B符合题意
C.电镀时,镀件在阳极,镀层在阴极,故C不符合题意
D.双液原电池中,氧化剂和还原剂需要隔开,故D不符合题意
故答案为:B
本题为电解池和原电池工作原理的应用,掌握工作原理则可解决此类问题。
3. A
解析:A.铜为正极,发生还原反应,故A符合题意
B.滤纸上为溶液,不能传递电子,故B不符合题意
C.盐桥中的氯离子移向甲池,故C不符合题意
D.b极为阳极,放出氧气,剩下H+ , 呈酸性,a点附近变红,故D不符合题意
故答案为:A
B、电子不下水
C、硫酸根离子浓度不变,移动的是盐桥当中的阴阳离子
D、电解质常见反应类型:放氢生碱,放氧生酸
4. A
解析:A. NaCl在水中就能发生电离,通电不是必要条件,A符合题意;
B. 电极a与电源的正极相连,是阳极,B不符合题意;
C. 阳离子向阴极移动,b极是阴极,Na+向b极移动,C不符合题意;D. a极为阳极,其电极反应式为:2Cl--2e-=Cl↑,产生黄绿色气体,D不符合题意;
2
故答案为:A。
与电源的正极相连的是阳极,与电源的负极相连的是阴极,所以a极是阳极,b极是阴极;阳离子向阴极移动,
阴离子向阳极移动;电解饱和食盐水,阳极电极反应式为:2Cl--2e-=Cl↑,阴极电极反应式为:2H++2e-=H ↑。
2 2 21
教育网
5. B
解析:A.由分析可知,d电极的电极反应式为2H++2e-=H ↑,电极周围c(H+)减小,c(OH-)增大,溶液显碱性,
2
因此pH试纸显蓝色,选项正确,A不符合题意;
www.21-cn-jy.com
B.由分析可知,a电极的电极反应式为4OH--4e-=2H O+O↑,电极周围c(OH-)减小,c(H+)增大,溶液显
2 2
酸性,pH试纸变红色,选项错误,B符合题意;
【出处:21教育名师】
C.试纸Ⅰ红色区和蓝色区不断向中间扩散,相遇时红色区约2.7cm,蓝色区约1.3cm,此现象说明试纸Ⅰ环
境中H+迁移速率比OH-快,说明电解质浓度影响H+和OH-的迁移,选项正确,C不符合题意;
D.试纸Ⅰ红色区和蓝色区不断向中间扩散,相遇时红色区约2.7cm,蓝色区约1.3cm,此现象说明此环境中
H+的迁移速率比OH-快,选项正确,D不符合题意;
故答案为:B
a电极与电源正极相连为阳极,b电极为阴极、c电极为阳极,d电极为阴极;电解NaSO 溶液时,a、c电极的
2 4
电极反应式为4OH--4e-=2H O+O↑;b、d电极的电极反应式为2H++2e-=H ↑;据此结合选项进行分析。
2 2 2
6. C
解析:A.电解AgNO 溶液时,水电离产生的OH-在阳极发生失电子的氧化反应,其电极反应式为2HO-4e
3 2
-=4H++O↑,因此阳极产生O , 溶液的酸性增强,选项正确,A不符合题意;
2 2
B.Zn(NO ) 溶液中,阴极上H+的放电能力小于Zn2+ , 因此阴极的电极反应式为Zn2++2e-=Zn,选项正
3 2
确,B不符合题意;
C.电解AlCl 时,阳极上Cl-发生失电子的氧化反应生成Cl , 阴极上HO电离产生的H+发生得电子的还
3 2 2
原反应生成H 和OH- , Al3+进一步与OH-反应生成Al(OH) 或AlO- , 选项错误,C符合题意;
2 3 2
D.混合溶液中,阴极上阳离子的放点顺序为Pb2+>Cu2+>H+ , 因此电解过程中存在三个过程,选项正确,
D不符合题意;
故答案为:C
A.电解AgNO 溶液时,Ag+在阴极发生还原反应,水电离产生的OH-在阳极发生失电子的氧化反应;
3
B.电解ZnBr 溶液时,阳极上Br-发生失电子的氧化反应,Zn2+发生得电子的还原反应;
2
C.Al3+能与OH-反应;
D.根据溶液中离子的放电顺序确定点结果中发生的反应;
7. A解析:A.放电时电子由负极流向正极,镁是负极,多孔活性碳材料是正极,即放电时外电路电子由镁电极流
向多孔碳材料电极,故A符合题意;
B.放电时,正极氧气发生还原反应生成氢氧根离子,所以正极的电极反应式为O+4e-+2H O=4OH- , 故B
2 2
不符合题意;
C.理论上,外电路中流过2mol电子时,生成1mol的镁离子,结合2mol的氢氧根离子,所以负极质量增加
34g,故C不符合题意;
D.氢氧化镁受热分解产生氧化镁,氧化镁还原成单质镁循环利用,故D不符合题意;
故答案为:A。
A.放电时作为原电池,电子由负极流向正极
B.放电时,正极氧气得电子
C.外电路中流过2mol电子时,生成1mol的氢氧化镁
D.镁是负极,制成的单质镁可以循环利用
8. B
解析:A.根据图示可知,该装置将电能和光能转化为化学能,不符合题意;
B.根据同种电荷相互排斥,异种电荷相互吸引的原则,该装置工作时,H+从正电荷较多的阳极b极区向负
电荷较多的阴极a极区迁移,符合题意;
C.该反应的总方程式是:6CO+8H O=2C HO+9O。根据反应方程式可知,每生成1 mol O , 有2/3molCO
2 2 3 8 2 2 2
被还原,其质量是88/3g,不符合题意;
D.根据图示可知与电源负极连接的a电极为阴极,发生还原反应,电极的反应式为:3CO+ 18H++18e-=
2
C HO+5HO,不符合题意;
3 8 2
故答案为:B。
A.该装置有外接电源,属于电解池,因此是电能转化为化学能的装置;
B.根据电极反应可知在工作时,a为阴极,b为阳极,电解质溶液中阳离子向阴极移动,阴离子向阳极移动;
C.根据氧化还原反应中电子转移数目知:每生成1 mol O , 有2/3molCO 被还原,其质量是88/3g;
2 2
D.a电极是阴极,因此发生的反应是还原反应。
9. C
解析:“2HCl +2Ag =2AgCl+H ↑”是非自发进行的,Ag要生成Ag+ , 做原电池阳极,接电源正极,H+生成
2
H 是在阴极。
2
故答案为:C
电解池中,金属做阳极,失去电子,作还原剂,和电源正极相连,溶液中的离子在阴极得到电子。
10. C
解析:A、甲槽是电解水,氢氧化钠溶液PH增大,b电极是阳极,电极反应为:4OH--4e-=2H O+O↑;乙槽电解
2 2硫酸铜溶液,溶液PH减小,c电极为阴极,电解反应为:Cu2++2e-=Cu,依据电子守恒可知,b、c两极上反应的
离子的物质的量不相等,故A不符合题意;
B、甲槽是电解硝酸铜,溶液PH减小,b电极是阳极,电极反应为:4OH--4e-=2H O+O↑;乙槽电解氯化钠,溶
2 2
液PH增大,c电极是阴极,电极反应为:2H++2e-=H ↑,依据电子守恒可知,b、c两极上反应的离子的物质的
2
量相等,故B不符合题意;
C、甲槽是氯化钾,溶液PH增大,b电极是阳极,电极反应为:2Cl--2e-=Cl↑;乙槽电解硝酸银溶液,溶液PH
2
减小,c电极为阴极,电解反应为:2Ag++2e-=2Ag,依据电子守恒可知,b、c两极上反应的离子的物质的量相
等.故C符合题意;
D、甲槽是电解水,溶液PH不变;乙槽电解水,溶液pH不变,故D不符合题意。
甲槽电解液pH上升,要求阴极上是H+放电,属于放H 生OH-型, 乙槽电解液pH下降,要求阳极上是OH-
2
放电,属于放O 生H+型。
2
二、综合题
11. (1)O+2H O+4e-=4OH-;溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色
2 2
(2)2Cl--2e-=Cl↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气
2
(3)A、E;因为A极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性
解析:(1)打开K , 闭合K 后,构成原电池,B是铁片,作负极,A是正极,由于溶液是氯化钠溶液,因此相
2 1
当于铁的吸氧腐蚀,正极反应式为O+2H O+4e-=4OH-。铁失去电子生成亚铁离子,然后结合OH-生成
2 2
Fe(OH) 沉淀,最终被氧化生成氢氧化铁沉淀,实验现象为溶液中产生白色沉淀,随即变成灰绿色,最终变为
2
红褐色,故本题答案为: O+2H O+4e-=4OH-;溶液中产生白色沉淀,随即变成灰绿色,最终变为红褐色;(2)
2 2
打开K , 闭合K , 装置是电解池,F是阳极,E是阴极,阳极氯离子放电,生成氯气,电极反应式为:2Cl-
1 2
-2e-=Cl↑,可利用氯气的氧化性来检验,即生成了碘单质,用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,
2
证明是氯气,故本题答案为:2Cl--2e-=Cl↑;用湿润的淀粉碘化钾试纸靠近F极,试纸变蓝,证明是氯气;(3)
2
由(1)、(2)分析可知,OH-在A和E两极出现,酚酞遇OH-变红,所以溶液变红,故本题答案为:A、E;因为A
极氧气放电产生氢氧根,E极上水放电产生氢气和氢氧根离子,均导致电极区域呈碱性。
当打开K , 闭合K 时,铁片、石墨和NaCl溶液构成原电池,负极为铁,石墨作正极,发生吸氧腐蚀,当打
2 1
开K , 闭台K 时,铁片、石墨和NaCl溶液,构成电解池,说明作阳极,铁作阴极,阳极上氯离子放电生成
1 2
氯气,阴极上氢离子放电生成氢气,可以用湿润的淀粉碘化钾试纸检验氯气。
12. (1)O+4H++4e﹣═2H O
2 2
(2)Fe-2e- = Fe2+
(3)2Cl-+2H O 2OH-+ H ↑+ Cl ↑
2 2 2
(4)正极;减小;Fe(OH) 胶粒
3
(5)1∶2(6)AgNO
3
解析:(1)氧气为正极,酸性条件下,产物为水,电极反应式为 O+4H++4e﹣═2H O
2 2
(2)连接a时为原电池,铁做负极发生的反应为 Fe-2e- = Fe2+
(3)连接b时为电解池,电解氯化钠溶液离子方程式为 2Cl-+2H O 2OH-+ H ↑+ Cl ↑
2 2 2
( 4)F附近为红色,则生成OH- , 电解H+ , 则F为阴极,A是正极,电解硫酸铜溶液为放氧生酸型,故pH
减小,丁中Y极颜色加深,这说明氢氧化铁胶粒带正电,移向阴极
( 5) 若甲、乙装置中的C、D、E、F电极上均只有一种单质生成时 ,则C上生成的是氧气,D上是铜,E上是
氯气,F上是氢气,则根据电子守恒,氧气与氢气的物质的量之比为1:2
(6)阴极的反应为银离子得到电子生成银单质,故,电镀液为硝酸银溶液
本题为原电池和电解池的工作原理的应用题,解决此类问题需要熟系原电池以及电解池的工作原理,较难
的为第(4)问,根据 F极附近溶液呈红色 ,可知生成了碱性物质让酚酞变红,故可知F为阴极,则B是负极,
A是正极。
13. (1)原电池;CHOH-6e-+8OH-=CO 2-+6HO
3 3 2
(2)阳极;4AgNO+2HO 4Ag+O↑+4HNO
3 2 2 3
(3)280;D;1.60
(4)减小;增大
(5)NH-4e-+4OH-=N ↑+4HO;O+4e-+2HO=4OH-
2 4 2 2 2 2
解析:(1)根据分析,甲池为原电池,通入CHOH电极的电极反应式为CHOH+8OH--6e-=CO2-+6H O;(2)
3 3 3 2
根据分析,乙池为电解池,A(石墨)电极的名称为阳极,阳极A的电极反应为4OH--4e-=2H O+O↑,阴极
2 2
B的电极反应为Ag++e-=Ag,总反应式为4AgNO+2HO 4Ag+O↑+4HNO;(3)根据分析,乙池中阴极
3 2 2 3
B的电极反应为Ag++e-=Ag,B极质量增加5.40 g时,即生成Ag单质的质量为5.40g,其物质的量=
=0.05mol,甲池中正极电极反应为O+4e-+2H O=4OH- , 根据电子守恒计算4Ag~O~4e- ,
2 2 2
甲池中理论上消耗O 的体积= mol×22.4L/mol =0.28L=280mL;丙为电解池,C为阳极,D为阴极,阴
2
极D的电极反应为 Cu2++2e-=Cu,结合电子守恒计算 2Ag~Cu~2e- , 析出铜质量= ×64g/mol
=1.60g;(4)甲中发生的反应为甲醇与氧气、氢氧化钾的反应,反应消耗氢氧根离子,则pH减小,丙中电极不
变,将其溶液换成NaCl溶液,则丙中电解NaCl溶液生成氢氧化钠,所以溶液pH增大;(5)燃料电池中,通入
燃料的电极通常为负极,通入氧气的一极为正极,则通入液体燃料肼(N H)的一极为负极,负极发生氧化反
2 4应,由图可知负极上有N 生成,电极反应式为:NH-4e-+4OH-=N ↑+4HO;通入氧气的一极为正极,正极
2 2 4 2 2
发生还原反应,电极反应式为:O+4e-+2HO=4OH-。
2 2
由图示可知甲池为甲醇燃料电池,燃料电池中通入燃料的一极为负极,通入氧气的一极为正极,则通入甲醇
的一极为负极,燃料在负极失电子发生氧化反应,在碱溶液中生成碳酸盐,电极反应为:CHOH+8OH--6e-
3
=CO2-+6H O,通入氧气的一极为正极,电极反应为O+4e-+2H O=4OH-;乙、丙二池为电解池,电解池中与
3 2 2 2
电源正极相连的一极为阳极,与电源负极相连的一极为阴极,则A、C为两个电解池的阳极,B、D为两个电
解池的阴极,乙池中电解质溶液为AgNO , 根据放电顺序,阳极A的电极反应为4OH--4e-=2H O+
3 2
O↑,阴极B的电极反应为Ag++e-=Ag;丙池中电解质溶液为CuCl , 根据放电顺序,阳极C的电极反应为
2 2
2Cl--2e-=Cl↑,阴极D的电极反应为Cu2++2e-=Cu,据此分析解答(1)~ (4);(5)燃料电池中,通入燃料的电极通
2
常为负极,通入氧气的一极为正极,结合图示分析书写电极反应。
14. (1)2H++2e-=H ↑;湿润的淀粉KI试纸变蓝则为Cl;2NaCl+2H O=2NaOH+H ↑+Cl↑
2 2 2 2 2
(2)粗铜板;Cu2++2e-=Cu;Au、 Ag;Cu2+ 、 Fe2+
(3)镍块;铁制品
(4)44.8L
解析:(1)甲是电解饱和食盐水,M为正极,则a为阳极发生氧化反应,电极方程式为2Cl--2e-=Cl↑,b为阴极
2
发生还原反应,电极反应式为2H++2e-=H ↑;检验a电极生成的氯气应该用湿润的淀粉碘化钾试纸,氯气可
2
将碘离子氧化为碘单质,使试纸变蓝;电解饱和食盐水生成氢气、氯气和氢氧化钠,总反应化学方程式为
2NaCl+2H O 2NaOH+Cl ↑+H ↑;(2)用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极,该装置中
2 2 2
M为原电池的正极,N为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液
为电解液,溶液中的Cu2+得到电子在阴极上发生还原反应,即Cu2++2e-=Cu;作阳极的粗铜中的铜以及比铜
活泼的金属失去电子进入溶液,所以Fe发生Fe-2e-=Fe2+反应,以Fe2+的形式进入溶液中;比铜不活泼的金属
Au、Ag不会失去电子,以单质的形成沉入电解槽形成“阳极泥”,则沉积在电解槽底部(阳极泥)的杂质是
Au、Ag,电解一段时间后,电解液中的金属离子有Cu2+、Fe2+;(3) 在铁制品上镀镍(二价金属),则铁制品作阴
极与电源负极N相连即f极,镍块为阳极与电源正极M相连即e极;(4) 若e电极的质量变化118g,根据转
移电子数相等,Ni~2e-~Cl , 则a电极上产生的气体在标准状况下的体积为
2
=44.8L。
本题的易错点为(2),粗铜的电解精炼过程中,阳极上比铜活泼的金属也要放电,活泼性比铜弱的形成阳极
泥。15.( 1)2Cl-+ 2H O 2OH-+H ↑+ Cl ↑;H+得电子生成H , H+浓度减小,促使水的电离平衡向着电离方
2 2 2 2
向移动,OH-浓度增大;Mg(OH) ;b;NaOH;12
2
(2)正;H-2e-+2OH-=2H O;锌;CuSO ;Cu-2e-= Cu2+;稀HSO
2 2 4 2 4
(3)HO+HSO --2e-= SO 2-+3H+;阴极室H+放电,产生OH- , OH-和HSO -反应,生成SO 2- , Na+通过
2 3 4 3 3
阳离子交换膜进入阴极室,NaSO 溶液吸收 SO , 又得到 NaSO 和 NaHSO 的混合溶液,实现循环利用
2 3 2 2 3 3
和再生
解析:(1)①氯化钠溶液中含Na+、Cl-、H+、OH- , 电解时阳极Cl-失电子生成Cl , 阴极H+得电子生成H ,
2 2
电解氯化钠溶液的离子方程式为:2Cl-+ 2H O 2OH-+H ↑+ Cl ↑;②由①可知,电解过程中阴极H+得电
2 2 2
子生成H , 导致溶液中H+浓度减小,促使水的电离平衡向着电离方向移动,溶液中OH-浓度增大,碱性增
2
强;因为OH-浓度增大,会与Mg2+生成Mg(OH) 白色沉淀,同时还能与HCO -反应生成CO2- , CO2-与
2 3 3 3
Ca2+生成CaCO , 故阴极附近产生的白色沉淀有Mg(OH) 和CaCO ;③电解池中,阳离子移向阴极,阴离
3 2 3
子移向阳极,则淡水出口为b,Ca2+、Mg2+在阴极生成沉淀被除去,故a出口的物质为NaOH;④当电池消耗
0.00025 molO 时,根据得失电子守恒和化学计量数得出关系:
2
O~4e-~2H~4NaOH,则生成n(NaOH)= 0.00025 mol×4=0.001mol, c(OH-)= c(NaOH)= 0.001mol/0.1L=0.01
2 2
mol/L,常温下c(H+)=K / c(OH-)=10-12 mol/L, pH=12;(2)①氢氧燃料电池,O 得电子,从正极通入,H 失电子,
W 2 2
从负极通入,电解质溶液为KOH 溶液,故电极反应式为H-2e-+2OH-=2H O;②锌片上镀铜,则锌被保护,为
2 2
阴极,铜被消耗,为阳极,b与电源负极相连,为阴极,故 b 的电极材料是锌,Cu2+得电子,N溶液为CuSO
4
溶液;③a与电源正极相连,为阳极,Cu+H SO = CuSO +H ↑,Cu失去电子作阳极,电极反应式为:Cu-2e-=
2 4 4 2
Cu2+ , N 溶液为稀HSO ;(3)①由图可知,HSO -在阳极失电子得到SO 2- , 故电极反应式为HSO --2e-=
2 4 3 4 3
SO 2-+H+;②阴极H+得电子生成H , OH-浓度增大,Na+通过阳离子交换膜进入阴极室,则阴极室产生的物
4 2
质为NaOH,NaOH用于吸收SO , 得到 NaSO 和 NaHSO , 将混合溶液进行电解,又可以得到
2 2 3 3
NaOH吸收液,实现循环利用和再生。
氯化钠溶液中含Na+、Cl-、H+、OH-,根据放电顺序Cl-、H+优先失电子分析产物,书写离子方程式,也因为H+减
少会引起水的电离平衡向着电离方向移动,OH-浓度增大,阴极区碱性增强,进而除去Ca2+、Mg2+ , 则阴极
室a出口为NaOH,因电解池中阳离子移向阴极,阴离子移向阳极,则淡水出口为b,原电池电解池组合电路
中整个电路中转移的电子数目相同,得出关系式进行计算;组合电路中b与电源负极相连,为阴极,得电子,
a与电源正极相连,为阳极,失电子,根据题目给出信息判断得失电子情况,确定其位置进行作答;吸收液再
生循环原理根据电解池工作原理,结合图示进行分析。