文档内容
第一学期高二期末试卷
化学
满分100分 考试时间90分钟
相对原子质量H1 O16 Zn65
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1. 下列能级符号正确的是
A. 6s B. 2d C. 3f D. 1p
2. 下列物质属于强电解质的是
A. NH·H O B. Ba(OH) C. CHCOOH D. HF
3 2 2 3
3. 下列措施不能加快Zn与1mol/LHSO 反应产生H 的速率的是
2 4 2
A. 用Zn粉代替Zn粒 B. 滴加少量的CuSO 溶液
4
C. 升高温度 D. 再加入1mol/LCH COOH溶液
3
4. 下列事实可以证明氨水是弱碱的是
的
A. 0.1mol/L氨水溶液pH<13 B. 0.1mol/L 氨水可以使酚酞试液变红
C. 氨水与Al3+盐反应生成Al(OH) D. 氨水的导电性比NaOH溶液弱
3
5. 25℃时,下列溶液中水的电离程度最小的是
.
A 0.1mol/LNH Cl溶液 B. 0.1mol/L盐酸
4
C. pH=2NaHSO 溶液 D. pH=12氨水
4
6. 下列说法或化学用语的使用正确的是
A. 构造原理呈现 的能级交错源于光谱学实验
B. 符号为M的能层最多容纳的电子数为32个
C. 基态碳原子的价电子轨道表示式:
D. Cr的原子核外电子排布式:[Ar]3d44s2
24
7. X、Y、Z、W为短周期元素,X2-和Y+核外电子排布相同,X、Z位于同一主族,Y、Z、W位于同一周
期,W的最外层电子数是X、Y最外层电子数之和。下列说法不正确的是
A. 离子半径Z>X>Y
B. 第一电离能:Y<Z
学科网(北京)股份有限公司C. Y、W均属于元素周期表中的p区元素
D. X、Y、Z、W核电荷数逐渐增大
8. NaCl固体溶解过程及NaCl溶液导电的示意图如下。下列说法正确的是
A. 图①中,a离子为Na+,b离子为Cl−
B. 通电后,NaCl发生电离
C. 图②表示通电后,离子定向移动,推测X为电源正极
D. 金属导电是物理变化,电解质溶液导电也是物理变化
9. 下列化学用语表示正确的是
A.
碳酸显酸性:HCO=2H++CO2-
2 3 3
B. 碳酸钠溶液显碱性:CO2- +H O HCO- +OH−
3 2 3
⇌
C. 用FeCl 溶液腐蚀印刷线路板上的Cu:Fe3++Cu=Fe2++Cu2+
3
D. “84消毒液”中加少量醋增强漂白性:ClO−+H+=HClO
10. 常温下,1mol化学键形成(或断裂)的能量变化用E表示。下列说法不正确的是
化学键 H−H Cl−Cl H−Cl
E/(mol/L) 436 243 431
A. 1molH−Cl化学键的形成,放出431kJ的能量
B. H 和Cl 反应生成HCl的过程中,非极性键断裂,极性键形成
2 2
C. H(g)+Cl (g)=2HCl(g) ΔH=−248kJ/mol
2 2
D. 1molH (g)和1molCl (g)的总能量高于2molHCl(g)的总能量
2 2
11. 一定温度下的某恒容密闭容器中发生下列反应:C(s)+CO(g)⇌2CO(g) ΔH>0。下列有关该反应的描述
2
正确的是
A. 容器内气体的压强不变时,反应一定处于平衡状态
B. 当CO 的生成速率等于CO的生成速率时,反应一定处于平衡状态
2
学科网(北京)股份有限公司C. 其它条件不变,降低温度有利于提高CO 转化率
2
D. 增加C(s)的质量,促进平衡向正反应方向移动
12. 元素铬(Cr)的几种化合物存在下列转化关系:
❑
已知:Cr
2
O
7
2− +H
2
O⇌2CrO2
4
− +2H+。下列判断不正确的是
❑
A. 反应①表明Cr O 具有酸性氧化物的性质
2 3
B. 反应②KCrO 表现出还原性
2
C. 反应①③的化合价均没有发生变化
D. 反应③的颜色变化是由化学平衡移动引起的,则试剂A可以是NaOH溶液
13. 向HO 溶液中加入少量KI溶液,反应历程是:i.HO+I−=H O+IO−;ii.HO+IO-=H O+O↑+I−,HO 分
2 2 2 2 2 2 2 2 2 2 2
解反应过程中不加KI溶液和加入KI溶液的能量变化如下图所示。下列判断不正确的是
A. KI是HO 分解的催化剂
2 2
的
B. 曲线②代表加入KI 能量图
C. KI能增大HO 的分解速率
2 2
D. 反应i是放热反应,反应ii是吸热反应
14. 某小组同学进行如下实验探究:
已知:√1.6×10-24≈1.26×10-12,常温下,几种难溶物质的颜色和溶度积常数如下:
难溶电解质 颜色 Ksp
学科网(北京)股份有限公司ZnS 白色 1.6×10-24
CuS 黑色 1.3×10-36
FeS 黑色 6.3×10-18
下列说法中,不正确的是
A. ①中浊液生成的原因是:Zn2++S2−=ZnS↓
B. a中浊液中存在溶解平衡:ZnS(s)⇌Zn2+(aq)+S2−(aq)
C. 实验②和③生成黑色沉淀,可用相同的离子方程式表示
D. 若在试管b中滴加1mL0.1mol/LFeSO 溶液,白色沉淀可以转化为黑色沉淀
4
第二部分
本部分共5题,共58分。
15. 根据信息回答下列问题:
I.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
元素 Al Be Mg C Cl Na Li N Si O H
电负性 1.5 1.5 2.5 3.0 0.9 1.0 3.0 1.8 3.5 2.1
已知:
i.两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M−O−H
结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH−或H+。
(1)通过分析电负性的变化规律,确定Mg元素电负性的最小范围___________。
(2)判断下列物质是离子化合物还是共价化合物:
A.LiN B.BeCl C.AlCl D.SiC
3 2 3
①属于离子化合物的是___________(填字母)。
②请设计实验方案证明其为离子化合物___________。
(3)HClO水溶液显酸性而不显碱性的依据是___________。
II.元素原子的第一电离能I 随原子序数呈周期性变化,请解释:
1
(4)Na的第一电离能小于Li,从原子结构的角度解释其原因___________。
(5)S的第一电离能小于P,结合价电子排布式解释其原因___________。
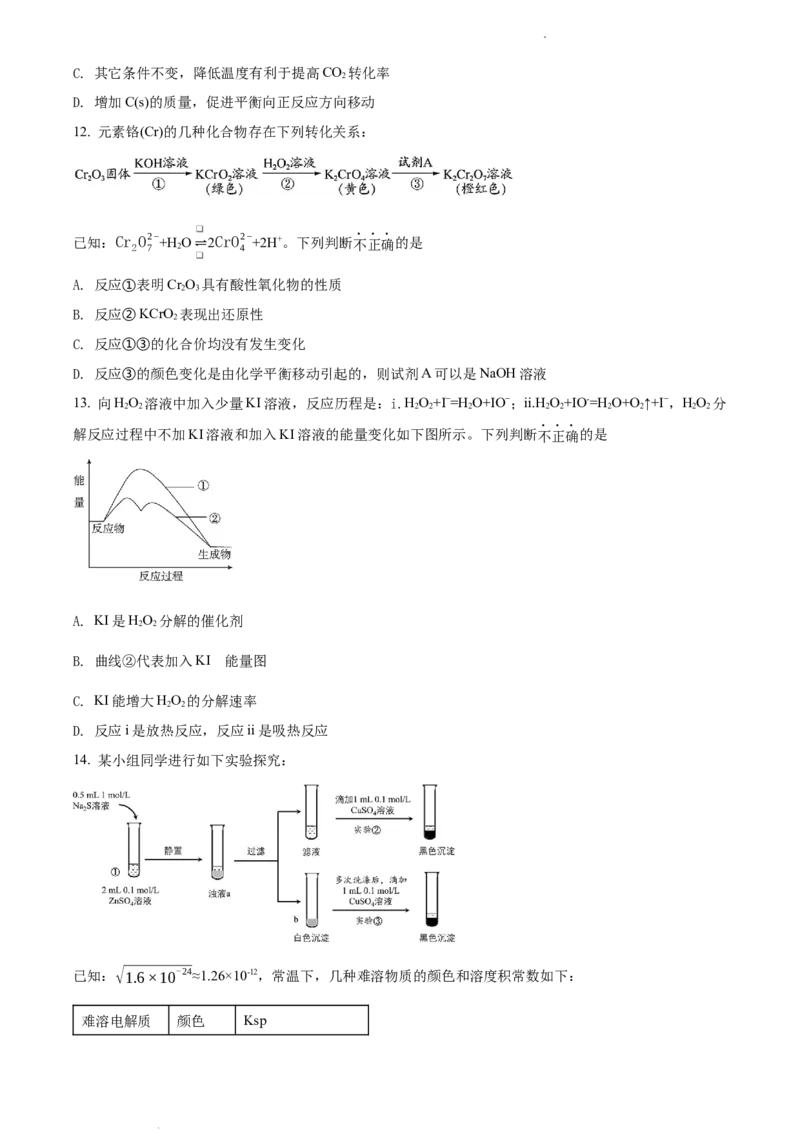
16. 电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
学科网(北京)股份有限公司①负极材料为Zn,其在此装置中的作用是___________。
②若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解
池,写出a端发生的电极反应___________。
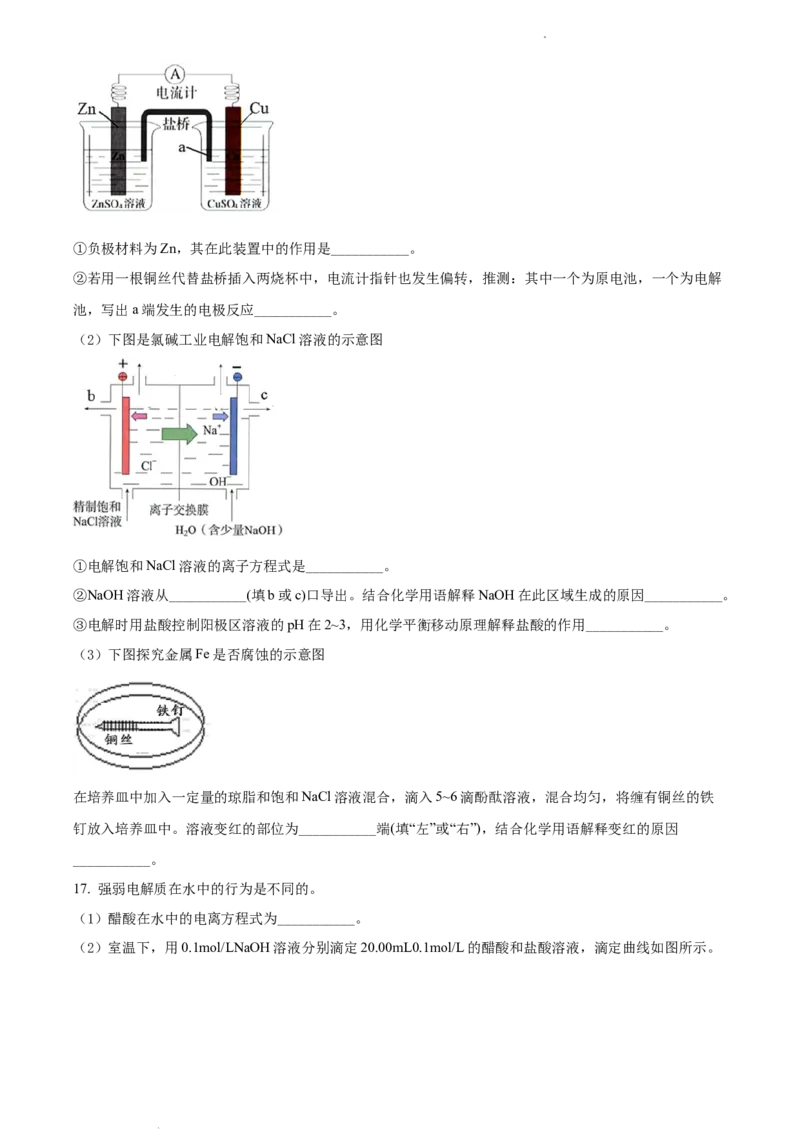
(2)下图是氯碱工业电解饱和NaCl溶液的示意图
①电解饱和NaCl溶液的离子方程式是___________。
②NaOH溶液从___________(填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因___________。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用___________。
(3)下图探究金属Fe是否腐蚀的示意图
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁
钉放入培养皿中。溶液变红的部位为___________端(填“左”或“右”),结合化学用语解释变红的原因
___________。
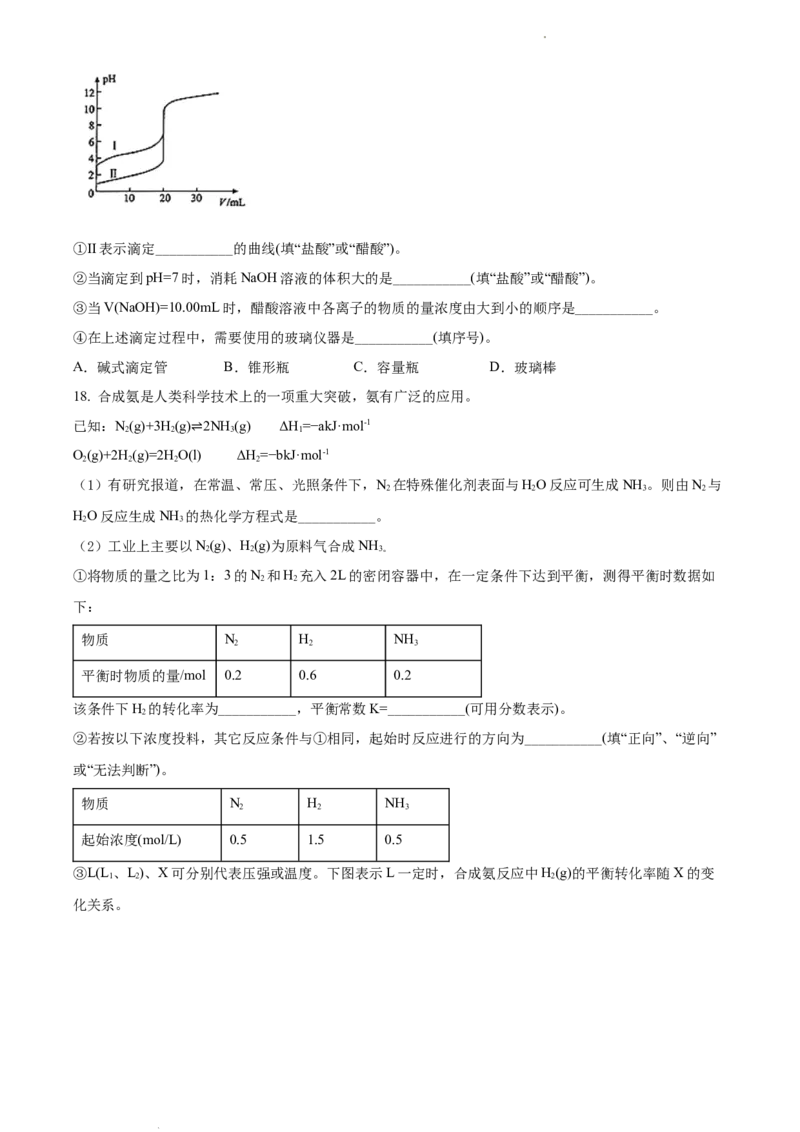
17. 强弱电解质在水中的行为是不同的。
(1)醋酸在水中的电离方程式为___________。
(2)室温下,用0.1mol/LNaOH溶液分别滴定20.00mL0.1mol/L的醋酸和盐酸溶液,滴定曲线如图所示。
学科网(北京)股份有限公司①II表示滴定___________的曲线(填“盐酸”或“醋酸”)。
②当滴定到pH=7时,消耗NaOH溶液的体积大的是___________(填“盐酸”或“醋酸”)。
③当V(NaOH)=10.00mL时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是___________。
④在上述滴定过程中,需要使用的玻璃仪器是___________(填序号)。
A.碱式滴定管 B.锥形瓶 C.容量瓶 D.玻璃棒
18. 合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N(g)+3H(g) 2NH (g) ΔH =−akJ·mol-1
2 2 3 1
O
2
(g)+2H
2
(g)=2H
2
O(⇌l) ΔH
2
=−bkJ·mol-1
(1)有研究报道,在常温、常压、光照条件下,N 在特殊催化剂表面与HO反应可生成NH 。则由N 与
2 2 3 2
HO反应生成NH 的热化学方程式是___________。
2 3
(2)工业上主要以N(g)、H(g)为原料气合成NH
2 2 3。
①将物质的量之比为1:3的N 和H 充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如
2 2
下:
物质 N H NH
2 2 3
平衡时物质的量/mol 0.2 0.6 0.2
该条件下H 的转化率为___________,平衡常数K=___________(可用分数表示)。
2
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________(填“正向”、“逆向”
或“无法判断”)。
物质 N H NH
2 2 3
起始浓度(mol/L) 0.5 1.5 0.5
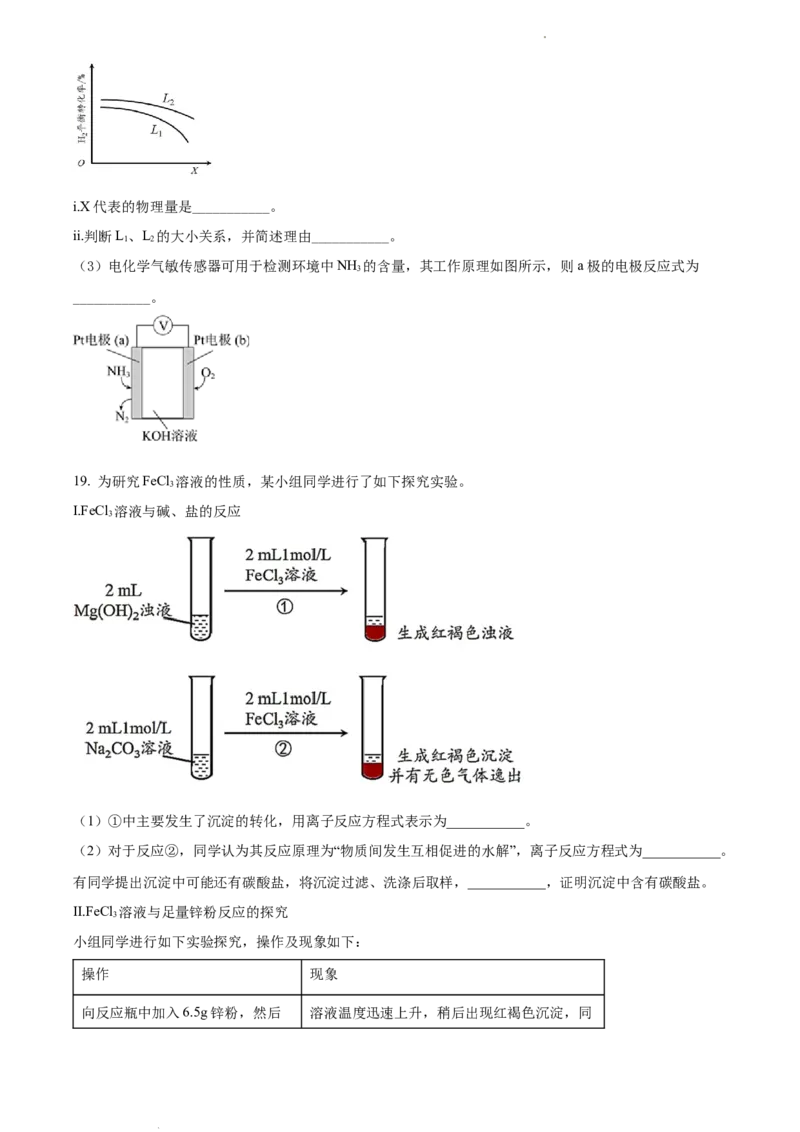
③L(L、L)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H(g)的平衡转化率随X的变
1 2 2
化关系。
学科网(北京)股份有限公司i.X代表的物理量是___________。
ii.判断L、L 的大小关系,并简述理由___________。
1 2
(3)电化学气敏传感器可用于检测环境中NH 的含量,其工作原理如图所示,则a极的电极反应式为
3
___________。
19. 为研究FeCl 溶液的性质,某小组同学进行了如下探究实验。
3
I.FeCl 溶液与碱、盐的反应
3
(1)①中主要发生了沉淀的转化,用离子反应方程式表示为___________。
(2)对于反应②,同学认为其反应原理为“物质间发生互相促进的水解”,离子反应方程式为___________。
有同学提出沉淀中可能还有碳酸盐,将沉淀过滤、洗涤后取样,___________,证明沉淀中含有碳酸盐。
II.FeCl 溶液与足量锌粉反应的探究
3
小组同学进行如下实验探究,操作及现象如下:
操作 现象
向反应瓶中加入6.5g锌粉,然后 溶液温度迅速上升,稍后出现红褐色沉淀,同
学科网(北京)股份有限公司加入50mL1.0mol·L−1的FeCl 溶 时出现少量气泡;反应一段时间后静置,上层
3
液,搅拌,充分反应 溶液为浅绿色,反应瓶底部有黑色固体
收集检验反应过程中产生的气体 集气管口靠近火焰,有爆鸣声
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na ZnO+H ↑
2 2 2
(3)结合实验现象和平衡移动原理解释出现红褐色沉淀的原因___________。
(4)用离子方程式表示溶液为浅绿色的原因___________。
(5)分离出黑色固体,经下列实验证实了其中含有的主要物质。
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸并加热,产生大量气泡;
的
iv.向iii反应后 溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是___________。
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe O,理由是___________。
3 4
学科网(北京)股份有限公司学科网(北京)股份有限公司