文档内容
浦东新区 2023 学年度第二学期期中教学质量检测
高三化学试卷
考生注意:
1.试卷满分100分,考试时间60分钟。
2.本考试分设试卷和答题纸。答题前,务必在答题纸上填写姓名、报名号、考场号和座位号,并将核对后的
条形码贴在指定位置上。作答必须涂或写在答题纸上,在试卷上作答一律不得分。
3.选择类试题中,标注“不定项”的试题,每小题有1~2个正确选项,只有1个正确选项的,多选不给分,
有2个正确选项的,漏选1个给一半分,错选不给分;未特别标注的试题,每小题只有1个正确选项。
相对原子质量:H–1 O–16 Si–28 Cu–64
一、地球的保护伞——臭氧(O )
3
自然界中的臭氧(O ),大多分布在距地面20~50km的大气臭氧层中,它能吸收对人体有害的紫外线,以保
3
护地球表面生物不受侵害。
1.O 和O 互为________(选填“同素异形体”或“同位素”)。
3 2
氧元素位于元素周期表的________区。
A.s B.p C.d D.f
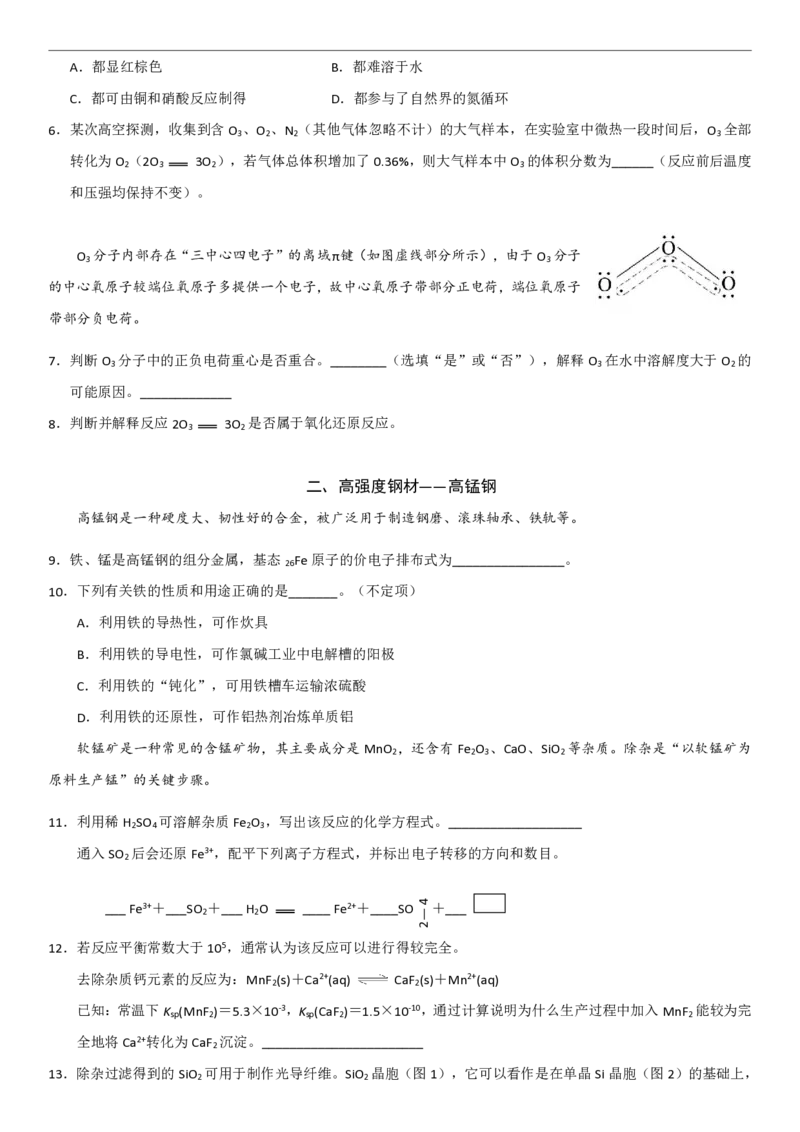
已知臭氧分子是由一个中心氧原子和两个端位氧原子构成的角形分子(如图),中心氧原子采用sp2杂化。
2.下列分子中,中心原子的杂化方式为sp2的是________。
A.H O B.Cl O
2 2
C.CO D.SO
2 2
3.中心原子采取sp2杂化的分子,其VSEPR模型的键角理论值为120°,但O 分子的键角仅为116.8°,键角变小是
3
因为______________________________________。
4.研究表明:氮氧化物(如NO)有催化作用,能加速臭氧的转化反应(2O 3O )。该转化过程由三步基元反
3 2
应构成:
第一步:NO+O O +NO
3 2 2
第二步:____________________________
第三步:O+O 2O
3 2
补全上述的第二步反应。
5.下列关于NO、NO 的叙述正确的是______。(不定项)
2A.都显红棕色 B.都难溶于水
C.都可由铜和硝酸反应制得 D.都参与了自然界的氮循环
6.某次高空探测,收集到含O 、O 、N (其他气体忽略不计)的大气样本,在实验室中微热一段时间后,O 全部
3 2 2 3
转化为O (2O 3O ),若气体总体积增加了0.36%,则大气样本中O 的体积分数为______(反应前后温度
2 3 2 3
和压强均保持不变)。
O 分子内部存在“三中心四电子”的离域π键(如图虚线部分所示),由于O 分子
3 3
的中心氧原子较端位氧原子多提供一个电子,故中心氧原子带部分正电荷,端位氧原子
带部分负电荷。
7.判断O 分子中的正负电荷重心是否重合。________(选填“是”或“否”),解释O 在水中溶解度大于O 的
3 3 2
可能原因。_____________
8.判断并解释反应2O 3O 是否属于氧化还原反应。
3 2
二、高强度钢材——高锰钢
高锰钢是一种硬度大、韧性好的合金,被广泛用于制造钢磨、滚珠轴承、铁轨等。
9.铁、锰是高锰钢的组分金属,基态 Fe原子的价电子排布式为________________。
26
10.下列有关铁的性质和用途正确的是_______。(不定项)
A.利用铁的导热性,可作炊具
B.利用铁的导电性,可作氯碱工业中电解槽的阳极
C.利用铁的“钝化”,可用铁槽车运输浓硫酸
D.利用铁的还原性,可作铝热剂冶炼单质铝
软锰矿是一种常见的含锰矿物,其主要成分是MnO ,还含有Fe O 、CaO、SiO 等杂质。除杂是“以软锰矿为
2 2 3 2
原料生产锰”的关键步骤。
11.利用稀H SO 可溶解杂质Fe O ,写出该反应的化学方程式。___________________
2 4 2 3
通入SO 后会还原Fe3+,配平下列离子方程式,并标出电子转移的方向和数目。
2
___Fe3++___SO +___H O ____Fe2++____SO
2 2
4—2 +___
12.若反应平衡常数大于105,通常认为该反应可以进行得较完全。
去除杂质钙元素的反应为:MnF (s)+Ca2+(aq) CaF (s)+Mn2+(aq)
2 2
已知:常温下K (MnF )=5.3×10-3,K (CaF )=1.5×10-10,通过计算说明为什么生产过程中加入MnF 能较为完
sp 2 sp 2 2
全地将Ca2+转化为CaF 沉淀。_______________________
2
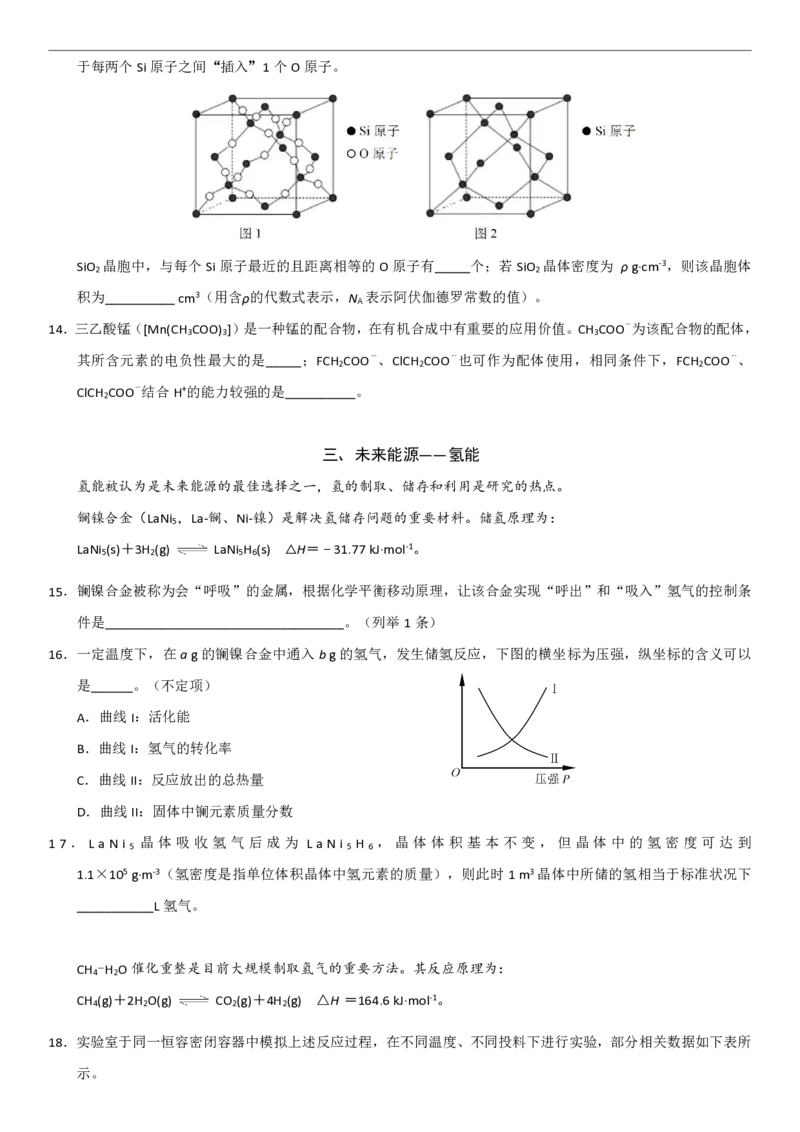
13.除杂过滤得到的SiO 可用于制作光导纤维。SiO 晶胞(图1),它可以看作是在单晶Si晶胞(图2)的基础上,
2 2于每两个Si原子之间“插入”1个O原子。
SiO 晶胞中,与每个Si原子最近的且距离相等的O原子有_____个;若SiO 晶体密度为 ρg·cm-3,则该晶胞体
2 2
积为__________cm3(用含ρ的代数式表示,N 表示阿伏伽德罗常数的值)。
A
14.三乙酸锰([Mn(CH COO) ])是一种锰的配合物,在有机合成中有重要的应用价值。CH COO―为该配合物的配体,
3 3 3
其所含元素的电负性最大的是_____;FCH COO―、ClCH COO―也可作为配体使用,相同条件下,FCH COO―、
2 2 2
ClCH COO―结合H+的能力较强的是__________。
2
三、未来能源——氢能
氢能被认为是未来能源的最佳选择之一,氢的制取、储存和利用是研究的热点。
镧镍合金(LaNi ,La-镧、Ni-镍)是解决氢储存问题的重要材料。储氢原理为:
5
LaNi
5
(s)+3H
2
(g) LaNi
5
H
6
(s) △H=–31.77kJ·mol-1。
15.镧镍合金被称为会“呼吸”的金属,根据化学平衡移动原理,让该合金实现“呼出”和“吸入”氢气的控制条
件是__________________________________。(列举1条)
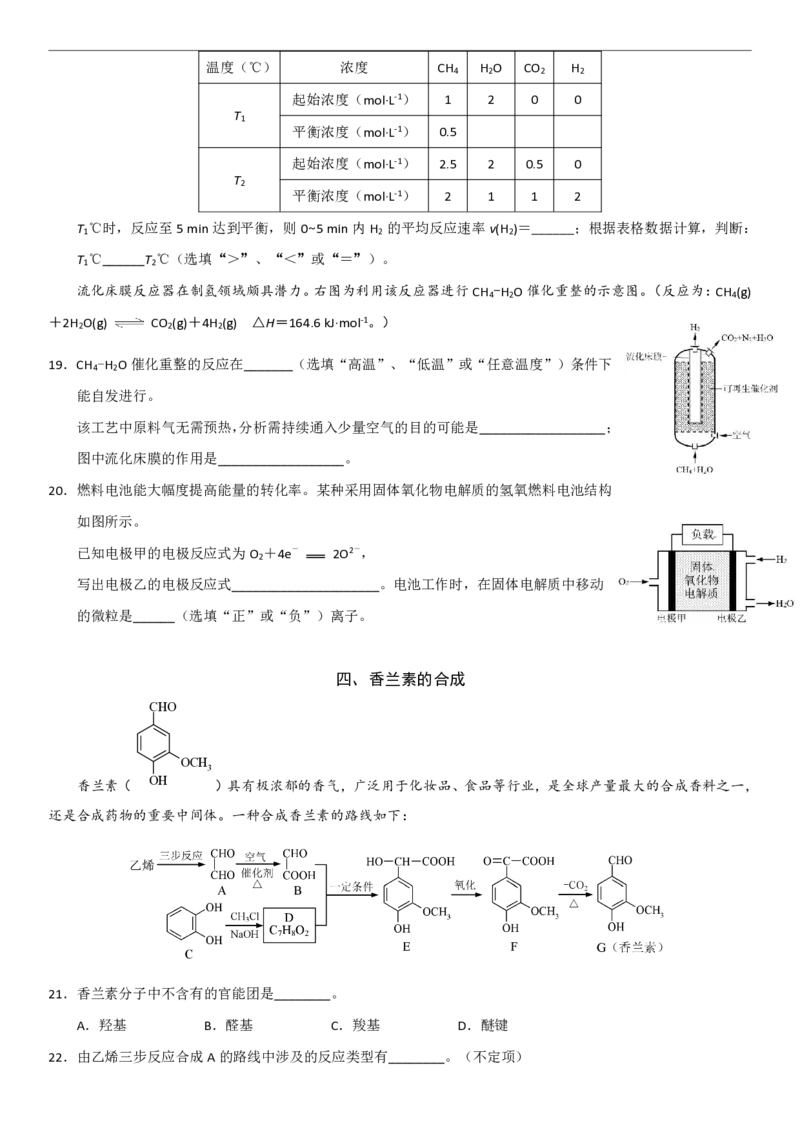
16.一定温度下,在ag的镧镍合金中通入bg的氢气,发生储氢反应,下图的横坐标为压强,纵坐标的含义可以
是______。(不定项)
A.曲线I:活化能
B.曲线I:氢气的转化率
C.曲线II:反应放出的总热量
D.曲线II:固体中镧元素质量分数
17.LaNi 晶体吸收氢气后成为 LaNi H ,晶体体积基本不变,但晶体中的氢密度可达到
5 5 6
1.1×105g·m-3(氢密度是指单位体积晶体中氢元素的质量),则此时1m3晶体中所储的氢相当于标准状况下
___________L氢气。
CH -H O催化重整是目前大规模制取氢气的重要方法。其反应原理为:
4 2
CH (g)+2H O(g) CO (g)+4H (g) △H =164.6kJ·mol-1。
4 2 2 2
18.实验室于同一恒容密闭容器中模拟上述反应过程,在不同温度、不同投料下进行实验,部分相关数据如下表所
示。温度(℃) 浓度 CH H O CO H
4 2 2 2
起始浓度(mol·L-1) 1 2 0 0
T
1
平衡浓度(mol·L-1) 0.5
起始浓度(mol·L-1) 2.5 2 0.5 0
T
2
平衡浓度(mol·L-1) 2 1 1 2
T
1
℃时,反应至5min达到平衡,则0~5min内H
2
的平均反应速率v(H
2
)=______;根据表格数据计算,判断:
T
1
℃______T
2
℃(选填“>”、“<”或“=”)。
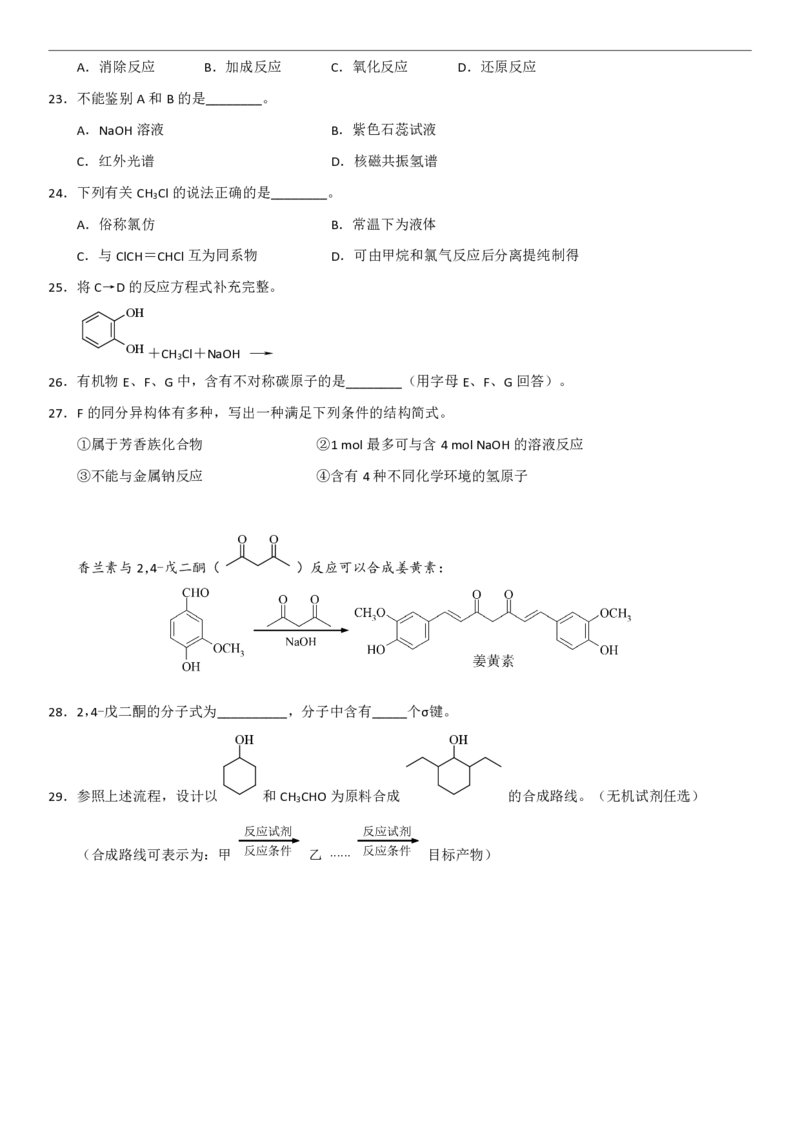
流化床膜反应器在制氢领域颇具潜力。右图为利用该反应器进行CH -H O催化重整的示意图。(反应为:CH (g)
4 2 4
+2H O(g) CO (g)+4H (g) △H=164.6kJ·mol-1。)
2 2 2
19.CH -H O催化重整的反应在_______(选填“高温”、“低温”或“任意温度”)条件下
4 2
能自发进行。
该工艺中原料气无需预热,分析需持续通入少量空气的目的可能是__________________;
图中流化床膜的作用是__________________。
20.燃料电池能大幅度提高能量的转化率。某种采用固体氧化物电解质的氢氧燃料电池结构
如图所示。
已知电极甲的电极反应式为O +4e― 2O2―,
2
写出电极乙的电极反应式_____________________。电池工作时,在固体电解质中移动
的微粒是______(选填“正”或“负”)离子。
四、香兰素的合成
CHO
OCH
3
香兰素( OH )具有极浓郁的香气,广泛用于化妆品、食品等行业,是全球产量最大的合成香料之一,
还是合成药物的重要中间体。一种合成香兰素的路线如下:
21.香兰素分子中不含有的官能团是________。
A.羟基 B.醛基 C.羧基 D.醚键
22.由乙烯三步反应合成A的路线中涉及的反应类型有________。(不定项)A.消除反应 B.加成反应 C.氧化反应 D.还原反应
23.不能鉴别A和B的是________。
A.NaOH溶液 B.紫色石蕊试液
C.红外光谱 D.核磁共振氢谱
24.下列有关CH Cl的说法正确的是________。
3
A.俗称氯仿 B.常温下为液体
C.与ClCH=CHCl互为同系物 D.可由甲烷和氯气反应后分离提纯制得
25.将C→D的反应方程式补充完整。
OH
OH+CH Cl+NaOH →
3
26.有机物E、F、G中,含有不对称碳原子的是________(用字母E、F、G回答)。
27.F的同分异构体有多种,写出一种满足下列条件的结构简式。
①属于芳香族化合物 ②1mol最多可与含4molNaOH的溶液反应
③不能与金属钠反应 ④含有4种不同化学环境的氢原子
O O
香兰素与2,4-戊二酮( )反应可以合成姜黄素:
28.2,4-戊二酮的分子式为__________,分子中含有_____个σ键。
OH OH
29.参照上述流程,设计以 和CH CHO为原料合成 的合成路线。(无机试剂任选)
3
(合成路线可表示为:甲 乙 ······ 目标产物)五、中国献给世界的化学礼物——黄铜
黄铜(Cu-Zn合金),外观酷似黄金,中国古代称为“諭石”或“諭铜”,我国陕西出土距今6700年的黄铜
碎片和断管,被誉为“中国献给世界的化学礼物”。
30.下列方法都能区分黄铜和黄金,其中利用了化学变化的是______。(不定项)
A.焰色反应 B.硬度测定 C.稀酸溶解 D.高温灼烧
31.试从金属活动性角度分析,青铜(Cu-Sn 合金)的大规模使用早于黄铜(Cu-Zn 合金)的原因可能是
__________________________。
实验室“碘量法测定黄铜中铜含量”的实验原理如下:
将一定质量的黄铜样品溶解后,配成一定体积的待测液,加入过量的KI溶液,发生反应①:2Cu2++4I- 2CuI↓
+ I , 用 N a S O 标 准 溶 液 滴 定 单 质 I , 发 生 反 应 ② :
2 2 2 3 2
I +2S O
2 2
3-2 2I-+S O
4
6-2 ,最终求出黄铜中铜的含量。(已知:Zn2+不干扰测定)
32.该实验所需的定量仪器有___________________(任写1种)。根据反应计量关系,确定合金中每含1gCu 最
终消耗cmol·L-1的Na S O 标准溶液______mL。(用含c的代数式表示)
2 2 3
33.实验中使用HCl-H
2
O
2
溶解黄铜样品,H
2
O
2
被称为“绿色氧化剂”的原因是______
_________________________________;溶解结束后需加热煮沸,使过量H O 尽快分解,否则可能使实验结果
2 2
偏大,因为_____________________________________。
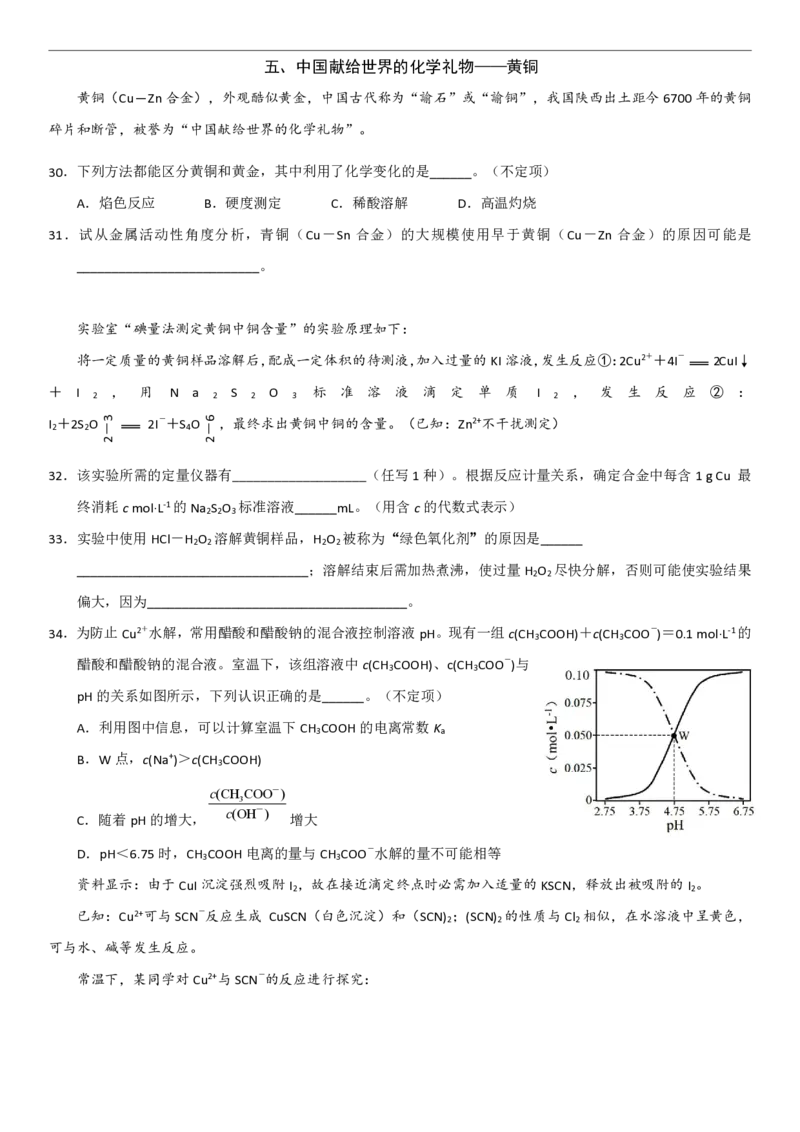
34.为防止Cu2+水解,常用醋酸和醋酸钠的混合液控制溶液pH。现有一组c(CH COOH)+c(CH COO-)=0.1mol·L-1的
3 3
醋酸和醋酸钠的混合液。室温下,该组溶液中c(CH COOH)、c(CH COO-)与
3 3
pH的关系如图所示,下列认识正确的是______。(不定项)
A.利用图中信息,可以计算室温下CH COOH的电离常数K
3 a
B.W点,c(Na+)>c(CH COOH)
3
c(CH COO-)
3
c(OH-)
C.随着pH的增大, 增大
D.pH<6.75时,CH COOH电离的量与CH COO-水解的量不可能相等
3 3
资料显示:由于CuI沉淀强烈吸附I ,故在接近滴定终点时必需加入适量的KSCN,释放出被吸附的I 。
2 2
已知:Cu2+可与SCN-反应生成 CuSCN(白色沉淀)和(SCN) ;(SCN) 的性质与Cl 相似,在水溶液中呈黄色,
2 2 2
可与水、碱等发生反应。
常温下,某同学对Cu2+与SCN-的反应进行探究:35.在pH=4的CuSO 溶液中加入pH=7的KSCN溶液后,pH下降的原因是________;
4
分析往b中加入1滴浓NaOH溶液后,产生少量白色沉淀的化学原理。_________