文档内容
2024 年高考考前仿真联考三
化学参考答案
一、选择题:本题共 14小题,每小题 3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B C A D C B A D B C B C D D
1.B
【解析】225Ac的中子数N 22589136,A项正确;
89
乙烷与O 反应生成乙烯和水,发生了氧化反应,B项错误;
2
葡萄糖和果糖分子式相同,结构不同,互为同分异构体,C项正确;
雄黄、雌黄中硫为2价,硫酸盐中硫为6价,硫元素化合价升高,氧气参与反应,发生了氧化还原反应,
D项正确。
2.C
【解析】PVAA含酯基,PNBAA含酯基、碳碳双键,它们的官能团种类不完全相同,A项错误;
PVAA的单体含酯基、碳碳双键、亚甲基,碳原子采用sp2、sp3杂化,PNBAA的单体含酯基、亚甲基、
碳碳三键,碳原子采取sp、sp2、sp3杂化,B项错误;
它们是高能材料,可作炸药,它们含酯基,在自然界中遇酸性、碱性条件可以发生水解反应生成小分子,
达到降解目的,C项正确;
PNBAA分子中1个链节含4个手性碳原子,高聚物的聚合度为n,故1mol PNBAA含:4n mol手性碳原
子,D项错误。
3.A
【解析】足量石灰水与NH、Fe2、SO2反应,正确的离子方程式为
4 4
2NH Fe2 2SO2 2Ca2 4OH 2NH H OFe OH 2CaSO ,A项错误;
4 4 3 2 2 4
通入Cl ,氧化Fe2,B项正确;
2
酸性KMnO 溶液氧化Fe2,C项正确;
4
反应生成FeCO ,促进HCO电离放出H,与过量的HCO结合产生CO ,D项正确。
3 3 3 2
4.D
【解析】曲霉甾A和曲霉甾B都不含酚羟基,遇氯化铁溶液不能发生显色反应,A项错误;
曲霉甾B不含苯环,不属于芳香族化合物,B项错误;
曲霉甾A和曲霉甾B的分子式相同,它们互为同分异构体,C项错误;
曲霉甾A和曲霉甾B均含羟基,分子间均能形成氢键,D项正确。
学科网(北京)股份有限公司5.C
【解析】根据图像可知,几种含硫物质的组成如下:
代号 a b c d e
化学式 H S S SO H SO Na SO(或NaHSO )
2 2 2 4 2 3 3
一定条件下,能实现H SSSO H SO 的转化,例如,H SO2SO2SO H2 O 2H SO ,
2 2 2 4 2 2 2 4
A项正确;
2H SSO S(还原产物)+2S(氧化产物)2H O,B项正确;
2 2 2
SO 不能漂白石蕊溶液,即向石蕊溶液中通入二氧化硫,溶液只变红色不褪色,C项错误;
2
△
Na SO S Na S O ,D项正确。
2 3 2 2 3
6.B
【解析】图示五种元素中,M的原子序数最大,由T化合物组成知,M为碱金属。根据短周期元素可知,
M为钠元素。由阴离子结构可知,X原子形成1个单键且原子序数最小,X为氢元素;W原子形成2个单
键,其最外层有6个电子,W为氧元素;依次类推,Y为碳元素,Z为氮元素。
氮、氧、碳的第一电离能依次减小,A项错误;
CO2、NO中C、N价层都有3个电子对,采用sp2杂化,空间结构为平面三角形,键角都是120,B
3 3
项正确;
H O、NH 、CH 的沸点依次降低,C项错误;
2 3 4
氧化钠的熔点高于氯化钠,且来源少、价格高,故工业上电解熔融氯化钠制备钠单质,节省能源,降低成
本,D项错误。
7.A
【解析】方案1用到“过滤”操作,需要使用漏斗,不需要分液漏斗,A项错误;
△
Cu2H SO (浓) CuSO 2H OSO ,参与反应的硫酸只有一半进入产品,且产生大气污
2 4 4 2 2
染物SO ,B项正确;
2
双氧水作氧化剂,C项正确;
空气中氧气作氧化剂,热空气同时提供热量,D项正确。
8.D
【解析】CO 中碳元素为4价,达到碳元素最高价,CO 转化成有机物X,碳元素的化合价降低,发生
2 2
还原反应,故a极为阴极,b极为阳极,发生氧化反应,A项错误;
在阴极上生成CH OH,在阳极上生成O ,B项错误;
3 2
学科网(北京)股份有限公司若X为乙烯,阴极反应式为2CO 12e 12H C H 4H O,生成1mol乙烯转移12mol电子,C
2 2 4 2
项错误;
b极反应式为2H O4e 4H O ,标准状况下11.2L O 即0.5mol O ,生成0.5mol O ,向a
2 2 2 2 2
极迁移2mol H,向b极迁移2mol OH,双极膜中水质量减少36g,D项正确。
9.B
【解析】碳的单质是非极性分子,A项正确;
SiF 呈正四面体形,SiF 中S价层有5个电子对,空间结构不是四面体形,B项错误;
4 4
硅晶体、锗晶体都是共价晶体,C项正确;
IO和SeO2中I、Se价层都有4个电子对,均采用sp3杂化,D项正确。
3 3
10.C
【解析】Nd O 6HCl 2NdCl 3H O,盐酸只表现酸性,A项正确;
2 3 3 2
采用降温结晶法获得氯化钕晶体,B项正确;
亚硫酰氯与结晶水反应:SOCl H O 2HClSO ,提供氯化氢,抑制NdCl 水解,C项错误;
2 2 2 3
阴极反应式为Nd3 3e Nd,D项正确。
11.B
【解析】常温下,二氧化锰与浓盐酸不发生反应,A项错误;
SO 能使酸性高锰酸钾溶液褪色,B项正确;
2
乙炔、硫化氢都能使溴水褪色,C项错误;
硝酸挥发出来,与硅酸钠反应生成硅酸,溶液变浑浊,不能说明碳的电负性大于硅,D项错误。
12.C
【解析】有机物1是催化剂,有机物2和3先生成,又被消耗,属于中间产物,A项正确;
总反应是取代反应,即—Nu取代了羟基,B项正确;
有机物2→3只断裂和形成了键,没有形成π键,C项错误;
有机催化剂中含苯环、亚甲基,苯环中碳原子采用sp2杂化,亚甲基中碳原子采用sp3杂化,D项正确。
13.D
c
HA
【解析】根据电离方程式和电离常数表达式可知,lg lgK pH ,
c H A a1
2
c
A2
c
NH
lg lgK pH,lg 4 lgK 14pH 。
c HA a2 c NH H O b
3 2
根据图像中a、b、c点数据计算:K 107103.97 103.03,K 109104.56 104.44,
a1 a2
学科网(北京)股份有限公司c
A2
K 109104.24 104.76。T点对应lg 6,pH4.44610.44,A项错误;
b
c
HA
c
HA
c
NH
K K
Q点对应的是 4 ,即 a1 b ,
c H A c NH H O c H c OH
2 3 2
变形得 K a1 K b ,解得c H 106.135。
c2
H
K
w
若Q点加入氨水体积为20.00mL,则溶液为0.05mol L的NH HA,
4
c
A2
c
H
c2
H
根据电离平衡常数可知,该溶液中以HA电离为主,K ,
a2 c HA 0.05
则c H 5103.22 106.135,故Q点对应溶液加入氨水体积大于20.00mL,B项错误;
加入氨水为40.00mL,恰好生成 NH A,
4 2
NH水解常数K NH 109.24,A2水解常数K A2 K w 109.56,
4 h 4 h1 K
a2
NH水解程度较大,对应溶液呈酸性,C项错误;
4
K2K K
104.762 103.03104.44
平衡常数K b a1 a2 1011.01,D项正确。
K2 10142
w
14.D
【解析】t min时,未达到水解平衡,水解反应向右进行,即正反应速率大于逆反应速率,A项正确;
2
t min时,达到水解平衡,正、逆反应速率都不等于0,B项正确;
3
通入氨气,消耗H,平衡向右移动,TiO2平衡水解率增大,C项正确;
根据水解反应式可知,v TiO2 c 3 c 2 molL1min1,D项错误。
2 t t
3 2
二、非选择题:本题共4小题,共 58分。
15.(14分)
(1)球形冷凝管(1分) b(1分)
(2)用酒精灯加热保温漏斗中的液体(1分)
(3)避免放热过多,使对硝基甲苯挥发,凝结在冷凝管壁(2分)
(4)降低产品溶解度(1分) 脱色(1分)
(5)使反应充分进行(1分) 避免温度降低过快,产品在烧杯壁析出(2分)
学科网(北京)股份有限公司(6)适当减小冷凝管的冷凝水流量,使对硝基甲苯熔融滴下(2分)
将对硝基苯甲酸钠转化成对硝基苯甲酸(2分)
【解析】(3)本反应是放热反应,加入硫酸过快,放出热量过多,导致对硝基甲苯挥发,如果遇到这种情
况,可用冷水冷却烧瓶。
(4)降低温度有利于产品析出。活性炭有吸附性,用于脱色。
(5)在沸水浴中加热,使反应完全,同时杂质能充分溶解。烧杯口大,散热快,导致产品在烧杯壁析出。
(6)冷凝管壁有白色反应物,减小冷凝水流量,提高温度使其熔融滴下。将滤液加入15%的硫酸中,可将
溶于水的对硝基苯甲酸钠转化为对硝基苯甲酸而析出,便于过滤分离。
16.(14分)
(1)过滤(1分) AD(2分,答对1个给1分,有错不给分)
高温
(2)TiO 2NaOH Na TiO H O (2分)
2 2 3 2
(3)将Na TiO 转化成TiO nH O(1分)
2 3 2 2
取最后流出洗涤液,滴加盐酸酸化,再加入BaCl 溶液,若不产生白色沉淀,则已洗涤干净(或测定洗涤
2
液pH,中性时已洗涤干净)(2分)
(4)阳极产生氧气,石墨在高温下可被氧气氧化,补充炭块可以消耗氧气,减轻石墨电极的氧化等合理答
案(2分)
(5)通入一段时间干燥的氢气后才加热(1分)
1.61032
(6)6(1分) (2分)
N a3
A
【解析】(1)“操作B”为灼烧,不需要烧杯、分液漏斗。
(2)二氧化钛与氢氧化钠在高温下反应生成钛酸钠和水。
(3)“水洗”除去硫酸,可以通过检验硫酸根离子或测定溶液pH的方法检验“水洗”是否洗净。
(4)类似电解熔融氧化铝制备铝,阳极上产生氧气,在高温下,阳极石墨被氧化生成二氧化碳或一氧化碳,
石墨阳极损失,补充炭块,减少石墨阳极损失。
(5)通入干燥的氢气排尽空气。
4832 2 1.61032
(6)1个晶胞含2个“TiO ”,晶体密度 gcm3 gcm3 。
2 N a1010 3 N a3
A
A
17.(15分)
(1)116.8(2分)
(2)BD(2分)
(3)Cat2(1分) 不是(1分) 催化剂活性降低(2分)
1
(4)>(2分) p(2分)
7
(5)C H 10CO2 20e 13CO 4H O(2分) CO (1分)
3 8 3 2 2 2
学科网(北京)股份有限公司【解析】(1)三种可燃物燃烧热的热化学方程式如下:
①C H g 5O g 3CO g 4H O l H 2220kJmol1
3 8 2 2 2 1
9
②C H g O g 3CO g 3H O l H 2051kJmol1
3 6 2 2 2 2 2
1
③H g O g H O l H 285.8kJmol1
2 2 2 2 3
根据盖斯定律,①-②-③得目标反应,故H 22202051285.8 kJmol1116.8kJmol1。
(2)可逆反应只部分转化,H 体积分数小于50%,A项错误;
2
正反应是吸热反应,升高温度,平衡向右移动,平衡常数增大,B项正确;
气体总质量不变,容器容积不变,密度始终不变,C项错误;
平衡后,再充入少量丙烷,相当于对原平衡加压,平衡向左移动,丙烷平衡转化率减小,D项正确。
故选BD。
(3)相同温度下,单位时间内Cat2催化下转化率较高,说明反应速率较大,即活化能降低较大,催化效能
较高。温度相同,平衡常数与催化剂无关,而b、a点转化率不同,故b点不是平衡点。温度升高,在催化
剂Cat1作用下转化率降低,说明催化剂活性降低。
(4)其他条件相同,升高温度,平衡向右移动,平衡转化率增大,T 高于T 。m、n点转化率相同,温度
1 2
高,平衡时速率较大,即mn。设起始取丙烷为1mol、Ar为2mol。
达到Q点时平衡体系中有0.5mol C H 、0.5mol C H 、0.5mol H 、2mol Ar,总物质的量为3.5mol。
3 8 3 6 2
0.5mol 1
p C H p C H p H pkPa p kPa,
3 8 3 6 2 3.5mol 7
p
C H
p
H
1
故K 3 6 2 p kPa 。
p p C H 7
3 8
(5)丙烷在负极发生氧化反应,结合碳酸根离子生成CO ,
2
负极反应式为C H 10CO2 20e 13CO 4H O,
3 8 3 2 2
正极反应式为O 4e 2CO 2CO2,
2 2 3
空气中CO 体积分数为0.03%,O 体积分数为21%,由正极反应式可知,空气中CO 含量不满足电极反
2 2 2
应,故通入的空气中应充入CO ,可以从负极区分离CO ,循环用于正极区。
2 2
18.(15分)
(1)酮羰基、醚键(2分) 6(1分) 6(1分)
(2)b(1分)
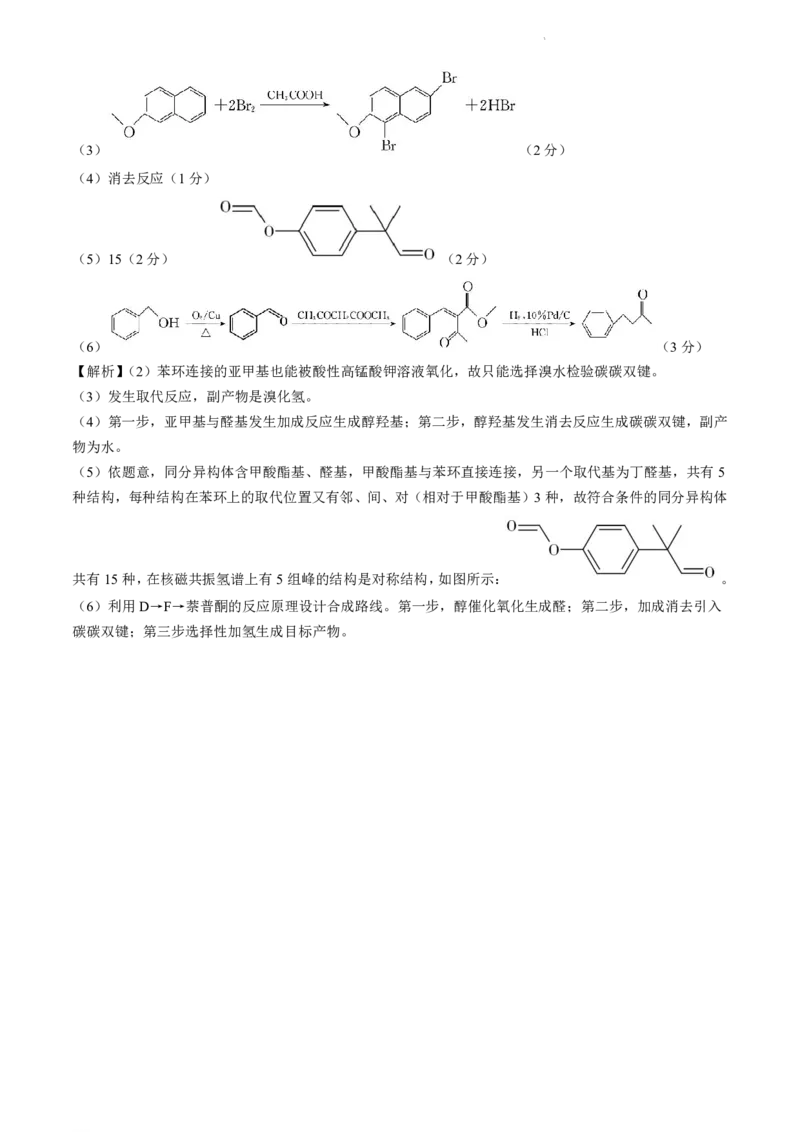
学科网(北京)股份有限公司(3) (2分)
(4)消去反应(1分)
(5)15(2分) (2分)
(6) (3分)
【解析】(2)苯环连接的亚甲基也能被酸性高锰酸钾溶液氧化,故只能选择溴水检验碳碳双键。
(3)发生取代反应,副产物是溴化氢。
(4)第一步,亚甲基与醛基发生加成反应生成醇羟基;第二步,醇羟基发生消去反应生成碳碳双键,副产
物为水。
(5)依题意,同分异构体含甲酸酯基、醛基,甲酸酯基与苯环直接连接,另一个取代基为丁醛基,共有5
种结构,每种结构在苯环上的取代位置又有邻、间、对(相对于甲酸酯基)3种,故符合条件的同分异构体
共有15种,在核磁共振氢谱上有5组峰的结构是对称结构,如图所示: 。
(6)利用D→F→萘普酮的反应原理设计合成路线。第一步,醇催化氧化生成醛;第二步,加成消去引入
碳碳双键;第三步选择性加氢生成目标产物。
学科网(北京)股份有限公司