文档内容
长郡中学 2024 届高考适应性考试(二)
化学
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 K-39
第Ⅰ卷
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.绿色发展推动人与自然和谐共生。下列有关说法错误的是
A.要推进美丽中国建设,坚持山、水、林、田、湖、草、沙一体化保护和系统治理
B.为满足工业发展的需求,要采用新技术快速开采煤、石油、天然气
C.城市公交采用电动机车替代燃油机车,可推进“碳达峰”、“碳中和”,有利于推动绿色发展
D.化工企业应确保“三废”处理设施各个环节及装置始终处于良好状态,实现“三废”稳定达标排放
2.下列有关医学典籍记载的物质中颜色为蓝色的是
A.《神农本草经》:硫磺味酸,坚筋骨,除头秃
B.《本草图经》:胆矾治螂牙,鼻内息肉
C.《神农本草经》:生石膏是清热药之一,单用有清热泻火、除烦止渴等功效
D.《品汇精要》:芒硝咸寒,具有润下软坚、泻热通便、清热解毒、消肿之功效
3.草酸(HOOC一COOH)具有较强的还原性,易被次氯酸钠氧化成二氧化碳和水,化学方程式为HOOC一
COOH+NaClO=NaCl+2CO ↑+H O,下列符号表征或说法正确的是
2 2
A.HO空间结构:V形 B.CO 空间填充模型:
2 2
C.Na、CI均位于元素周期表p区 D.草酸的电离方程式:HC O +2H+
2 2 4
4.S Cl 常用于制作橡胶的粘结剂,SCl 与水反应的化学方程式为2 S Cl+2HO=SO ↑+3S↓+4HCl。设N
2 2 2 2 2 2 2 2 A
表示阿伏加德罗常数的值。下列说法错误的是
A.32gS 与32gS 均含有N 个硫原子
2 8 A
B.0.1molS Cl 含有6.6N 个质子
2 2 A
C.标准状况下,2.24LSO 中S原子的孤电子对数为0.1N
2 A
D.若有4molHCl生成,则该反应中转移的电子数为6N
A
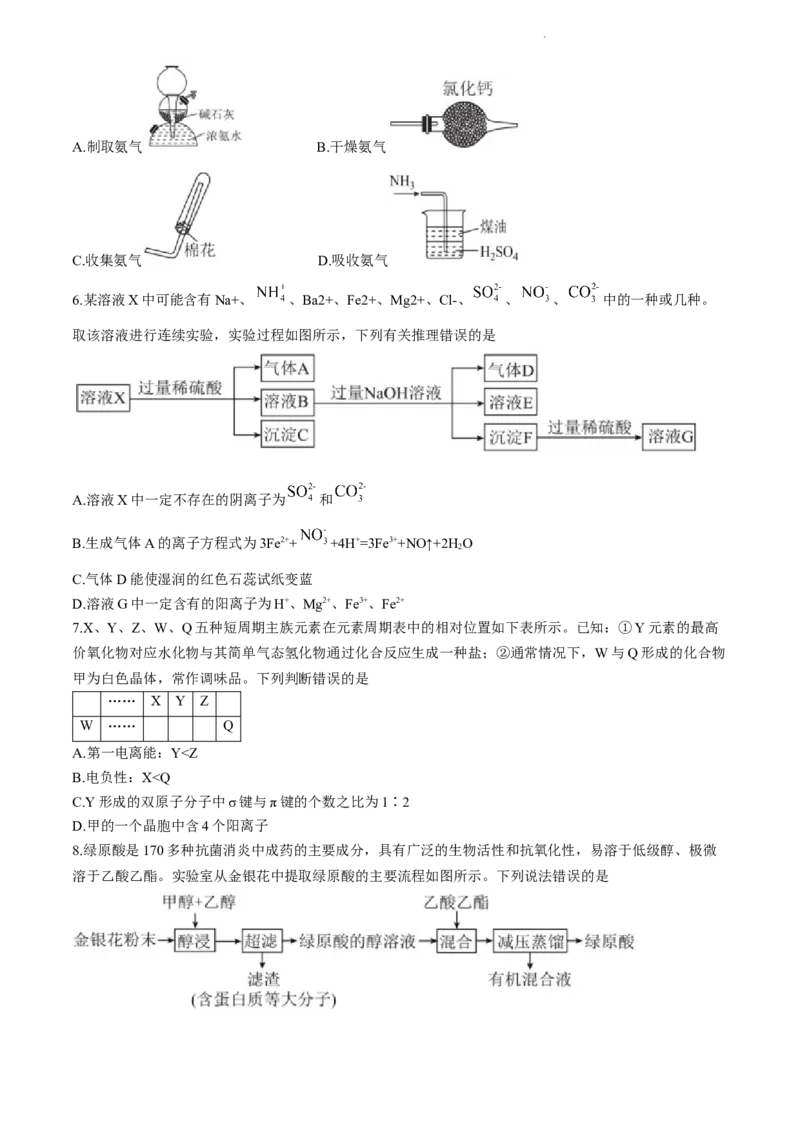
5.用浓氨水和碱石灰反应生成NH ,下列装置能达到实验目的的是
3
学科网(北京)股份有限公司A.制取氨气 B.干燥氨气
C.收集氨气 D.吸收氨气
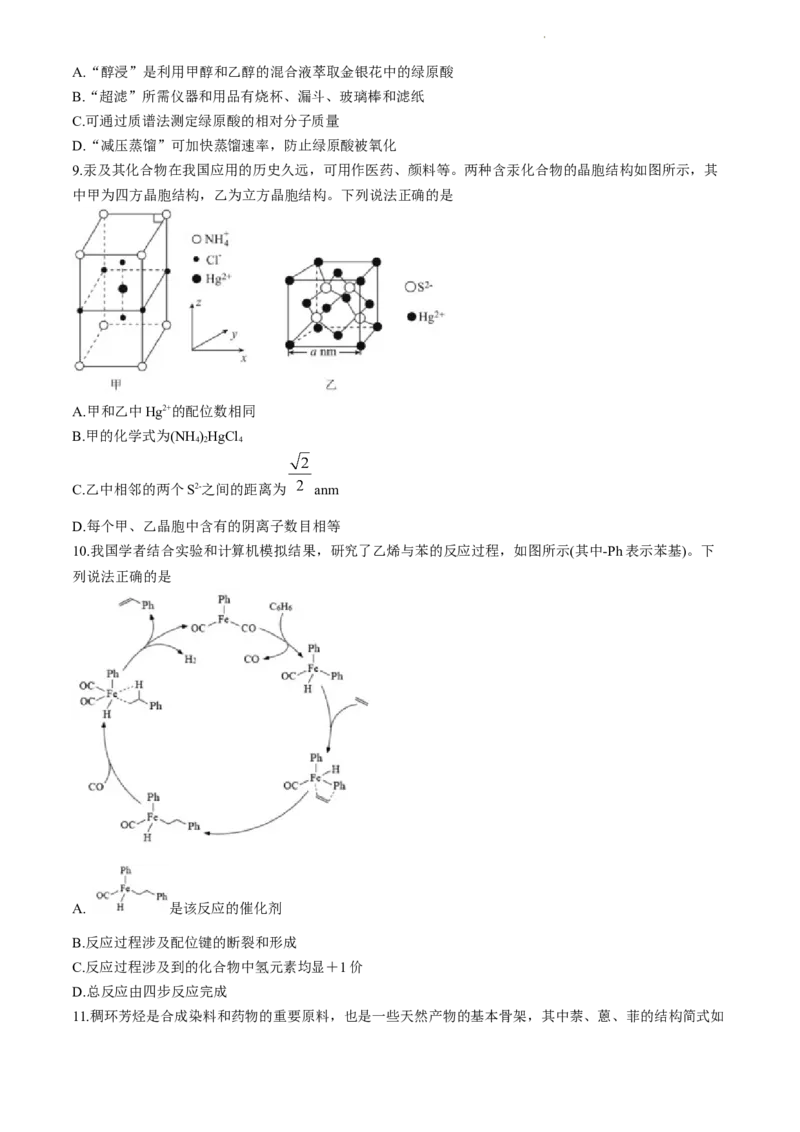
6.某溶液X中可能含有Na+、 、Ba2+、Fe2+、Mg2+、Cl-、 、 、 中的一种或几种。
取该溶液进行连续实验,实验过程如图所示,下列有关推理错误的是
A.溶液X中一定不存在的阴离子为 和
B.生成气体A的离子方程式为3Fe2++ +4H+=3Fe3++NO↑+2HO
2
C.气体D能使湿润的红色石蕊试纸变蓝
D.溶液G中一定含有的阳离子为H+、Mg2+、Fe3+、Fe2+
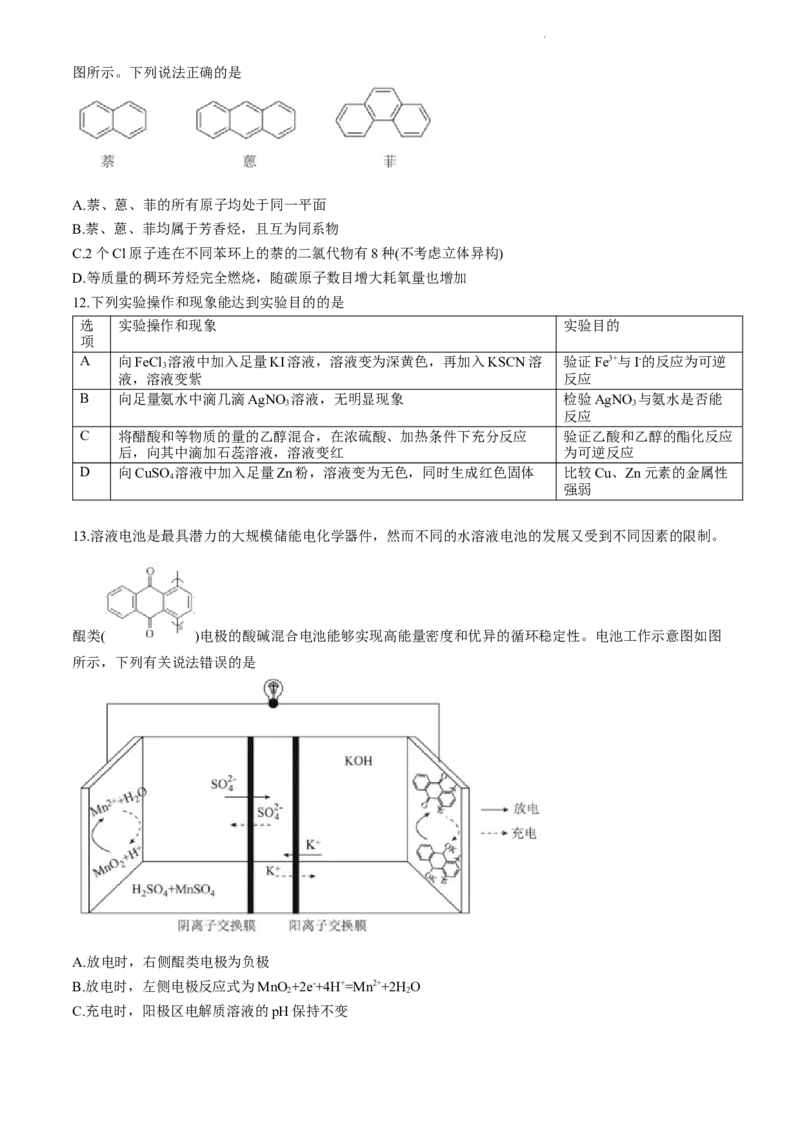
7.X、Y、Z、W、Q五种短周期主族元素在元素周期表中的相对位置如下表所示。已知:①Y元素的最高
价氧化物对应水化物与其简单气态氢化物通过化合反应生成一种盐;②通常情况下,W与Q形成的化合物
甲为白色晶体,常作调味品。下列判断错误的是
…… X Y Z
W …… Q
A.第一电离能:Yc( )>c(H PO )
3 3
第Ⅱ卷
二、非选择题:本题共4小题,共58分。
15.(15分)
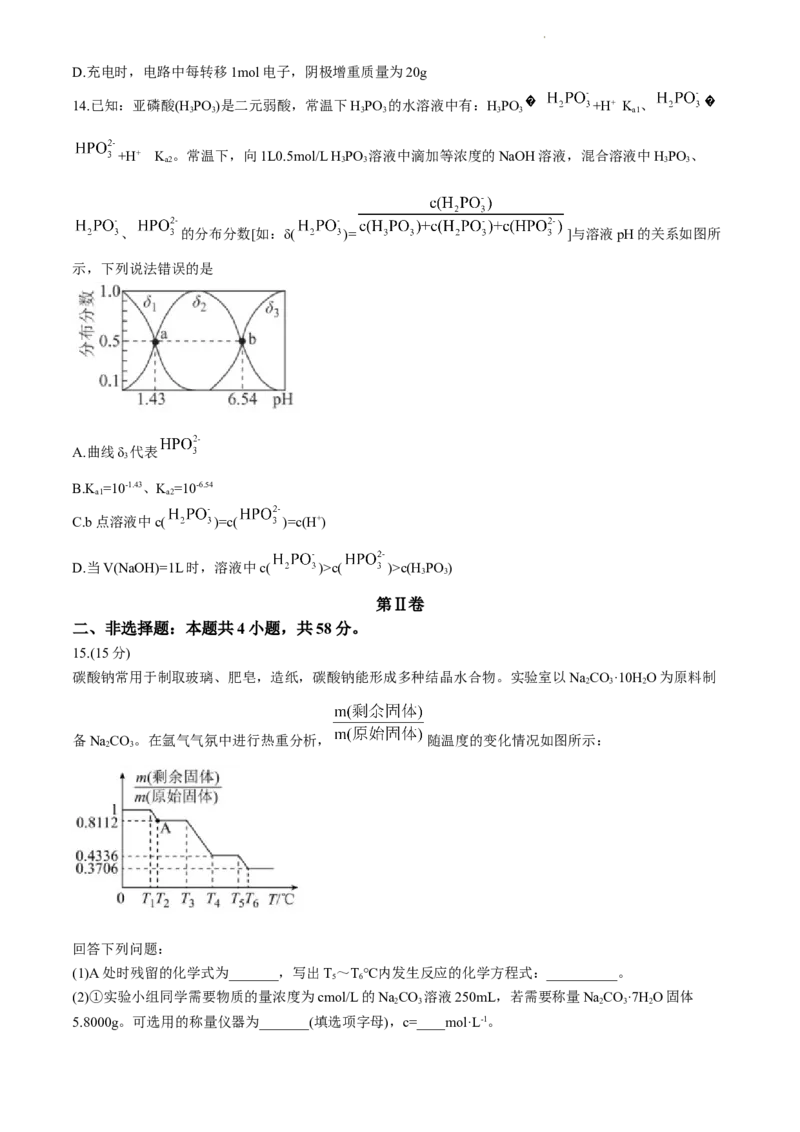
碳酸钠常用于制取玻璃、肥皂,造纸,碳酸钠能形成多种结晶水合物。实验室以NaCO·10H O为原料制
2 3 2
备NaCO。在氩气气氛中进行热重分析, 随温度的变化情况如图所示:
2 3
回答下列问题:
(1)A处时残留的化学式为_______,写出T~T℃内发生反应的化学方程式:__________。
5 6
(2)①实验小组同学需要物质的量浓度为cmol/L的NaCO 溶液250mL,若需要称量NaCO·7H O固体
2 3 2 3 2
5.8000g。可选用的称量仪器为_______(填选项字母),c=____mol·L-1。
学科网(北京)股份有限公司A.杆秤 B.弹簧秤 C.托盘天平 D.分析天平
②实验小组同学用未知物质的量浓度的盐酸滴定①配制的NaCO 溶液,以测定盐酸的浓度。滴定的主要步
2 3
骤如下:
a.取①配制的NaCO 溶液25.00mL于锥形瓶中,滴加2~3滴甲橙。
2 3
b.用未知物质的量浓度的盐酸进行滴定,当到达滴定终点时,消耗盐酸VmL。
c.平行测定三次,消耗盐酸的体积数据如下表所示:
实验序号 1 2 3
消耗盐酸溶液体积/mL 25.86 25.06 24.94
d.数据处理。
滴定终点的现象为_______,滴定过程中NaCO 与盐酸分步反应的离子方程式依次为______、______,盐
2 3
酸的浓度为______mol·L-1。
(3)在滴定过程中,初始时平视读数,终点时俯视读数(其他操作均正确),盐酸的物质的量浓度将______ (填
“偏大”“偏小”或“无影响”)。
(4)下列实验方案用于证明久置的NaCO 固体中是否含有NaHCO 。结合实验结论,补充实验现象。
2 3 3
实验方 选择的装置 实验操作 实验现象 实验结论
案
一 AB 加热大试管 B中澄清石灰水不变浑浊 样品中不含NaHCO
3
二 ACB 加热大试管 _________ 样品中含NaHCO
3
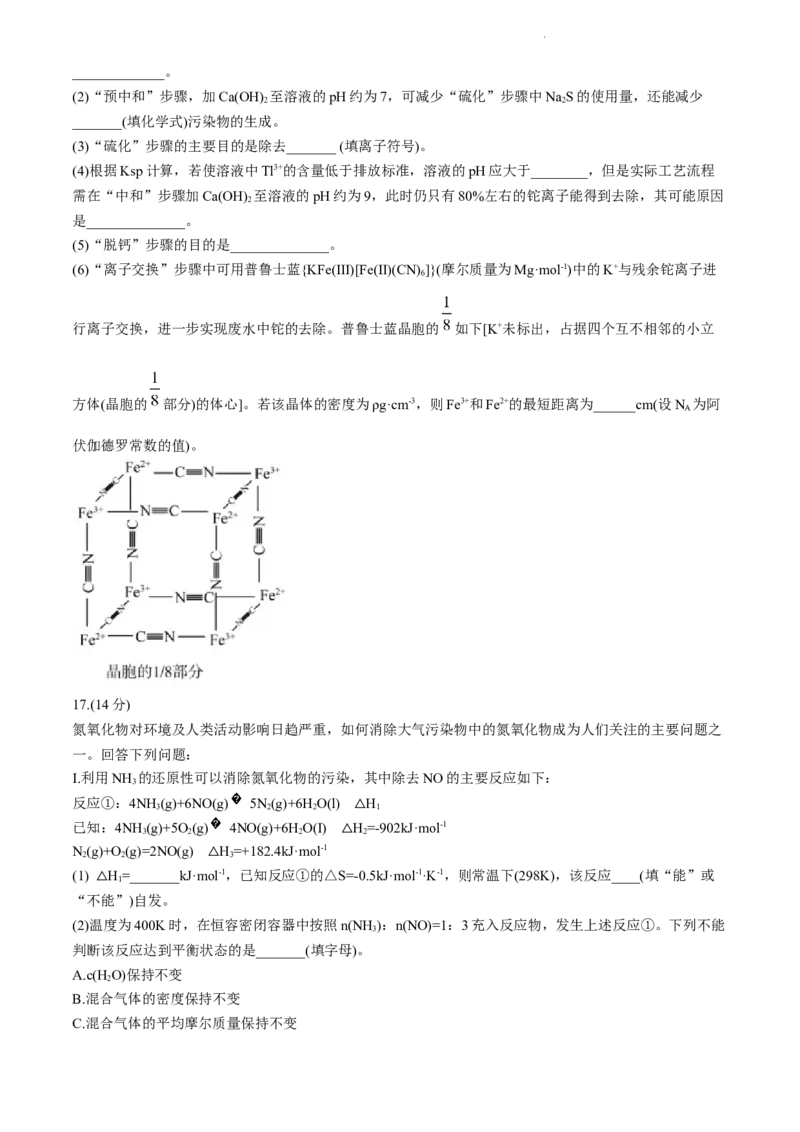
16.(14分)
湿法炼锌工业废水中主要阳离子有Zn2+、H+、TI+、Tl3+。废水除铊的工艺流程如下。
已知:
①TI+能够在pH为0~14的范围内以离子态稳定存在,不易与OH-形成沉淀
②Tl3+易与废水中的有机物分子形成稳定的配合物,为了简便,通常用Tl3+表示
③部分物质的Ksp
物 Zn(OH) TI(OH) ZnS TlS
2 3 2
质
Ksp 6.8×10-17 1.5×10-44 1.6×10-24 5.0×10-21
④排放标准:Tl的含量低于1.5×10-8mol·L-1
请回答:
(1)已知“氧化”步骤中KMnO 被还原为MnO 且Tl+氧化不彻底,写出该反应的离子方程式:
4 2
学科网(北京)股份有限公司_____________。
(2)“预中和”步骤,加Ca(OH) 至溶液的pH约为7,可减少“硫化”步骤中NaS的使用量,还能减少
2 2
_______(填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去_______ (填离子符号)。
(4)根据Ksp计算,若使溶液中Tl3+的含量低于排放标准,溶液的pH应大于________,但是实际工艺流程
需在“中和”步骤加Ca(OH) 至溶液的pH约为9,此时仍只有80%左右的铊离子能得到去除,其可能原因
2
是______________。
(5)“脱钙”步骤的目的是______________。
(6)“离子交换”步骤中可用普鲁士蓝{KFe(Ⅲ)[Fe(Ⅱ)(CN) ]}(摩尔质量为Mg·mol-1)中的K+与残余铊离子进
6
行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[K+未标出,占据四个互不相邻的小立
方体(晶胞的 部分)的体心]。若该晶体的密度为ρg·cm-3,则Fe3+和Fe2+的最短距离为______cm(设N 为阿
A
伏伽德罗常数的值)。
17.(14分)
氮氧化物对环境及人类活动影响日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之
一。回答下列问题:
Ⅰ.利用NH 的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:
3
反应①:4NH (g)+6NO(g) 5N(g)+6HO(l) H
3 2 2 1
已知:4NH (g)+5O(g) 4NO(g)+6H O(I) H=-902kJ·mol-1
3 2 2 △2
N(g)+O(g)=2NO(g) H=+182.4kJ·mol-1
2 2 3 △
(1) H=_______kJ·mol-1,已知反应①的△S=-0.5kJ·mol-1·K-1,则常温下(298K),该反应____(填“能”或
1 △
“不能”)自发。
△
(2)温度为400K时,在恒容密闭容器中按照n(NH ):n(NO)=1:3充入反应物,发生上述反应①。下列不能
3
判断该反应达到平衡状态的是_______(填字母)。
A.c(HO)保持不变
2
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
学科网(北京)股份有限公司D.有3molN—H断裂的同时,有6molO—H生成
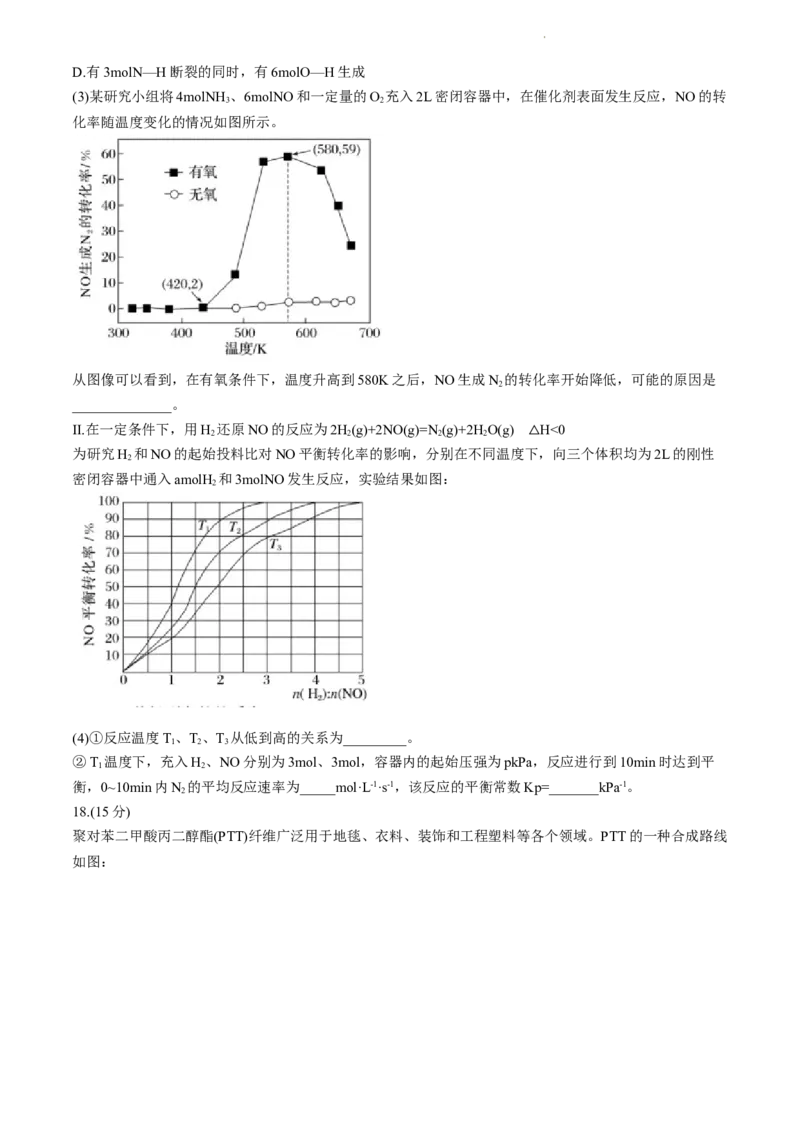
(3)某研究小组将4molNH 、6molNO和一定量的O 充入2L密闭容器中,在催化剂表面发生反应,NO的转
3 2
化率随温度变化的情况如图所示。
从图像可以看到,在有氧条件下,温度升高到580K之后,NO生成N 的转化率开始降低,可能的原因是
2
______________。
Ⅱ.在一定条件下,用H 还原NO的反应为2H(g)+2NO(g)=N (g)+2HO(g) H<0
2 2 2 2
为研究H 和NO的起始投料比对NO平衡转化率的影响,分别在不同温度下,向三个体积均为2L的刚性
2 △
密闭容器中通入amolH 和3molNO发生反应,实验结果如图:
2
(4)①反应温度T、T、T 从低到高的关系为_________。
1 2 3
②T 温度下,充入H、NO分别为3mol、3mol,容器内的起始压强为pkPa,反应进行到10min时达到平
1 2
衡,0~10min内N 的平均反应速率为_____mol·L-1·s-1,该反应的平衡常数Kp=_______kPa-1。
2
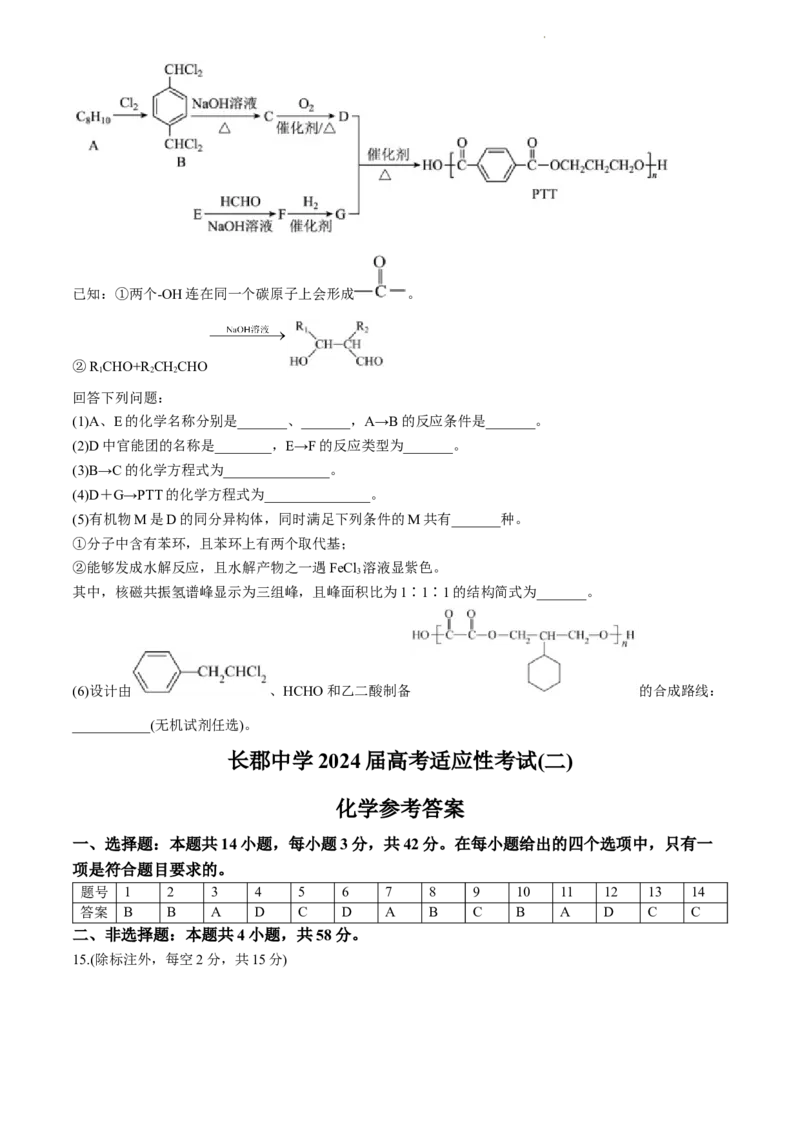
18.(15分)
聚对苯二甲酸丙二醇酯(PTT)纤维广泛用于地毯、衣料、装饰和工程塑料等各个领域。PTT的一种合成路线
如图:
学科网(北京)股份有限公司已知:①两个-OH连在同一个碳原子上会形成 。
②R CHO+R CHCHO
1 2 2
回答下列问题:
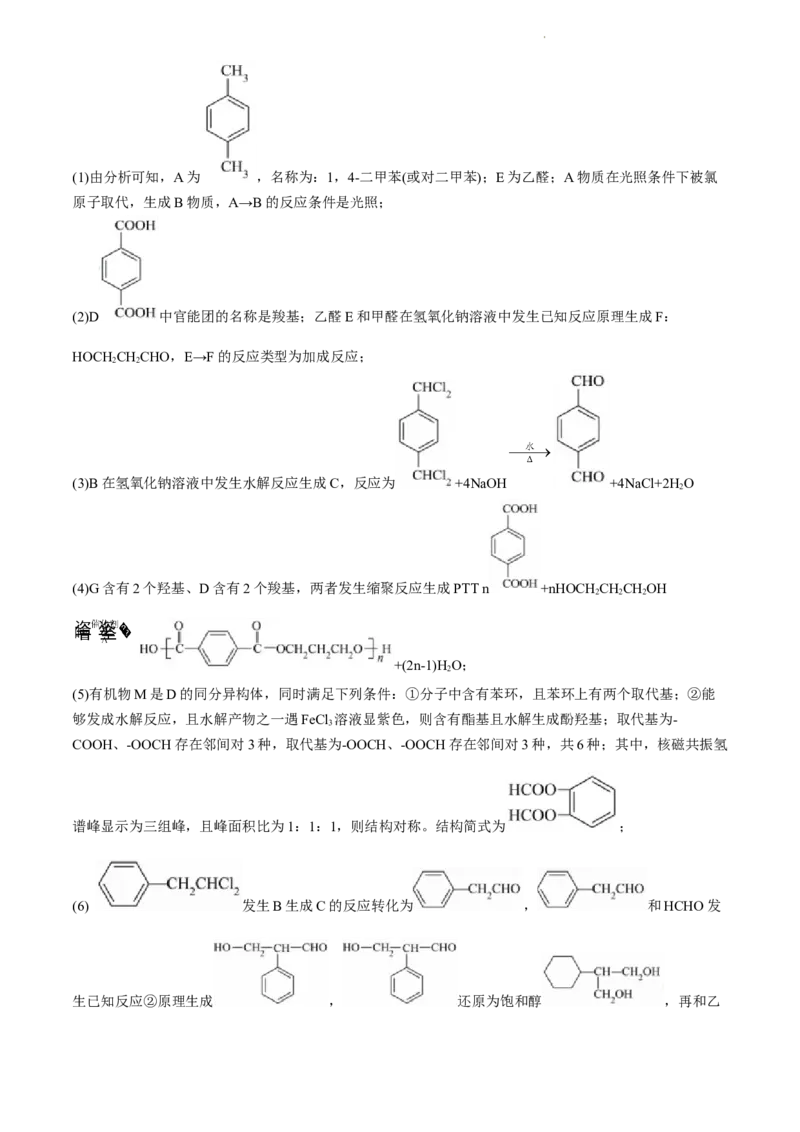
(1)A、E的化学名称分别是_______、_______,A→B的反应条件是_______。
(2)D中官能团的名称是________,E→F的反应类型为_______。
(3)B→C的化学方程式为_______________。
(4)D+G→PTT的化学方程式为_______________。
(5)有机物M是D的同分异构体,同时满足下列条件的M共有_______种。
①分子中含有苯环,且苯环上有两个取代基;
②能够发成水解反应,且水解产物之一遇FeCl 溶液显紫色。
3
其中,核磁共振氢谱峰显示为三组峰,且峰面积比为1∶1∶1的结构简式为_______。
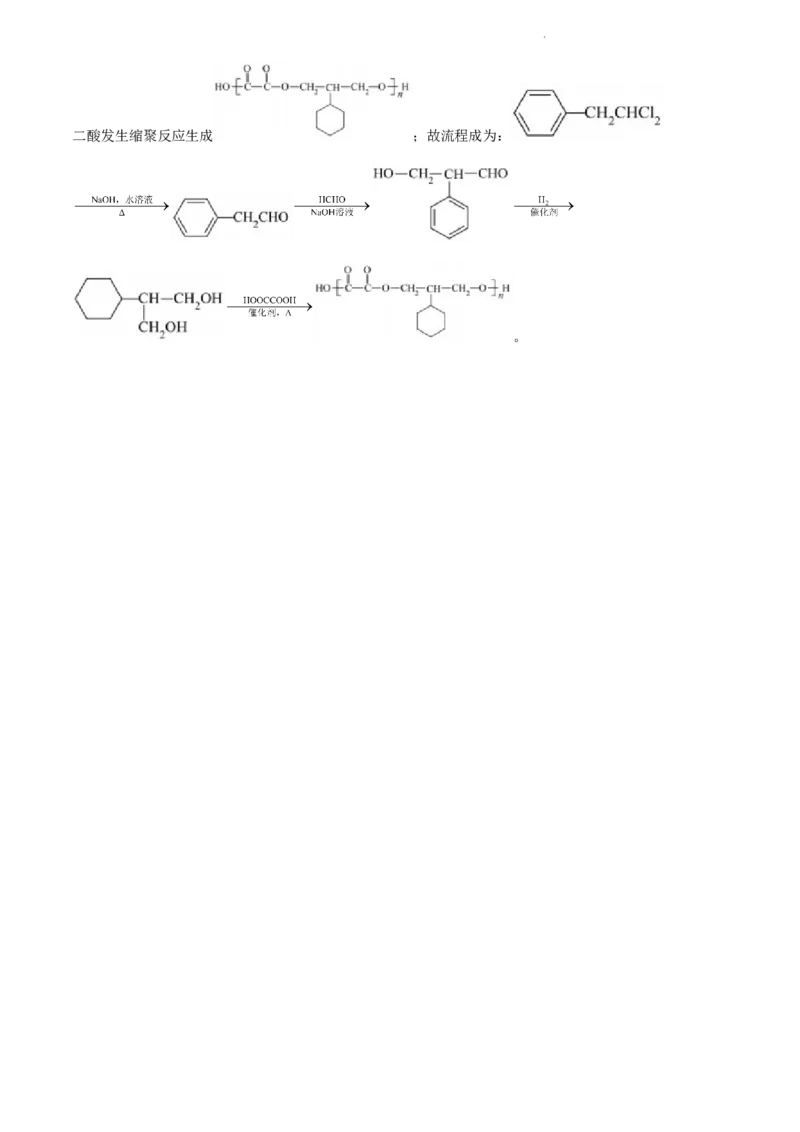
(6)设计由 、HCHO和乙二酸制备 的合成路线:
___________(无机试剂任选)。
长郡中学 2024 届高考适应性考试(二)
化学参考答案
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 B B A D C D A B C B A D C C
二、非选择题:本题共4小题,共58分。
15.(除标注外,每空2分,共15分)
学科网(北京)股份有限公司(1)Na CO·7H O;NaCO·H O NaCO+H O
2 3 2 2 3 2 2 3 2
(2)①D;0.1
②溶液颜色由黄色变成橙色,且半分钟内溶液颜色不复原;
+H+= ; +H+=H O+CO↑;0.2
2 2
(3)偏大
(4)C中无水CuSO 变蓝色,B中澄清石灰水变浑浊
4
16.(除标注外,每空2分,共14分)
(1)2 +3Tl++8H+=2MnO+3T13++4H O
2 2
(2)H S
2
(3)Zn2+和Tl+(4)2
第一步氧化时Tl+氧化不彻底,TlS也会溶解部分离子在溶液中
2
(5)除去加入的钙离子
(6)a=
【解析】(1)根据所给信息KMnO 被还原为MnO ,Tl+被氧化Tl3+,可得该反应的离子方程式为2
4 2
+3Tl++8H+=2MnO+3Tl3++4H O;
2 2
(2)因为溶液中含有氢离子,与硫化步骤中要加入的硫离子会反应生成硫化氢有毒气体,所以要加Ca(OH)
2
至溶液的pH约为7;
(3)硫化钠中的硫离子和Zn2+和Tl+生成ZnS沉淀和TlS沉淀;
2
(4)根据Ksp[Tl(OH) ]= =1.5×10-44,Tl3+的排放标准为1.5×10-8mol·L-1,则
3
=1×10-12, =l×10-2,所以pH为2;“中和”步骤加Ca(OH) 至溶液的pH约为9,此时仍只有
2
80%左右的铊离子能得到去除,其可能原因是第一步氧化时Tl+氧化不彻底,TlS也会溶解部分离子在溶液
2
中;
(5)加入碳酸钠,与滤液中的钙离子反应生成碳酸钙沉淀,从而除去前面步骤中引入的钙离子;
(6)设Fe3+和Fe2+的最短距离为a,根据已知条件晶体的密度为ρg·cm-3,普鲁士蓝摩尔质量为Mg·mol-1,从
晶胞的 部分图示结构可知Fe3+和Fe2+的最短距离为晶胞参数的 ,由图示可知Fe3+和Fe2+分别位于立方
学科网(北京)股份有限公司体的四个顶点,而CN-位于棱的中点,故该单元中含有的Fe3+数和Fe2+数相等,都为4× = ,CN-的个数
为12× =3,根据电荷守恒可知K+数为 ,因此该单元的摩尔质量为 M,则有ρ= ,那
么a= 。
17.(除标注外,每空2分,共14分)
(1)-1814;能
(2)BD
(3)平衡逆向移动(或催化剂失活等)
(4)①T