文档内容
2024 学年第一学期奉贤区高三化学练习卷
考生注意:
1.试卷满分100分,考试时间60分钟。
2.本考试分设试卷和答题纸。答题前,务必在答题纸上填写学校、姓名、考号,将条形
码贴在指定位置。答题时,必须将答案涂或写在答题纸上,在试卷上答题一律不得分。
3.选择类试题中,标注“不定项”的试题,每小题有1~2个正确选项,未特别标注的试
题,每小题只有1个正确选项。
相对原子质量:C−12 N−14 K−39 Fe−56 Cu−64
一、多姿多彩的过渡金属
过渡金属因具有良好理化特性,在国防、军事、科技、工农业生产等众多领域都有很重
要的用途。回答下列问题:
1.过渡金属处于元素周期表的_______区。金属铜 Cu在周期表中的位置是___________,
29
基态铜原子的价电子所占轨道数为_______________。
2.古埃及人很早就开始利用含钴矿石制作颜料。K [Co(NO ) ]是一种黄色颜料,中心离子
3 2 6
是______,其配位数是__________,其配体的VSEPR模型为_________。
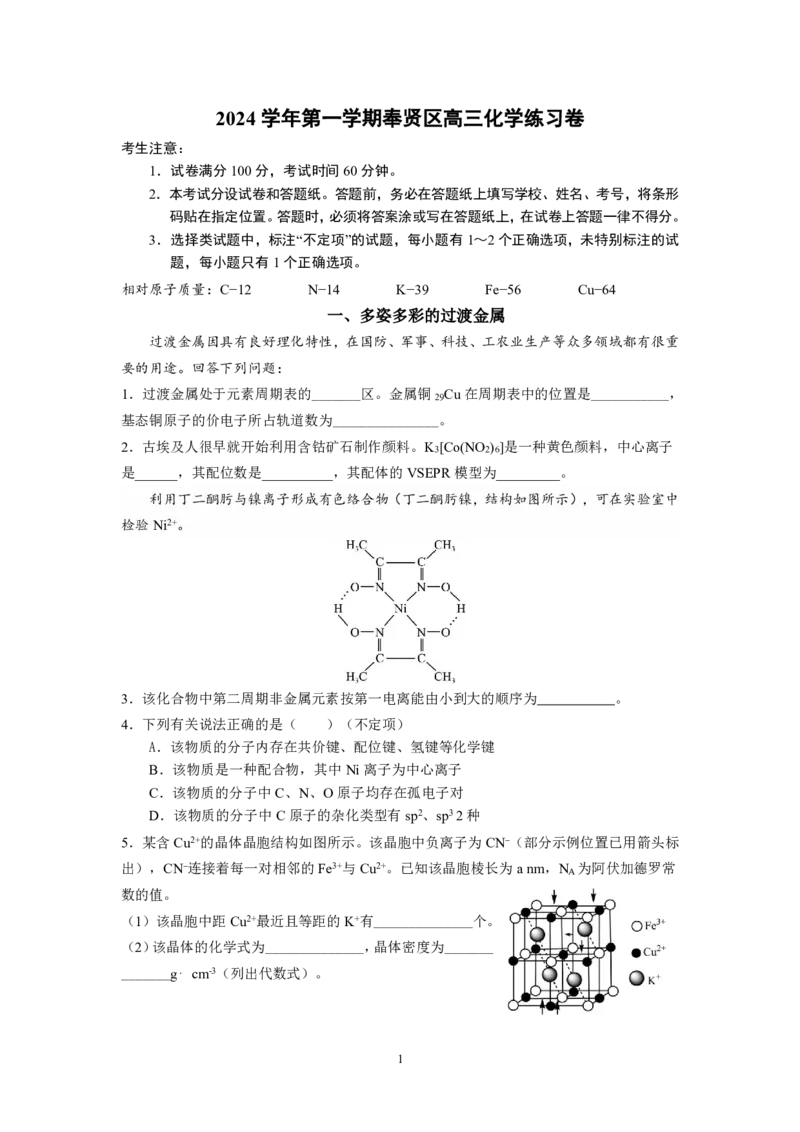
利用丁二酮肟与镍离子形成有色络合物(丁二酮肟镍,结构如图所示),可在实验室中
检验Ni2+。
3.该化合物中第二周期非金属元素按第一电离能由小到大的顺序为 。
4.下列有关说法正确的是( )(不定项)
A.该物质的分子内存在共价键、配位键、氢键等化学键
B.该物质是一种配合物,其中Ni离子为中心离子
C.该物质的分子中C、N、O原子均存在孤电子对
D.该物质的分子中C原子的杂化类型有sp2、sp32种
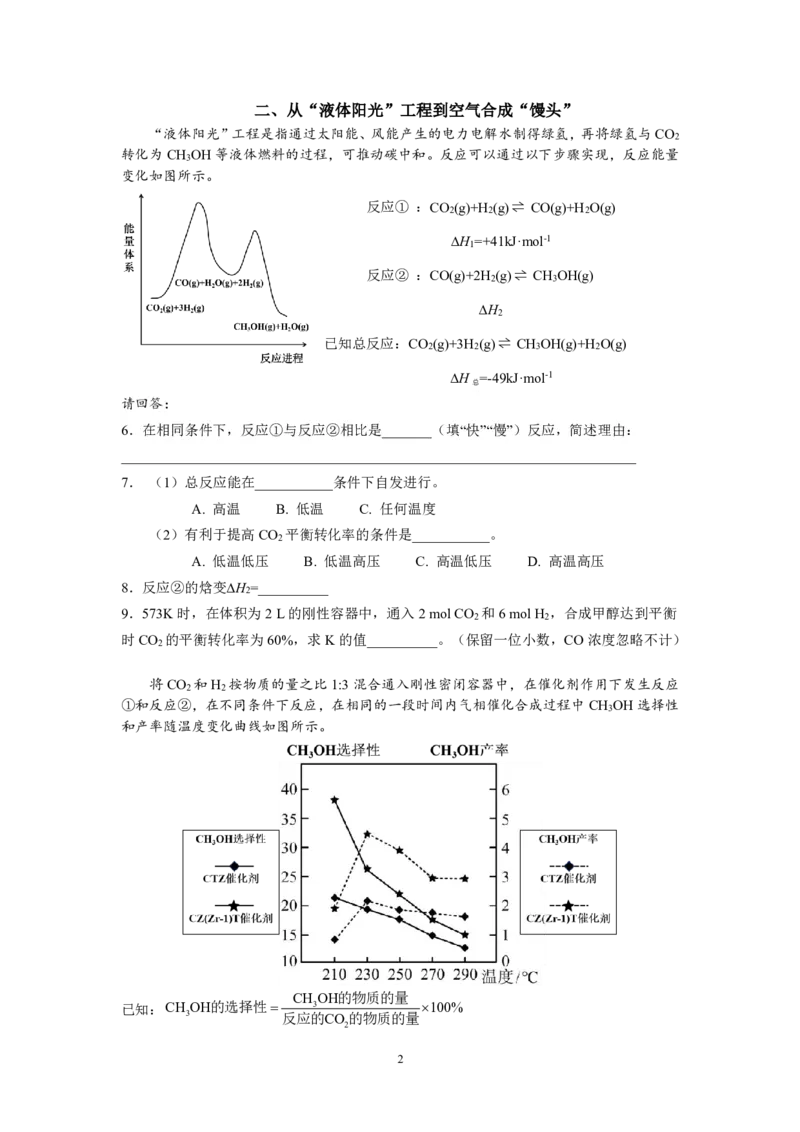
5.某含Cu2+的晶体晶胞结构如图所示。该晶胞中负离子为CN⁻(部分示例位置已用箭头标
出),CN⁻连接着每一对相邻的Fe3+与Cu2+。已知该晶胞棱长为anm,N 为阿伏加德罗常
A
数的值。
(1)该晶胞中距Cu2+最近且等距的K+有______________个。
(2)该晶体的化学式为______________,晶体密度为_______
_______g⋅ cm-3(列出代数式)。
1
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}二、从“液体阳光”工程到空气合成“馒头”
“液体阳光”工程是指通过太阳能、风能产生的电力电解水制得绿氢,再将绿氢与CO
2
转化为CH OH等液体燃料的过程,可推动碳中和。反应可以通过以下步骤实现,反应能量
3
变化如图所示。
反应① :CO (g)+H (g) ⇌ CO(g)+H O(g)
2 2 2
∆H =+41kJ·mol-1
1
反应② :CO(g)+2H (g) ⇌ CH OH(g)
2 3
∆H
2
已知总反应:CO (g)+3H (g) ⇌ CH OH(g)+H O(g)
2 2 3 2
∆H =-49kJ·mol-1
总
请回答:
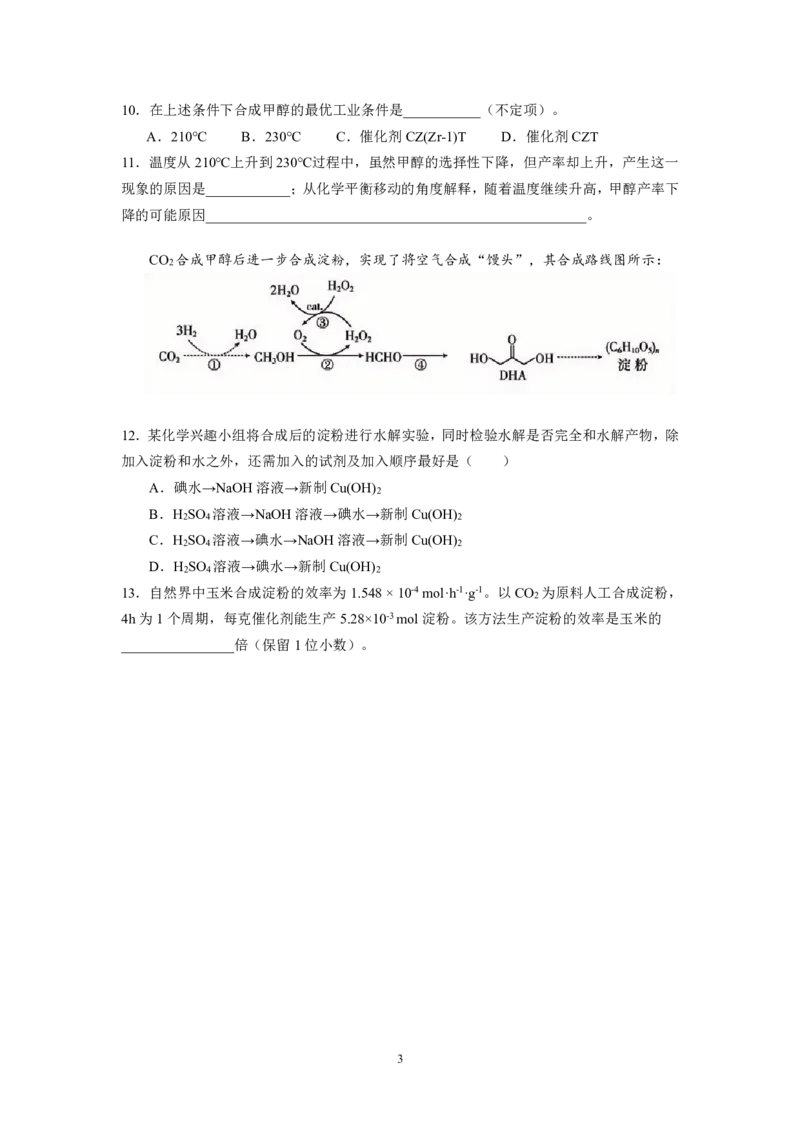
6.在相同条件下,反应①与反应②相比是_______(填“快”“慢”)反应,简述理由:
_________________________________________________________________________
7. (1)总反应能在___________条件下自发进行。
A. 高温 B. 低温 C. 任何温度
(2)有利于提高CO 平衡转化率的条件是___________。
2
A. 低温低压 B. 低温高压 C. 高温低压 D. 高温高压
8.反应②的焓变∆H =__________
2
9.573K时,在体积为2L的刚性容器中,通入2molCO 和6molH ,合成甲醇达到平衡
2 2
时CO 的平衡转化率为60%,求K的值__________。(保留一位小数,CO浓度忽略不计)
2
将CO 和H 按物质的量之比1:3混合通入刚性密闭容器中,在催化剂作用下发生反应
2 2
①和反应②,在不同条件下反应,在相同的一段时间内气相催化合成过程中CH OH选择性
3
和产率随温度变化曲线如图所示。
CH OH的物质的量
已知:CH OH的选择性 3 100%
3 反应的CO的物质的量
2
2
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}10.在上述条件下合成甲醇的最优工业条件是___________(不定项)。
A.210℃ B.230℃ C.催化剂CZ(Zr-1)T D.催化剂CZT
11.温度从210℃上升到230℃过程中,虽然甲醇的选择性下降,但产率却上升,产生这一
现象的原因是____________;从化学平衡移动的角度解释,随着温度继续升高,甲醇产率下
降的可能原因______________________________________________________。
CO 合成甲醇后进一步合成淀粉,实现了将空气合成“馒头”,其合成路线图所示:
2
12.某化学兴趣小组将合成后的淀粉进行水解实验,同时检验水解是否完全和水解产物,除
加入淀粉和水之外,还需加入的试剂及加入顺序最好是( )
A.碘水→NaOH溶液→新制Cu(OH)
2
B.H SO 溶液→NaOH溶液→碘水→新制Cu(OH)
2 4 2
C.H SO 溶液→碘水→NaOH溶液→新制Cu(OH)
2 4 2
D.H SO 溶液→碘水→新制Cu(OH)
2 4 2
13.自然界中玉米合成淀粉的效率为1.548×10-4mol·h-1·g-1。以CO 为原料人工合成淀粉,
2
4h为1个周期,每克催化剂能生产5.28×10-3mol淀粉。该方法生产淀粉的效率是玉米的
________________倍(保留1位小数)。
3
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}三、紫外光响应聚合物的制备
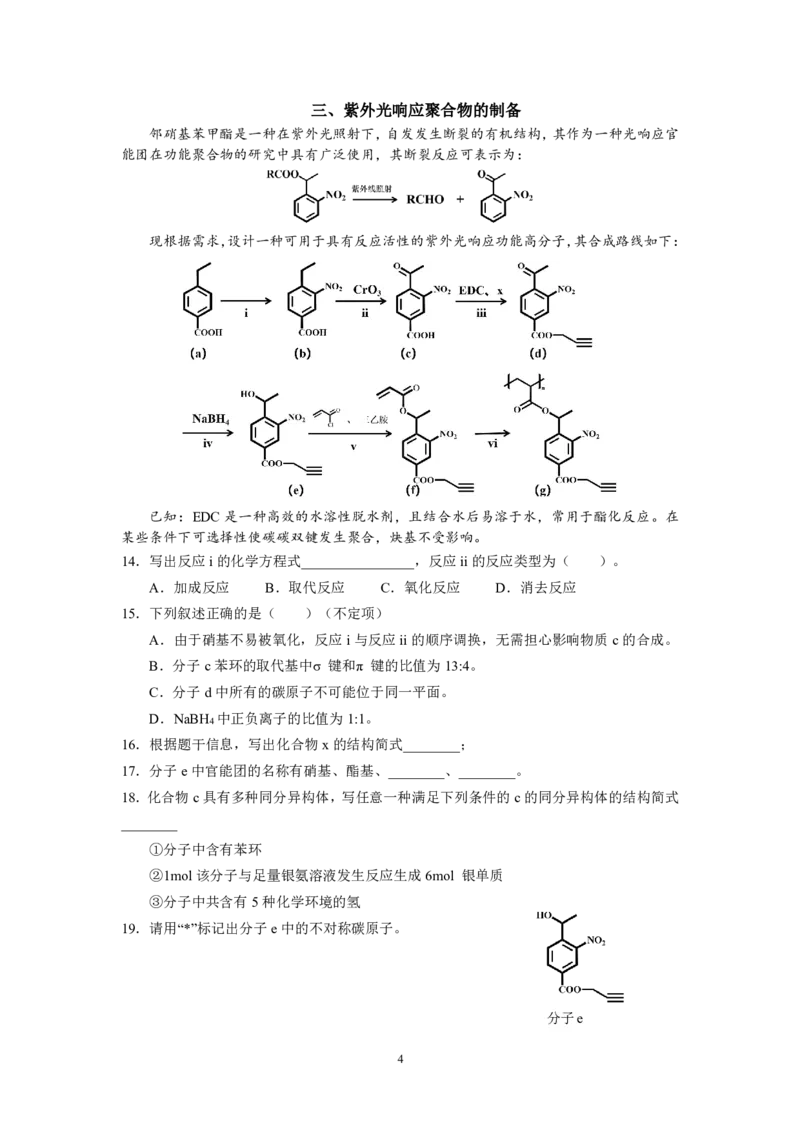
邻硝基苯甲酯是一种在紫外光照射下,自发发生断裂的有机结构,其作为一种光响应官
能团在功能聚合物的研究中具有广泛使用,其断裂反应可表示为:
现根据需求,设计一种可用于具有反应活性的紫外光响应功能高分子,其合成路线如下:
已知:EDC是一种高效的水溶性脱水剂,且结合水后易溶于水,常用于酯化反应。在
某些条件下可选择性使碳碳双键发生聚合,炔基不受影响。
14.写出反应i的化学方程式________________,反应ii的反应类型为( )。
A.加成反应 B.取代反应 C.氧化反应 D.消去反应
15.下列叙述正确的是( )(不定项)
A.由于硝基不易被氧化,反应i与反应ii的顺序调换,无需担心影响物质c的合成。
B.分子c苯环的取代基中σ 键和π 键的比值为13:4。
C.分子d中所有的碳原子不可能位于同一平面。
D.NaBH 中正负离子的比值为1:1。
4
16.根据题干信息,写出化合物x的结构简式________;
17.分子e中官能团的名称有硝基、酯基、________、________。
18.化合物c具有多种同分异构体,写任意一种满足下列条件的c的同分异构体的结构简式
________
①分子中含有苯环
②1mol该分子与足量银氨溶液发生反应生成6mol 银单质
③分子中共含有5种化学环境的氢
19.请用“*”标记出分子e中的不对称碳原子。
分子e
4
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}20.已知三乙胺N(C H ) 是一种有机碱,可中和反应生成的HCl,提高反应转化率。是否
2 5 3
可用同为有机碱的二乙胺NH(C H ) 代替,请说出你的结论并说明理由________________。
2 5 2
21.写出聚合物g经紫外线照射后,所剩聚合物结构简式________________。
22.聚丙烯酸( )是一种重要的pH响应功能聚合物,请以3-氯-1-丙醇 为
原料,制备聚丙烯酸。(已知:在碱性环境中,—CHO不稳定)
5
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}四、重要的硫及其化合物
硫及其化合物在药物合成、材料工程等领域有许多用途,请根据所学知识回答问题:
23.基态 S 原子核外有( )种能量不同的电子。
A 3 B 5 C 7 D 16
24.下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.25℃时,0.10mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
25. S Cl 是一种重要的化工原料,请写出其电子式________;已知该分子内的四个原子不
2 2
在同一平面上,则该分子是( )分子
A.极性 B.非极性
26.已知硒是硫的同族元素,硒代硫酸是弱酸,0.1mol·L-1Na SeSO 溶液中有关离子浓度
2 3
关系是:
2c(SeSO 2-)+c(HSeSO -)+c(OH-)______0.2mol·L-1
3 3
A.> B.< C.=
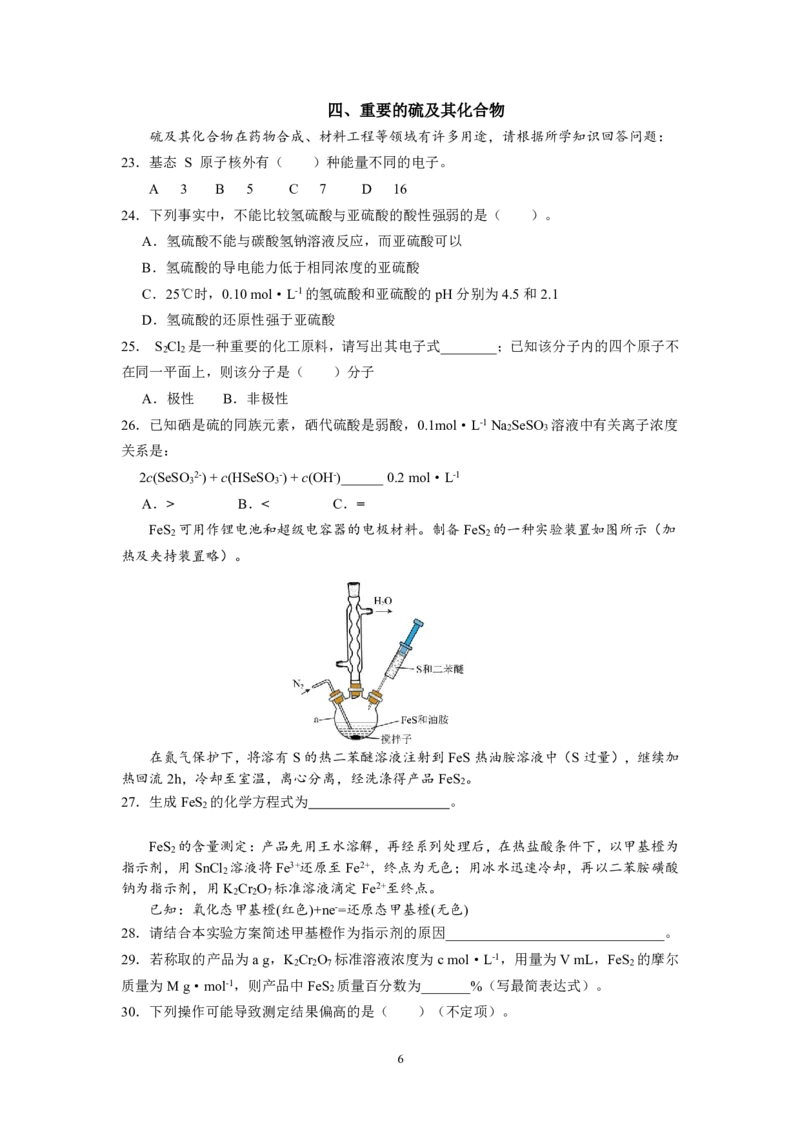
FeS 可用作锂电池和超级电容器的电极材料。制备FeS 的一种实验装置如图所示(加
2 2
热及夹持装置略)。
在氮气保护下,将溶有S的热二苯醚溶液注射到FeS热油胺溶液中(S过量),继续加
热回流2h,冷却至室温,离心分离,经洗涤得产品FeS 。
2
27.生成FeS 的化学方程式为 。
2
FeS 的含量测定:产品先用王水溶解,再经系列处理后,在热盐酸条件下,以甲基橙为
2
指示剂,用SnCl 溶液将Fe3+还原至Fe2+,终点为无色;用冰水迅速冷却,再以二苯胺磺酸
2
钠为指示剂,用K Cr O 标准溶液滴定Fe2+至终点。
2 2 7
已知:氧化态甲基橙(红色)+ne-=还原态甲基橙(无色)
28.请结合本实验方案简述甲基橙作为指示剂的原因_______________________________。
29.若称取的产品为ag,K Cr O 标准溶液浓度为cmol·L-1,用量为VmL,FeS 的摩尔
2 2 7 2
质量为Mg·mol-1,则产品中FeS 质量百分数为_______%(写最简表达式)。
2
30.下列操作可能导致测定结果偏高的是( )(不定项)。
6
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}A.还原Fe3+时SnCl 溶液滴加过量
2
B.热的Fe2+溶液在空气中缓慢冷却
C.滴定开始时滴定管尖嘴部分有气泡,滴定后气泡消失
D.滴定前锥形瓶中有少量蒸馏水
31.FeS 经一系列反应后,得到氯化铁溶液。有一化学兴趣小组,要制备氢氧化铁胶体,并
2
研究其性质。“在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和氯化
铁溶液,继续煮沸并用玻璃棒搅拌至呈红褐色,停止加热,即得氢氧化铁胶体。”请摘抄出
描述错误的操作原文___________________________________。
7
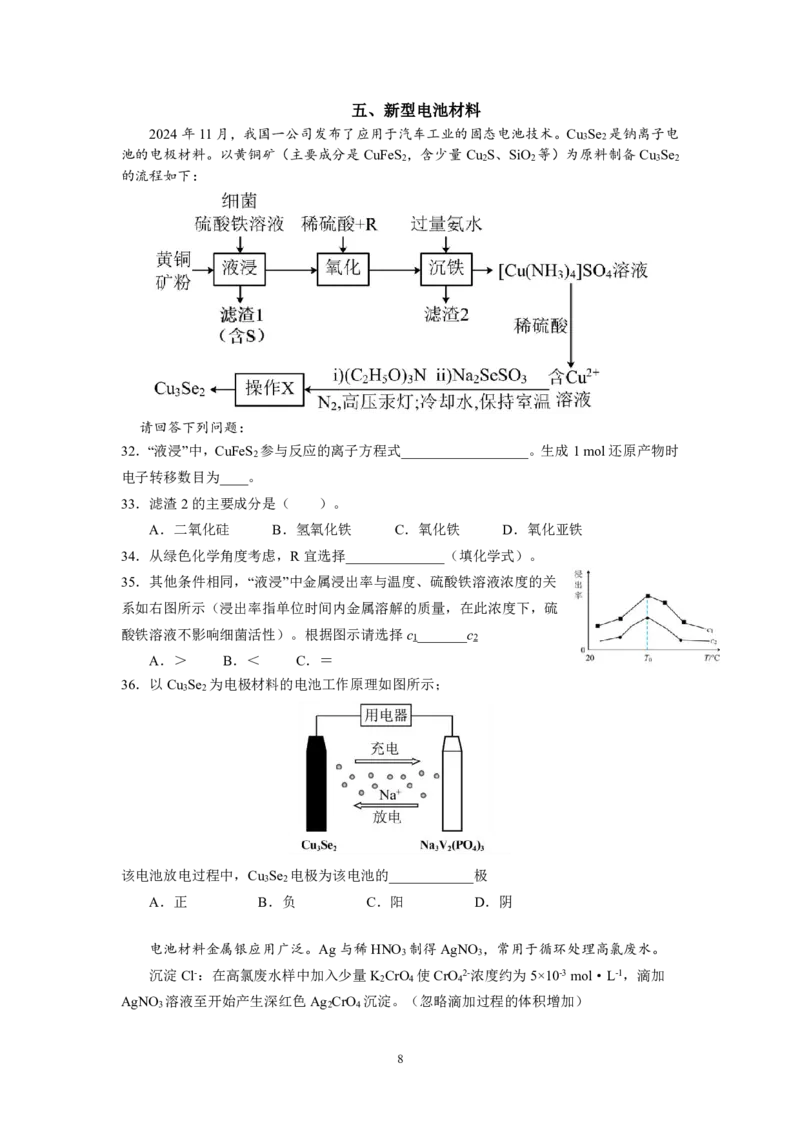
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}五、新型电池材料
2024年11月,我国一公司发布了应用于汽车工业的固态电池技术。Cu Se 是钠离子电
3 2
池的电极材料。以黄铜矿(主要成分是CuFeS ,含少量Cu S、SiO 等)为原料制备Cu Se
2 2 2 3 2
的流程如下:
请回答下列问题:
32.“液浸”中,CuFeS 参与反应的离子方程式__________________。生成1mol还原产物时
2
电子转移数目为____。
33.滤渣2的主要成分是( )。
A.二氧化硅 B.氢氧化铁 C.氧化铁 D.氧化亚铁
34.从绿色化学角度考虑,R宜选择______________(填化学式)。
35.其他条件相同,“液浸”中金属浸出率与温度、硫酸铁溶液浓度的关
系如右图所示(浸出率指单位时间内金属溶解的质量,在此浓度下,硫
酸铁溶液不影响细菌活性)。根据图示请选择c _______c
1 2
A.> B.< C.=
36.以Cu Se 为电极材料的电池工作原理如图所示;
3 2
该电池放电过程中,Cu Se 电极为该电池的____________极
3 2
A.正 B.负 C.阳 D.阴
电池材料金属银应用广泛。Ag与稀HNO 制得AgNO ,常用于循环处理高氯废水。
3 3
沉淀Cl-:在高氯废水样中加入少量K CrO 使CrO 2-浓度约为5×10-3mol·L-1,滴加
2 4 4
AgNO 溶液至开始产生深红色Ag CrO 沉淀。(忽略滴加过程的体积增加)
3 2 4
8
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}37.请通过计算判断Cl-是否已完全沉淀。已知:K (AgCl)=1.8×10-10,K (Ag CrO )=2×10-12,
sp sp 2 4
当离子浓度小于10-5mol·L-1时,可认为完全沉淀。(写出计算及分析过程)
还原AgCl:在AgCl沉淀中埋入铁圈并压实,加入足量0.5mol·L-1盐酸后静置,充分
反应得到Ag。
38.(1)铁将AgCl转化为单质Ag的化学方程式为_______________。
(2)不与铁圈直接接触的AgCl也能转化为Ag的原因是_______。
9
{#{QQABKQqEogCIAAJAABgCQwUQCkCQkhCAAYgGhAAEMAAASBFABAA=}#}