文档内容
湛江市第二十一中学 2024-2025 学年第二学期 4 月考高二级·化学
考试时间:75分钟,满分100分
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 Na-23 Zn-65 Cu-64 N-14
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4
分。在每小题给出的四个选项中,只有一项是符合题目要求的。
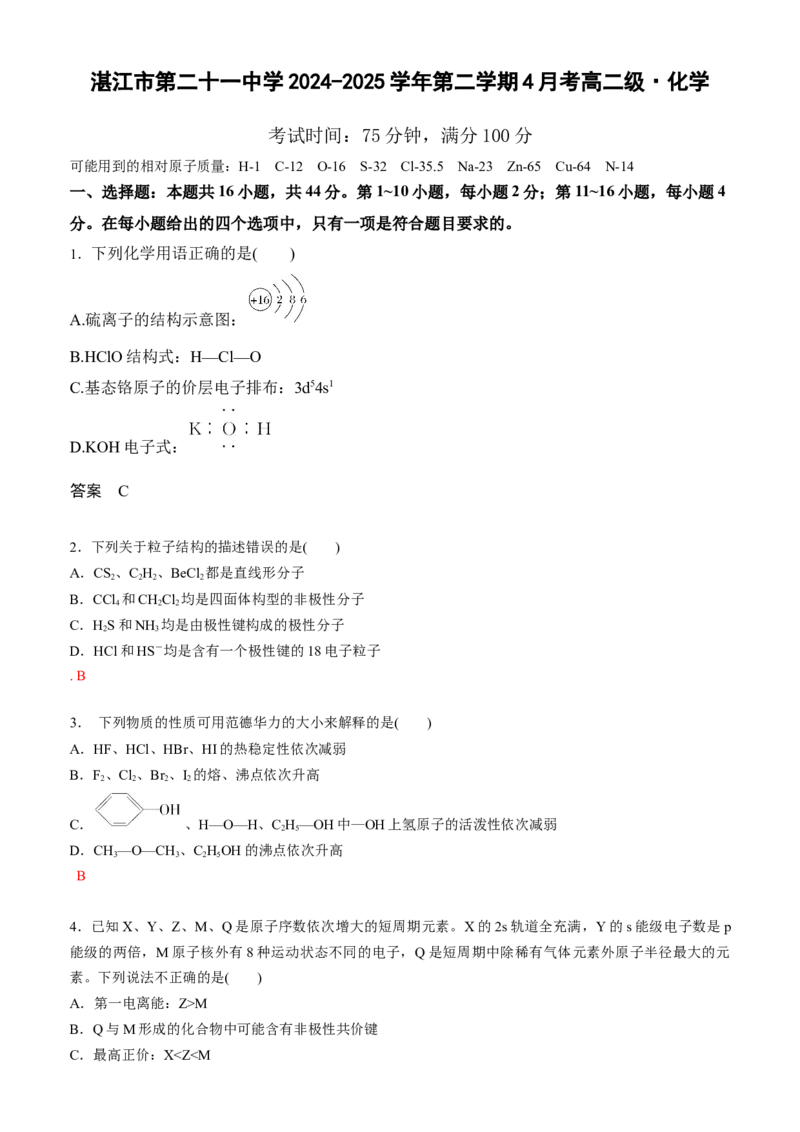
1.下列化学用语正确的是( )
A.硫离子的结构示意图:
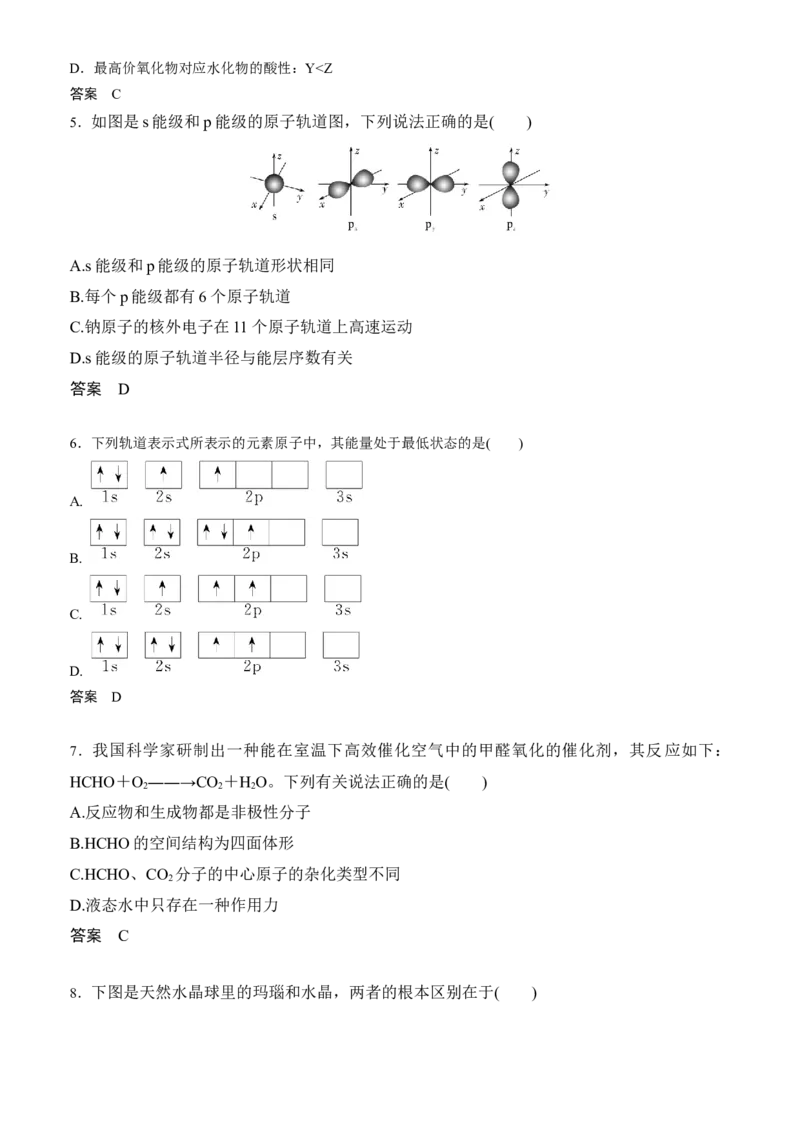
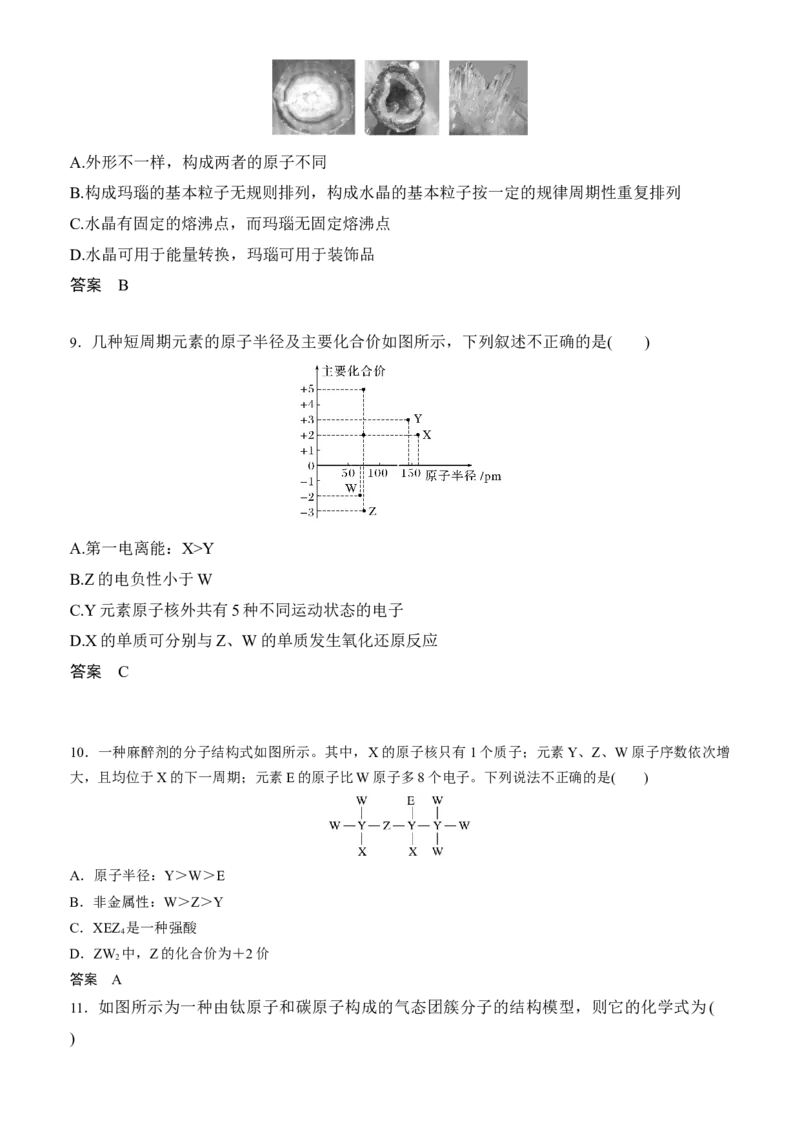
B.HClO结构式:H—Cl—O
C.基态铬原子的价层电子排布:3d54s1
D.KOH电子式:
答案 C
2.下列关于粒子结构的描述错误的是( )
A.CS、C H、BeCl 都是直线形分子
2 2 2 2
B.CCl 和CHCl 均是四面体构型的非极性分子
4 2 2
C.HS和NH 均是由极性键构成的极性分子
2 3
D.HCl和HS-均是含有一个极性键的18电子粒子
. B
3. 下列物质的性质可用范德华力的大小来解释的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.F、Cl、Br 、I 的熔、沸点依次升高
2 2 2 2
C. 、H—O—H、C H—OH中—OH上氢原子的活泼性依次减弱
2 5
D.CH—O—CH 、C HOH的沸点依次升高
3 3 2 5
B
4.已知X、Y、Z、M、Q是原子序数依次增大的短周期元素。X的2s轨道全充满,Y的s能级电子数是p
能级的两倍,M原子核外有8种运动状态不同的电子,Q是短周期中除稀有气体元素外原子半径最大的元
素。下列说法不正确的是( )
A.第一电离能:Z>M
B.Q与M形成的化合物中可能含有非极性共价键
C.最高正价:XY
B.Z的电负性小于W
C.Y元素原子核外共有5种不同运动状态的电子
D.X的单质可分别与Z、W的单质发生氧化还原反应
答案 C
10.一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增
大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是( )
A.原子半径:Y>W>E
B.非金属性:W>Z>Y
C.XEZ 是一种强酸
4
D.ZW 中,Z的化合价为+2价
2
答案 A
11.如图所示为一种由钛原子和碳原子构成的气态团簇分子的结构模型,则它的化学式为(
)A.Ti C B.TiC
4 4
C.Ti C D.Ti C
14 13 2
答案 C
12.下列化学用语或图示表达正确的是
A.NaCl的电子式 B.SO 的VSEPR模型
2
C.p-p σ键电子云轮廓图 D.NO 的空间结构模型
-
3
答案 D
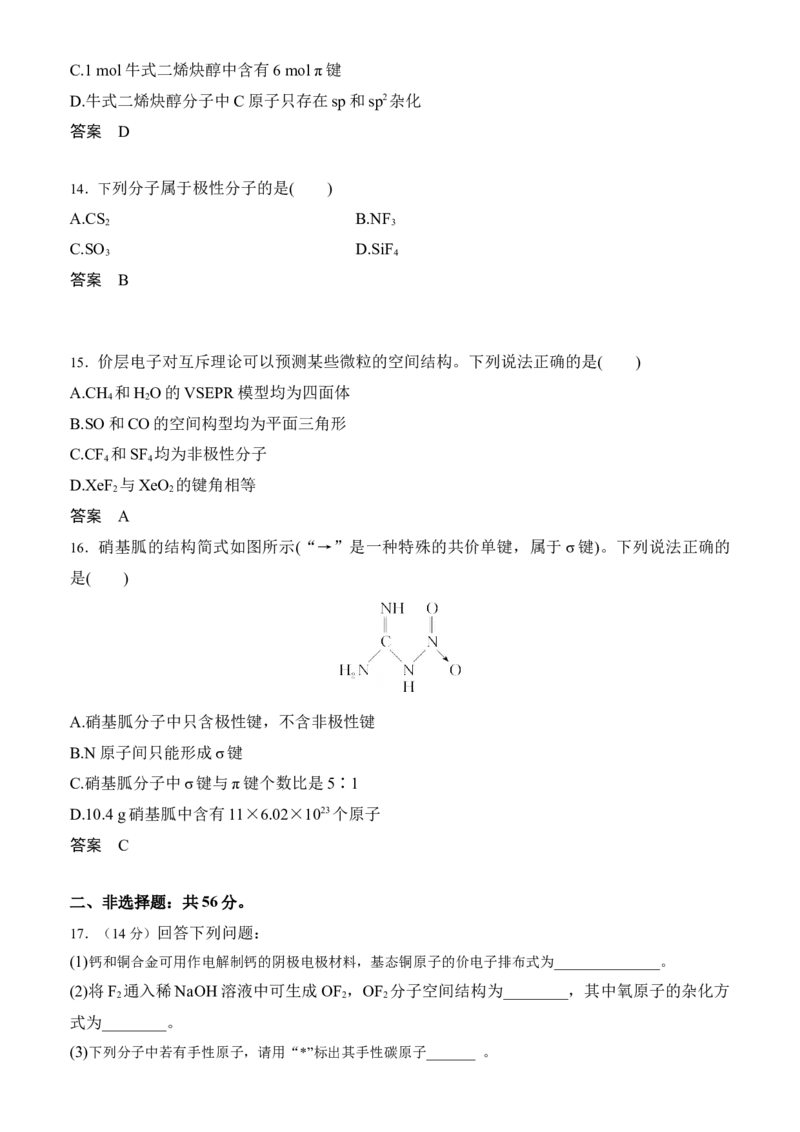
13.有一种有机物的键线式酷似牛,故称为牛式二烯炔醇。下列有关说法不正确的是( )
A.牛式二烯炔醇的官能团可以用红外光谱测定
B.牛式二烯炔醇中含有三个手性碳原子C.1 mol牛式二烯炔醇中含有6 mol π键
D.牛式二烯炔醇分子中C原子只存在sp和sp2杂化
答案 D
14.下列分子属于极性分子的是( )
A.CS B.NF
2 3
C.SO D.SiF
3 4
答案 B
15.价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是( )
A.CH 和H O的VSEPR模型均为四面体
4 2
B.SO和CO的空间构型均为平面三角形
C.CF 和SF 均为非极性分子
4 4
D.XeF 与XeO 的键角相等
2 2
答案 A
16.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的
是( )
A.硝基胍分子中只含极性键,不含非极性键
B.N原子间只能形成σ键
C.硝基胍分子中σ键与π键个数比是5∶1
D.10.4 g硝基胍中含有11×6.02×1023个原子
答案 C
二、非选择题:共56分。
17.(14分)回答下列问题:
(1)钙和铜合金可用作电解制钙的阴极电极材料,基态铜原子的价电子排布式为_______________。
(2)将F 通入稀NaOH溶液中可生成OF ,OF 分子空间结构为________,其中氧原子的杂化方
2 2 2
式为________。
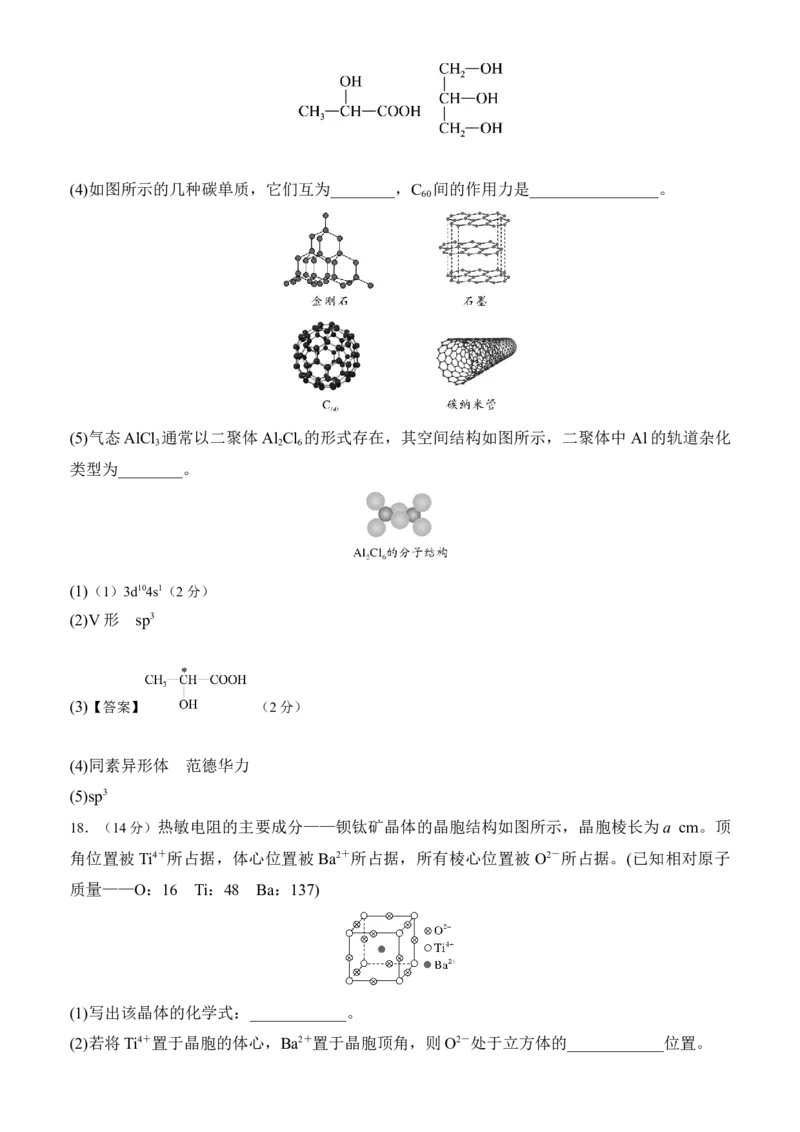
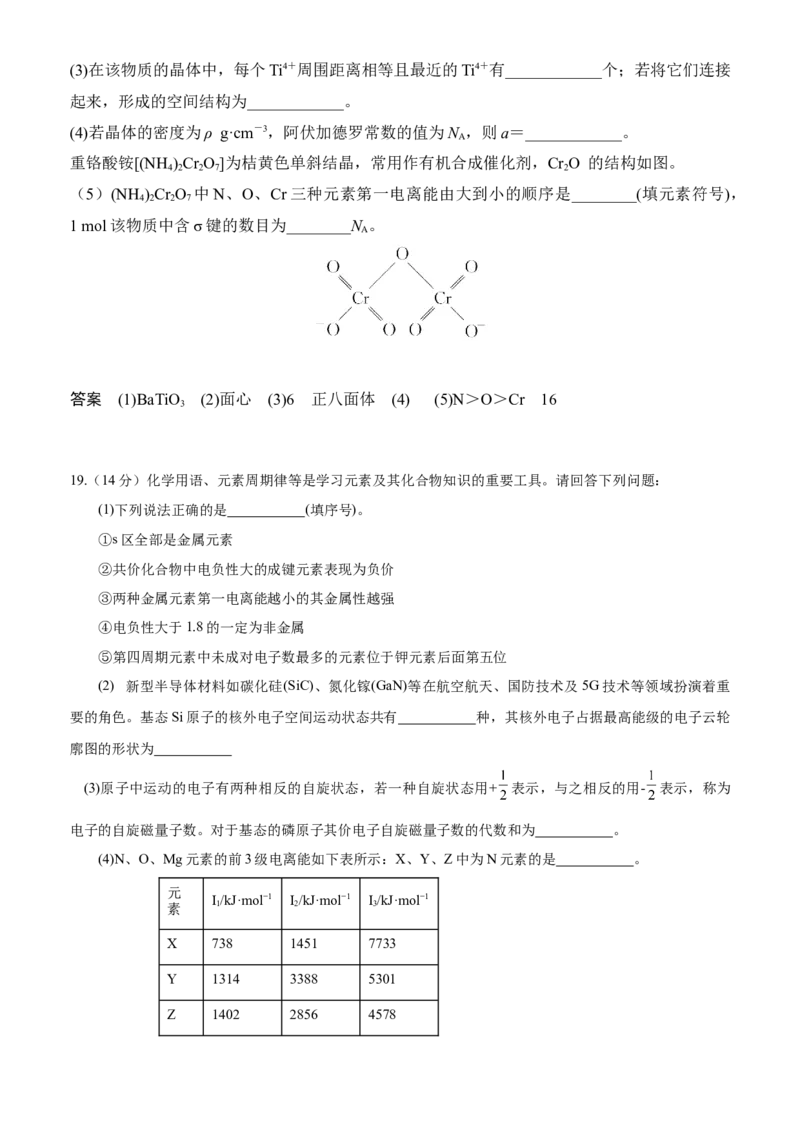
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子_______ 。(4)如图所示的几种碳单质,它们互为________,C 间的作用力是________________。
60
(5)气态AlCl 通常以二聚体Al Cl 的形式存在,其空间结构如图所示,二聚体中Al的轨道杂化
3 2 6
类型为________。
(1)(1)3d104s1(2分)
(2)V形 sp3
(3)【答案】 (2分)
(4)同素异形体 范德华力
(5)sp3
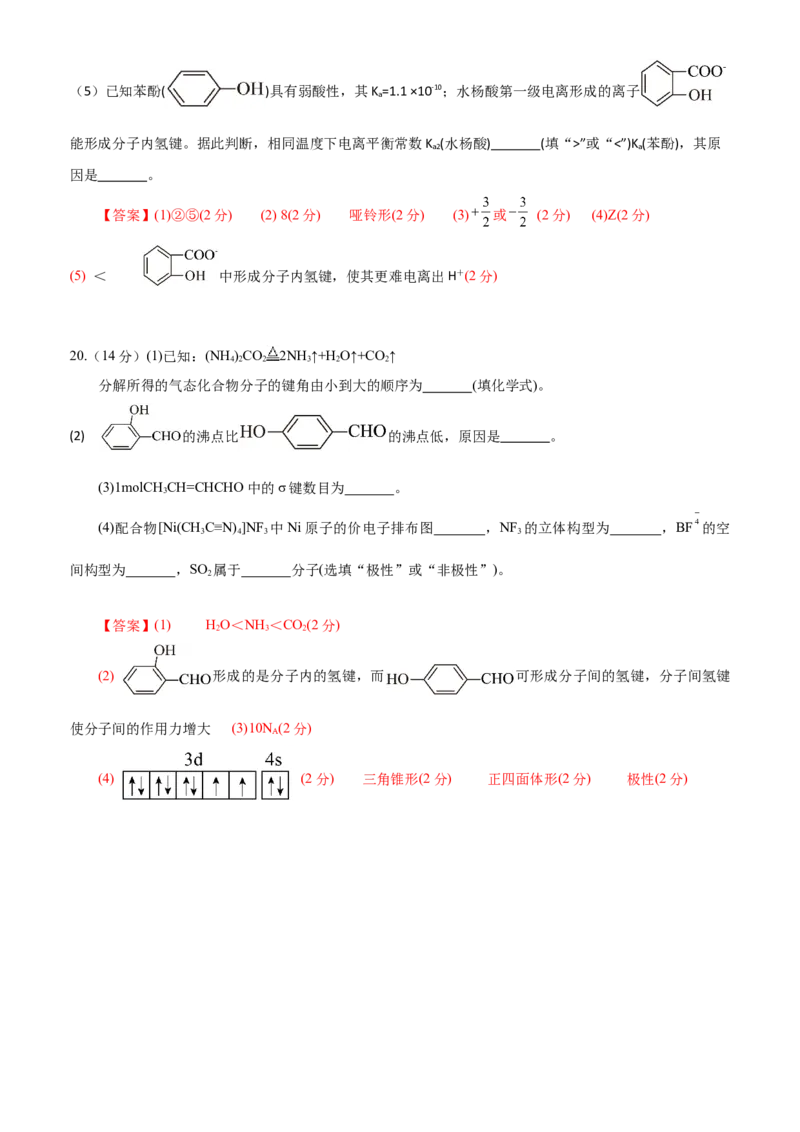
18.(14分)热敏电阻的主要成分——钡钛矿晶体的晶胞结构如图所示,晶胞棱长为a cm。顶
角位置被Ti4+所占据,体心位置被Ba2+所占据,所有棱心位置被 O2-所占据。(已知相对原子
质量——O:16 Ti:48 Ba:137)
(1)写出该晶体的化学式:____________。
(2)若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶角,则O2-处于立方体的____________位置。(3)在该物质的晶体中,每个Ti4+周围距离相等且最近的Ti4+有____________个;若将它们连接
起来,形成的空间结构为____________。
(4)若晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为N ,则a=____________。
A
重铬酸铵[(NH ) Cr O ]为桔黄色单斜结晶,常用作有机合成催化剂,Cr O 的结构如图。
4 2 2 7 2
(5)(NH ) Cr O 中N、O、Cr三种元素第一电离能由大到小的顺序是________(填元素符号),
4 2 2 7
1 mol该物质中含σ键的数目为________N 。
A
答案 (1)BaTiO (2)面心 (3)6 正八面体 (4) (5)N>O>Cr 16
3
19.(14分)化学用语、元素周期律等是学习元素及其化合物知识的重要工具。请回答下列问题:
(1)下列说法正确的是 (填序号)。
①s区全部是金属元素
②共价化合物中电负性大的成键元素表现为负价
③两种金属元素第一电离能越小的其金属性越强
④电负性大于1.8的一定为非金属
⑤第四周期元素中未成对电子数最多的元素位于钾元素后面第五位
(2) 新型半导体材料如碳化硅(SiC)、氮化镓(GaN)等在航空航天、国防技术及5G技术等领域扮演着重
要的角色。基态Si原子的核外电子空间运动状态共有 种,其核外电子占据最高能级的电子云轮
廓图的形状为
(3)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为
电子的自旋磁量子数。对于基态的磷原子其价电子自旋磁量子数的代数和为 。
(4)N、O、Mg元素的前3级电离能如下表所示:X、Y、Z中为N元素的是 。
元
I/kJ·mol−1 I/kJ·mol−1 I/kJ·mol−1
素 1 2 3
X 738 1451 7733
Y 1314 3388 5301
Z 1402 2856 4578(5)已知苯酚( )具有弱酸性,其K=1.1 ×10-10;水杨酸第一级电离形成的离子
a
能形成分子内氢键。据此判断,相同温度下电离平衡常数K (水杨酸) (填“>”或“<”)K(苯酚),其原
a2 a
因是 。
【答案】(1)②⑤(2分) (2) 8(2分) 哑铃形(2分) (3) 或 (2分) (4)Z(2分)
(5) < 中形成分子内氢键,使其更难电离出H+(2分)
20.(14分)(1)已知:(NH )CO 2NH ↑+H O↑+CO↑
4 2 2 3 2 2
分解所得的气态化合物分子的键角由小到大的顺序为 (填化学式)。
(2) 的沸点比 的沸点低,原因是 。
(3)1molCH CH=CHCHO中的σ键数目为 。
3
(4)配合物[Ni(CH C≡N) ]NF 中Ni原子的价电子排布图 ,NF 的立体构型为 ,BF 的空
3 4 3 3
间构型为 ,SO 属于 分子(选填“极性”或“非极性”)。
2
【答案】(1) H O<NH <CO(2分)
2 3 2
(2) 形成的是分子内的氢键,而 可形成分子间的氢键,分子间氢键
使分子间的作用力增大 (3)10N (2分)
A
(4) (2分) 三角锥形(2分) 正四面体形(2分) 极性(2分)