文档内容
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡相应位置上。
3.请按照题号顺序在各题的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试
题卷上答题无效。
4.考试结束后,将本试题卷和答题卡一并上交。
可能用到的相对原子质量:H1 C12 N 14 O16 F19 P 31 Cl35.5 Sc45 Cr52
一、选择题:本大题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
符合题目要求。
1.第19届亚运会秉持“绿色、智能、节俭、文明”的办会理念,主火炬使用的绿色燃料是使用废碳再生的
“零碳甲醇”,实现循环内“碳”的零排放。下列说法正确的是( )
A.亚运村餐厅中使用的“竹餐具”含有丰富的多糖
B.主火炬使用的绿色燃料“零碳甲醇”中的碳是指碳元素
C.吉祥物“江南忆”机器人有机高分子材料面罩为纯净物
D.甲醇和氧气在酸性条件下可构成燃料电池,该电池工作时甲醇被还原
2.下列有关化学用语表示正确的是( )
A.镁原子最外层电子的电子云图: B.醛基碳氧双键的极性:
C.HClO的结构式:H—O—Cl,分子呈V形 D.HF的电离方程式:HF=H+F
3.下列有关金属的工业制法正确的是( )
A.制铜:火法炼铜,即将黄铜矿CuFeS 受热分解以获得铜单质
2
B.制铁:以铁矿石、焦炭、石灰石为原料,CO还原得铁
C.制镁:用海水为原料,经一系列过程制得氧化镁固体,H 还原得镁
2
D.制铝:从铝土矿制得氯化铝固体,再电解熔融的氯化铝得到铝
4.设N 为阿伏加德罗常数的值。下列说法正确的是( )
A
A.3.2g CH OH中OH的数目为0.1N
3 A
B.4.6g乙醇完全氧化生成乙醛,转移电子数为0.2N
A
C.常温常压下,124 P 中所含P—P的数目为4N
4 A
D.1molCuNH CO 中σ键的个数为10N
3 3 A
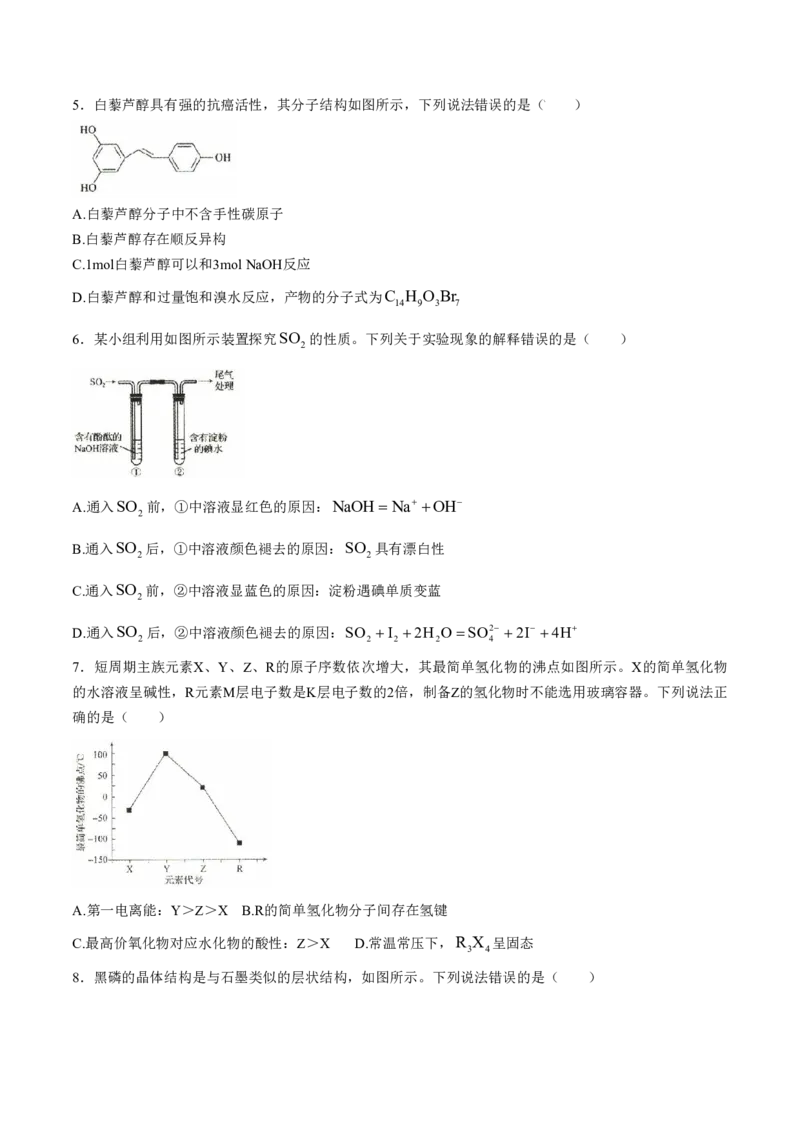
学科网(北京)股份有限公司5.白藜芦醇具有强的抗癌活性,其分子结构如图所示,下列说法错误的是( )
A.白藜芦醇分子中不含手性碳原子
B.白藜芦醇存在顺反异构
C.1mol白藜芦醇可以和3molNaOH反应
D.白藜芦醇和过量饱和溴水反应,产物的分子式为C H O Br
14 9 3 7
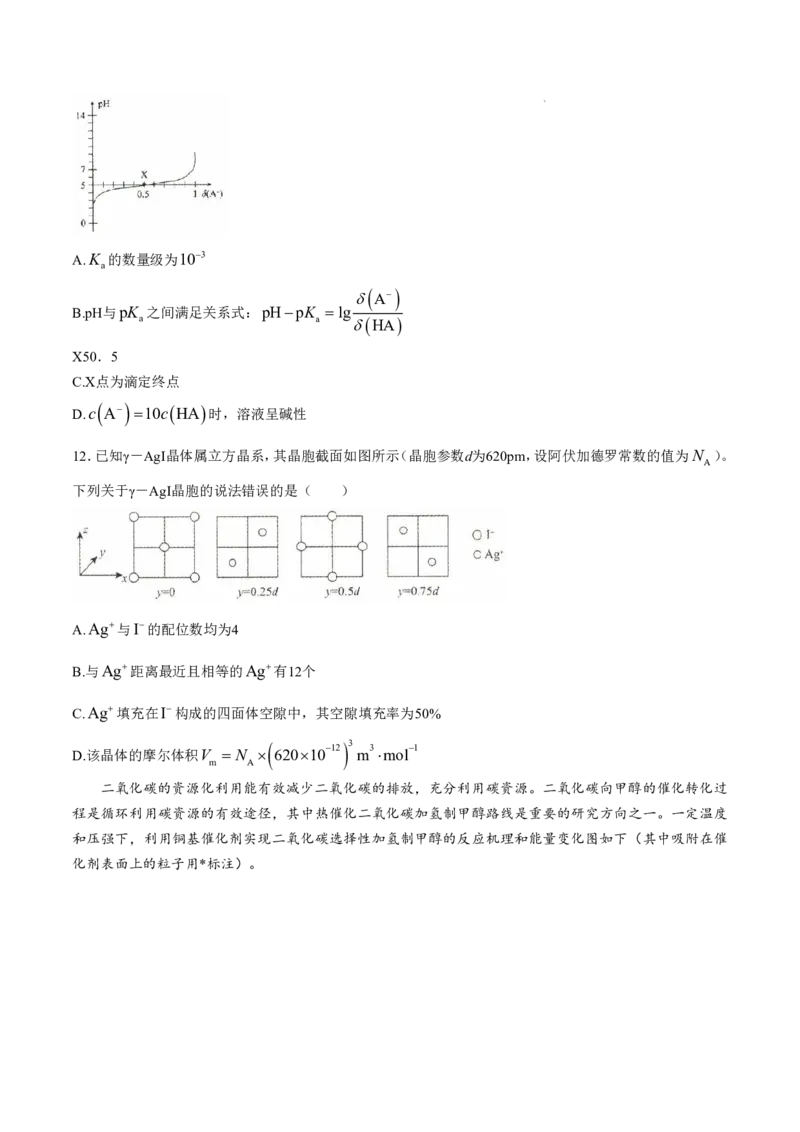
6.某小组利用如图所示装置探究SO 的性质。下列关于实验现象的解释错误的是( )
2
A.通入SO 前,①中溶液显红色的原因:NaOH Na OH
2
B.通入SO 后,①中溶液颜色褪去的原因:SO 具有漂白性
2 2
C.通入SO 前,②中溶液显蓝色的原因:淀粉遇碘单质变蓝
2
D.通入SO 后,②中溶液颜色褪去的原因:SO I 2H O SO2 2I 4H
2 2 2 2 4
7.短周期主族元素X、Y、Z、R的原子序数依次增大,其最简单氢化物的沸点如图所示。X的简单氢化物
的水溶液呈碱性,R元素M层电子数是K层电子数的2倍,制备Z的氢化物时不能选用玻璃容器。下列说法正
确的是( )
A.第一电离能:Y>Z>X B.R的简单氢化物分子间存在氢键
C.最高价氧化物对应水化物的酸性:Z>X D.常温常压下,R X 呈固态
3 4
8.黑磷的晶体结构是与石墨类似的层状结构,如图所示。下列说法错误的是( )
学科网(北京)股份有限公司A.黑磷与白磷均可导电
B.黑磷晶体中片层间作用力为范德华力
C.黑磷晶体的熔沸点比白磷高
D.1mol黑磷晶体中含有1.5molP—P
9.下列关于实验现象的解释或结论正确的是( )
选
实验操作 实验现象 解释或结论
项
向某补血口服液中滴加酸
酸性KMnO 溶液紫
A 4 该补血口服液中一定含有Fe2
性KMnO 溶液
4 色褪去
B 用蒸馏水溶解CuCl 2 固体, 溶液由绿色逐渐变为 CuCl 4 2 4H 2 O Cu H 2 O 4 2 4Cl
蓝色
并继续加水笔稀释 平衡正向移动,绿色配离子转
向NaBr溶液中滴加过量氯 溶液先变橙色,后变
C 氧化性:Cl >Br>I
水,再加入淀粉—KI溶液 为蓝色 2 2 2
将铜与浓硫酸反应产生的
D 产生白色沉淀 该气体中一定含有SO
气体通入BaCl 溶液中 2
2
10.一种海水提溴的部分工艺流程如图所示。下列说法错误的是( )
A.“氧化”和“转化”工序中Cl 的主要作用相同
2
B.水相Ⅰ和水相Ⅱ中均含有H和Cl
C.“洗脱”工序可完成R NCl的再生
3
D.保存液溴时加适量水的主要作用是防止溴单质被氧化
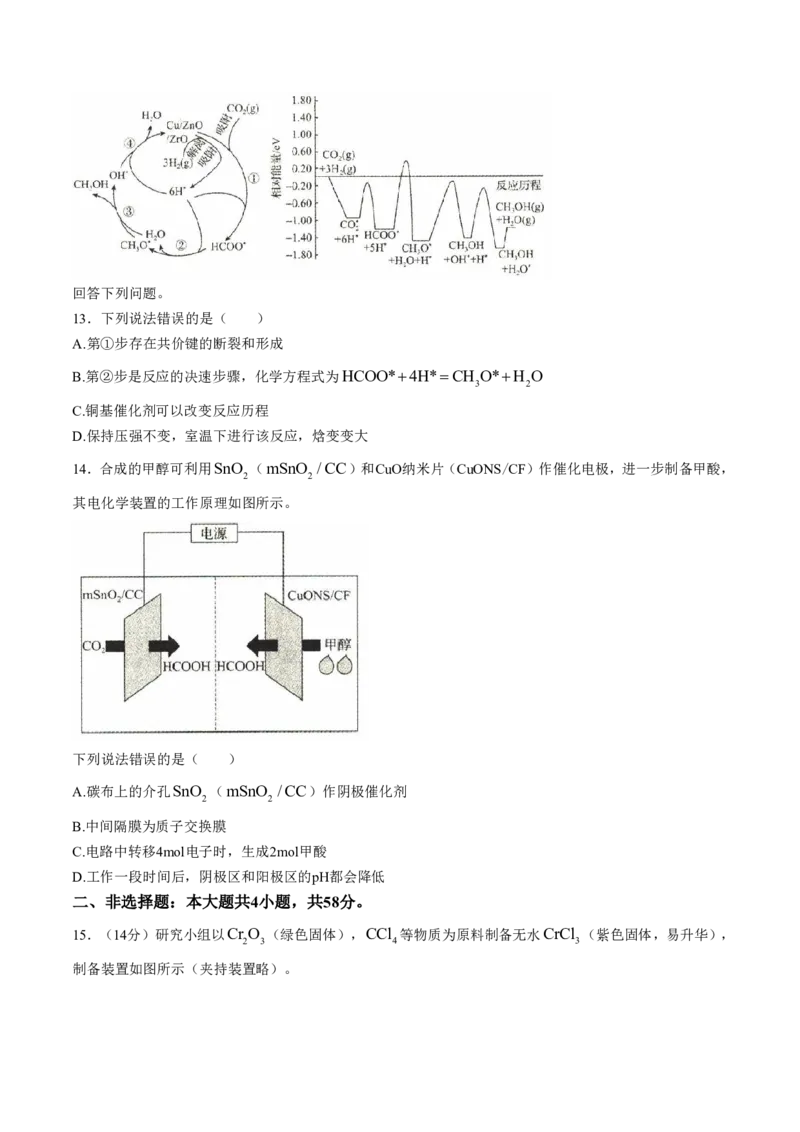
11.室温下,用NaOH溶液滴定HA溶液,溶液中A的物质的量分数 A 随pH的变化曲线如图所示。已
c
A
知:
A
= 。下列说法正确的是( )
c A c HA
学科网(北京)股份有限公司A.K 的数量级为103
a
A
B.pH与pK 之间满足关系式:pHpK lg
a a HA
X50.5
C.X点为滴定终点
D.c A 10c HA 时,溶液呈碱性
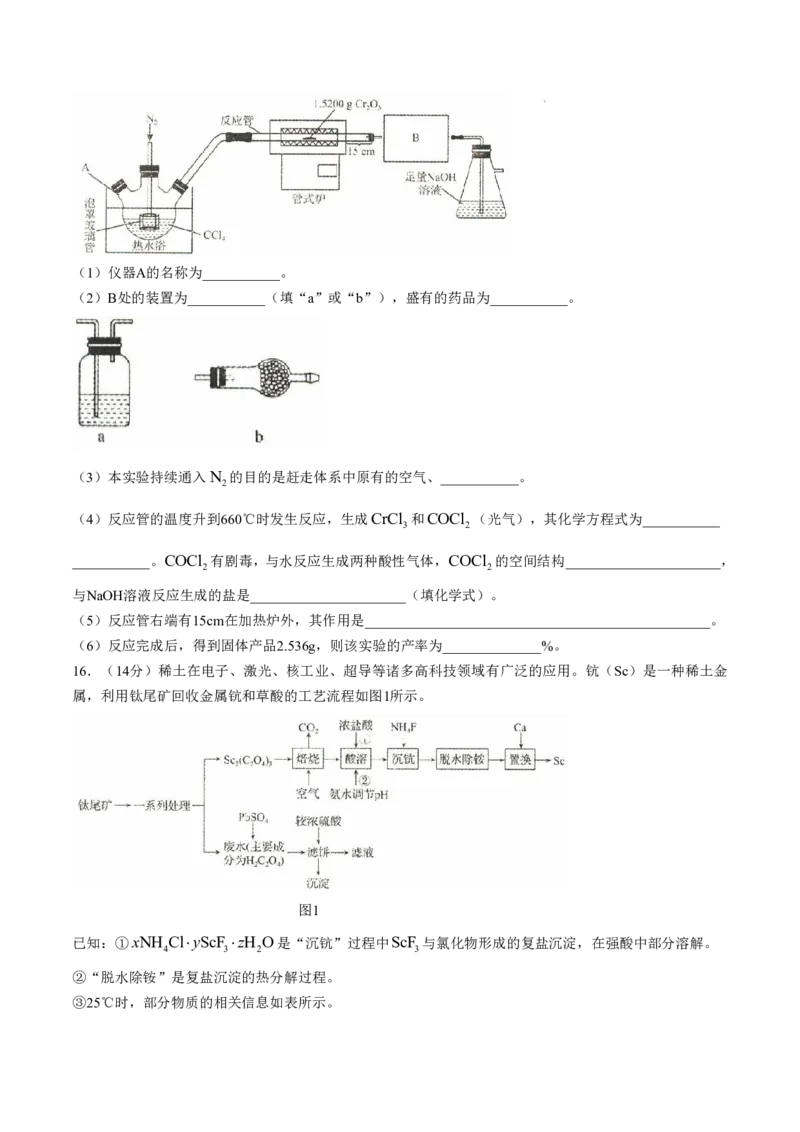
12.已知γ-AgI晶体属立方晶系,其晶胞截面如图所示(晶胞参数d为620pm,设阿伏加德罗常数的值为N )。
A
下列关于γ-AgI晶胞的说法错误的是( )
A.Ag与I的配位数均为4
B.与Ag距离最近且相等的Ag有12个
C.Ag填充在I构成的四面体空隙中,其空隙填充率为50%
D.该晶体的摩尔体积V N 62010 12 3 m 3mol 1
m A
二氧化碳的资源化利用能有效减少二氧化碳的排放,充分利用碳资源。二氧化碳向甲醇的催化转化过
程是循环利用碳资源的有效途径,其中热催化二氧化碳加氢制甲醇路线是重要的研究方向之一。一定温度
和压强下,利用铜基催化剂实现二氧化碳选择性加氢制甲醇的反应机理和能量变化图如下(其中吸附在催
化剂表面上的粒子用*标注)。
学科网(北京)股份有限公司回答下列问题。
13.下列说法错误的是( )
A.第①步存在共价键的断裂和形成
B.第②步是反应的决速步骤,化学方程式为HCOO*4H*CH O*H O
3 2
C.铜基催化剂可以改变反应历程
D.保持压强不变,室温下进行该反应,焓变变大
14.合成的甲醇可利用SnO (mSnO /CC)和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸,
2 2
其电化学装置的工作原理如图所示。
下列说法错误的是( )
A.碳布上的介孔SnO (mSnO /CC)作阴极催化剂
2 2
B.中间隔膜为质子交换膜
C.电路中转移4mol电子时,生成2mol甲酸
D.工作一段时间后,阴极区和阳极区的pH都会降低
二、非选择题:本大题共4小题,共58分。
15.(14分)研究小组以Cr O (绿色固体),CCl 等物质为原料制备无水CrCl (紫色固体,易升华),
2 3 4 3
制备装置如图所示(夹持装置略)。
学科网(北京)股份有限公司(1)仪器A的名称为___________。
(2)B处的装置为___________(填“a”或“b”),盛有的药品为___________。
(3)本实验持续通入N 的目的是赶走体系中原有的空气、___________。
2
(4)反应管的温度升到660℃时发生反应,生成CrCl 和COCl (光气),其化学方程式为___________
3 2
___________。COCl 有剧毒,与水反应生成两种酸性气体,COCl 的空间结构______________________,
2 2
与NaOH溶液反应生成的盐是______________________(填化学式)。
(5)反应管右端有15cm在加热炉外,其作用是_________________________________________________。
(6)反应完成后,得到固体产品2.536g,则该实验的产率为______________%。
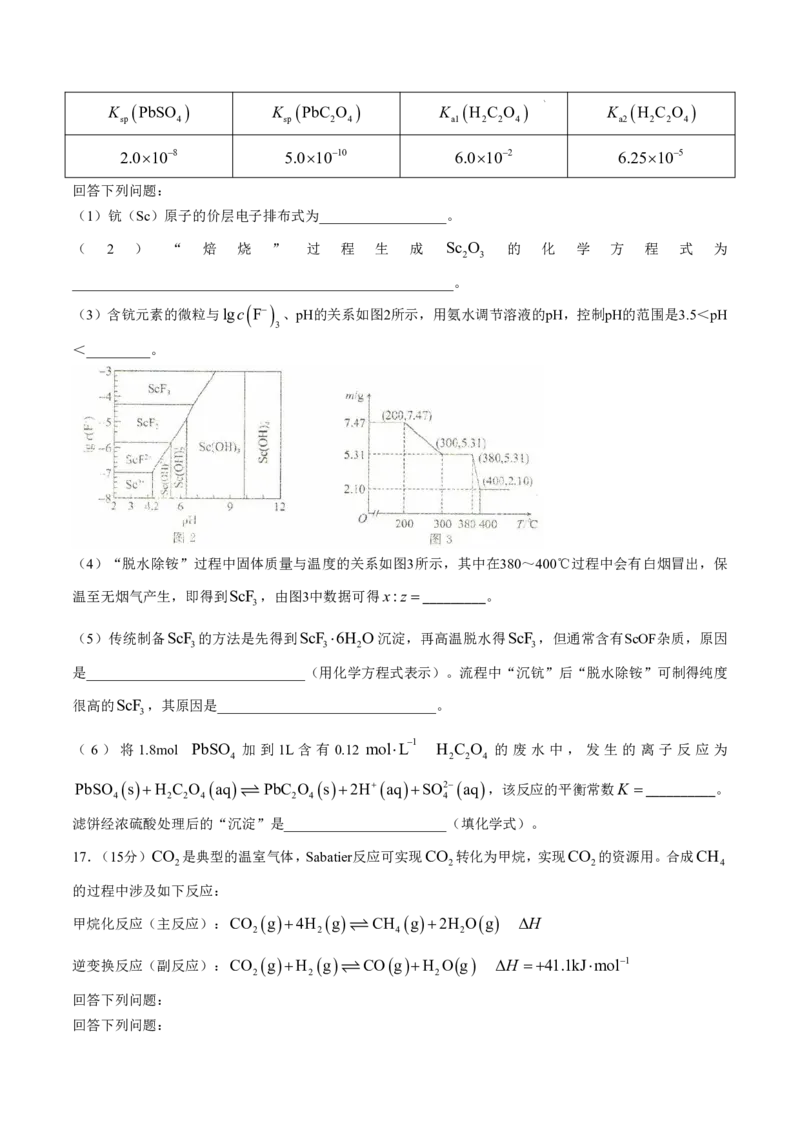
16.(14分)稀土在电子、激光、核工业、超导等诸多高科技领域有广泛的应用。钪(Sc)是一种稀土金
属,利用钛尾矿回收金属钪和草酸的工艺流程如图1所示。
图1
已知:①xNH ClyScF zH O是“沉钪”过程中ScF 与氯化物形成的复盐沉淀,在强酸中部分溶解。
4 3 2 3
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示。
学科网(北京)股份有限公司
K PbSO K PbC O K H C O K H C O
sp 4 sp 2 4 a1 2 2 4 a2 2 2 4
2.0108 5.01010 6.0102 6.25105
回答下列问题:
(1)钪(Sc)原子的价层电子排布式为__________________。
( 2 ) “ 焙 烧 ” 过 程 生 成 Sc O 的 化 学 方 程 式 为
2 3
______________________________________________________。
(3)含钪元素的微粒与lgc
F
、pH的关系如图2所示,用氨水调节溶液的pH,控制pH的范围是3.5<pH
3
<_________。
(4)“脱水除铵”过程中固体质量与温度的关系如图3所示,其中在380~400℃过程中会有白烟冒出,保
温至无烟气产生,即得到ScF ,由图3中数据可得x:z _________。
3
(5)传统制备ScF 的方法是先得到ScF 6H O沉淀,再高温脱水得ScF ,但通常含有ScOF杂质,原因
3 3 2 3
是_______________________________(用化学方程式表示)。流程中“沉钪”后“脱水除铵”可制得纯度
很高的ScF ,其原因是_______________________________。
3
( 6 ) 将 1.8mol PbSO 加 到 1L 含 有 0.12 molL
1
H C O 的 废 水 中 , 发 生 的 离 子 反 应 为
4 2 2 4
PbSO s H C O aq PbC O s 2H aq SO2 aq ,该反应的平衡常数K __________。
4 2 2 4 2 4 4
滤饼经浓硫酸处理后的“沉淀”是_______________________(填化学式)。
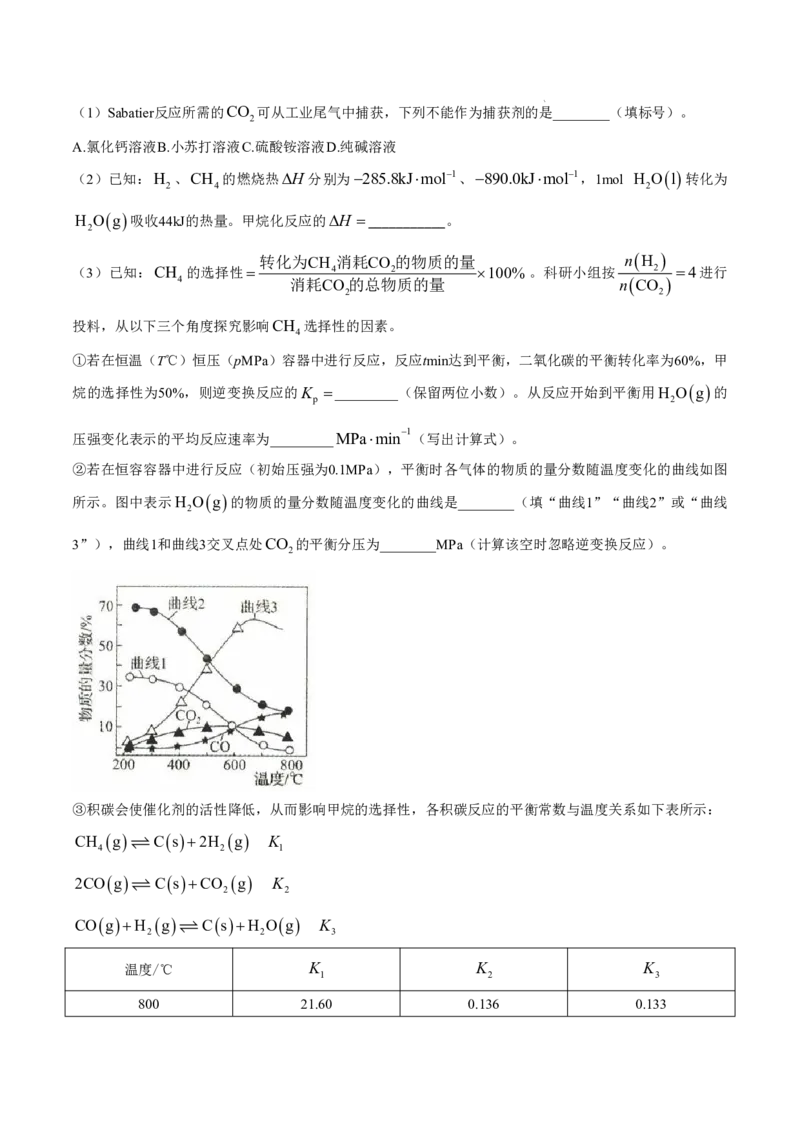
17.(15分)CO 是典型的温室气体,Sabatier反应可实现CO 转化为甲烷,实现CO 的资源用。合成CH
2 2 2 4
的过程中涉及如下反应:
甲烷化反应(主反应):CO g 4H g CH g 2H O g H
2 2 4 2
逆变换反应(副反应):CO g H g CO g H O g H 41.1kJmol1
2 2 2
回答下列问题:
回答下列问题:
学科网(北京)股份有限公司(1)Sabatier反应所需的CO 可从工业尾气中捕获,下列不能作为捕获剂的是________(填标号)。
2
A.氯化钙溶液B.小苏打溶液C.硫酸铵溶液D.纯碱溶液
(2)已知:H 、CH 的燃烧热H 分别为285.8kJmol1、890.0kJmol1,1mol H O l 转化为
2 4 2
H O g 吸收44kJ的热量。甲烷化反应的H ___________。
2
转化为CH 消耗CO 的物质的量 n H
(3)已知:CH 的选择性 4 2 100%。科研小组按 2 4进行
4 消耗CO 的总物质的量 n CO
2 2
投料,从以下三个角度探究影响CH 选择性的因素。
4
①若在恒温(T℃)恒压(pMPa)容器中进行反应,反应tmin达到平衡,二氧化碳的平衡转化率为60%,甲
烷的选择性为50%,则逆变换反应的K _________(保留两位小数)。从反应开始到平衡用H O g 的
p 2
压强变化表示的平均反应速率为_________MPamin
1
(写出计算式)。
②若在恒容容器中进行反应(初始压强为0.1MPa),平衡时各气体的物质的量分数随温度变化的曲线如图
所示。图中表示H O g 的物质的量分数随温度变化的曲线是________(填“曲线1”“曲线2”或“曲线
2
3”),曲线1和曲线3交叉点处CO 的平衡分压为________MPa(计算该空时忽略逆变换反应)。
2
③积碳会使催化剂的活性降低,从而影响甲烷的选择性,各积碳反应的平衡常数与温度关系如下表所示:
CH g C s 2H g K
4 2 1
2CO g C s CO g K
2 2
CO g H g C s H O g K
2 2 3
温度/℃ K K K
1 2 3
800 21.60 0.136 0.133
学科网(北京)股份有限公司850 33.94 0.058 0.067
900 51.38 0.027 0.036
由表中数据可知,积碳反应主要由反应______________________________________引起(填化学方程式),
该反应的H________0(填“>”或“<”)。
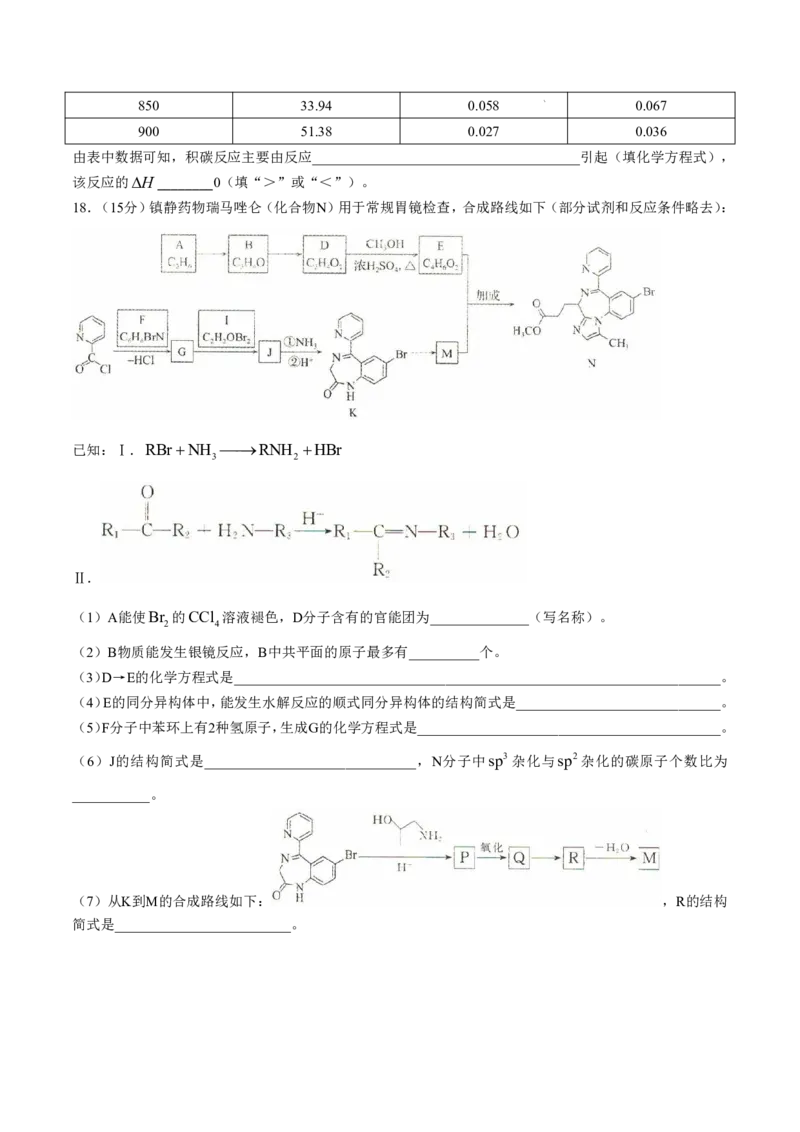
18.(15分)镇静药物瑞马唑仑(化合物N)用于常规胃镜检查,合成路线如下(部分试剂和反应条件略去):
已知:Ⅰ.RBrNH RNH HBr
3 2
Ⅱ.
(1)A能使Br 的CCl 溶液褪色,D分子含有的官能团为______________(写名称)。
2 4
(2)B物质能发生银镜反应,B中共平面的原子最多有__________个。
(3)D→E的化学方程式是_____________________________________________________________________。
(4)E的同分异构体中,能发生水解反应的顺式同分异构体的结构简式是_____________________________。
(5)F分子中苯环上有2种氢原子,生成G的化学方程式是___________________________________________。
(6)J的结构简式是______________________________,N分子中sp3杂化与sp2杂化的碳原子个数比为
___________。
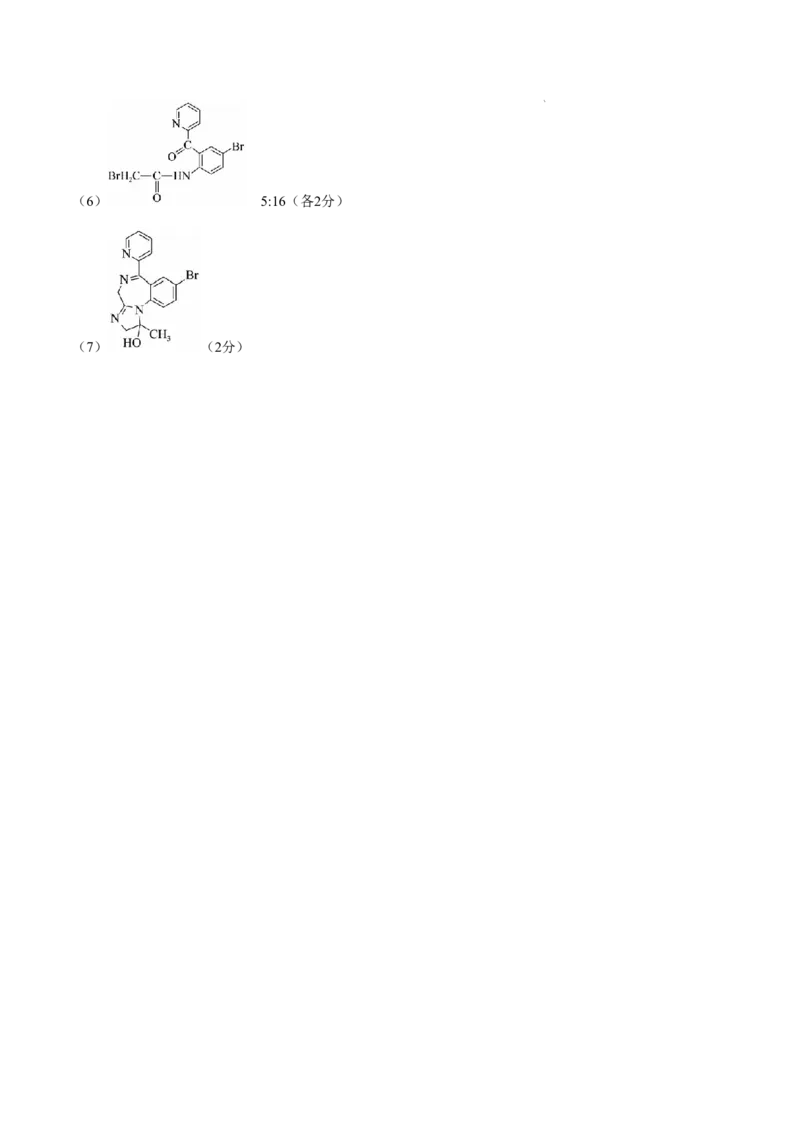
(7)从K到M的合成路线如下: ,R的结构
简式是_________________________。
学科网(北京)股份有限公司化学·参考答案
1.A “竹餐具”的主要成分为纤维素,纤维素属于多糖,A正确;主火炬燃料“零碳甲醇”中的碳是指
二氧化碳,B错误;有机高分子的聚合度不确定,吉祥物“江南忆”机器人有机高分子材料面罩为混合物,
C错误;甲醇和氧气在酸性条件下构成的燃料电池中,电池工作时,甲醇在负极被氧化,氧气在正极被还原,
D错误。
2.C 镁原子的价层电子排布式为3s2,最外层电子云轮廓图为球形,A错误;电负性:O>C,则呈负电
性的为O,B错误;HClO的结构式为H—O—Cl,中心原子O采用sp3杂化,分子呈V形,C正确;HF是弱酸,
部分电离,其电离方程式为HFH F,D错误。
3 . B 黄 铜 矿 ( CuFeS ) 中 Fe 的 化 合 价 为 + 2 , 工 业 上 用 黄 铜 矿 冶 炼 铜 的 反 应 :
2
高温
8CuFeS 21O 8Cu4FeO2Fe O 16SO ,该反应不是分解反应,A错误;工业上常用CO在
2 2 2 3 2
高温
高温下还原铁矿石炼铁:3COFe O 2Fe3CO ,B正确;工业上以海水为原料,经过一系列过程
2 3 2
电解
获得无水氯化镁,电解熔融氯化镁制镁:MgCl 熔融 Mg Cl ,C错误;氯化铝是共价化合物,
2 2
熔 融 状 态 下 氯 化 铝 不 电 离 , 也 不 导 电 , 工 业 制 铝 是 电 解 熔 融 的 氧 电 解 化 铝 :
电解
2Al O 熔融 4Al3O ,D错误。
2 3 冰晶石 2
4.B CH OH中没有OH ,A错误;1mol乙醇转化为1mol乙醛转移电子数为2mol,4.6g乙醇物质的量为
3
0.1mol,完全转化为乙醛,转移电子数为0.2N ,B正确;1分子P 中存在6个P—P键,常温常压下,124g P
A 4 4
(1mol)中所含P—P的数目为6N ,C错误;NH 、CO与Cu形成配位键,即4个σ键,3个氨分子中含有
A 3
9个σ键,1个CO中含有1个σ键,因此1mol
Cu NH
3
3
CO
中所含σ键个数为14N
A
,D错误。
5.D 由结构简式可知,白藜芦醇分子中不含连有4个不同原子或原子团的手性碳原子,A正确;白藜芦醇
分子中碳碳双键上的2个碳原子连有不同的原子或原子团,存在顺反异构,B正确;白藜芦醇分子中含有的
酚羟基能与NaOH反应,则1mol白藜芦醇可以和3molNaOH反应,C正确;白藜芦醇分子中含有酚羟基,能
与溴水发生取代反应,溴原子取代酚羟基邻、对位上的氢原子,分子中含有的碳碳双键能与溴水发生加成
反应,则白藜芦醇和过量饱和溴水反应,产物的分子式为C H O Br ,D错误。
14 7 3 7
6.B 酚酞遇碱变红,NaOH在水中能电离:NaOH Na OH,溶液显碱性,所以①中溶液显红色,
学科网(北京)股份有限公司A正确;通入SO 后,SO 能与NaOH溶液反应生成亚硫酸钠或亚硫酸氢钠,消耗了NaOH,溶液碱性减弱,
2 2
溶液红色褪去,体现了SO 的酸性氧化物的性质,不是漂白性,B错误;淀粉遇碘变蓝,所以②中溶液显蓝
2
色,C正确;通入SO 后,②中溶液颜色褪去是SO 和碘发生了氧化还原反应,I 被还原为I,溶液蓝色
2 2 2
褪去,D正确。
7.D 短周期主族元素X、Y、Z、R的原子序数依次增大,X的简单氢化物的水溶液呈碱性,则X为N元素;
制备Z的氢化物时不能选用玻璃容器,则Y为O元素,Z为F元素;R元素M层电子数是K层电子数的2倍,则R
为Si元素。同周期元素随着原子序数变大,第一电离能变大,N的2p轨道为半充满稳定状态,第一电离能大
于同周期相邻元素,则第一电离能:F>N>O,A错误;SiH 不存在分子间氢键,B错误;氟元素的非金属
4
性最强,没有正化合价,不存在最高价氧化物对应水化物,C错误;氮化硅是熔沸点高、硬度大的共价晶体,
所以常温下氮化硅为固态,D正确。
8.A 白磷为分子晶体,黑磷的晶体结构是与石墨类似的层状结构,为混合型晶体,则黑磷能导电、白磷
不导电,A错误;黑磷的晶体结构是与石墨类似的层状结构,片层间作用力为范德华力,B正确;黑磷的结
构与石墨类似,其熔沸点很高,故黑磷晶体的熔沸点比白磷高,C正确;利用均摊法得黑磷晶体中1个磷原
3
子形成 =1.5个共价键,则1mol黑磷晶体中含有1.5molP—P,D正确。
2
9.B 酸性KMnO 溶液紫色褪去,也可能口服液中含有其他还原性物质,不确定一定含有Fe2,A错误;
4
用蒸馏水溶解CuCl 2 固体,并继续加水稀释, CuCl 4 2 4H 2 O Cu H 2 O 4 2 4Cl,溶液由绿色
逐渐变为蓝色,说明生成
Cu H
2
O
4
2 ,平衡正向移动,B正确;氯水过量,Cl
2
既氧化了Br又氧化了
I,无法Br 确定I 和化性强弱,C错误;二氧化硫不能和氯化钡反应生成白色沉淀,D错误。
2 2
10.D 卤水“氧化”时氯气与卤水反应置换出Br ,同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时
2
SO 与R N ClBr 反应生成H SO 、HBr、R NCl,R NCl再与HBr反应生成HCl和R NBr,用盐酸
2 3 2 2 4 3 3 3
“洗脱”R NBr生成HBr和R NCl,HBr被氯气氧化得到溴单质,蒸馏得到液溴。“氧化”和“转化”工
3 3
序中Cl 的主要作用均为氧化Br,A正确;由流程中转化关系知,“氧化”时氯气与卤水反应置换出Br ,
2 2
同时氯气与水反应生成HCl进入水相Ⅰ;“还原”时SO 与R N ClBr 反应生成H SO 、HBr、R NCl,
2 3 2 2 4 3
R NCl再与HBr反应生成HCl和R NBr,故水相Ⅱ中含H和Cl,则水相Ⅰ和水相Ⅱ中均含有H和Cl,
3 3
B正确;用盐酸“洗脱”R NBr生成HBr同时生成R NCl,可完成R NCl的再生,C正确;保存液溴时加
3 3 3
适量水的主要作用是防止溴单质挥发,D错误。
学科网(北京)股份有限公司c
H
c
A
11.B 当 A 0.5时,c A c HA ,此时溶液的pH=5,因此,K c H 105,
a c HA
c
H
c
A
K c HA c
A
A错误;由K 可得c H a ,两边同取负对数可得:pHpK lg ,
a c HA c A a c HA
c
A
A
A
又由于 ,所以pHpK lg ,B正确;X点时,c A c HA ,无法判断是
c HA HA a HA
c
H
c
A
否达到滴定终点,C错误;将 c A 10c HA 代入 K 10c H 105 ,可得
a c HA
c H 106mol1L1>107molL1,溶液呈酸性,D错误。
1 1
12.D 由晶胞截面图可知,晶胞中碘离子位于顶点和面心,则碘离子个数为8 6 4,碘离子构
8 2
成8个四面体,银离子交替填充在碘离子构成的四面体的体心,则位于体内的银离子个数为4。由分析可知,
银离子交替填充在碘离子构成的四面体的体心,则银离子的配位数为4,由化学式可知,碘离子的配位数也
为4,A正确;银离子交替填充在碘离子构成的四面体的体心,则与银离子距离最近且相等的银离子有12个,
B正确;碘离子构成8个四面体,银离子交替填充在碘离子构成的四面体的体心,则空隙填充率为
4
100%50% , C 正 确 ; 由 晶 胞 参 数 可 知 , 晶 体 的 摩 尔 体 积
8
6201012 3 m3 N 6201012 3
V A m3mol1,D错误。
m 4 4
mol
N
A
13.D 根据反应机理示意图可知,第①步反应涉及碳氧极性键的断裂和碳氢键的形成,A正确;第②步化
学方程式为HCOO*4H*CH O*H O ,该步反应活化能最大,反应速率最慢,是该历程的决速步骤,
3 3
B正确;铜基催化剂可以影响反应的活化能,从而影响反应历程,C正确;焓变与反应体系的始末状态有关,
D错误。
14.C 从图示来看,左侧发生还原反应,碳布上的介孔SnO (mSnO /CC)作为阴极催化剂,A正确;
2 2
阴 极 的 电 极 反 应 式 为 CO 2H 2e HCOOH , 阳 极 的 电 极 反 应 式 为
2
CH OHH O4e HCOOH4H,电路中每转移4mol电子,阳极区有4mol H通过质子交换膜进
3 2
电解
入阴极区,B正确;总反应为2CO CH OHH O 3HCOOH ,电路中转移4mol电子时,生成3mol
2 3 2
HCOOH,C错误;阴极区和阳极区的产物都为HCOOH,工作一段时间后阴极区和阳极区pH都会降低,D正
确。
15.(1)三颈烧瓶(1分)
学科网(北京)股份有限公司(2)b 无水CaCl (各1分)
2
(3)将气态四氯化碳吹入管式炉(1分)
660℃
(4)Cr O 3CCl 2CrCl 3COCl 平面三角形 Na CO 和NaCl(各2分)
2 3 4 3 2 2 3
(5)使CrCl 凝华(2分)
3
(6)80(2分)
16.(1)3d 1 4s 2(1分)
焙烧
(2)2Sc C O 3O 2Sc O 12CO (2分)
2 2 4 3 2 2 3 2
(3)4.2(1分)
(4)1:2(2分)
(5)ScF H OScOF 2HF “除铵”时,NH Cl分解生成HCl,抑制Sc3的水解(各2分)
3 2 3 4
(6)1.5104 PbSO (各2分)
4
17.(1)ABC(2分,少选且正确的得1分,多选或错选不得分)
(2)165.2kJmol1(2分)
9p
(3)①0.27 (各2分)
44t
②曲线2 0.004(各2分)
③CH g C s 2H g (1分) >(2分)
4 2
18.(1)碳碳双键、羧基(1分)
(2)8(2分)
浓硫酸
(3)CH CHCOOHCH OH CH CHCOOCH H O (2分)
2 3 2 3 2
(4) (2分)
(5) (2分)
学科网(北京)股份有限公司(6) 5:16(各2分)
(7) (2分)
学科网(北京)股份有限公司