文档内容
—
2024 学年第一学期浙江省名校协作体试题
高三年级化学学科
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写学校、班级、姓名、试场号、座位号及准考证号;
座位号
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
可能用到的相对原子质量:H-1 C-12 N-14 0-16 Na-23 S-32 Mn-55
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有一个
是符合题目要求的,不选、多选、错选均不得分)
考场号
密封线内不要答题 1.硫酸铜铵晶体(NH4)?Cu(SO?)?·6H?O)属于
A.酸 B.碱 C.盐 D.混合物
2.下列说法不正确的是
A.电解饱和食盐水可制取金属钠
B.石灰石在高温下可用于消除燃煤烟气中的SO?
C. BaCO?不溶于水,但溶于盐酸,故不可用作医疗上检查肠胃的钡餐
D. 纯碱可用于去除物品表面的油污
准考证号
3. 下列化学用语正确的是
A. M2-核外有a个电子,b个中子,M的原子符号为0+2M
姓名
B.基态Cr原子核外电子排布式为:[Ar]3d?4s2
C.2-甲基丁烷的键线式:
D.次氯酸的电子式 H:Cl:0:
4.下列有关说法正确的是
班级
A.金属锂、钠、钾应保存在煤油中
B.蒸馏操作时需用到仪器:
C.萃取时分液漏斗振荡几次之后打开上口玻璃塞放气
D.点燃可燃性气体前,应先检验气体的纯度
5.硫脲(CS(NH?)?)是一种有机合成中常用的试剂,对于反应 CS(NH?)?+I?+H?O=X+SJ+
2HI,下列说法正确的是
A. X的化学式为HCONH? B.氧化产物与还原产物物质的量之比为2:1
C.氧化性I?>S D.每产生32g S单质,转移NA个电子
学校 6.下列反应的方程式正确的是
A. Na?CO?溶液中通入过量 SO?: CO?2+2SO?+H?O=2HSO?+CO?
B.向H??0中投入 Na?O?固体:2H?180+2Na?O?=4Na++40H-+18O?↑
高三化学试卷 第1页C.浓硝酸见光分解:4HNO?=4NO个+30?个+2H?O
D. H?的燃烧热为241.8 kJ·mol1,则2H?(g)+O?(g)=2H?O(g) △H=-483.6kJ·mol1
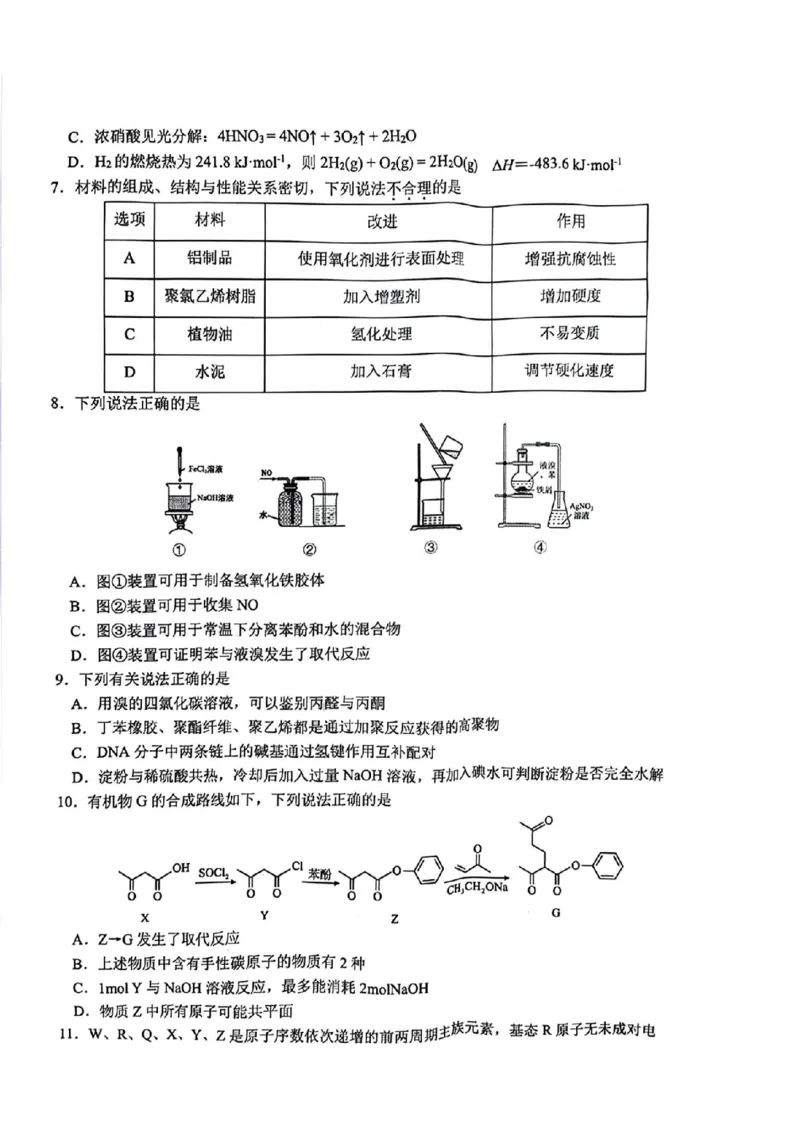
7.材料的组成、结构与性能关系密切,下列说法不合理的是
选项 材料 改进 作用
A 铝制品 使用氧化剂进行表面处理 增强抗腐蚀性
B
聚氯乙烯树脂 加入增塑剂 增加硬度
C
植物油 氢化处理 不易变质
D
水泥 加入石膏 调节硬化速度
8.下列说法正确的是
口
FC,溶液 NO 液况
苯
铁
LN?OH溶液
ApNO,
水~ 古 语液
③ ④
① ②
A.图①装置可用于制备氢氧
B.图②装置可用于收集NO
C.图③装置可用于常温下分离苯酚和水的混合物
D.图④装置可证明苯与液溴发生了取代反应
9.下列有关说法正确的是
A.用溴的四氯化碳溶液,可以鉴别丙醛与丙酮
B.丁苯橡胶、聚酯纤维、聚乙烯都是通过加聚反应获得的高聚物
C. DNA”分子中两条链一上的碱基通°过氢键作用互=补配n对 -o
D.淀粉与稀硫酸共热,冷却后加入过量NaOH 溶液,再加入碘水可判断淀粉是否完全水解
10.有机物G的合成路线如下,下列说法正确的是
)
A.Z→G发生了取代反应
B.上述物质中含有手性碳原子的物质有2种
C. 1molY与NaOH 溶液反应,最多能消耗2molNaOH
D.物质Z中所有原子可能共平面
11. W、R、Q、X、Y、Z是原子序数依次递增的前两周期主族元素,基态R原子无未成对电子,基态Q原子 2 子。W、R、X、Z四种元素可以组成离子化合物:
(XW4)?RZ?,其阴、阳离子均为正四面体结构。下列说法正确的是
A.(XW?)?RZ?阴阳离子中均含有配位键 B. X?W?分子空间结构为平面形
C.Q?W?Z?一定是非极性分子 D.氢化物热稳定性:Y>X
12.某研究团队通过膜电解法制得纯碱,甘氨酸(H?NCH?COOH)和高浓度烧碱,其装置如图所
示。其中膜 a、b为离子交换膜,双极膜c在直流电的作用下,中间界面层水发生解离产生H+和
OH。下列说法正确的是
电报A 膜a 双极膜c 膜b 电报B
H?O
H*
OH
NaHCO?溶液 H?NCH?COONa NaOH溶液 NaOH溶液
盐室1 溶液盐室2 码1 碱室2
A.膜 a为阴离子交换膜
B.制得7.5g甘氨酸,盐室1增重2.2g
C.碱室2反应式:2H?O-4e~= O?个+4H+
D.一段时间后,碱室1浓度变小,碱室2浓度变大
13.在K?Cr?O?溶液中加入 30?O?溶液,能得到紫色的 KHCrO?溶液,继续加入稀硫酸,立即
有蓝色的CrO?生成,该蓝色物质能被乙醚萃取。下列说法不正确的是
8。
A. CrOs结构为:
B. CrOs在酸性溶液继续反应可能会生成O?
C. KHCrO?和CrOs均能氧化Na?SO?
D. CrO?与KHCrO?晶体类型不同,后者难以被乙醚萃取
14.室温下,用含少量Mg2+的MnSO?溶液制备MnCO?的过程如题图所示:
NaF溶液 NaHCO?溶液
MnSO?
除镁 沉锰 →MnCO?
溶液
己知:Ksp(MgF?)=5.2×10-1,Ksp(MnCO?)=8.0×10-11;
K?p(Mn(OH?)=1.9×10-13,K?(H?CO3)=4.5×10-7,K?(H?CO?)=4.7×10-11
下列说法正确的是
A. MgF?饱和溶液中:c(F-)+c(HF)=2c(Mg2+)
B.为提高MnCO?的产率,使用Na?CO?溶液“沉锰”效果更好
C. 0.1molL1NaHCO?溶液中,c(Na+)>c(HCO3)>c(CO3-)>c(H?CO?)
D.反应:Mn2++2HCO;“=MnCO?J+H?CO?的平衡常数为K≈1.3×106
高三化学试卷 第3页k
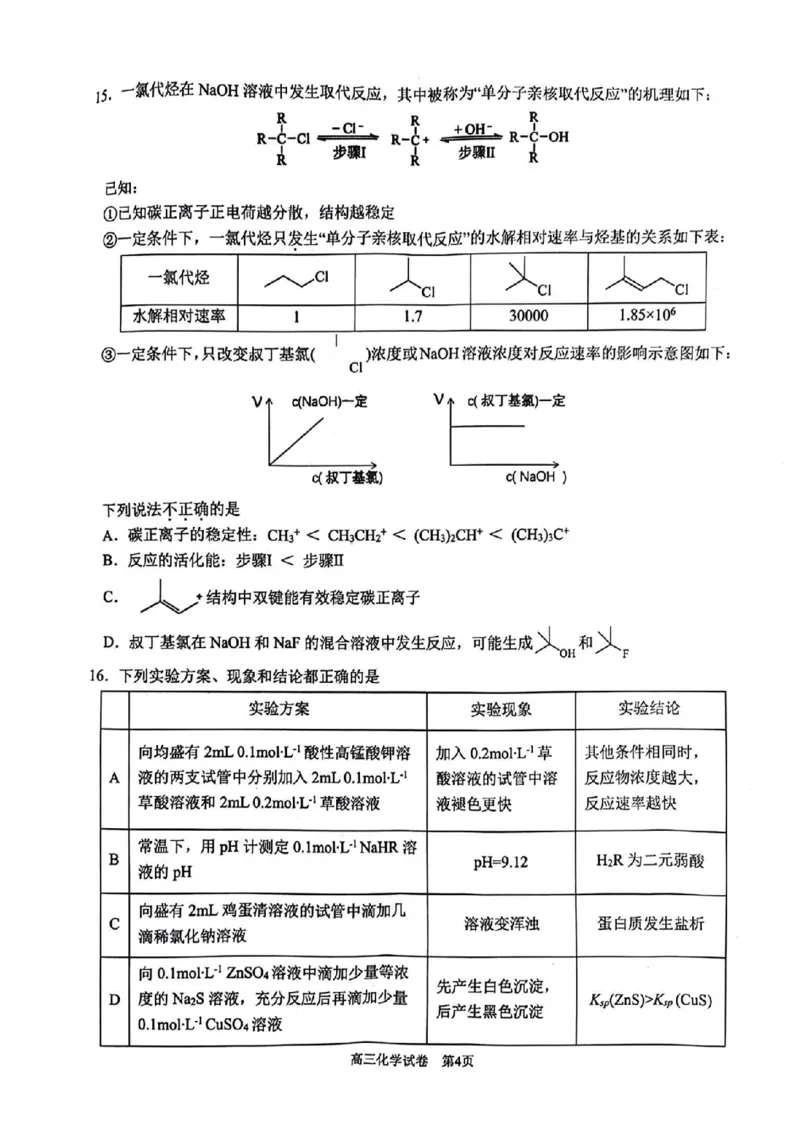
15.一氯代烃在NaOH , 称 应”的机理如下:
--a--步o--oR
已知:
①已知碳正离子正电荷越分散,结构越稳定
②一定条件下,一氯代烃只发生“单分子亲核取代反应”的水解相对速率与烃基的关系如下表:
Cl
一氯代烃
CI CI Cl
水解相对速率 1 1.7 30000 1.85×10?
③一定条件下,只改变叔丁基氯( )浓度或NaOH溶液浓度对反应速率的影响示意图如下:
CI
V
V个 c(NaOH)一定 c(叔丁基氯)一定
c(叔丁基氯)
下列说法不正确的是
A.碳正离子的稳定性:CH?+< CH?CH?+<(CH?)?CH+<(CH?)?C+
B.反应的活化能:步骤I< 步骤Ⅱ
C.
+结构中双键能有效稳定碳正离子
oH
D.叔丁基氯在NaOH和NaF的混合溶液中发生反应,可能生成 和
F
16.下列实验方案、现象和结论都正确的是
实验方案 实验现象 实验结论
向均盛有2mL 0.1mol-L1酸性高锰酸钾溶 加入0.2mol-L1草 其他条件相同时,
A
液的两支试管中分别加入2mL0.1mol-L1 酸溶液的试管中溶 反应物浓度越大,
草酸溶液和 2mL 0.2molL1草酸溶液 液褪色更快 反应速率越快
常温下,用pH计测定0.1molL1NaHR溶
B
pH=9.12 H?R为二元弱酸
液的 pH
向盛有2mL鸡蛋清溶液的试管中滴加几
C
溶液变浑浊 蛋白质发生盐析
滴稀氯化钠溶液
向0.1mol-L-1 ZnSO4溶液中滴加少量等浓
先产生白色沉淀,
D
度的Na?S溶液,充分反应后再滴加少量 Ksp(ZnS)>Ksp(CuS)
后产生黑色沉淀
0.1mol-L1CuSO?溶液
高三化学试卷 第4页非选择题部分
二、非选择题(本大题共5小题,共52分) ,
● 代表 Sr
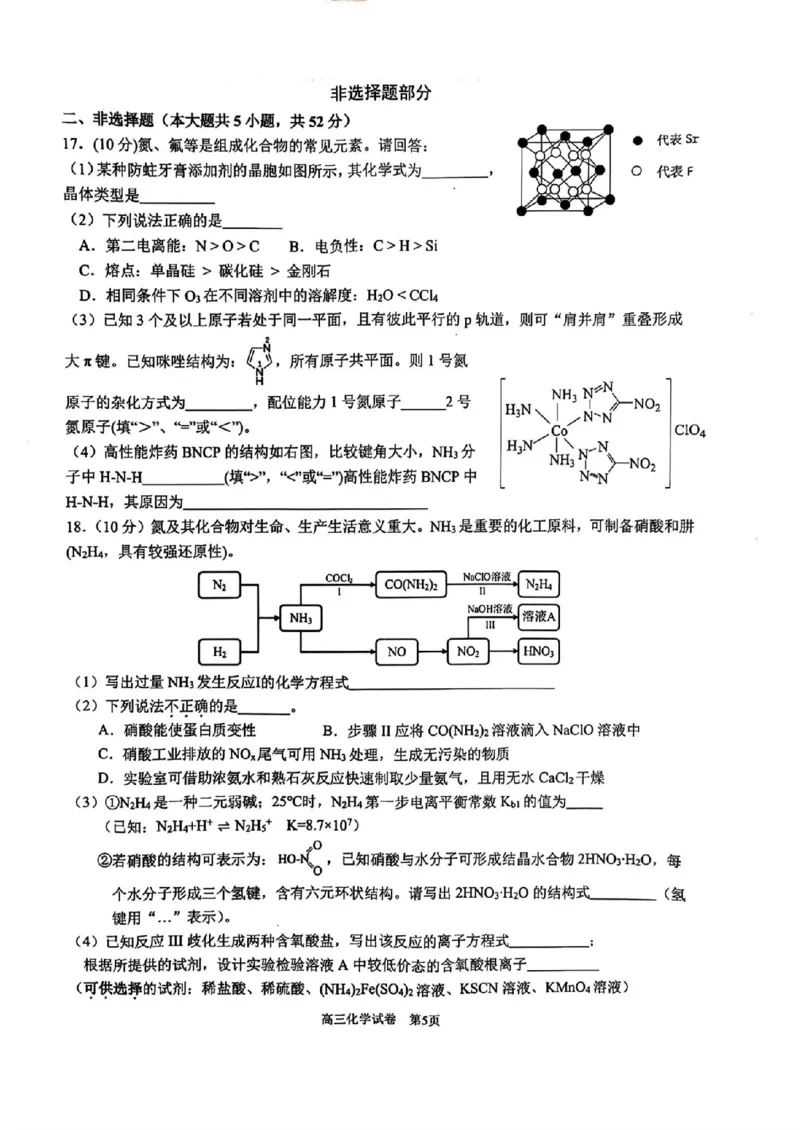
17.(10分)氮、氟等是组成化合物的常见元素。请回答:
(1)某种防蛀牙膏添加剂的晶胞如图所示,其化学式为
O 代表 F
晶体类型是
(2)下列说法正确的是
A.第二电离能:N>0>C B.电负性:C>H>Si
C.熔点:单晶硅>碳化硅>金刚石
D.相同条件下 O?在不同溶剂中的溶解度:H?O”、“=”或“<”)。
(4)高性能炸药 BNCP的结构如右图,比较键角大小,NH?分
子中H-N-H (填“>”,“<”或“=”高性能炸药 BNCP中
H-NH,其原因为
18.(10分)氮及其化合物对生命、生产生活意义重大。NH?是重要的化工原料,可制备硝酸和肼
(N?H?,具有较强还原性)。
N? COCb NaCIO溶液 N?H?
CO(NH?)?
1 Ⅱ
NH? NaOH溶液 溶液A
I
H? 。 NO NO? HNO?
(1)写出过量NH?发生反应I的化学方程式
(2)下列说法不正确的是
A.硝酸能使蛋白质变性 B.步骤Ⅱ应将CO(NH?)2溶液滴入NaClO溶液中
C.硝酸工业排放的NOx尾气可用NH?处理,生成无污染的物质
D.实验室可借助浓氨水和熟石灰反应快速制取少量氨气,且用无水 CaCl?干燥
(3)①N?H?是一种二元弱碱;25℃时,N?H?第一步电离平衡常数 Kbi的值为
(已知:N?H?+H+=N?Hs+ K=8.7×10?)
aok。,
②若硝酸的结构可表示为: 已知硝酸与水分子可形成结晶水合物2HNO?H?O,每
个水分子形成三个氢键,含有六元环状结构。请写出2HNOyH?O的结构式 (氢
键用“.”表示)。
_;
(4)已知反应Ⅲ歧化生成两种含氧酸盐,写出该反应的离子方程式
根据所提供的试剂,设计实验检验溶液A中较低价态的含氧酸根离子_
(可供选择的试剂:稀盐酸、稀硫酸、(NH4)?Fe(SO4)2溶液、KSCN 溶液、KMnO4溶液)
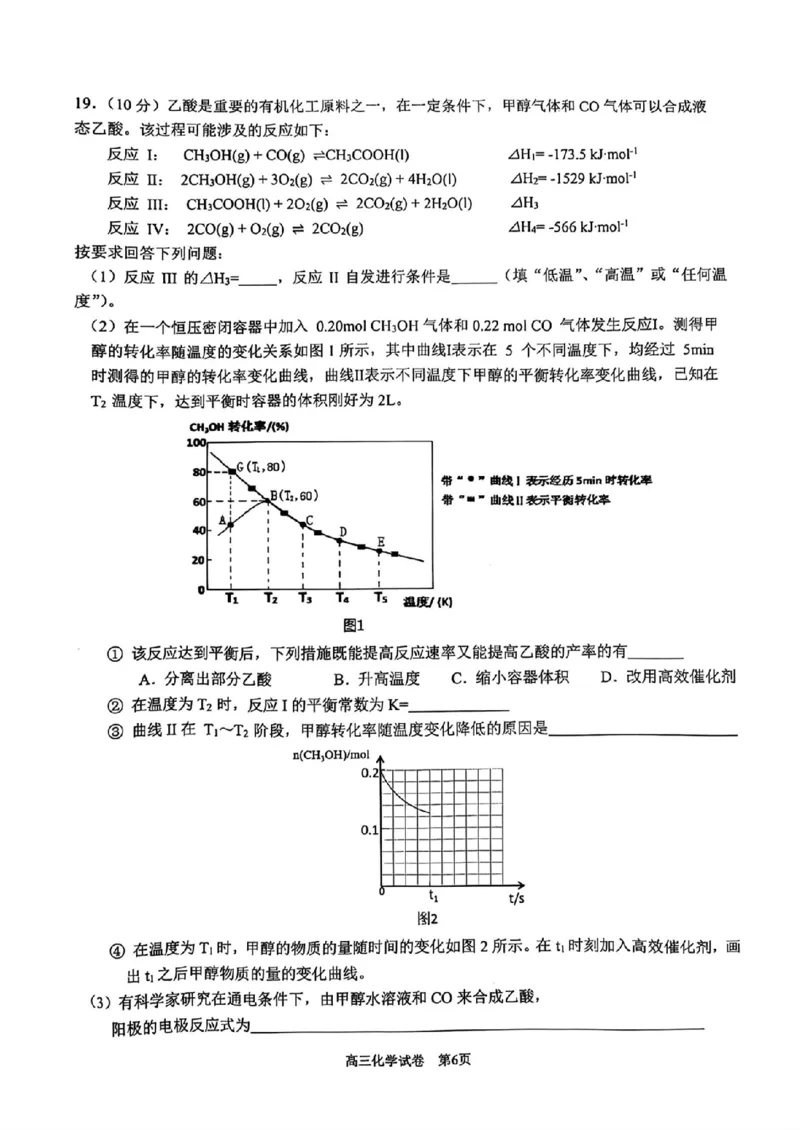
高三化学试卷 第5页19.(10分)乙酸是重要的有机化工原料之一,在一定条件下,甲醇气体和 CO气体可以合成液
态乙酸。该过程可能涉及的反应如下:
反应 I: CH?OH(g)+CO(g)=CH?COOH(1) △H?=-173.5 kJ·mol
反应 Ⅱ: 2CH?OH(g)+30?(g)=2CO?(g)+4H?O(1) △H?=-1529 kJ·mol-
反应 IⅢ: CH?COOH(1)+2O?(g)=2CO?(g)+2H?O(1) △H?
反应 IV: 2CO(g)+O?(g)=2CO?(g) △H?=-566 kJmol-1
按要求回答下列问题:
(1)反应 Ⅲ的△H?= ,反应 Ⅱ自发进行条件是 (填“低温”、“高温”或“任何温
度”)。
(2)在一个恒压密闭容器中加入 0.20mol CH?OH气体和 0.22 mol CO 气体发生反应I。测得甲
醇的转化率随温度的变化关系如图1所示,其中曲线I表示在5 个不同温度下,均经过 5min
时测得的甲醇的转化率变化曲线,曲线Ⅱ表示不同温度下甲醇的平衡转化率变化曲线,已知在
T?温度下,达到平衡时容器的体积刚好为2L。
CH?OH 转化率/19%)
100
80 G(I,80)
带“”曲线I表示经历5min时转化率
B(I?,60)
60 带“■”曲线Ⅱ表示平衡转化率
C
Aj
40 D
E
20
0L
T? T? T? T? Ts
温度/(K)
图1
①该反应达到平衡后,下列措施既能提高反应速率又能提高乙酸的产率的有
A.分离出部分乙酸 B.升高温度 C.缩小容器体积 D.改用高效催化剂
②在温度为T?时,反应I的平衡常数为K=
③ 曲线Ⅱ在 T?~T?阶段,甲醇转化率随温度变化降低的原因是
n(CH?OH)/mol
0.2k
0.1
δ t?
t/s
图2
④在温度为T?时,甲醇的物质的量随时间的变化如图2所示。在t时刻加入高效催化剂,画
出t?之后甲醇物质的量的变化曲线。
(3)有科学家研究在通电条件下,由甲醇水溶液和CO来合成乙酸,
阳极的电极反应式为
高三化学试卷 第6页20.(10分)铋酸钠(NaBiO?)常用作分析试剂、氧化剂,如在钢铁分析中测定锰等。某兴趣小
组设计实验制取铋酸钠并探究其应用。
I.制取铋酸钠(NaBiO?):
在NaOH 溶液中,Bi(OH)?与Cl?充分搅拌反应制取 NaBiO?,实验装置如下图所示:
浓盐酸 搅拌
NaOH Kg
K?
多 曲 溶液
K?
x-
KMnO?
甲 乙 丙 丁
已知:
①Bi(OH)?固体呈白色且难溶于水
②NaBiO?粉末呈浅黄色,不溶于冷水,在空气逐渐分解,遇沸水或酸溶液迅速分解
(1)丙中发生反应的离子方程式为
(2)丙中反应完成后,需及时关闭K?,原因是 ,甲中NaOH的作用是
→ →
(3)反应结束后,为从丙中获取 NaBiO?,请从下列选项中选出最合理的操作并排序:
—十 (填标号)。
a.冷水洗涤; b.热水洗涤; c.自然晾干
d.在干燥器中干燥 e.在冰水中冷却; f.快速过滤;
Ⅱ.探究NaBiO?的应用:利用NaBiO?测定溶液中Mn2+含量
(4)在试管中加入V?mLMnSO?和H?SO?的混合液,然后加入一定量的NaBiO?,充分反应分离
出剩余的NaBiO?,向所得滤液中加入足量KI溶液,充分反应后转移至碘量瓶中,用c mol-L-1
Na?S?O3溶液滴定至浅黄色,加入淀粉溶液,继续用c mol-L-1 Na?S?O?溶液滴定至终点,共消耗
Na?S?O?溶液V?mL
(已知:MnO?+I+H+→Mn2++I?+H?O、I?+S?O?2→S?O?2+I,均未配平)
①混合液中 Mn22+的含量为 mgmL-(用含V?、V?、c的代数式表示);
②在滴定过程中,下列实验操作会使测定结果偏高的是 (填标号)。
a.滴定前平视读数,滴定终点时俯视读数
b.滴定时碘量瓶中溶液酸性太强
c.碘量瓶用蒸馏水洗涤后未干燥
d. 滴定前滴定管尖嘴内无气泡,达到终点有气泡
e.没有分离出剩余的NaBiO?,直接加入足量KI溶液
高三化学试卷 第7页一一
二
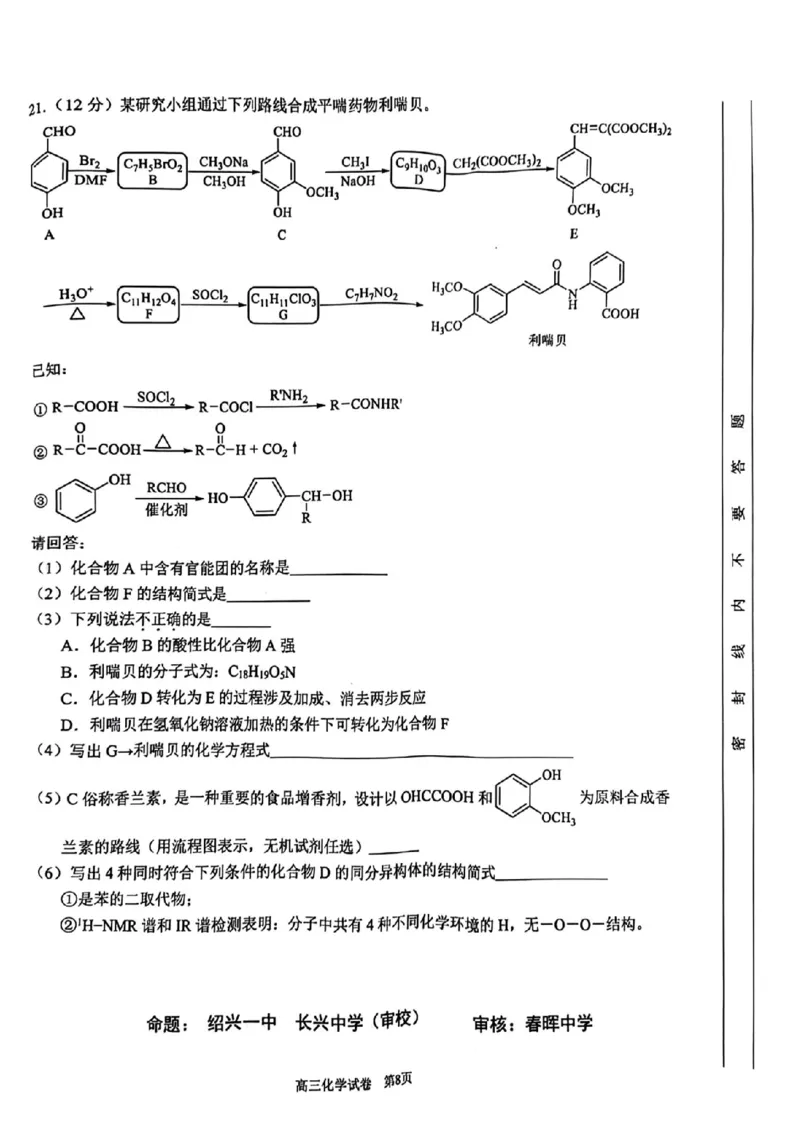
21.(12分)某研究小组通过下列路线合成平喘药物利喘贝。
A C
已知:
①R-COOH SOCl?→R-cocl—RNH?R-CONHR 密封线内不要答题
②R-c-con-△R-8-a+Co?t
·-=-二-c-oB
请回答:
(1)化合物A中含有官能团的名称是
(2)化合物F的结构简式是_
(3)下列说法不正确的是
A.化合物B的酸性比化合物A强
B.利喘贝的分子式为:C??H?9O?N
C.化合物D转化为E的过程涉及加成、消去两步反应
D.利喘贝在氢氧化钠溶液加热的条件下可转化为化合物F
(4)写出G→利喘贝的化学方程式_
OH
为原料合成香
(5)C俗称香兰素,是一种重要的食品增香剂,设计以OHCCOOH和
OCH?
兰素的路线(用流程图表示,无机试剂任选)
(6)写出4种同时符合下列条件的化合物D的同分异构体的结构简式
①是苯的二取代物;
②'H-NMR 谱和IR谱检测表明:分子中共有4种不同化学环境的H,无-0-0一结构。
命题:绍兴一中 长兴中学(审校) 审核:春晖中学
高三化学试卷 第8页2024学年第一学期浙江省名校协作体联考参考答案
高三年级化学学科
首命题:绍兴一中 次命题兼审校:长兴中学 审核:春晖中学
一、选择题(本大题共16小题,每小题3分,共48分。每个小题列出的四个备选项中只有一个是符
合题目要求的,不选、多选、错选均不得分)
题号 1 2 3 4 5 6 7 8
C A C D C A B B
答案
题号 9 10 11 12 13 14 15 16
答案 C C A B A D B D
二、非选择题(本大题共5小题,共52分)
17.(10分)
(1)SrF? (1分)离子晶体(1分)(2)BD(2分)
(3)sp2杂化(1分),<(2分)
(4)<(1分)BNCP内NH?中N形成配位键后无孤电子对,对N-H键的排斥作用减弱(2分)(其
它合理答案也给分)
18.(10分)
(1)4NH?+COCl?=CO(NH?)2+2NH?Cl(2分,产物正确,仅配平错误,1分)
(2)BD(2分)
(3)08x00(1分)②Ho0-oro-。
(1分,硝酸分子中羟基中氢氧键不标
出也给分)
(4)2NO?+2OH-=NO?+NO?·+H?O(2分,仅配平错误,1分)
取适量反应后溶液于试管中,滴入少量用稀硫酸酸化的KMnO?溶液,若观察到紫红色褪去,
则有NO?(2分,用稀盐酸酸化不得分,未酸化扣1分,其它合理答案即可)
19.(10分)
(1)-874 kJ·mol-(1分),低温(1分)
n(CH?OH)/mol
(2)①C(1分)②500(2分) 0.2
③T?~T?阶段,反应已到达平衡,升高温度,平
衡逆向移动,所以甲醇的转化率降低。(1分)
④见右图(2分,起点、趋势1分,平衡点在0.04处1 0.1
分)
(3)2 CH?OH-4e= CH?COOH +4H+(2分)
8 t?
t/s
20.(10
(1)Bi(OH)?+3OH+Na++Cl?=NaBiO?+2Cl+3H?O(2分,未配平1分,写化学方程式不得分)
(2)若继续通Cl?,导致Cl?过量,会使溶液呈酸性,NaBiO?分解(1分)
吸收甲中多余的氯气(1分)
v
(3)efad(2分,有错不得分)
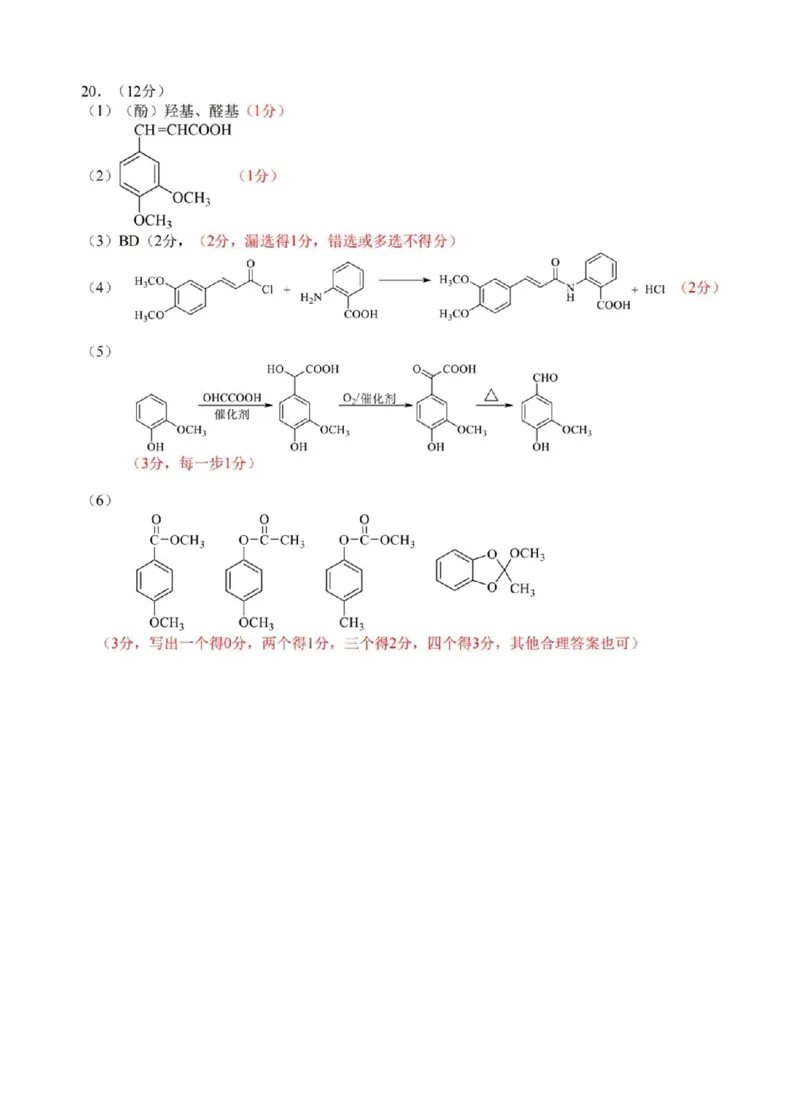
(4)(① (2分)②be(2分,漏选得1分,错选或多选不得分)20.(12分)
(1)(酚)羟基、醛基(1分)
CH=CHCOOH
(2) (1分)
OCH?
OCH?
+一
(3)BD(2分,(2分,漏选得1分,错选或多选不得分)
0 0 (2分)
H?CO、
(4) 乙H
COOH
H?CO
COOH
(5)
HO COOH O COOH
CHO
OHCCOOH O?/催化剂 △
催化剂
OCH?
OCH? OCH? OCH?
OH OH OH OH
(3分,每一步1分)
(6)
-0H; o-8-0cH;
g-C-CH?
X
OCH? OCH? CH?
(3分,写出一个得0分,两个得1分,三个得2分,四个得3分,其他合理答案也可)