文档内容
2025 届高三第四阶段模拟考试 化学 试卷
时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 O-16 Na-23 Cl-35.5 K -39 Mn-55
一、选择题(每题3分,共14题,每道题只有一个选项符合题意,共42分)
1.国画、古诗词是我国传统文化的瑰宝。下列有关说法不正确的是( )
A.墨的主要成分炭黑是一种无定形碳,与金刚石互为同素异形体
B.我国古代绘画所用的“绢”是一种人工合成的高分子材料
C.朝坛雾卷,曙岭烟沉”,雾有丁达尔效应是因为胶体粒子对光有散射作用
D.“章山之铜,所谓丹阳铜也。今有白铜,盖点化为之,非其本质”,白铜比纯铜硬度大,熔点低
2.下列化学用语表示正确的是( )
A.二氧化硅的分子式:SiO
2
B.SO 的VSEPR模型:
2
C.基态 Fe2+的价层电子轨道表示式为
D.反-2-丁烯的结构简式:
3.下列有关物质的性质与用途具有对应关系的是( )
A.Na CO 溶液呈碱性,可用作生产普通玻璃的原料
2 3
B.氧化铝的熔点高,可用于电解铝
C.氢氧化铝具有弱酸性,可用于治疗胃酸过多
D.铁粉具有还原性,可用于食品袋中的抗氧化剂
4.下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )
A.F—F 键的键能小于Cl—Cl键的键能
B.三氟乙酸的K 大于三氯乙酸的K
a a
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在(HF) ,而气态氯化氢中是HCl分子
2
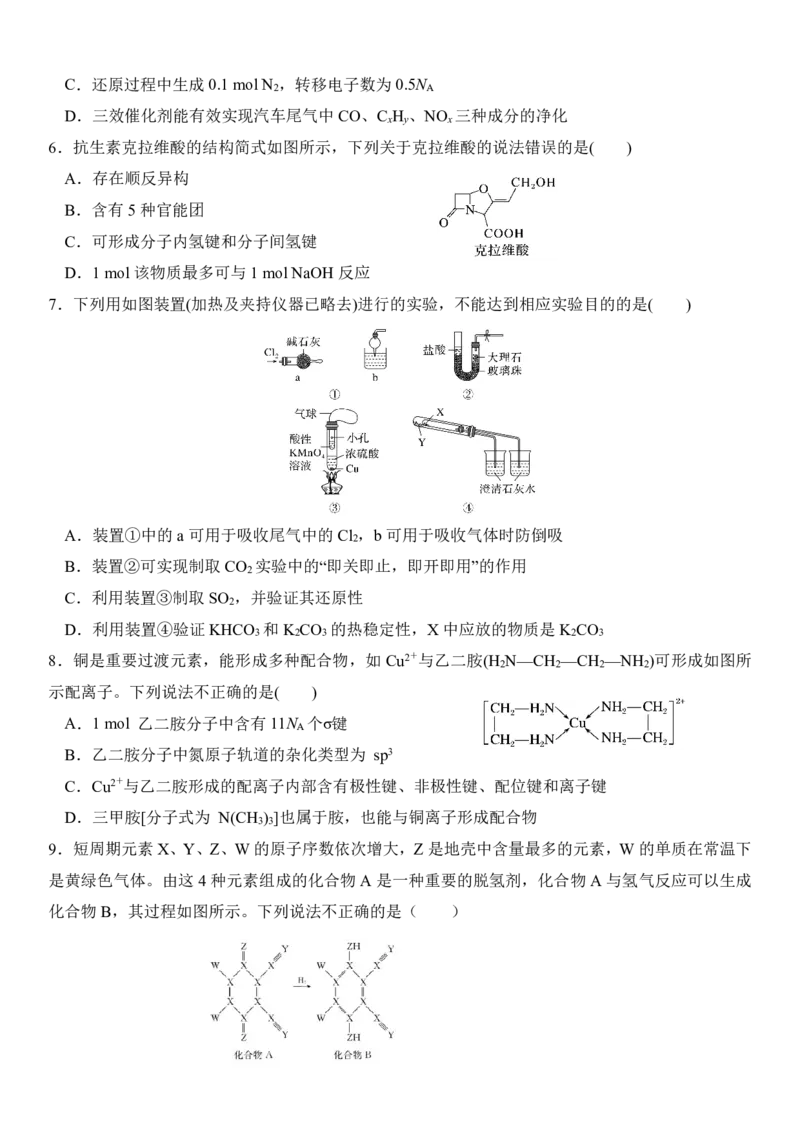
5.三效催化剂是最为常见的汽车尾气催化剂,其催化剂表面物质转化的关系如图所示,下列说法正
确的是( )
A.在转化过程中,氮元素均被还原
B.依据图示判断催化剂不参与储存和还原过程
1
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}C.还原过程中生成0.1molN ,转移电子数为0.5N
2 A
D.三效催化剂能有效实现汽车尾气中CO、C H 、NO 三种成分的净化
x y x
6.抗生素克拉维酸的结构简式如图所示,下列关于克拉维酸的说法错误的是( )
A.存在顺反异构
B.含有 5种官能团
C.可形成分子内氢键和分子间氢键
D.1mol该物质最多可与1mol NaOH 反应
7.下列用如图装置(加热及夹持仪器已略去)进行的实验,不能达到相应实验目的的是( )
A.装置①中的a可用于吸收尾气中的Cl ,b可用于吸收气体时防倒吸
2
B.装置②可实现制取CO 实验中的“即关即止,即开即用”的作用
2
C.利用装置③制取SO ,并验证其还原性
2
D.利用装置④验证KHCO 和K CO 的热稳定性,X中应放的物质是K CO
3 2 3 2 3
8.铜是重要过渡元素,能形成多种配合物,如 Cu2+与乙二胺(H N—CH —CH —NH )可形成如图所
2 2 2 2
示配离子。下列说法不正确的是( )
A.1mol 乙二胺分子中含有11N 个σ键
A
B.乙二胺分子中氮原子轨道的杂化类型为 sp3
C.Cu2+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键
D.三甲胺[分子式为 N(CH ) ]也属于胺,也能与铜离子形成配合物
3 3
9.短周期元素X、Y、Z、W的原子序数依次增大,Z是地壳中含量最多的元素,W 的单质在常温下
是黄绿色气体。由这 4 种元素组成的化合物 A 是一种重要的脱氢剂,化合物 A与氢气反应可以生成
化合物B,其过程如图所示。下列说法不正确的是( )
2
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}A.工业上可采用电解饱和食盐水的方法制备W的单质
B.第一电离能:Y>Z>X
C.Y、Z与氢三种元素形成的化合物的晶体类型一定是分子晶体
D.用FeCl 溶液可鉴别A和B
3
10.二氧化氯是(ClO )是一种黄绿色气体,是国际上公认的安全、无毒的绿色消毒剂。二氧化氯的
2
制备以及由二氧化氯制备一种重要的含氯消毒剂——亚氯酸钠(NaClO )的工艺流程如图:
2
已知:①NaClO 的溶解度随温度升高而增大,适当条件下可结晶析出NaClO ·3H O;
2 2 2
②纯ClO 易分解爆炸,一般用稀有气体或空气稀释到10%以下保证安全。
2
下列说法正确的是( )
A.工业上氯碱工业用的是阴离子交换膜
B.“ClO 发生器”中鼓入空气的作用是将NaClO 氧化成ClO
2 3 2
C.“吸收塔”内发生反应的化学方程式为2NaOH+2ClO ==NaClO +H O+NaClO
2 2 2 3
D.对NaClO ·3H O晶体进行重结晶可获得纯度更高的晶体。
2 2
11.某 Fe N 的晶胞如图 1 所示,晶胞边长为 a pm,Cu 可以完全替代该晶体中 a 位置 Fe 或 b 位置
x y
Fe,形成Cu 替代型产物Fe Cu N 。Fe N 转化为两种Cu替代型产物的能量变化如图2所示,下列
(x-n) n y x y
说法正确的是( )
A.该Fe N 的化学式为Fe N
x y 2
B.与 N等距且最近的N为8个
2
C.两个 a位置Fe 的最近距离为 apm
2
D.其中较稳定的Cu 替代型产物的化学式为FeCu N
3
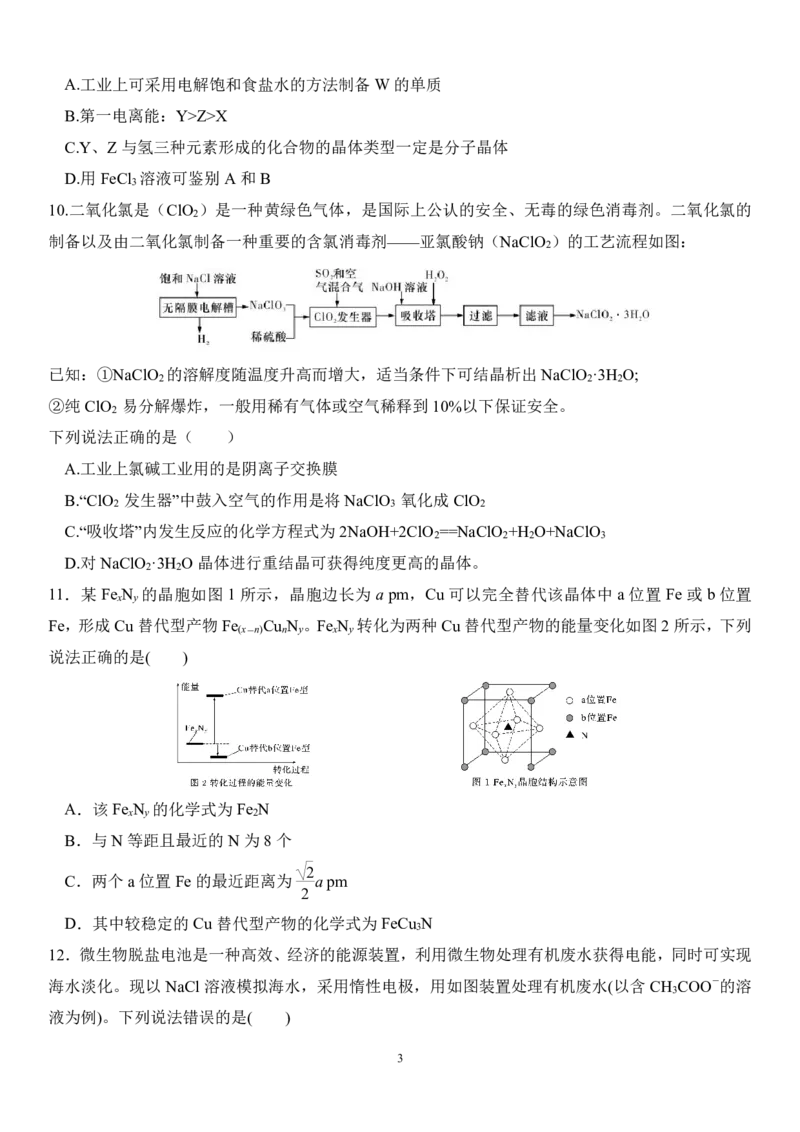
12.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现
海水淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH COO-的溶
3
液为例)。下列说法错误的是( )
3
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}A.负极反应为CH COO-+2H O-8e-===2CO ↑+7H+
3 2 2
B.隔膜 1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
13.铝离子电池常用离子液体 AlCl /[EMIM]Cl 作电解质,其中阴离子有 AlCl-、Al Cl-,阳离子为
3 4 2 7
EMIM+( ),EMIM+以单个形式存在时可以获得良好的溶解性能。下列说法错误的是
( )
Π6
A.EMIM+中存在大π键,表示为 5
B. Al Cl -中各原子最外层均达到8电子结构
2 7
C.1molEMIM+中所含σ键数为17N
A
D. 为使EMIM+获得良好的溶解性,不能将与N原子相连的—CH 、—C H 替换为H 原子
3 2 5
14.(2022·济宁模拟)25 ℃时,用HCl 气体调节0.1mol·L-1氨水的pH,系统中微粒浓度的对数值(lg c)
n HCl
与pH的关系如图1所示,反应物的物质的量之比[t= ]与pH的关系如图2所示。若忽
n NH ·H O
3 2
略通入气体后溶液体积的变化,下列有关说法正确的是( )
A.P 所示溶液:c(Cl-)=0.05mol·L-1
1
B.P 所示溶液:c(NH ·H O)<c(OH-)+c(Cl-)
2 3 2
C.P 所示溶液:c(NH+)+c(NH ·H O)=c(Cl-)+c(H+)
3 4 3 2
D.25℃时,NH ·H O的电离平衡常数为10-9.25
3 2
4
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}二、非选题(共4题,共58分)
15. (12分)某化学小组同学探究NaClO溶液与KI 溶液的反应,实验过程和记录如下:
实验 实验操作 实验现象
ⅰ.溶液变为浅黄色
Ⅰ
ⅱ.溶液变蓝
ⅰ.溶液保持无色
Ⅱ
ⅱ.溶液不变蓝,溶液的pH=10
【资料】:碘的化合物主要以 I和IO的形式存在。酸性条件下IO不能氧化Cl、可以氧化 I ,ClO
3 3
在pH 4并加热的条件下极不稳定。
(1)0.5mol·L-1NaClO 溶液的pH 11,用离子方程式表示其原因:_______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______________。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
①提出假设a:I 在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是____。
2
②进一步提出假设b:NaClO可将I 氧化为IO,进行实验证实了假设b成立。
2 3
(4)检验实验Ⅱ所得溶液中的IO:取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,
3
一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH 2。再加入KI溶液,溶液变蓝,说明
实验Ⅱ所得溶液中存在IO。
3
①有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO,理由是_______。
3
②欲证明实验Ⅱ所得溶液中存在IO,改进的实验方案是______________。
3
③实验Ⅱ中反应的离子方程式是______________。
16.(14分)以某混合氧化物(由MnO 、ZnO、CuO、Fe O 组成)为原料制备KMnO 和FeSO ·7H O
2 2 3 4 4 2
的工艺流程如下:
5
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}已知:ZnO与Al O 的化学性质相似。
2 3
回答下列问题:
(1)写出“酸浸”时,CuO反应的化学方程式:__ _____。
(2)“去铜”时,除了生成CuCl外,还有SO 2- 、H+生成,该反应的离子方程式为_______。
4
(3)为检验“去铜”后是否含有Fe3+,选用的试剂是_______。
(4)“熔融”时MnO 转化为K MnO ,该反应中每转移1mol电子,消耗_______gMnO 。
2 2 4 2
(5)已知"“歧化”时反应为3K MnO +2CO =2KMnO +MnO ↓+2K CO 。常温下,相关物质的溶解度
2 4 2 4 2 2 3
数据如下:
物质 K CO KHCO K SO KMnO CH COOK
2 3 3 2 4 4 3
溶解度(g/100g 水) 111 33.7 11.1 6.34 256
通入 CO 至溶液 pH 达10~11时,应停止通 CO ,不能继续通入 CO 的原因是_______。可以替
2 2 2
代CO 的试剂是_______(填“稀盐酸”“稀硫酸”或“稀醋酸”)。
2
(6) KMnO 的纯度测定:称取mgKMnO 粗品于烧杯中,加入蒸馏水和稀硫酸溶解,再用0.5mol·L-1
4 4
的Na C O 溶液滴定3次,平均消耗Na C O 溶液20.00mL。KMnO 样品的纯度为_______%(用含m
2 2 4 2 2 4 4
的代数式表示,杂质不参与反应)。已知酸性条件下KMnO 与Na C O 反应,生成Mn2+和CO 。
4 2 2 4 2
17.(16分)用于治疗高血压的药物Q的合成路线如下:
已知:①E与FeCl 溶液作用显紫色;
3
②W分子中只有一种化学环境的氢原子;
③G分子中含两个甲基,核磁共振氢谱显示只有3组峰,且遇FeCl 溶液作用显紫色
3
④芳香族化合物与卤代烃在AlCl 催化下可发生如下可逆反应:
3
6
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}AlCl
+R′Cl 3 +HCl
(1)B→D反应类型为 。(1分)
(2)W的名称是 ,W 的同分异构体中,含一种官能团的结构有 种(不考虑
立体异构)。
(3)下列说法正确的是 (填标号)。
a.酸性强弱:A>B b.E分子中所有原子一定在同一平面上
c.E能作为缩聚反应的单体 d.1molCH CH CN最多能与2molH 发生加成反应
3 2 2
(4)G的结构简式为 。
(5)乙二胺H
2
NCH
2
CH
2
NH
2
和三甲胺
NCH
3
3
均属于胺,且相对分子质量接近,但乙二胺比三甲
胺的沸点高很多,原因是 。
(6)J→L发生了取代反应,请写出反应的化学方程式 。
(7)已知: ,结合药物Q的合成路线,设计以甲苯为原料制备 的
合成路线 (无机试剂任选)。
18.(16分)Ⅰ.利用CO 、H 为原料合成CH OH的主要反应如下。
2 2 3
①
②
回答下列问题:
K
(1)已知反应Ⅲ的平衡常数K = 1 ,写出反应③的热化学方程式 。(2分)
3 K
2
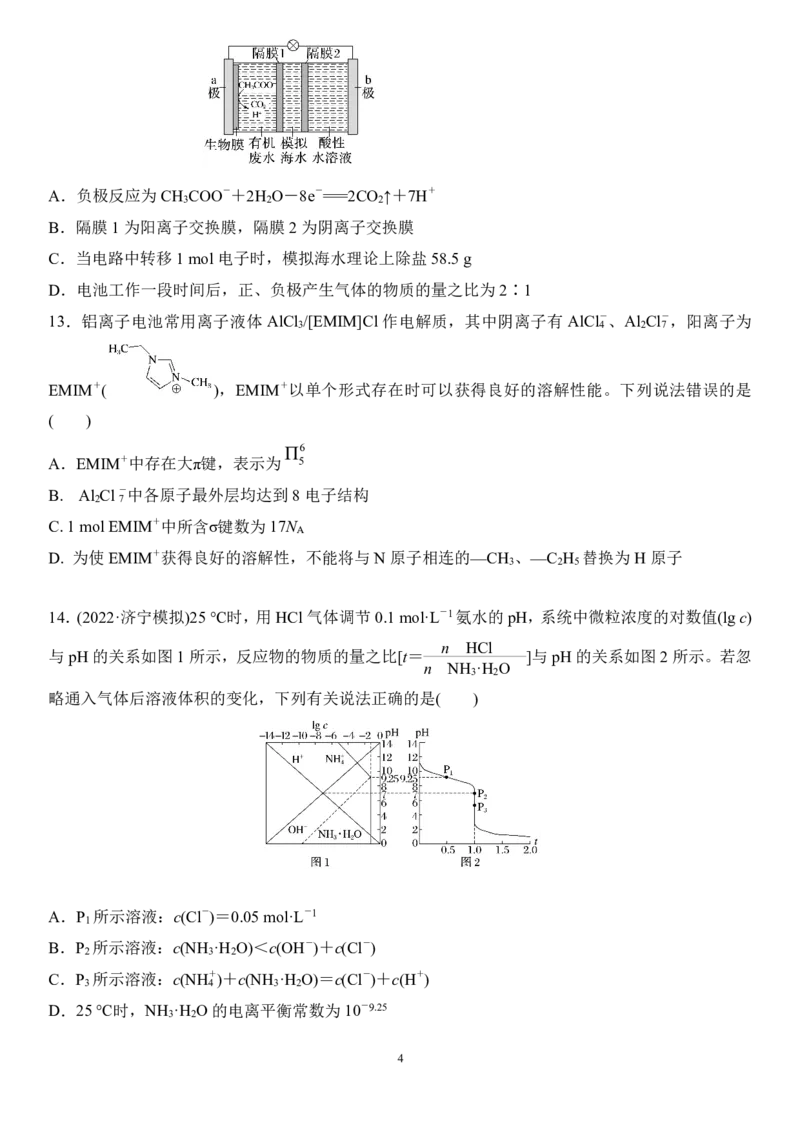
(2)一定条件下,向恒压密闭容器中以一定流速通入CO 和H 混合气体,CO 平衡转化率和CH OH选择
2 2 2 3
n 生成的CH OH
性 3 ×100% 随温度、投料比的变化曲线如图所示。
n
消耗的CO
2
7
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}1 表示CH OH选择性的曲线是 (填“L ”或“L ”) (1分),CO 平衡转化率随温度升高发生如图
3 1 2 2
变化的原因是 。(2分)
②生成CH OH的最佳条件是 (填标号)。(1分)
3
a.220°C,nCO :nH =1:3 b.220°C,nCO :nH =1:4
2 2 2 2
c.320°C,nCO :nH =1:4 d.320°C,nCO :nH =1:3
2 2 2 2
(3)一定温度下,向压强恒为pMPa的密闭容器中通入1mol CO g和3mol H g,充分反应后,测得CO
2 2 2
平衡转化率为a,CH OH选择性为b,该温度下反应Ⅱ的平衡常数Kp (2分)
3
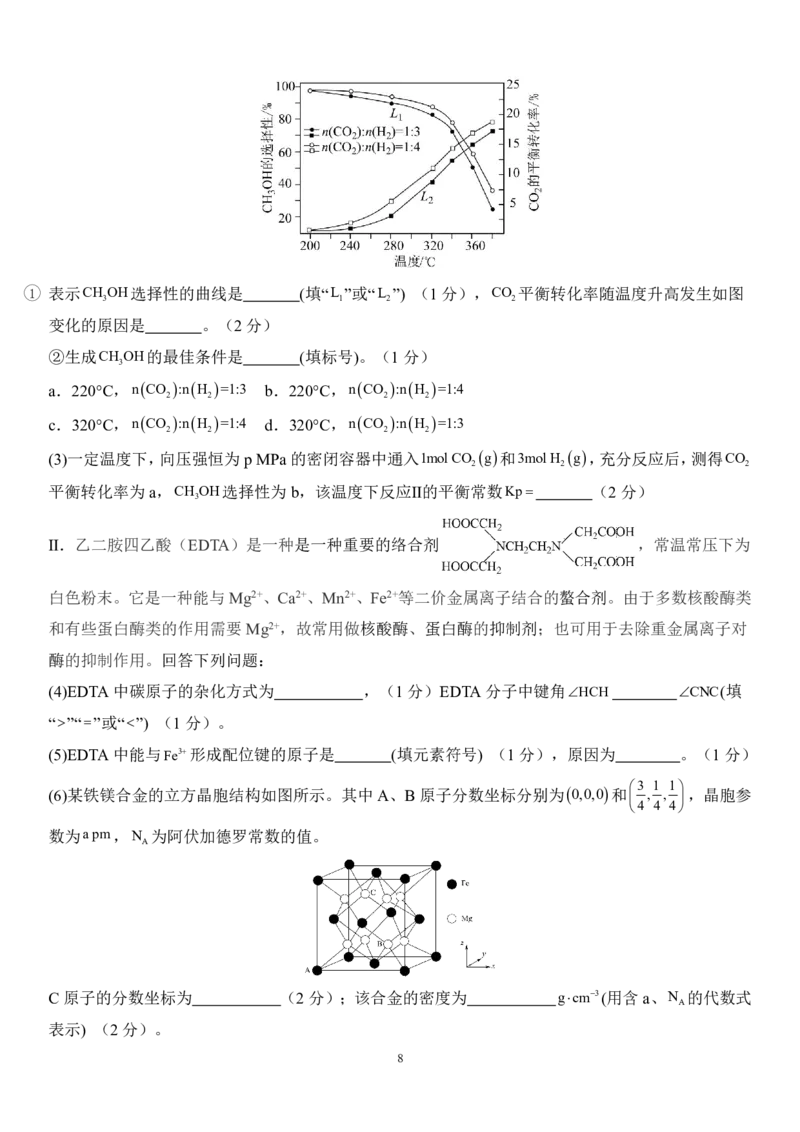
Ⅱ.乙二胺四乙酸(EDTA)是一种是一种重要的络合剂 ,常温常压下为
白色粉末。它是一种能与Mg2+、Ca2+、Mn2+、Fe2+等二价金属离子结合的螯合剂。由于多数核酸酶类
和有些蛋白酶类的作用需要Mg2+,故常用做核酸酶、蛋白酶的抑制剂;也可用于去除重金属离子对
酶的抑制作用。回答下列问题:
(4)EDTA中碳原子的杂化方式为 ,(1分)EDTA分子中键角HCH CNC(填
“”“”或“”) (1分)。
(5)EDTA中能与 Fe3形成配位键的原子是 (填元素符号) (1分),原因为 。(1分)
3 1 1
(6)某铁镁合金的立方晶胞结构如图所示。其中A、B原子分数坐标分别为0,0,0和 , , ,晶胞参
4 4 4
数为a pm,N 为阿伏加德罗常数的值。
A
C 原子的分数坐标为 (2分);该合金的密度为 gcm3(用含a、N 的代数式
A
表示) (2分)。
8
{#{QQABZQgEggCgAhBAABhCQwGQCgCQkhCACQgGAEAMIAAASAFABAA=}#}