文档内容
射洪中学高 2023 级高二上期半期考试
化学试题
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.答题前,务必将自己的姓名、班级、考号填写在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用
橡皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
可能用到的相对原子量:H—1 C—12 O—16 Mg—24 Si—28 S—32
第 I 卷(选择题,共 42 分)
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.文房四宝是中华传统文化的瑰宝。下列有关叙述错误的是
A.羊毛可用于制毛笔,主要成分为蛋白质
B.松木可用于制墨,墨的主要成分是单质碳
C.竹子可用于造纸,纸的主要成分是纤维素
D.大理石可用于制砚台,主要成分为硅酸盐
2.下列图示实验中,操作规范 是的
B.用 试纸测定溶液 D.向试管中滴加溶
A.调控滴定速度 C.加热试管中的液体
液
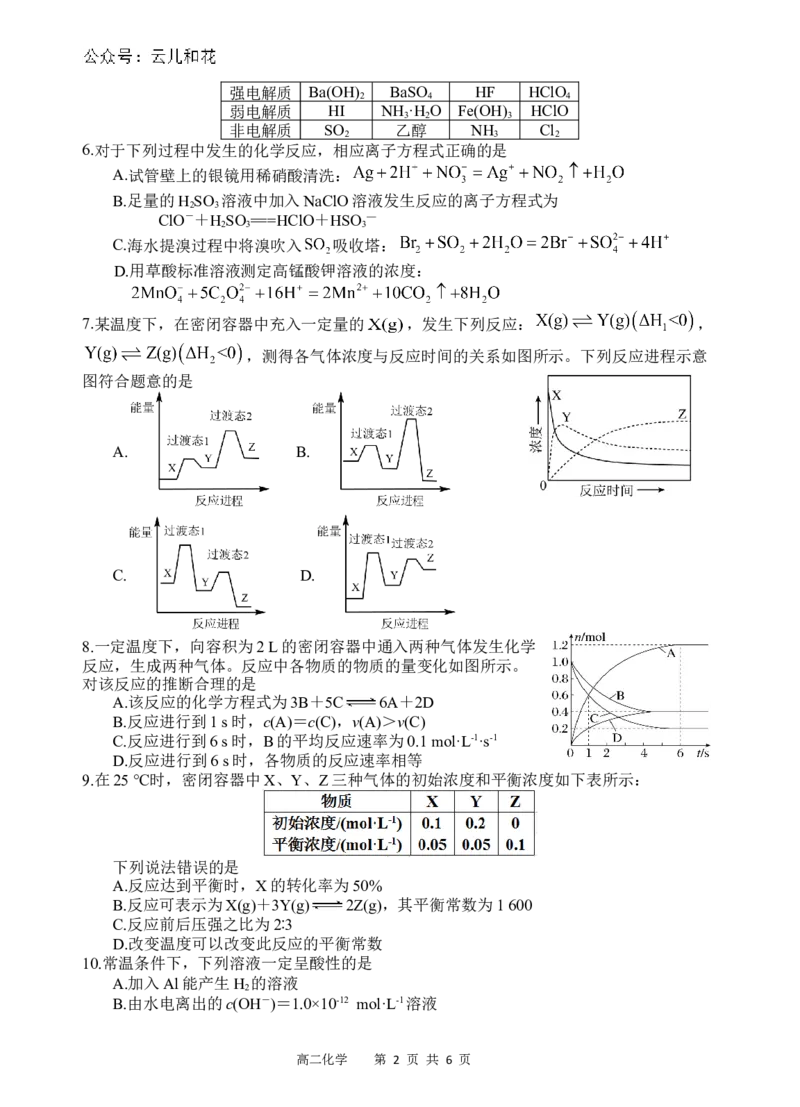
3.用如图所示的装置进行中和反应反应热的测定。下列说法正确的是
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.为了使反应均匀进行,药品可以分几次加入
D.分别测量NaOH与醋酸和硫酸中和反应的反应热,数值不同
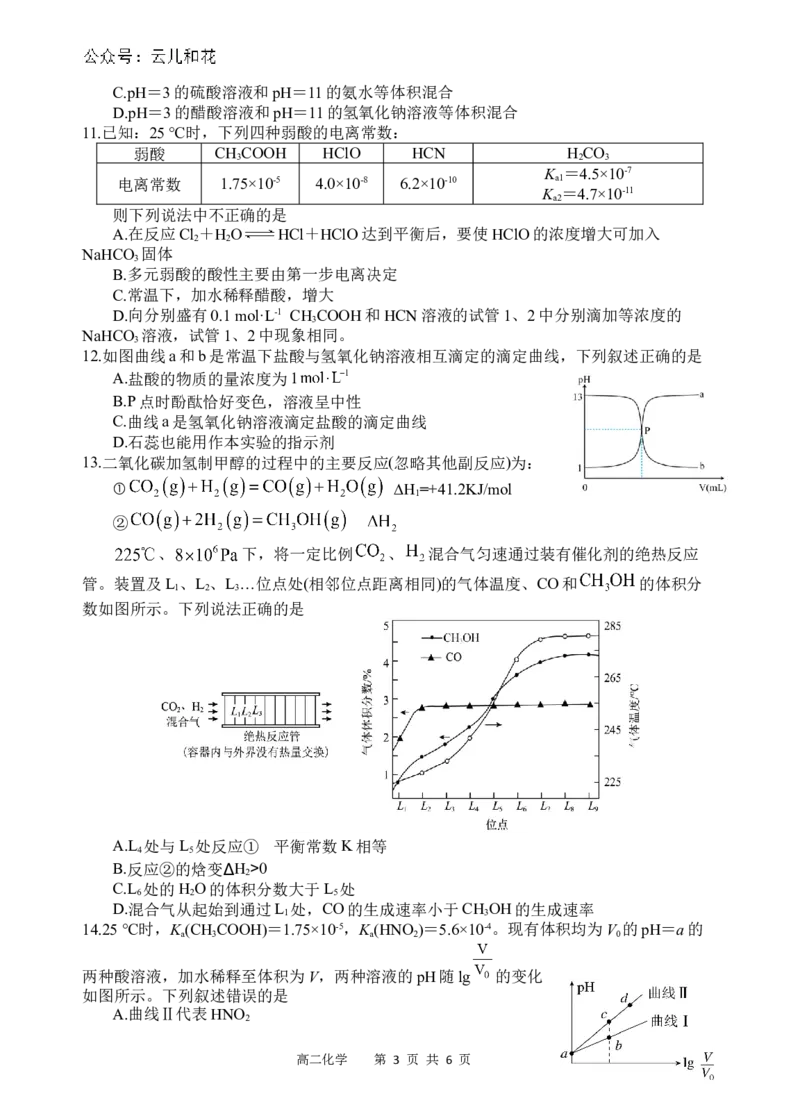
4.图像法是研究化学反应的一种常用方法。已知化学反应A (g)+B (g)===2AB(g)的能量变化
2 2
曲线如图所示,则下列叙述中正确的是
A.该反应在任何温度下都能自发
B.每生成2 mol AB(g)时吸收(a-b) kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B时放出a kJ能量
5.分类是认识和研究物质的一种常用科学方法,下列物质
的分类完全正确的一组是
选项 A B C D
高二化学 第 1 页 共 6 页强电解质 Ba(OH) BaSO HF HClO
2 4 4
弱电解质 HI NH ·H O Fe(OH) HClO
3 2 3
非电解质 SO 乙醇 NH Cl
2 3 2
6.对于下列过程中发生的化学反应,相应离子方程式正确的是
A.试管壁上的银镜用稀硝酸清洗:
B.足量的H SO 溶液中加入NaClO溶液发生反应的离子方程式为
2 3
ClO-+H SO ===HClO+HSO —
2 3 3
C.海水提溴过程中将溴吹入 吸收塔:
D.用草酸标准溶液测定高锰酸钾溶液的浓度:
7.某温度下,在密闭容器中充入一定量的 ,发生下列反应: ,
,测得各气体浓度与反应时间的关系如图所示。下列反应进程示意
图符合题意的是
A. B.
C. D.
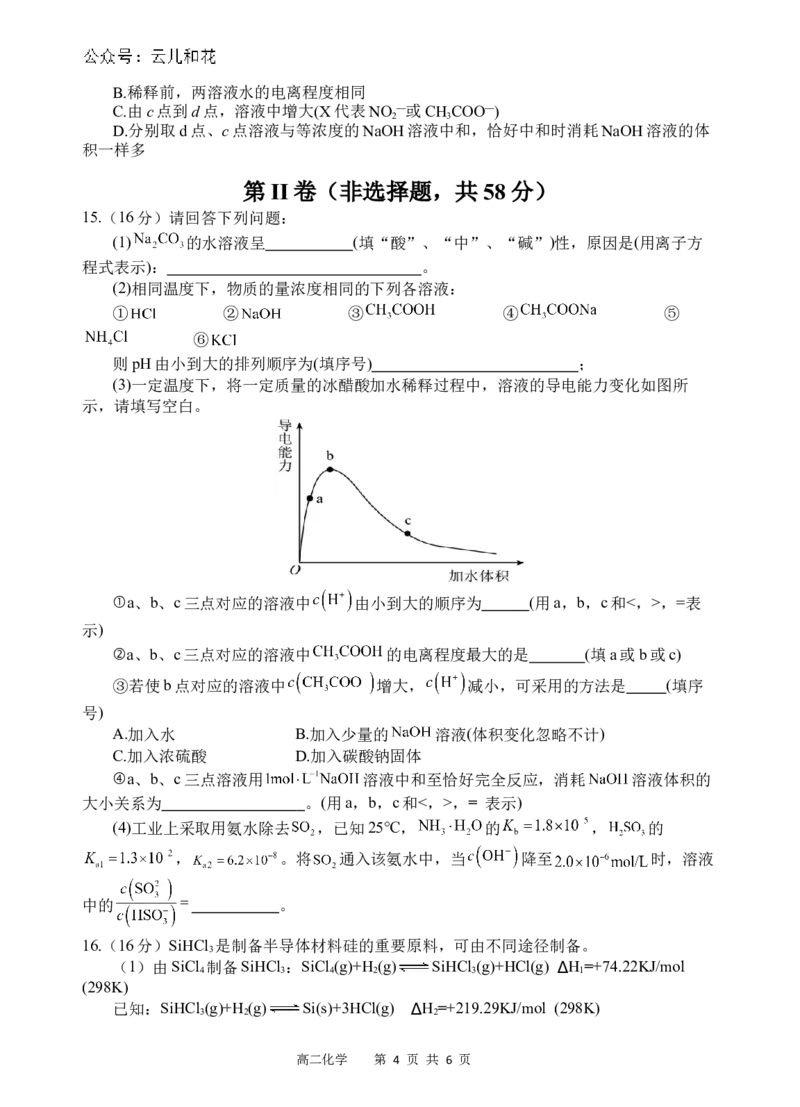
8.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学
反应,生成两种气体。反应中各物质的物质的量变化如图所示。
对该反应的推断合理的是
A.该反应的化学方程式为3B+5C 6A+2D
B.反应进行到1 s时,c(A)=c(C),v(A)>v(C)
C.反应进行到6 s时,B的平均反应速率为0.1 mol·L-1·s-1
D.反应进行到6 s时,各物质的反应速率相等
9.在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表所示:
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g) 2Z(g),其平衡常数为1 600
C.反应前后压强之比为2∶3
D.改变温度可以改变此反应的平衡常数
10.常温条件下,下列溶液一定呈酸性的是
A.加入Al能产生H 的溶液
2
B.由水电离出的c(OH-)=1.0×10-12 mol·L-1溶液
高二化学 第 2 页 共 6 页C.pH=3的硫酸溶液和pH=11的氨水等体积混合
D.pH=3的醋酸溶液和pH=11的氢氧化钠溶液等体积混合
11.已知:25 ℃时,下列四种弱酸的电离常数:
弱酸 CH COOH HClO HCN H CO
3 2 3
K =4.5×10-7
电离常数 1.75×10-5 4.0×10-8 6.2×10-10 a1
K =4.7×10-11
a2
则下列说法中不正确的是
A.在反应Cl +H O HCl+HClO达到平衡后,要使HClO的浓度增大可加入
2 2
NaHCO 固体
3
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,增大
D.向分别盛有0.1 mol·L-1 CH COOH和HCN溶液的试管1、2中分别滴加等浓度的
3
NaHCO 溶液,试管1、2中现象相同。
3
12.如图曲线a和b是常温下盐酸与氢氧化钠溶液相互滴定的滴定曲线,下列叙述正确的是
A.盐酸的物质的量浓度为1
B.P点时酚酞恰好变色,溶液呈中性
C.曲线a是氢氧化钠溶液滴定盐酸的滴定曲线
D.石蕊也能用作本实验的指示剂
13.二氧化碳加氢制甲醇的过程中的主要反应(忽略其他副反应)为:
① ∆H =+41.2KJ/mol
1
②
、 下,将一定比例 、 混合气匀速通过装有催化剂的绝热反应
管。装置及L 、L 、L …位点处(相邻位点距离相同)的气体温度、CO和 的体积分
1 2 3
数如图所示。下列说法正确的是
A.L 处与L 处反应① 平的衡常数K相等
4 5
B.反应②的焓变∆H >0
2
C.L 处的H O的体积分数大于L 处
6 2 5
D.混合气从起始到通过L 处,CO的生成速率小于CH OH的生成速率
1 3
14.25 ℃时,K(CH COOH)=1.75×10-5,K(HNO )=5.6×10-4。现有体积均为V 的pH=a的
a 3 a 2 0
两种酸溶液,加水稀释至体积为V,两种溶液的pH随lg 的变化
如图所示。下列叙述错误的是
A.曲线Ⅱ代表HNO
2
高二化学 第 3 页 共 6 页B.稀释前,两溶液水的电离程度相同
C.由c点到d点,溶液中增大(X代表NO —或CH COO—)
2 3
D.分别取d点、c点溶液与等浓度的NaOH溶液中和,恰好中和时消耗NaOH溶液的体
积一样多
第 II 卷(非选择题,共 58 分)
15.(16分)请回答下列问题:
(1) 的水溶液呈 (填“酸”、“中”、“碱”)性,原因是(用离子方
程式表示): 。
(2)相同温度下,物质的量浓度相同的下列各溶液:
① ② ③ ④ ⑤
⑥
则pH由小到大的排列顺序为(填序号) ;
(3)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所
示,请填写空白。
①a、b、c三点对应的溶液中 由小到大的顺序为 (用a,b,c和<,>,=表
示)
②a、b、c三点对应的溶液中 的电离程度最大的是 (填a或b或c)
③若使b点对应的溶液中 增大, 减小,可采用的方法是 (填序
号)
A.加入水 B.加入少量的 溶液(体积变化忽略不计)
C.加入浓硫酸 D.加入碳酸钠固体
④a、b、c三点溶液用 溶液中和至恰好完全反应,消耗 溶液体积的
大小关系为 。(用a,b,c和<,>,= 表示)
(4)工业上采取用氨水除去 ,已知25℃, 的 , 的
, 。将 通入该氨水中,当 降至 时,溶液
中的 。
16.(16分)SiHCl 是制备半导体材料硅的重要原料,可由不同途径制备。
3
(1)由SiCl 制备SiHCl :SiCl (g)+H (g) SiHCl (g)+HCl(g) ∆H =+74.22KJ/mol
4 3 4 2 3 1
(298K)
已知:SiHCl (g)+H (g) Si(s)+3HCl(g) ∆H =+219.29KJ/mol (298K)
3 2 2
高二化学 第 4 页 共 6 页时,由SiCl (g)+2H (g) Si(s)+4HCl(g)制备 硅_______(填“吸”或“放”)
4 2
热_______ 。升高温度有利于制备硅的原因是 。
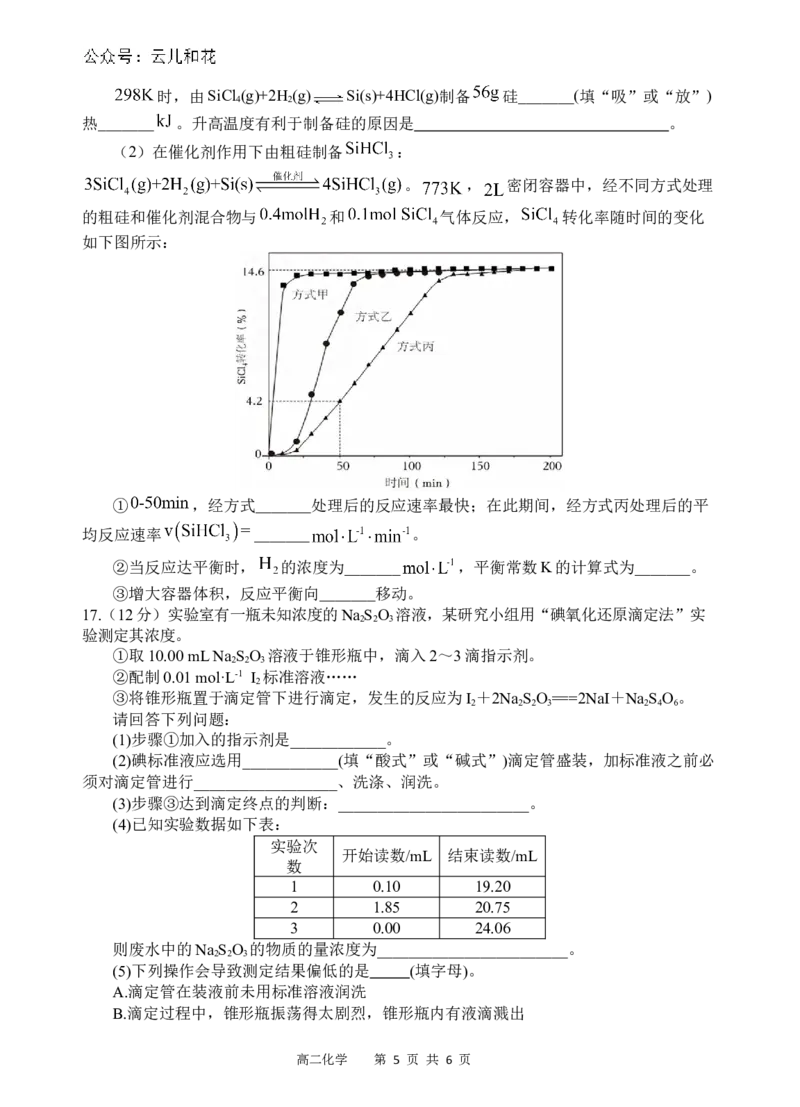
(2)在催化剂作用下由粗硅制备 :
。 , 密闭容器中,经不同方式处理
的粗硅和催化剂混合物与 和 气体反应, 转化率随时间的变化
如下图所示:
① ,经方式_______处理后的反应速率最快;在此期间,经方式丙处理后的平
均反应速率 _______ 。
②当反应达平衡时, 的浓度为_______ ,平衡常数K的计算式为_______。
③增大容器体积,反应平衡向_______移动。
17.(12分)实验室有一瓶未知浓度的Na S O 溶液,某研究小组用“碘氧化还原滴定法”实
2 2 3
验测定其浓度。
①取10.00 mL Na S O 溶液于锥形瓶中,滴入2~3滴指示剂。
2 2 3
②配制0.01 mol·L-1 I 标准溶液……
2
③将锥形瓶置于滴定管下进行滴定,发生的反应为I +2Na S O ===2NaI+Na S O 。
2 2 2 3 2 4 6
请回答下列问题:
(1)步骤①加入的指示剂是____________。
(2)碘标准液应选用____________(填“酸式”或“碱式”)滴定管盛装,加标准液之前必
须对滴定管进行__________________、洗涤、润洗。
(3)步骤③达到滴定终点的判断:________________________。
(4)已知实验数据如下表:
实验次
开始读数/mL 结束读数/mL
数
1 0.10 19.20
2 1.85 20.75
3 0.00 24.06
则废水中的Na S O 的物质的量浓度为________________________。
2 2 3
(5)下列操作会导致测定结果偏低的是 (填字母)。
A.滴定管在装液前未用标准溶液润洗
B.滴定过程中,锥形瓶振荡得太剧烈,锥形瓶内有液滴溅出
高二化学 第 5 页 共 6 页C.装标准溶液的滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.起始读数时平视,终点读数时仰视
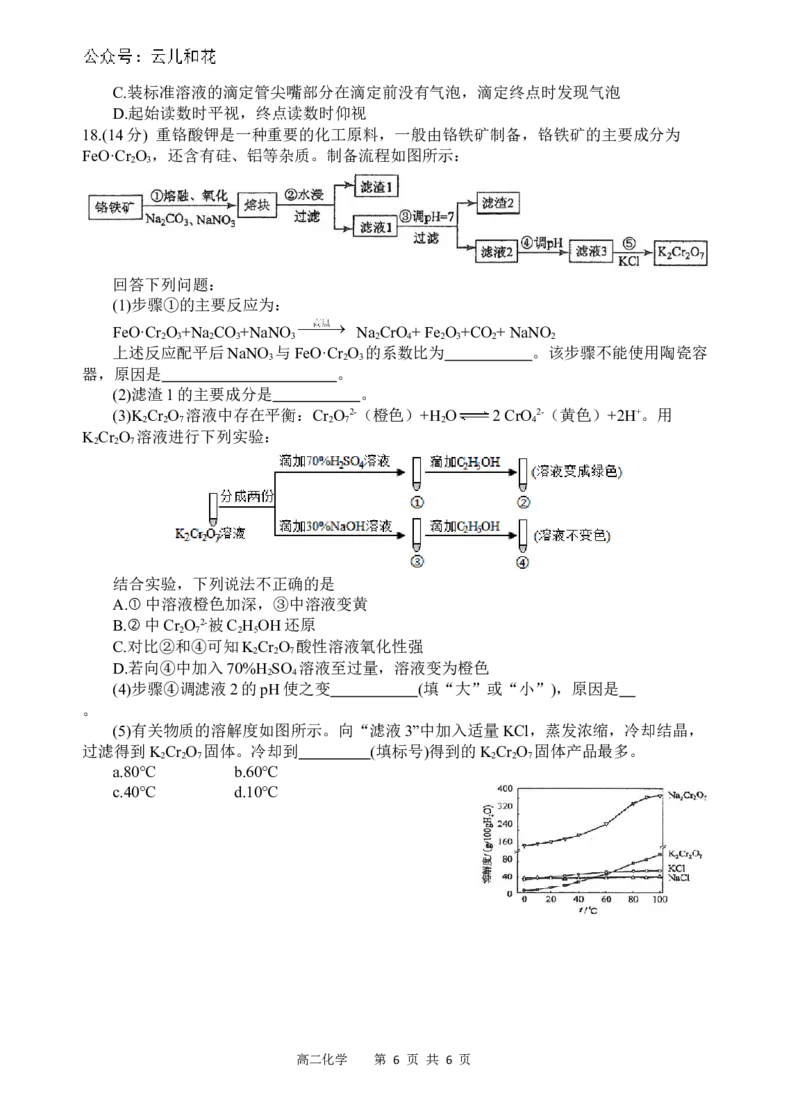
18.(14分) 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
FeO·Cr O ,还含有硅、铝等杂质。制备流程如图所示:
2 3
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr O +Na CO +NaNO Na CrO + Fe O +CO + NaNO
2 3 2 3 3 2 4 2 3 2 2
上述反应配平后NaNO 与FeO·Cr O 的系数比为 。该步骤不能使用陶瓷容
3 2 3
器,原因是 。
(2)滤渣1的主要成分是 。
(3)K Cr O 溶液中存在平衡:Cr O 2-(橙色)+H O 2 CrO 2-(黄色)+2H+。用
2 2 7 2 7 2 4
K Cr O 溶液进行下列实验:
2 2 7
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr O 2-被C H OH还原
2 7 2 5
C.对比②和④可知K Cr O 酸性溶液氧化性强
2 2 7
D.若向④中加入70%H SO 溶液至过量,溶液变为橙色
2 4
(4)步骤④调滤液2的pH使之变 (填“大”或“小”),原因是
。
(5)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,
过滤得到K Cr O 固体。冷却到 (填标号)得到的K Cr O 固体产品最多。
2 2 7 2 2 7
a.80℃ b.60℃
c.40℃ d.10℃
高二化学 第 6 页 共 6 页