文档内容
高二化学 4 月考
一、单选题(每题3分,共42分)。
1. 化学与科技、生活密切相关,下列说法正确的是
A. 小米汽车SU7使用了SiC材料,SiC晶体属于分子晶体
B. 可以用原子光谱分析的方法来确定饮用水中是否含有重金属元素
C. 通过X-射线衍射实验不可区分晶体和非晶体
的
D. 成都大运会所释放 烟花与原子核外电子跃迁吸收能量有关
2. 下列化学用语的表达正确的是
A. BeCl 的球棍模型:
2
B. HCl分子中σ键的形成:
C. 的水解方程式:
D. NaCl溶液中的水合离子:
3. 下列说法不正确的是
A. 键角:
B. 金属的电子气理论可以很好地解释金属的导电性、导热性、延展性
C. 分子中含有2个手性碳原子
D. 的沸点高于 原因是 键键能大于 键
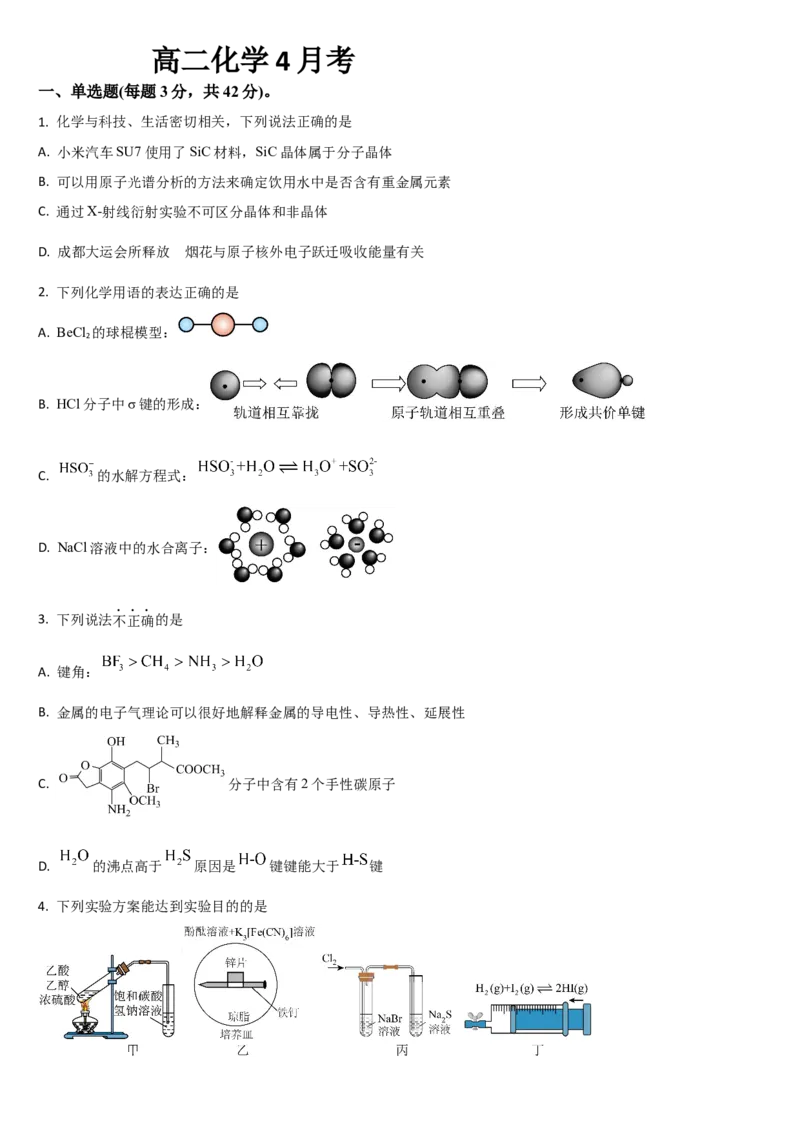
4. 下列实验方案能达到实验目的的是A. 甲可制备乙酸乙酯 B. 乙可验证金属性:
C. 丙可验证非金属性: D. 丁可探究压强对平衡的影响
5. 下列离子方程式正确且能用来解释相应实验现象的是
实验现象 离子方程式
A 向氢氧化银悬浊液中滴加氨水,沉淀溶解
B 向饱和碳酸钠溶液中通入足量CO,溶液变浑浊
2
C 酸性高锰酸钾溶液滴定草酸溶液,紫色褪去
D 酸性溶液中KIO 与KI反应生成I
3 2
A. A B. B C. C D. D
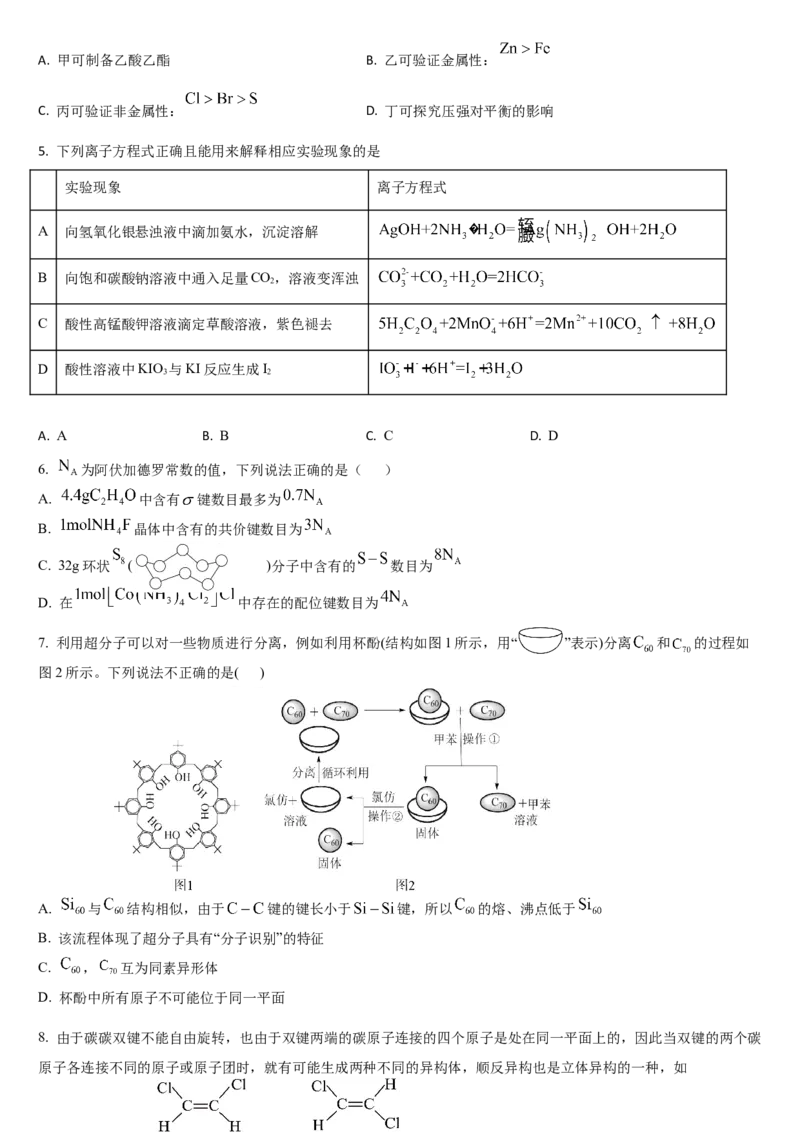
6. 为阿伏加德罗常数的值,下列说法正确的是( )
A. 中含有 键数目最多为
B. 晶体中含有的共价键数目为
C. 32g环状 ( )分子中含有的 数目为
D. 在 中存在的配位键数目为
7. 利用超分子可以对一些物质进行分离,例如利用杯酚(结构如图1所示,用“ ”表示)分离 和 的过程如
图2所示。下列说法不正确的是( )
A. 与 结构相似,由于 键的键长小于 键,所以 的熔、沸点低于
B. 该流程体现了超分子具有“分子识别”的特征
C. , 互为同素异形体
D. 杯酚中所有原子不可能位于同一平面
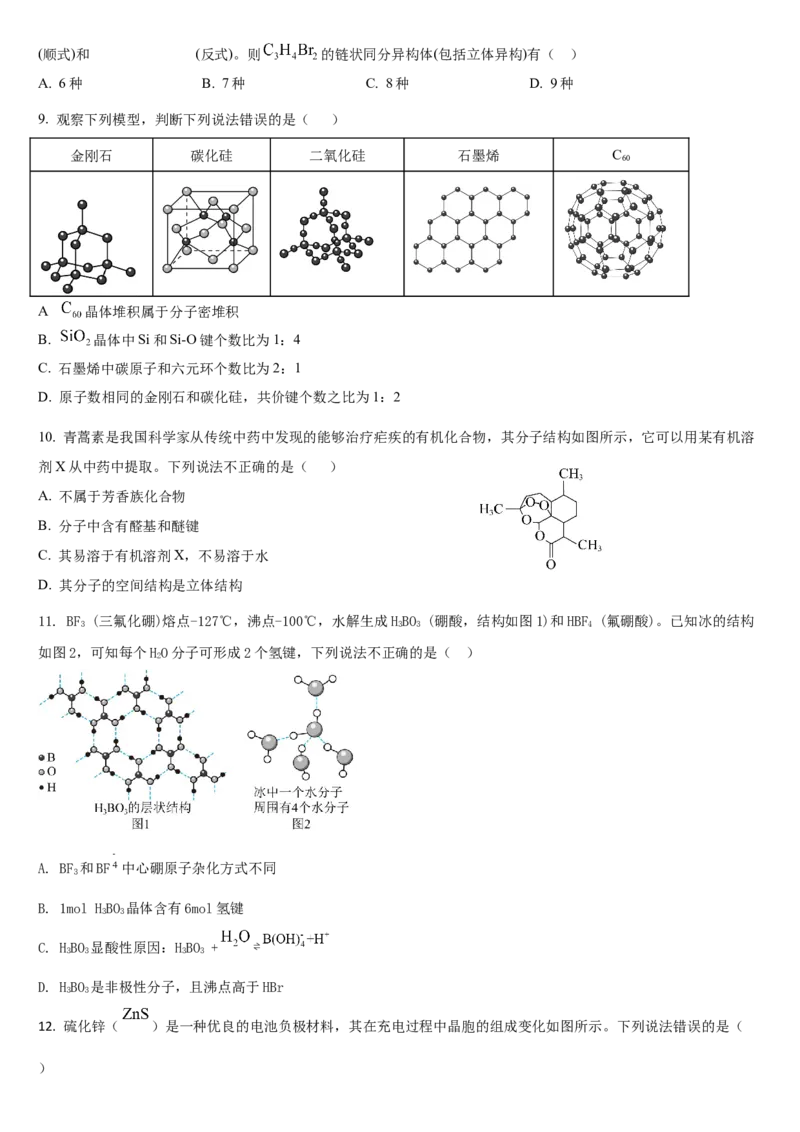
8. 由于碳碳双键不能自由旋转,也由于双键两端的碳原子连接的四个原子是处在同一平面上的,因此当双键的两个碳
原子各连接不同的原子或原子团时,就有可能生成两种不同的异构体,顺反异构也是立体异构的一种,如(顺式)和 (反式)。则 的链状同分异构体(包括立体异构)有( )
A. 6种 B. 7种 C. 8种 D. 9种
9. 观察下列模型,判断下列说法错误的是( )
金刚石 碳化硅 二氧化硅 石墨烯 C
60
.
A 晶体堆积属于分子密堆积
B. 晶体中Si和Si-O键个数比为1:4
C. 石墨烯中碳原子和六元环个数比为2:1
D. 原子数相同的金刚石和碳化硅,共价键个数之比为1:2
10. 青蒿素是我国科学家从传统中药中发现的能够治疗疟疾的有机化合物,其分子结构如图所示,它可以用某有机溶
剂X从中药中提取。下列说法不正确的是( )
A. 不属于芳香族化合物
B. 分子中含有醛基和醚键
C. 其易溶于有机溶剂X,不易溶于水
D. 其分子的空间结构是立体结构
11. BF (三氟化硼)熔点-127℃,沸点-100℃,水解生成HBO (硼酸,结构如图1)和HBF (氟硼酸)。已知冰的结构
3 3 3 4
如图2,可知每个HO分子可形成2个氢键,下列说法不正确的是( )
2
A. BF 和BF 中心硼原子杂化方式不同
3
B. 1mol HBO 晶体含有6mol氢键
3 3
C. HBO 显酸性原因:HBO + ⇌
3 3 3 3
D. HBO 是非极性分子,且沸点高于HBr
3 3
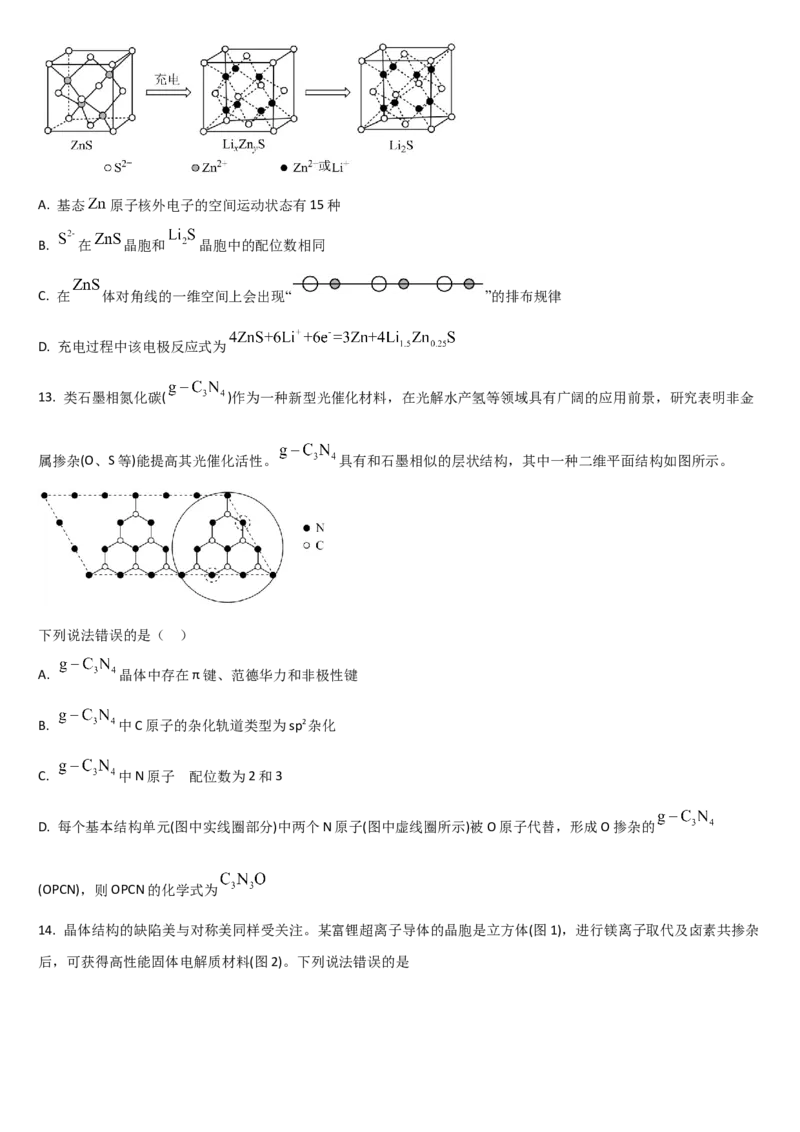
12. 硫化锌( )是一种优良的电池负极材料,其在充电过程中晶胞的组成变化如图所示。下列说法错误的是(
)A. 基态 原子核外电子的空间运动状态有15种
B. 在 晶胞和 晶胞中的配位数相同
C. 在 体对角线的一维空间上会出现“ ”的排布规律
D. 充电过程中该电极反应式为
13. 类石墨相氮化碳( )作为一种新型光催化材料,在光解水产氢等领域具有广阔的应用前景,研究表明非金
属掺杂(O、S等)能提高其光催化活性。 具有和石墨相似的层状结构,其中一种二维平面结构如图所示。
下列说法错误的是( )
A. 晶体中存在π键、范德华力和非极性键
B. 中C原子的杂化轨道类型为sp2杂化
的
C. 中N原子 配位数为2和3
D. 每个基本结构单元(图中实线圈部分)中两个N原子(图中虚线圈所示)被O原子代替,形成O掺杂的
(OPCN),则OPCN的化学式为
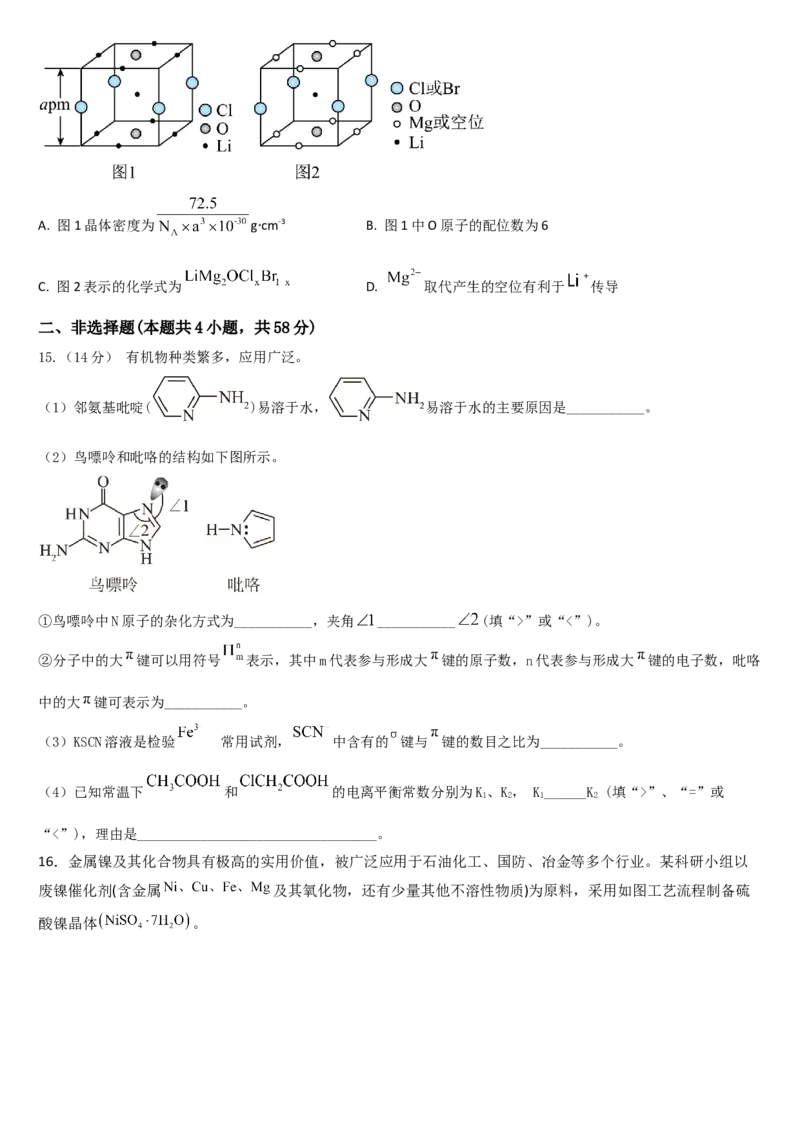
14. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂
后,可获得高性能固体电解质材料(图2)。下列说法错误的是A. 图1晶体密度为 gcm-3 B. 图1中O原子的配位数为6
∙
C. 图2表示的化学式为 D. 取代产生的空位有利于 传导
二、非选择题(本题共4小题,共58分)
15.(14分) 有机物种类繁多,应用广泛。
(1)邻氨基吡啶( )易溶于水, 易溶于水的主要原因是___________。
(2)鸟嘌呤和吡咯的结构如下图所示。
①鸟嘌呤中N原子的杂化方式为___________,夹角 ___________ (填“>”或“<”)。
②分子中的大 键可以用符号 表示,其中m代表参与形成大 键的原子数,n代表参与形成大 键的电子数,吡咯
中的大 键可表示为___________。
的
(3)KSCN溶液是检验 常用试剂, 中含有的 键与 键的数目之比为___________。
(4)已知常温下 和 的电离平衡常数分别为K、K, K______K (填“>”、“=”或
1 2 1 2
“<”),理由是__________________________________。
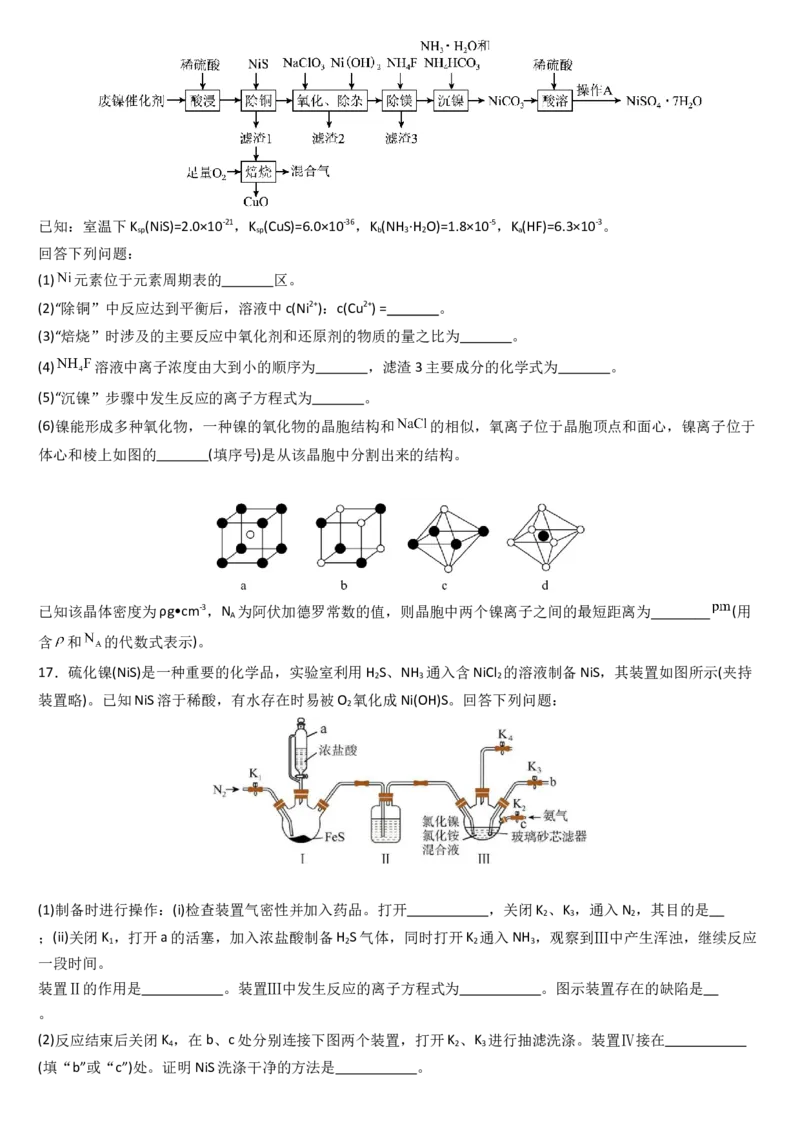
16.金属镍及其化合物具有极高的实用价值,被广泛应用于石油化工、国防、冶金等多个行业。某科研小组以
废镍催化剂(含金属 及其氧化物,还有少量其他不溶性物质)为原料,采用如图工艺流程制备硫
酸镍晶体 。已知:室温下K (NiS)=2.0×10-21,K (CuS)=6.0×10-36,K (NH ·H O)=1.8×10-5,K(HF)=6.3×10-3。
sp sp b 3 2 a
回答下列问题:
(1) 元素位于元素周期表的 区。
(2)“除铜”中反应达到平衡后,溶液中c(Ni2+):c(Cu2+) = 。
(3)“焙烧”时涉及的主要反应中氧化剂和还原剂的物质的量之比为 。
(4) 溶液中离子浓度由大到小的顺序为 ,滤渣3主要成分的化学式为 。
(5)“沉镍”步骤中发生反应的离子方程式为 。
(6)镍能形成多种氧化物,一种镍的氧化物的晶胞结构和 的相似,氧离子位于晶胞顶点和面心,镍离子位于
体心和棱上如图的 (填序号)是从该晶胞中分割出来的结构。
已知该晶体密度为ρg•cm-3,N 为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为 (用
A
含 和 的代数式表示)。
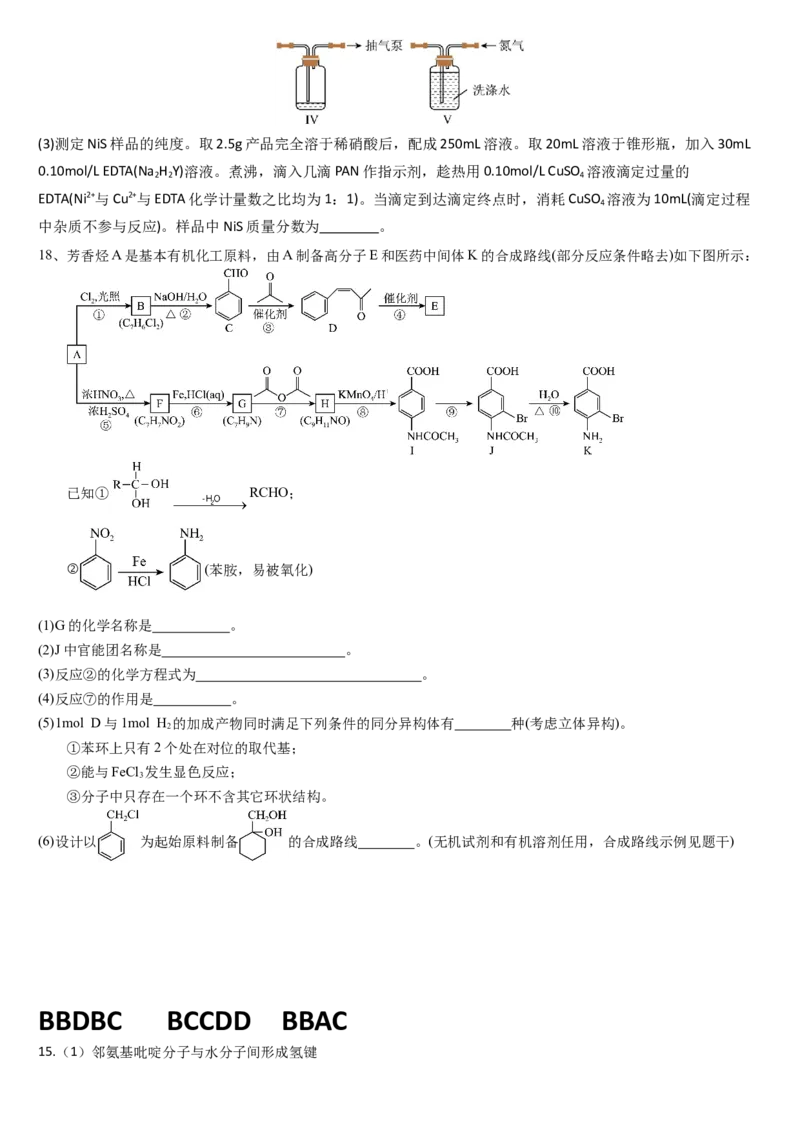
17.硫化镍(NiS)是一种重要的化学品,实验室利用H S、NH 通入含NiCl 的溶液制备NiS,其装置如图所示(夹持
2 3 2
装置略)。已知NiS溶于稀酸,有水存在时易被O 氧化成Ni(OH)S。回答下列问题:
2
(1)制备时进行操作:(i)检查装置气密性并加入药品。打开 ,关闭K 、K ,通入N ,其目的是
2 3 2
;(ii)关闭K ,打开a的活塞,加入浓盐酸制备H S气体,同时打开K 通入NH ,观察到Ⅲ中产生浑浊,继续反应
1 2 2 3
一段时间。
装置Ⅱ的作用是 。装置Ⅲ中发生反应的离子方程式为 。图示装置存在的缺陷是
。
(2)反应结束后关闭K ,在b、c处分别连接下图两个装置,打开K 、K 进行抽滤洗涤。装置Ⅳ接在
4 2 3
(填“b”或“c”)处。证明NiS洗涤干净的方法是 。(3)测定NiS样品的纯度。取2.5g产品完全溶于稀硝酸后,配成250mL溶液。取20mL溶液于锥形瓶,加入30mL
0.10mol/L EDTA(Na H Y)溶液。煮沸,滴入几滴PAN作指示剂,趁热用0.10mol/L CuSO 溶液滴定过量的
2 2 4
EDTA(Ni2+与Cu2+与EDTA化学计量数之比均为1:1)。当滴定到达滴定终点时,消耗CuSO 溶液为10mL(滴定过程
4
中杂质不参与反应)。样品中NiS质量分数为 。
18、芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
已知① RCHO;
② (苯胺,易被氧化)
(1)G的化学名称是 。
(2)J中官能团名称是 。
(3)反应②的化学方程式为 。
(4)反应⑦的作用是 。
(5)1mol D与1mol H 的加成产物同时满足下列条件的同分异构体有 种(考虑立体异构)。
2
①苯环上只有2个处在对位的取代基;
②能与FeCl 发生显色反应;
3
③分子中只存在一个环不含其它环状结构。
(6)设计以 为起始原料制备 的合成路线 。(无机试剂和有机溶剂任用,合成路线示例见题干)
BBDBC BCCDD BBAC
15.(1)邻氨基吡啶分子与水分子间形成氢键(2) ①. sp3、sp2 ②. > ③.
(3)1:1 (4) ①. < ②. Cl的电负性大于H, 中羟基极性大于 中的羟基极
性
16【答案】(1)d (2) (3)3:2 (4) c(F-)>c(NH )>c(H+)>c(OH-) MgF
2
(5) (6) bd
17.【答案】(1) 反应都处在氮气氛围下,防止NiS被氧气氧化为Ni(OH)S 除去中H S的HCl杂质
2
气体 没有 的尾气处理装置
(2) b 取最后一次抽滤洗涤液少许与试管中,先加入稀硝酸,再加入硝酸银溶液,若无白色沉淀产生,则证
明洗涤干净
(3)91%
18 (1)对甲基苯胺(4-甲基苯胺) (2)羧基、碳溴键、酰胺基
(3) +2NaOH +2NaCl+HO (4)保护氨基
2
(5)11
(6)