文档内容
A.可穿戴式智能测温设备“测温创可贴”的测温芯片主要成分是硅
长春外国语学校2024-2025学年第一学期期初考试
B.可降解餐具代替传统塑料餐具可以减少“白色污染”
高二年级化学试卷(理科) C.速滑运动员头盔使用的碳纤维属于新型有机高分子材料
D.二氧化碳取代氟利昂作为制冷剂,对保护臭氧层作出重要贡献
出题人 :商金玲 审题人:罗睿
4.下列说法正确的是( )
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 3页。考试结束后,将答
A. 吸热反应可看成热能转化为化学能被生成物所“储存”
题卡交回。
注意事项: B. 需要加热才能进行的反应一定是吸热反应
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条 C. 能量变化必然伴随发生化学反应
形码粘贴区。 D. 化学反应中能量变化的大小与反应物的物质的量多少无关
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字 5.N 为阿伏伽德罗常数,下列说法正确的是( )
A
体工整、笔迹清楚。 A.7.8 g苯所含碳碳双键数目为0.3 N
A
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿
B.0.1mol CH 与0.1mol Cl 在光照条件下充分反应,生成CHCl分子数为0.1 N
4 2 3 A
纸、试题卷上答题无效。
C.标准状况下,11.2 L溴乙烷所含分子数为0.5 N
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 A
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 D.28 g乙烯所含共用电子对数目为6 N A
可能用到的相对原子质量:H—1 C—12 O—16 6.工业上制备下列物质的生产流程不合理的是( )
第Ⅰ卷
A.由黄铁矿制硫酸:黄铁矿
一、选择题:本题共15小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
题目要求的。 B.由铝土矿冶炼铝:铝土矿
1.下列说法不正确的是( )
A.多糖、油脂、蛋白质在一定条件下都能发生水解反应 C.工业制硝酸:
B.油脂不是高分子化合物,多糖、蛋白质是高分子化合物
D.由石英砂制高纯硅:石英砂 粗硅 纯硅
C.重金属盐能使蛋白质变性,但吞服钡餐BaSO 不会引起中毒
4
D.煤的气化、液化、干馏以及石油的分馏、裂化裂解都涉及化学变化 7.下列指定反应的离子方程式书写正确的是( )
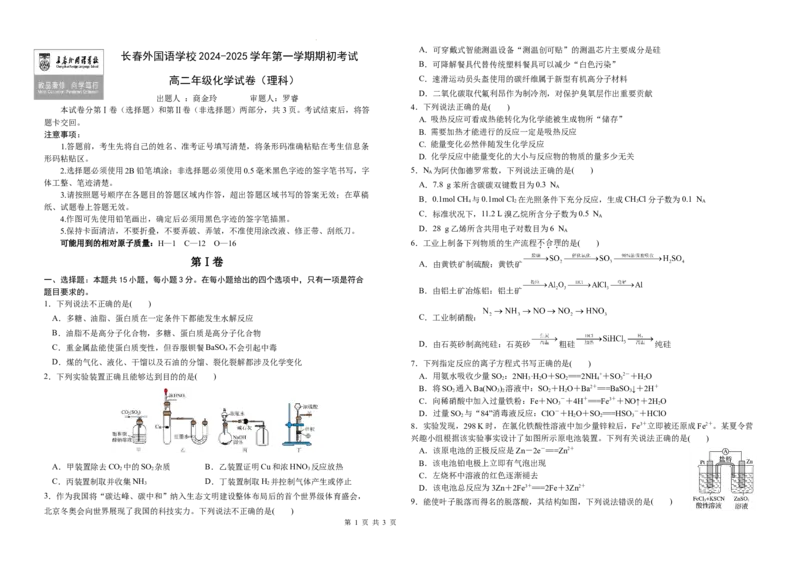
2.下列实验装置正确且能够达到目的的是( ) A.用氨水吸收少量SO :2NH ·H O+SO ===2NH++SO 2-+HO
2 3 2 2 4 3 2
B.将SO 通入Ba(NO ) 溶液中:SO +HO+Ba2+===BaSO ↓+2H+
2 3 2 2 2 3
C.向稀硝酸中加入过量铁粉:Fe+NO -+4H+===Fe3++NO↑+2HO
3 2
D.过量SO 与“84”消毒液反应:ClO-+HO+SO ===HSO -+HClO
2 2 2 3
8.实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营
兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是( )
A.该原电池的正极反应是Zn-2e-===Zn2+
B.该电池铂电极上立即有气泡出现
A.甲装置除去CO 中的SO 杂质 B.乙装置证明Cu和浓HNO 反应放热
2 2 3
C.左烧杯中溶液的红色逐渐褪去
C.丙装置制取并收集NH D.丁装置制取H 并控制气体产生或停止
3 2 D.该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
3.作为我国将“碳达峰、碳中和”纳入生态文明建设整体布局后的首个世界级体育盛会,
9.能使叶子脱落而得名的脱落酸,其结构如图,下列说法错误的是( )
北京冬奥会向世界展现了我国的科技实力。下列说法不正确的是( )
第 1 页 共 3 页
学科网(北京)股份有限公司A.分子中含有4种官能团 用于工业生产,下列说法中正确的是( )
A.电镀工业中,X是待镀金属,Y是镀层金属
B.一定条件下脱落酸可生成多种加聚产物
B.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
C.1mol 脱落酸与足量NaHCO 溶液反应生成22.4L CO (标准状况)
3 2
C.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO 溶液
4
D.一定条件下1mol 脱落酸多能与5 mol H 反应
2 D.外加电流法中,X是待保护金属
10.用如图所示的装置测定中和反应反应热。将浓度为0.50mol/L的酸溶液和0.55mol/L的
14.分子式为C H O 与饱和NaHCO 溶液反应能放出气体,且1molC H O 与足量钠反应放出
5 10 3 3 5 10 3
碱溶液各50mL混合(溶液密度均为1g/mL),生成的溶液的比热容c=4.18J·g-1·℃-1(Q=mcΔt),
1mol气体的有机物有(不含立体异构)( )
测得温度如表,则下列说法错误的是 ( )
A.7种 B.8种 C.9种 D.12种
A 15.500 mL KNO 和Cu(NO ) 的混合溶液中c(NO)=6.0 mol·L-1,用石墨作电极电解此溶液,当
反应物 起始温度t/℃ 最高温度t/℃ 3 3 2
1 2
. 该 通电一段时间后,两极均收集到22.4 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下
甲组(HCl+NaOH) 15.0 18.3 列说法正确的是( )
实 验
A.原混合溶液中c(K+)为1 mol·L-1 B.电解后溶液中c(H+)为2 mol·L-1
装 乙组(HCl+NH·H O) 15.0 18.1 置
3 2
C.电解得到的Cu的物质的量为0.5 mol D.上述电解过程中共转移4 mol电子
中 缺
第Ⅱ卷
乏玻璃搅拌器,用金属搅拌器代替玻璃搅拌器,会使ΔH偏大
B.测定中和反应反应热实验中,应读取混合溶液的最高温度为终止温度
二、非选择题:本题共4小题,共55分。
C.乙组实验所得结果ΔH=-51.8kJ/mol,与甲组比较,因NH ·H O为弱碱,电离吸热导致 16.(14分)回答下列问题。
3 2
放出热量较少 (1)在25℃、101kPa下,1g甲醇(CHOH)燃烧生成CO 和液态水时放热22.68kJ。则表示甲醇燃烧
3 2
D.某同学利用上述装置重新做甲组实验,测得反应热ΔH偏大,可能是实验时室温偏高 热的热化学方程式为: 。
11.下列有关物质检验的操作和实验结论都正确的是( ) (2)把煤作为燃料可通过下列两种途径:
选项 实验操作及现象 实验结论 途径I:C(s)+O 2 (g)=CO 2 (g) ΔH 1 <0 ①
途径II:先制成水煤气:C(s)+HO(g)=CO(g)+H (g) ΔH >0 ②
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生 2 2 2
A 该溶液中一定含有SO 2-
成 4 再燃烧水煤气:2CO(g)+O(g)=2CO (g) ΔH <0 ③
2 2 3
2H(g)+O(g)=2HO(g) ΔH<0 ④
B 将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO 2 2 2 4
2
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;ΔH、ΔH、
1 2
向某溶液中加入2滴KSCN溶液,溶液不显红色,再向
C 该溶液中一定含有Fe2+ ΔH、ΔH 的数学关系式是 。
溶液中加入几滴新制的氯水,溶液变为红色 3 4
(3)已知拆开1mol H-H键、1mol N-H键、 键分别需要的能量是436kJ、391kJ、946kJ,
向试管中的溶液加入稀盐酸,产生的无色气体能够使澄
D 该溶液中一定含有CO2-
清的石灰水变浑浊 3 则N 与H 反应生成NH (g)的热化学方程式为:
2 2 3
12.下列说法错误的是( ) 。
A.除去乙烯中混有的SO 2 气体的方法:通入溴水洗气 (4)①已知:C(s)+O 2 (g)=CO 2 (g) ΔH 1
B.除去乙醇中的水的方法:加入新制生石灰蒸馏 C(g)+O 2 (g)=CO 2 (g) ΔH 2
C.鉴别己烷、己烯、乙酸、CCl 4 四种无色液体的方法:分别加入溴水 则ΔH 1 ΔH 2 (填“>”、“<”或“=”)。
D.油脂在碱性条件下的水解反应可以用于生产甘油和肥皂
②若 ΔH=-56.9kJ/mol
13.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应
第 2 页 共 3 页
学科网(北京)股份有限公司则1molNO (g)置于密闭容器中充分反应放出的热量 28.45kJ(填“>”、“<”或“=”)。 ②在①操作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子
2
(5)为有效降低含氮化物的排放量,又能充分利用化学能,合作 方程式是 ;该反应体现了硝酸的 性。
③装置B中用注射器压入空气之后现象是 。
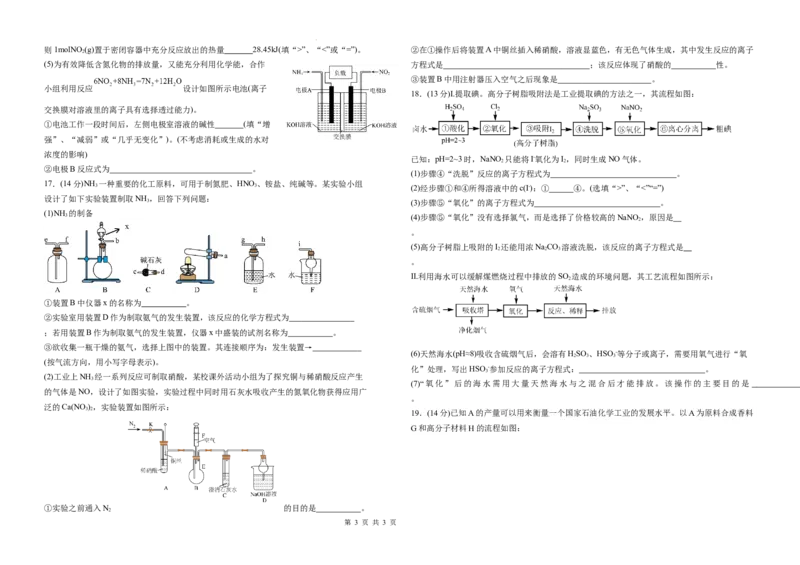
小组利用反应 设计如图所示电池(离子
18.(13分)Ⅰ.提取碘。高分子树脂吸附法是工业提取碘的方法之一,其流程如图:
交换膜对溶液里的离子具有选择透过能力)。
①电池工作一段时间后,左侧电极室溶液的碱性 (填“增
强”、“减弱”或“几乎无变化”)。(不考虑消耗或生成的水对
浓度的影响)
已知:pH=2~3时,NaNO 只能将I-氧化为I,同时生成NO气体。
2 2
②电极B反应式为 。
(1)步骤④“洗脱”反应的离子方程式为 。
17.(14分)NH 一种重要的化工原料,可用于制氮肥、HNO、铵盐、纯碱等。某实验小组
3 3 (2)经步骤①和④所得溶液中的c(I-):① ④。(选填“>”、“<”“=”)
设计了如下实验装置制取NH ,回答下列问题:
3 (3)步骤⑤“氧化”的离子方程式为 。
(1)NH 的制备
3 (4)步骤⑤“氧化”没有选择氯气,而是选择了价格较高的NaNO ,原因是
2
x
。
(5)高分子树脂上吸附的I 还能用浓NaCO 溶液洗脱,该反应的离子方程式是
2 2 3
。
Ⅱ.利用海水可以缓解煤燃烧过程中排放的SO 造成的环境问题,其工艺流程如图所示:
2
①装置B中仪器x的名称为 。
②实验室用装置D作为制取氨气的发生装置,该反应的化学方程式为
;若用装置B作为制取氨气的发生装置,仪器x中盛装的试剂名称为 。
③欲收集一瓶干燥的氨气,选择上图中的装置。其连接顺序为:发生装置→
(6)天然海水(pH≈8)吸收含硫烟气后,会溶有HSO 、HSO -等分子或离子,需要用氧气进行“氧
2 3 3
(按气流方向,用小写字母表示)。
化”处理,写出HSO -参加反应的离子方程式: 。
3
(2)工业上NH 经一系列反应可制取硝酸,某校课外活动小组为了探究铜与稀硝酸反应产生
3
(7)“氧化”后的海水需用大量天然海水与之混合后才能排放。该操作的主要目的是
的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广
。
泛的Ca(NO ),实验装置如图所示:
3 2
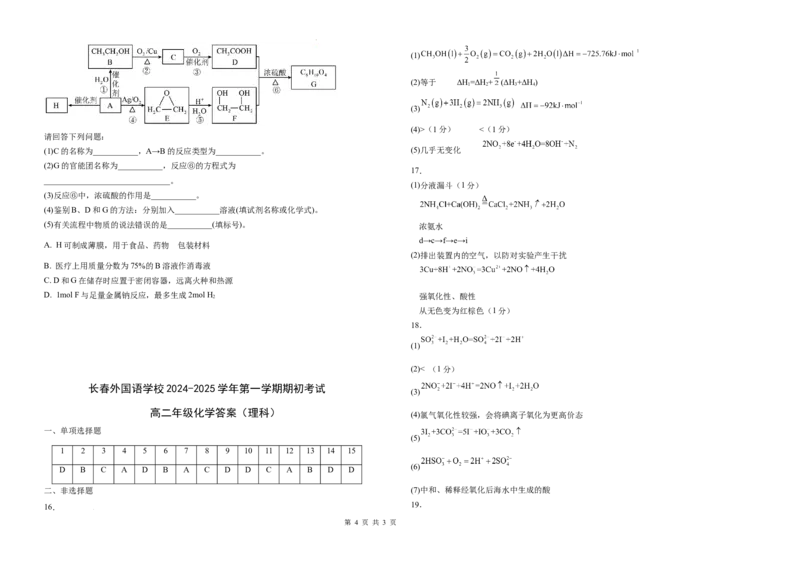
19.(14分)已知A的产量可以用来衡量一个国家石油化学工业的发展水平。以A为原料合成香料
G和高分子材料H的流程如图:
①实验之前通入N 的目的是 。
2
第 3 页 共 3 页
学科网(北京)股份有限公司(1)
(2)等于 ΔH=ΔH + (ΔH +ΔH )
1 2 3 4
(3)
(4)>(1分) <(1分)
请回答下列问题:
(1)C的名称为___________,A→B的反应类型为___________。 (5)几乎无变化
(2)G的官能团名称为___________,反应⑥的方程式为
17.
_______________________________。
(1)分液漏斗(1分)
(3)反应⑥中,浓硫酸的作用是___________。
(4)鉴别B、D和G的方法:分别加入___________溶液(填试剂名称或化学式)。
(5)有关流程中物质的说法错误的是___________(填标号)。 浓氨水
的
d→c→f→e→i
A. H可制成薄膜,用于食品、药物 包装材料
(2)排出装置内的空气,以防对实验产生干扰
B. 医疗上用质量分数为75%的B溶液作消毒液
C. D和G在储存时应置于密闭容器,远离火种和热源
D. 1mol F与足量金属钠反应,最多生成2mol H 2 强氧化性、酸性
从无色变为红棕色(1分)
18.
(1)
(2)< (1分)
长春外国语学校2024-2025学年第一学期期初考试
(3)
高二年级化学答案(理科)
(4)氯气氧化性较强,会将碘离子氧化为更高价态
一、单项选择题
(5)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
(6)
D B C A D B A C D D C A B D D
二、非选择题 (7)中和、稀释经氧化后海水中生成的酸
19.
16.
第 4 页 共 3 页
学科网(北京)股份有限公司(1)乙醛
加成反应
(2)酯基
(3)催化剂和吸水剂
(4)碳酸钠溶液
(5)BD
第 5 页 共 3 页
学科网(北京)股份有限公司