昭通市 2025 届高中毕业生诊断性检测
化学参考答案
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
题号 1 2 3 4 5 6 7
答案 D B B A C D D
题号 8 9 10 11 12 13 14
答案 C B B C D A C
【解析】
1.天然油脂都是混合物,A 错误。光伏发电板主要成分为硅,B 错误。小碗红糖的主要成分
为蔗糖,C错误。竹子中富含天然有机高分子物质,D正确;故选D。
2.H O+的空间结构为三角锥形,A错误。NaH是离子化合物,钠原子与氢原子通过得失电子
3
形成的,所以形成过程为 ,B 正确。基态碳原子的轨道表示式:
,C错误。 为CH COOH的球棍模型,D错误;故选B。
3
3.①为蒸馏装置,可分离互溶但沸点不同的液体混合物,A正确。葡萄糖与氯化钠的混合液,
均可透过半透膜,不能选渗析法分离,鸡蛋内膜可以制作该半透膜,B 错误。Mg 与盐酸
反应放热,使温度升高,因为温度越高氢氧化钙溶解度越小,饱和石灰水变浑浊可证明
Mg与盐酸反应为放热,C正确。碱石灰能干燥氨气,装置④干燥、收集均正确,D正确;
故选B。
4.1mol晶体硅含有共价键为2mol,数目为2N ,A正确。标准状况下,C H 为液态,无法
A 6 14
计算 C H 的体积,B 错误。未指明溶液体积,无法计算物质的量,C 错误。氢气和碘反
6 14
应生成HI,反应物的系数之和等于生成物系数之和,故反应前后的物质的量不变,无论反
应程度如何,容器中分子的总数为0.2N ,D错误;故选A。
A
5.少量 SO 通入 Ca(ClO) 溶液中,二者发生氧化还原反应,正确的离子反应为
2 2
SO +Ca2++3ClO−+H O=CaSO ↓+2HClO+Cl−,A 错误。氢氧化亚铁和浓硝酸发生氧化
2 2 4
还 原 反 应 生 成 三 价 铁 离 子 、 NO 和 水 , 正 确 的 离 子 方 程 式 为
2
Fe(OH) +NO+4H+=Fe3++NO ↑+3H O,B 错误。NH Al(SO ) 溶液与少量的 KOH 溶
2 3 2 2 4 4 2
液反应,铝离子优先反应,离子方程式为Al3++3OH−=Al(OH) ↓,C正确。还原性Fe2+
3
化学参考答案·第1页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}>Br−,所以通入氯气先发生反应 2Fe2++Cl =2Fe3++2Cl−,Fe2+反应完毕,剩余的氯气
2
再发生反应 2Br−+Cl =Br +2Cl−,200mL 4mol/L 的 FeBr 溶液中 0.8mol FeBr ,含有
2 2 2 2
0.8mol亚铁离子和1.6mol溴离子,通入22.4L标准状况下的Cl 物质的量为1mol,0.8mol
2
亚铁离子完全反应消耗0.4mol氯气,剩余的0.6mol氯气完全反应消耗1.2mol溴离子,则
该反应的亚铁离子与溴离子的物质的量之比为0.8mol∶1.2mol=2∶3,则反应的离子方程式
为4Fe2++6Br−+5Cl =4Fe3++3Br +10Cl−,D错误;故选C。
2 2
6.均为短周期元素,X的一种核素没有中子,X为H;Y原子有6种电子运动状态可知Y应
为C;W成2个键,W可能为O或S,Z成键数为3,Z可能为N或P,Y、W原子序数
之和是Z的2倍,则W为O,Z为N,据此分析解答。由分析可知,X为H,Y为C,Z
为 N,W 为 O,四种元素可以形成(NH ) CO 、NH HCO ,CH COONH 等都是离子化合
4 2 3 4 3 3 4
物,A正确。由分析可知,Y为C,Z为N,W为O;同一周期,从左到右,元素的第一
电离能逐渐增大,但是第VA族的元素的第一电离能高于与其相邻的元素,故第一电离能:
N>O>C,B正确。由分析可知,Y为C,Z为N;分子中C采用sp2杂化,N采用sp3杂化,
二者杂化类型不同,C 正确。由分析可知,Z 为 N,其简单氢化物为 NH ;NH 分子间能
3 3
形成氢键,氨气的沸点高于同族相邻元素的氢化物(PH ),W为O,其简单氢化物为H O;
3 2
H O分子间能形成氢键,水的沸点高于同族相邻元素的氢化物(H S),D错误;故选D。
2 2
7.c分子存在饱和碳原子,是四面体结构,不可能所有碳原子共面,A正确。a中含有羧基、
b含有酯基,它们物质类别不同,故a与b不属于同系物,c的分子式为C H O ,B正确。
7 12 4
连接四种不同基团的碳为手性碳原子,b、c中三个醇羟基所连碳均为手性碳,故含有的手
性碳原子都是3,C正确。a、b、c含双键与溴水均能发生加成反应、a含羧基与氢氧化钠
发生中和反应、b含酯基能与氢氧化钠溶液发生水解反应,c与氢氧化钠不反应,D错误;
故选D。
8.由该反应的热化学方程式可知,该反应涉及的主要物质有HCl、O 、CuO、Cl 、H O;CuO
2 2 2
与Y反应生成Cu(OH)Cl,则Y为HCl;Cu(OH)Cl分解生成W和Cu OCl ,则W为H O;
2 2 2
CuCl 分解为X和CuCl,则X为Cl ;CuCl 和Z反应生成Cu OCl ,则Z为O ;综上所
2 2 2 2 2
述,X、Y、Z、W依次是Cl 、HCl、O 和H O。该催化机理中如有HCl极性键断裂、O
2 2 2 2
有非极性和π键的断裂,H O有极性键形成,Cl 有非极性形成无π键形成,A错误。CuO
2 2
为该反应催化剂,加入催化剂不能改变反应焓变,B 错误。如 Cu OCl =CuCl +CuO
2 2 2
1
为非氧化还原反应,C正确。CuCl与Z反应的化学方程式应为2CuCl+ O =Cu OCl ,
2 2 2
2
D错误;故选C。
化学参考答案·第2页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}9.饱和Na CO 溶液中通入足量CO 气体,发生反应Na CO +CO +H O=2NaHCO ,
2 3 2 2 3 2 2 3
Na CO 与CO 反应消耗水,使溶剂的质量减少,且生成的NaHCO 的质量大,所以溶液
2 3 2 3
变浑浊,不能说明NaHCO 与Na CO 溶解度大小关系,A 错误。苯酚与饱和溴水发生取
3 2 3
代反应生成2,4,6−三溴苯酚,此物质难溶于水,为白色沉淀,B正确。碘水能与氢氧化
钠溶液反应被消耗,故淀粉水解液经中和后再加少量碘水不会显蓝色,因此无法判断淀粉
是否完全水解,C 错误。滴加稀硝酸无现象说明不含亚硫酸根离子、碳酸根离子等,再加
氯化钡溶液生成白色沉淀,可能为硫酸钡或氯化银,则溶液X中含硫酸根离子或银离子,
D错误;故选B。
10.反应Ⅲ中水为液态,无法计算,A错误。保持压强不变,降低氨碳比可提高反应Ⅰ中NH
3
的平衡转化率,B正确。恒温条件下,反应Ⅰ在加压条件下可以提高氨基甲酸铵的产率,
故反应Ⅰ改变压强对氨基甲酸铵的产率有影响,C错误。保持容积不变,充入惰性气体增
大压强,但是反应物气体的浓度不变,反应速率不变,D错误;故选B。
11.由图结合物质类别和化合价可知,a为HCl,b为Cl ,c为ClO ,d为HClO,e为氯酸盐,
2 2
f为次氯酸盐。由此进行分析。次氯酸不稳定见光易分解,生成氯化氢与氧气,次氯酸变
盐酸,酸性增强,A正确。根据氧化还原的原理,盐酸和次氯酸盐混合制得氯气,B正确。
稀盐酸与二氧化锰加热不反应,C错误。氯气与水反应生成次氯酸,次氯酸可用于自来水
的杀菌消毒,二氧化氯也可以用于自来水消毒,次氯酸盐可用于环境杀菌消毒,D正确;
故选C。
12.放电时,Ca失电子转化为Ca2+,则钙电极为负极,Li FePO /LiFePO 电极为正极;充电
1−x 4 4
时,钙电极为阴极,Li FePO /LiFePO 电极为阳极。由分析可知,放电时,钙电极为负
1−x 4 4
极,失电子发生氧化反应,A错误。充电时,Li FePO /LiFePO 电极为阳极,Ca电极为
1−x 4 4
阴极电势低,B 错误。Ca 的金属性强,能与水发生剧烈反应,所以采用非水电解质,不
能换成硫酸锂溶液,C 错误。充电时,Li FePO /LiFePO 电极为阳极,电极反应式为
1−x 4 4
LiFePO −xe−=Li FePO +xLi+,D正确;故选D。
4 1−x 4
13.图乙中,a 的分数坐标为(0,0,0),则 c 点Mn位于左侧面的面心上,故其分数坐标为
1 1
0, , ,A正确。GaAs晶体中每个Ga原子周围与它最近且相等距离的As原子有4
2 2
1 1 27
个,B错误。图乙中掺杂Mn之后,晶胞中Ga原子数为7 +5 = ,As原子数为4,
8 2 8
化学参考答案·第3页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}1 1 5
Mn原子个数为1 +1 = ,故晶体中Mn、Ga、As的原子个数比为 5∶27∶32,C
8 2 8
1 1
错误。根据均摊原则,图甲中,Ga原子数为8 +6 =4、As原子数为 4,GaAs的相
8 2
对分子质量为 M,晶体密度为gcm3,N 表示阿伏加德罗常数,则晶胞的边长为
A
3 4M
107nm ;晶胞中距离最近的两个Ga原子间距离为面对角线的一半,距离为
N
A
2 3 4M
107nm,D错误;故选A。
2 N
A
14.已知298K时,Cu(OH) 和Fe(OH) 的饱和溶液中,a、b分别表示lgc(Cu2+)、lgc(Fe2+)
2 2
1014 2
与溶液pH的变化关系,由X点数据可知K [Cu(OH) ] 1011.7 1019.7,由(8,
sp 2 1010
1014 2
3.1 ) 数 据 可 知 K [Fe(OH) ] 103.1 1015.1 , 所 以 该 温 度 下 ,
sp 2 108
K [Cu(OH) ]
p >p 或p (1分) T 温度达到平衡时v v ,K 正 3 2 1,而在温
1 正 逆 k c(CO )c3(H )
逆 2 2
度T时,该反应的化学平衡常数K=0.8,K减小平衡逆向移动,结合反应正反应为放热反
应可知,发生该反应的温度T>T
1
【解析】(1)根据题意,焓变等于生成物总能量减去反应物总能量,则干重整反应的热化
学方程式为CH (g)+CO (g) 2CO(g)+2H (g) ΔH=+(E −E )kJ/mol。
4 2 2 3 1
(2)该反应ΔH>0,则需ΔS>0,才能ΔG<0,反应才能自发进行。活化能越小反应越快,
活化能越大反应越慢,决定总反应速率的是慢反应,反应Ⅱ的活化能比反应Ⅰ活化能小,
该反应的决速步骤是反应Ⅰ。
化学参考答案·第6页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}(3)对应反应CO(g)+2H (g) CH OH(g):CO和H 按物质的量之比1∶2充入,与反
2 3 2
应系数之比相等,故CO和H 剩余的物质的量之比为1∶2,其浓度之比是不变量,不能
2
作为平衡的标志,A错误。由于此反应全部是气体参与和生成的反应,故反应体系中气体
的质量不变,在恒温恒容的容器中,容器的体积不变,则混合气体的密度始终不变,所
以不能说明反应达到平衡状态,B错误。在绝热恒容的容器中,反应的平衡常数不再变化,
说明容器的温度已不再变化,所以反应达到了平衡状态,C正确。此反应是气体物质的量
减小的反应,因气体的总质量不变,气体的物质的量会随反应变化,则气体的平均摩尔
质量不变时,反应达到平衡状态,D正确;故选CD。
(4)据 CO(g)+2H (g) CH OH(g)可知,压强增大平衡正向移动,甲醇的体积分数增
2 3
大,故p >p >p 。
1 2 3
C点时CH OH的体积分数为50%,设CO的转化率为x,则
3
CO(g)+2H (g) CH OH(g)
2 3
起始量(mol) 1 2 0
转化量(mol) x 2x x
平衡量(mol) 1−x 2−2x x
x
在C点时,CH OH的体积分数= 100%=0.5,解得x=0.75,该反应C点p 为3kPa,
3 2
32x
0.75
3
则压强平衡常数K 1.5 3(kPa)2。
p 0.25 0.5 2
3 3
1.5 1.5
(5)由H 0可知,该反应为放热反应,升高温度,反应速率加快,速率常数也增大,
且平衡逆向移动,则逆反应速率增大的幅度大于正反应速率,则图中能代表k 的曲线为
逆
L 。
4
(6)由图像信息可知,T 1 温度达到平衡时,则有 v 正 v 逆 ,即k 正 c(CO 2 )c3(H 2 )k 逆
k c(CH OH)c(H O)
c(CH OH)c(H O),此时k k ,故有K 正 3 2 1,温度T时,
3 2 正 逆 k c(CO )c3(H )
逆 2 2
该反应的化学平衡常数K=0.8,K减小平衡逆向移动,结合反应正反应为放热反应可知,
发生该反应的温度T>T 。
1
18.(除特殊标注外,每空2分,共14分)
(1)对硝基苯胺或4−硝基苯胺(1分) 酰胺基、硝基(共计2分,写出一个给1分,
写错0分)
化学参考答案·第7页(共9页)
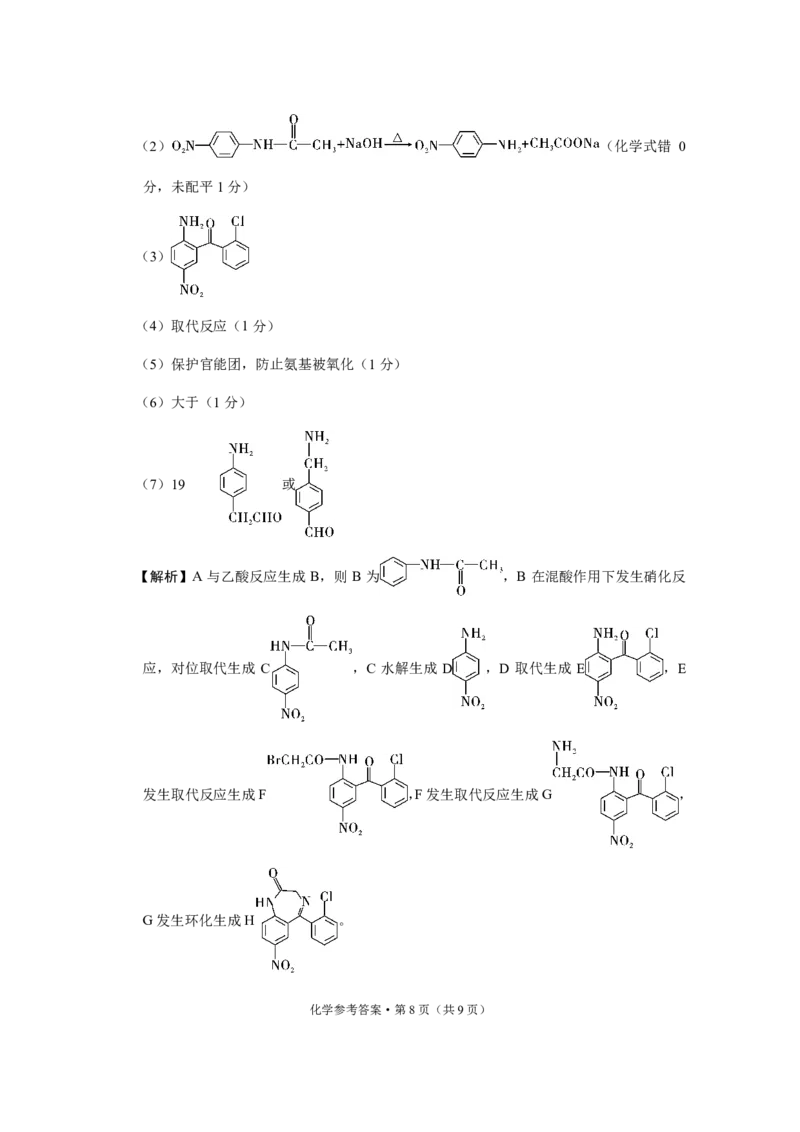
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}(2) (化学式错 0
分,未配平1分)
(3)
(4)取代反应(1分)
(5)保护官能团,防止氨基被氧化(1分)
(6)大于(1分)
(7)19 或
【解析】A 与乙酸反应生成 B,则 B 为 ,B 在混酸作用下发生硝化反
应,对位取代生成 C ,C 水解生成 D ,D 取代生成 E ,E
发生取代反应生成F ,F发生取代反应生成G ,
G发生环化生成H 。
化学参考答案·第8页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}(2)据上述分析可知 CD 即酰胺基在碱性加热条件下水解,化学方程式为
。
(3)由分析可知,E的结构简式为 。
(4)F→G的反应类型为取代反应。
(5)A→B过程中A与乙酸反应生成B,该过程—NH 和—COOH反应生成酰胺基,C→D
2
即酰胺基在碱性加热条件下水解生成—NH ,该过程主要是为了保护—NH 不被氧化,故
2 2
该空填保护氨基不被氧化。
(6)D 中含有硝基,硝基为吸电子基团,导致 D 中氨基氮原子周围电子云密度减小,从
而结合质子的能力减弱,所以碱性A大于D,该空填大于。
(7)B分子式为C H NO,其同分异构体需包含1个苯环,一个醛基且醛基要接在C原子
8 9
上,故当该同分异构体包含1个苯环,1个—NH ,1个—CH CHO时,其同分异构体有
2 2
3种;含1个苯环,1个—CHO时,1个—NHCH ,其同分异构体有3种;含1个苯环,
3
1个—CHO时,1个—CH NH ,其同分异构体有3种;含1个苯环,1个—CHO,1个
2 2
—CH ,一个—NH 时,其同分异构体有10种。
3 2
化学参考答案·第9页(共9页)
{#{QQABCYAk5gKYkASACB4rUQHkCkqQkJAjJegEwRAcKAYqCIFABIA=}#}