文档内容
福宁古五校教学联合体 2024-2025 学年第一学期期中质量监测
高三化学试题
(考试时间:75分钟,试卷总分:100分)
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5 Ce140
第I卷 选择题(共 40 分)
一、选择题(本题共10小题,每小题4分。每小题只有一个选项符合题意)
1. 中国“天宫”空间站运用的“黑科技”很多,下列对所涉及物质的性质描述错误的是
A. 被誉为“百变金刚”的太空机械臂主要成分为铝合金,其强度大于纯铝
B. 太阳电池翼采用碳纤维框架和玻璃纤维网,二者均为无机非金属材料
C. 核心舱配置的离子推进器以氙和氩气作为推进剂,氙和氩属于稀有气体
D. 柔性太阳能板使用了国产新型高纯度二氧化硅,其性质稳定,是优良的光电材料
2. 劳动创造未来。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 生产活动:海水晒盐 蒸发原理
B 医院消毒:喷洒次氯酸钠溶液 次氯酸钠溶液具有强氧化性
C 卫生劳动:用食醋洗水壶 醋酸可与水垢中的Mg(OH) 、CaCO 反应
2 3
D 酿酒师:在葡萄酒中添加适量的二氧化硫 SO 是酸性氧化物
2
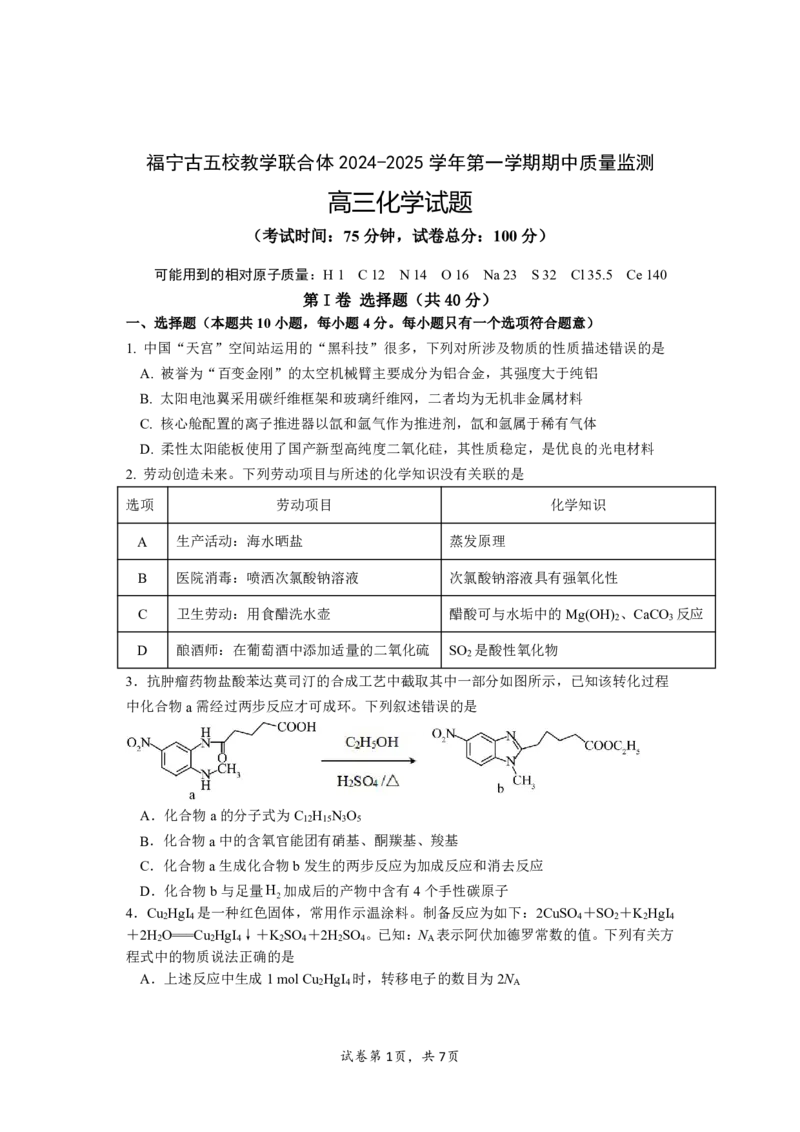
3.抗肿瘤药物盐酸苯达莫司汀的合成工艺中截取其中一部分如图所示,已知该转化过程
中化合物a需经过两步反应才可成环。下列叙述错误的是
A.化合物a的分子式为C H N O
12 15 3 5
B.化合物a中的含氧官能团有硝基、酮羰基、羧基
C.化合物a生成化合物b发生的两步反应为加成反应和消去反应
D.化合物b与足量H 加成后的产物中含有4个手性碳原子
2
4.Cu HgI 是一种红色固体,常用作示温涂料。制备反应为如下:2CuSO +SO +K HgI
2 4 4 2 2 4
+2H O===Cu HgI ↓+K SO +2H SO 。已知:N 表示阿伏加德罗常数的值。下列有关方
2 2 4 2 4 2 4 A
程式中的物质说法正确的是
A.上述反应中生成1molCu HgI 时,转移电子的数目为2N
2 4 A
试卷第1页,共7页B.标准状况下,44.8L水中所含O原子数目为2N
A
C.1molH SO 含有的H+数目为2N
2 4 A
D.1L0.1mol·L-1CuSO 溶液中Cu2+数目为0.1N
4 A
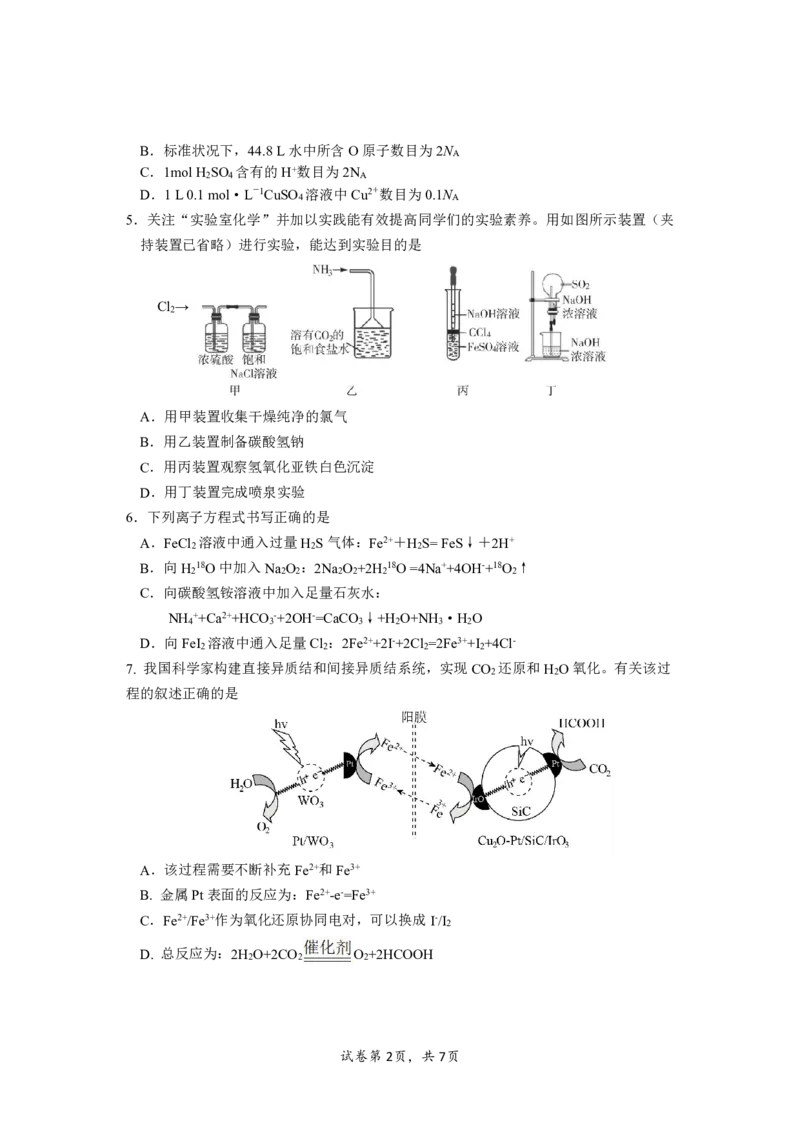
5.关注“实验室化学”并加以实践能有效提高同学们的实验素养。用如图所示装置(夹
持装置已省略)进行实验,能达到实验目的是
Cl →
2
A.用甲装置收集干燥纯净的氯气
B.用乙装置制备碳酸氢钠
C.用丙装置观察氢氧化亚铁白色沉淀
D.用丁装置完成喷泉实验
6.下列离子方程式书写正确的是
A.FeCl 溶液中通入过量H S气体:Fe2++H S=FeS↓+2H+
2 2 2
B.向H 18O中加入Na O :2Na O +2H 18O=4Na++4OH-+18O ↑
2 2 2 2 2 2 2
C.向碳酸氢铵溶液中加入足量石灰水:
NH ++Ca2++HCO -+2OH-=CaCO ↓+H O+NH ·H O
4 3 3 2 3 2
D.向FeI 溶液中通入足量Cl :2Fe2++2I-+2Cl =2Fe3++I +4Cl-
2 2 2 2
7. 我国科学家构建直接异质结和间接异质结系统,实现CO 还原和H O氧化。有关该过
2 2
程的叙述正确的是
A.该过程需要不断补充Fe2+和Fe3+
B. 金属Pt表面的反应为:Fe2+-e-=Fe3+
C.Fe2+/Fe3+作为氧化还原协同电对,可以换成I-/I
2
D. 总反应为:2H O+2CO O +2HCOOH
2 2 2
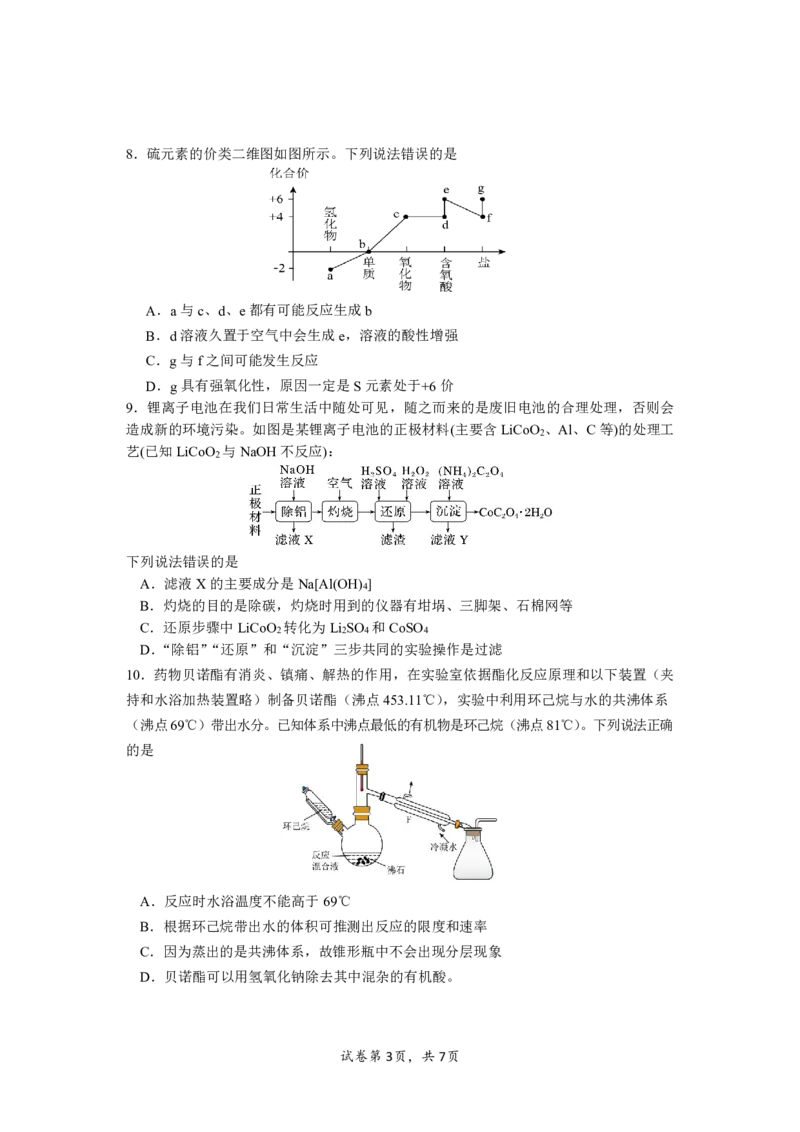
试卷第2页,共7页8.硫元素的价类二维图如图所示。下列说法错误的是
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e,溶液的酸性增强
C.g与f之间可能发生反应
D.g具有强氧化性,原因一定是S元素处于+6价
9.锂离子电池在我们日常生活中随处可见,随之而来的是废旧电池的合理处理,否则会
造成新的环境污染。如图是某锂离子电池的正极材料(主要含LiCoO 、Al、C等)的处理工
2
艺(已知LiCoO 与NaOH不反应):
2
下列说法错误的是
A.滤液X的主要成分是Na[Al(OH) ]
4
B.灼烧的目的是除碳,灼烧时用到的仪器有坩埚、三脚架、石棉网等
C.还原步骤中LiCoO 转化为Li SO 和CoSO
2 2 4 4
D.“除铝”“还原”和“沉淀”三步共同的实验操作是过滤
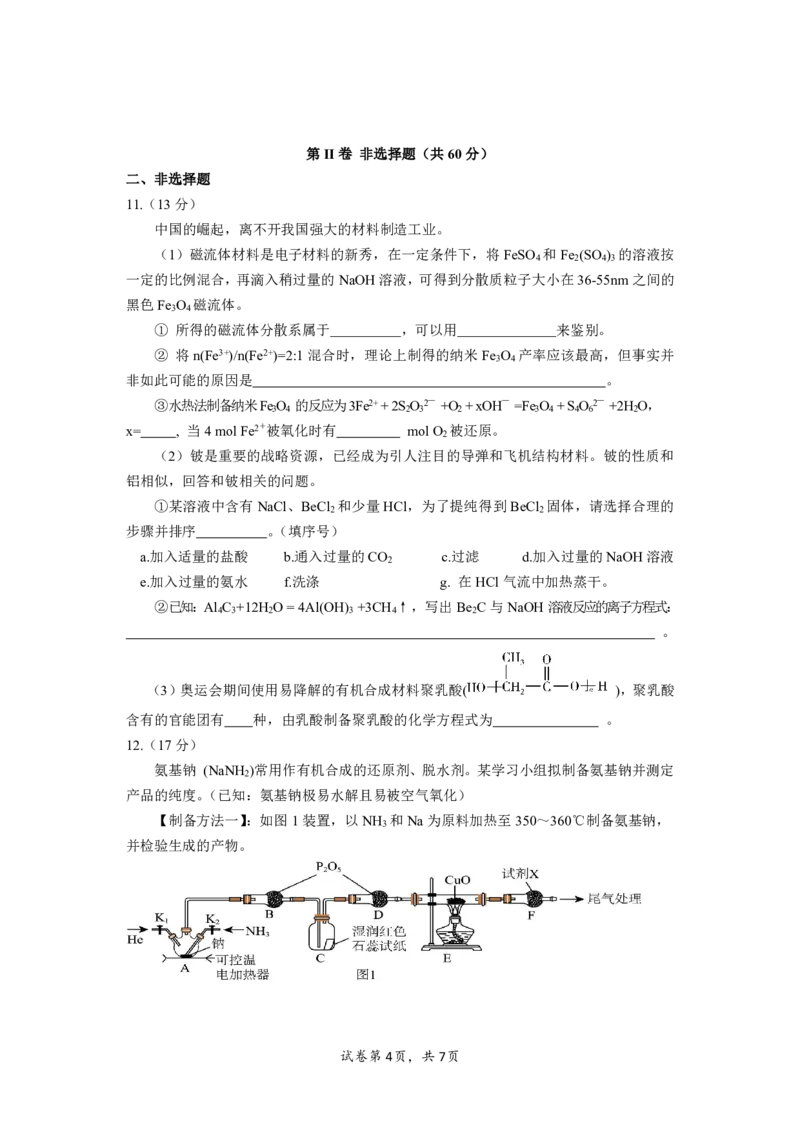
10.药物贝诺酯有消炎、镇痛、解热的作用,在实验室依据酯化反应原理和以下装置(夹
持和水浴加热装置略)制备贝诺酯(沸点453.11℃),实验中利用环己烷与水的共沸体系
(沸点69℃)带出水分。已知体系中沸点最低的有机物是环己烷(沸点81℃)。下列说法正确
的是
A.反应时水浴温度不能高于69℃
B.根据环己烷带出水的体积可推测出反应的限度和速率
C.因为蒸出的是共沸体系,故锥形瓶中不会出现分层现象
D.贝诺酯可以用氢氧化钠除去其中混杂的有机酸。
试卷第3页,共7页第II卷 非选择题(共60分)
二、非选择题
11.(13分)
中国的崛起,离不开我国强大的材料制造工业。
(1)磁流体材料是电子材料的新秀,在一定条件下,将FeSO 和Fe (SO ) 的溶液按
4 2 4 3
一定的比例混合,再滴入稍过量的NaOH溶液,可得到分散质粒子大小在36-55nm之间的
黑色Fe O 磁流体。
3 4
① 所得的磁流体分散系属于 ,可以用 来鉴别。
② 将n(Fe3+)/n(Fe2+)=2:1混合时,理论上制得的纳米Fe O 产率应该最高,但事实并
3 4
非如此可能的原因是 。
③水热法制备纳米FeO 的反应为3Fe2++2SO2— +O +xOH— =FeO +SO2— +2HO,
3 4 2 3 2 3 4 4 6 2
x= , 当4molFe2+被氧化时有 molO 被还原。
2
(2)铍是重要的战略资源,已经成为引人注目的导弹和飞机结构材料。铍的性质和
铝相似,回答和铍相关的问题。
①某溶液中含有NaCl、BeCl 和少量HCl,为了提纯得到BeCl 固体,请选择合理的
2 2
步骤并排序 。(填序号)
a.加入适量的盐酸 b.通入过量的CO c.过滤 d.加入过量的NaOH溶液
2
e.加入过量的氨水 f.洗涤 g. 在HCl气流中加热蒸干。
②已知:Al C +12H O=4Al(OH) +3CH ↑,写出Be C与NaOH溶液反应的离子方程式:
4 3 2 3 4 2
。
(3)奥运会期间使用易降解的有机合成材料聚乳酸( ),聚乳酸
含有的官能团有 种,由乳酸制备聚乳酸的化学方程式为 。
12.(17分)
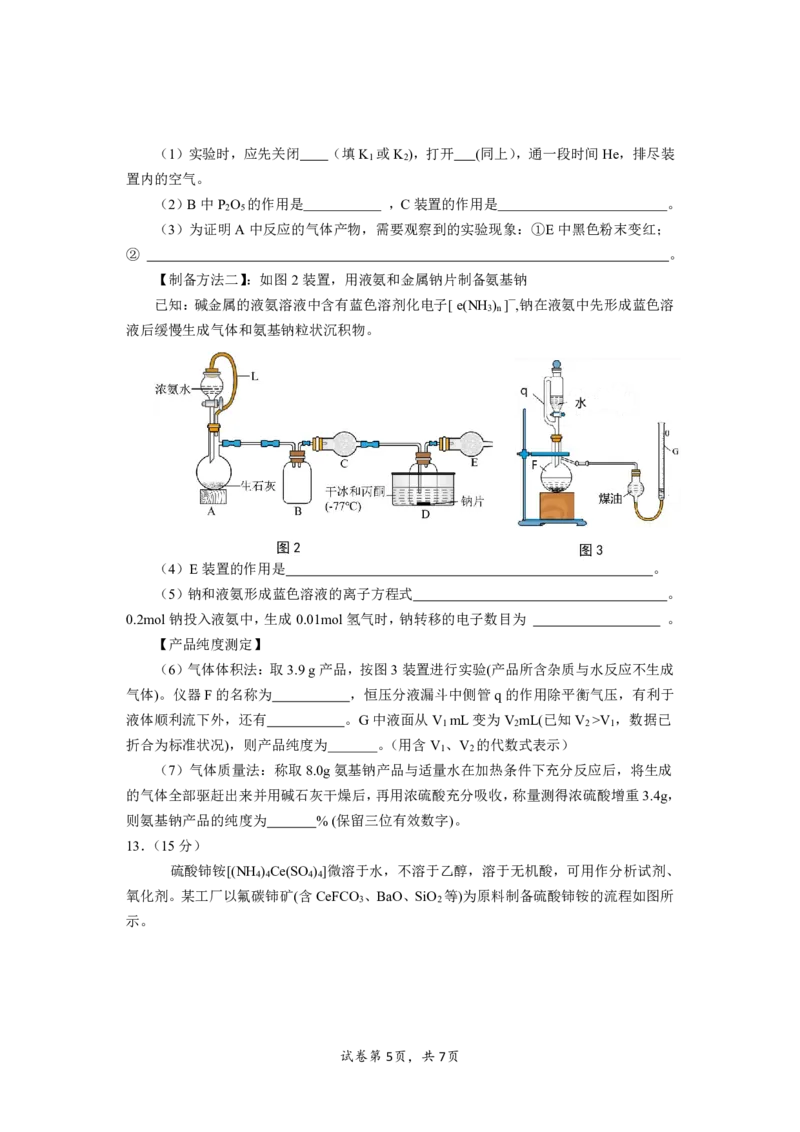
氨基钠 (NaNH )常用作有机合成的还原剂、脱水剂。某学习小组拟制备氨基钠并测定
2
产品的纯度。(已知:氨基钠极易水解且易被空气氧化)
【制备方法一】:如图1装置,以NH 和Na为原料加热至350~360℃制备氨基钠,
3
并检验生成的产物。
试卷第4页,共7页(1)实验时,应先关闭 (填K 或K ),打开 (同上),通一段时间He,排尽装
1 2
置内的空气。
(2)B中P O 的作用是 ,C装置的作用是 。
2 5
(3)为证明A中反应的气体产物,需要观察到的实验现象:①E中黑色粉末变红;
② 。
【制备方法二】:如图2装置,用液氨和金属钠片制备氨基钠
已知:碱金属的液氨溶液中含有蓝色溶剂化电子[e(NH ) ]—,钠在液氨中先形成蓝色溶
3 n
液后缓慢生成气体和氨基钠粒状沉积物。
图2 图3
(4)E装置的作用是 。
(5)钠和液氨形成蓝色溶液的离子方程式 。
0.2mol钠投入液氨中,生成0.01mol氢气时,钠转移的电子数目为 。
【产品纯度测定】
(6)气体体积法:取3.9g产品,按图3装置进行实验(产品所含杂质与水反应不生成
气体)。仪器F的名称为 ,恒压分液漏斗中侧管q的作用除平衡气压,有利于
液体顺利流下外,还有 。G中液面从V mL变为V mL(已知V >V ,数据已
1 2 2 1
折合为标准状况),则产品纯度为 。(用含V 、V 的代数式表示)
1 2
(7)气体质量法:称取8.0g氨基钠产品与适量水在加热条件下充分反应后,将生成
的气体全部驱赶出来并用碱石灰干燥后,再用浓硫酸充分吸收,称量测得浓硫酸增重3.4g,
则氨基钠产品的纯度为 %(保留三位有效数字)。
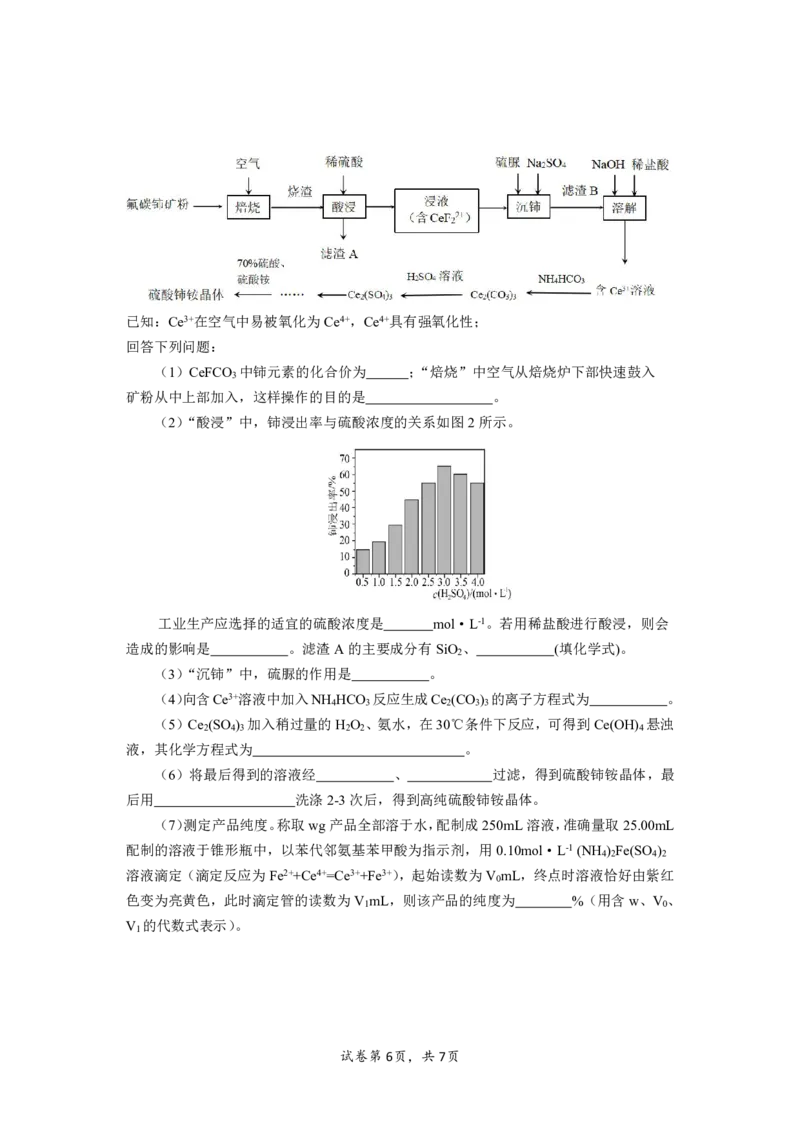
13.(15分)
硫酸铈铵[(NH ) Ce(SO ) ]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、
4 4 4 4
氧化剂。某工厂以氟碳铈矿(含CeFCO 、BaO、SiO 等)为原料制备硫酸铈铵的流程如图所
3 2
示。
试卷第5页,共7页已知:Ce3+在空气中易被氧化为Ce4+,Ce4+具有强氧化性;
回答下列问题:
(1)CeFCO 中铈元素的化合价为 ;“焙烧”中空气从焙烧炉下部快速鼓入
3
矿粉从中上部加入,这样操作的目的是 。
(2)“酸浸”中,铈浸出率与硫酸浓度的关系如图2所示。
工业生产应选择的适宜的硫酸浓度是 mol·L-1。若用稀盐酸进行酸浸,则会
造成的影响是 。滤渣A的主要成分有SiO 、 (填化学式)。
2
(3)“沉铈”中,硫脲的作用是 。
(4)向含Ce3+溶液中加入NH HCO 反应生成Ce (CO ) 的离子方程式为 。
4 3 2 3 3
(5)Ce (SO ) 加入稍过量的H O 、氨水,在30℃条件下反应,可得到Ce(OH) 悬浊
2 4 3 2 2 4
液,其化学方程式为 。
(6)将最后得到的溶液经 、 过滤,得到硫酸铈铵晶体,最
后用 洗涤2-3次后,得到高纯硫酸铈铵晶体。
(7)测定产品纯度。称取wg产品全部溶于水,配制成250mL溶液,准确量取25.00mL
配制的溶液于锥形瓶中,以苯代邻氨基苯甲酸为指示剂,用0.10mol·L-1(NH ) Fe(SO )
4 2 4 2
溶液滴定(滴定反应为Fe2++Ce4+=Ce3++Fe3+),起始读数为V mL,终点时溶液恰好由紫红
0
色变为亮黄色,此时滴定管的读数为V mL,则该产品的纯度为 %(用含w、V 、
1 0
V 的代数式表示)。
1
试卷第6页,共7页14.(15分)
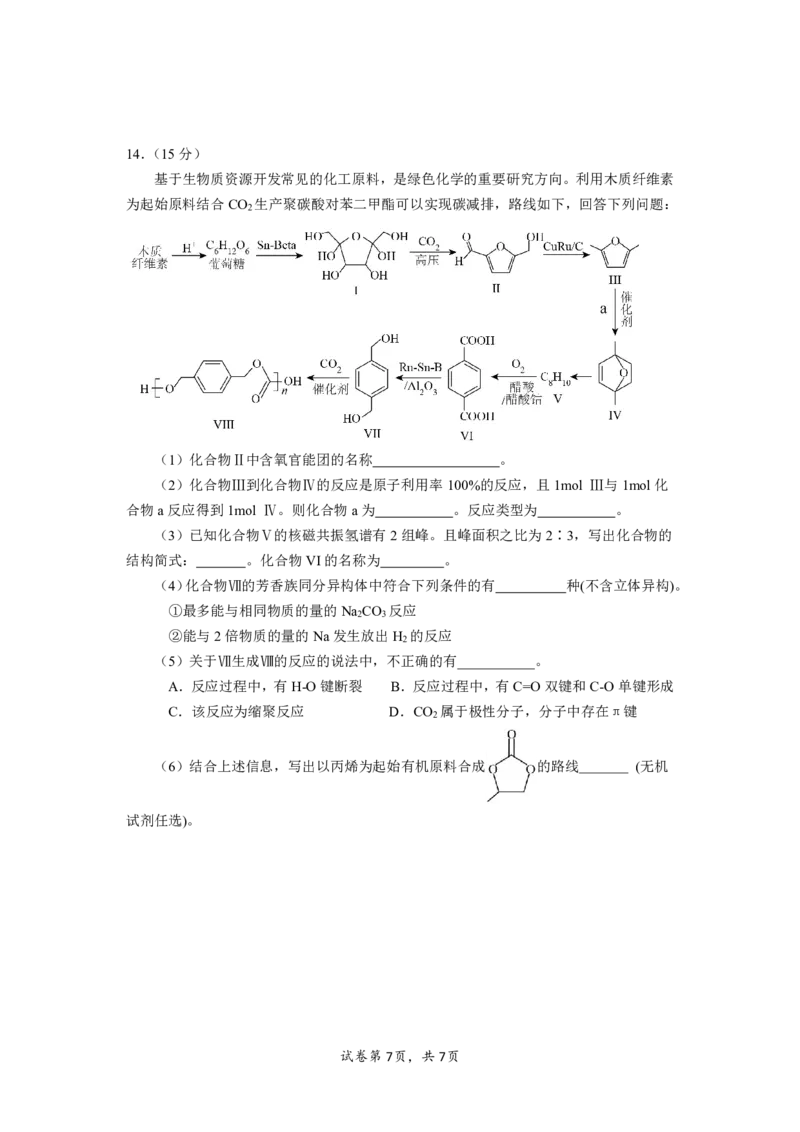
基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。利用木质纤维素
为起始原料结合CO 生产聚碳酸对苯二甲酯可以实现碳减排,路线如下,回答下列问题:
2
(1)化合物Ⅱ中含氧官能团的名称 。
(2)化合物Ⅲ到化合物Ⅳ的反应是原子利用率100%的反应,且1mol Ⅲ与1mol化
合物a反应得到1mol Ⅳ。则化合物a为 。反应类型为 。
(3)已知化合物Ⅴ的核磁共振氢谱有2组峰。且峰面积之比为2∶3,写出化合物的
结构简式: 。化合物VI的名称为 。
(4)化合物Ⅶ的芳香族同分异构体中符合下列条件的有 种(不含立体异构)。
①最多能与相同物质的量的Na CO 反应
2 3
②能与2倍物质的量的Na发生放出H 的反应
2
(5)关于Ⅶ生成Ⅷ的反应的说法中,不正确的有___________。
A.反应过程中,有H-O键断裂 B.反应过程中,有C=O双键和C-O单键形成
C.该反应为缩聚反应 D.CO 属于极性分子,分子中存在π键
2
(6)结合上述信息,写出以丙烯为起始有机原料合成 的路线 (无机
试剂任选)。
试卷第7页,共7页