文档内容
兰州一中 2024-2025 年高三 12 月月考检测卷
化 学
时长:75分钟 总分:100分
第 I 卷(选择题 共 50 分)
一、单选题(每题5分,共50分)
1.化学与生产和生活密切相关。下列过程中没有发生化学变化的是( )
A.氯气作水杀菌消毒剂
B.硅胶作袋装食品的干燥剂
C.二氧化硫作纸浆的漂白剂
D.肥皂水作蚊虫叮咬处的清洗剂
2.下列有关化学用语表示正确的是( )
A.次氯酸的结构式:H-Cl-O
B.CaO 的电子式:
2
C.CO 分子的比例模型:
2
D.乙醇的分子式:CHCHOH
3 2
3.四氯化锗( )是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态 原子价层电子排布式为
B. 的熔点比 低
C. 的空间构型为正四面体
D.第一电离能大小:
4.孔雀石古称石绿,是铜的表生矿物[化学式 ,“水色”从植物中提取,如花青(分子式
)。下列说法错误的是
学科网(北京)股份有限公司 学科网(北京)股份有限公司A.“石绿”耐酸、耐碱 B. 属于纯净物
C.保存不善的国画,“水色”容易变色 D.从蓝草中提取花青,可用有机溶剂萃取
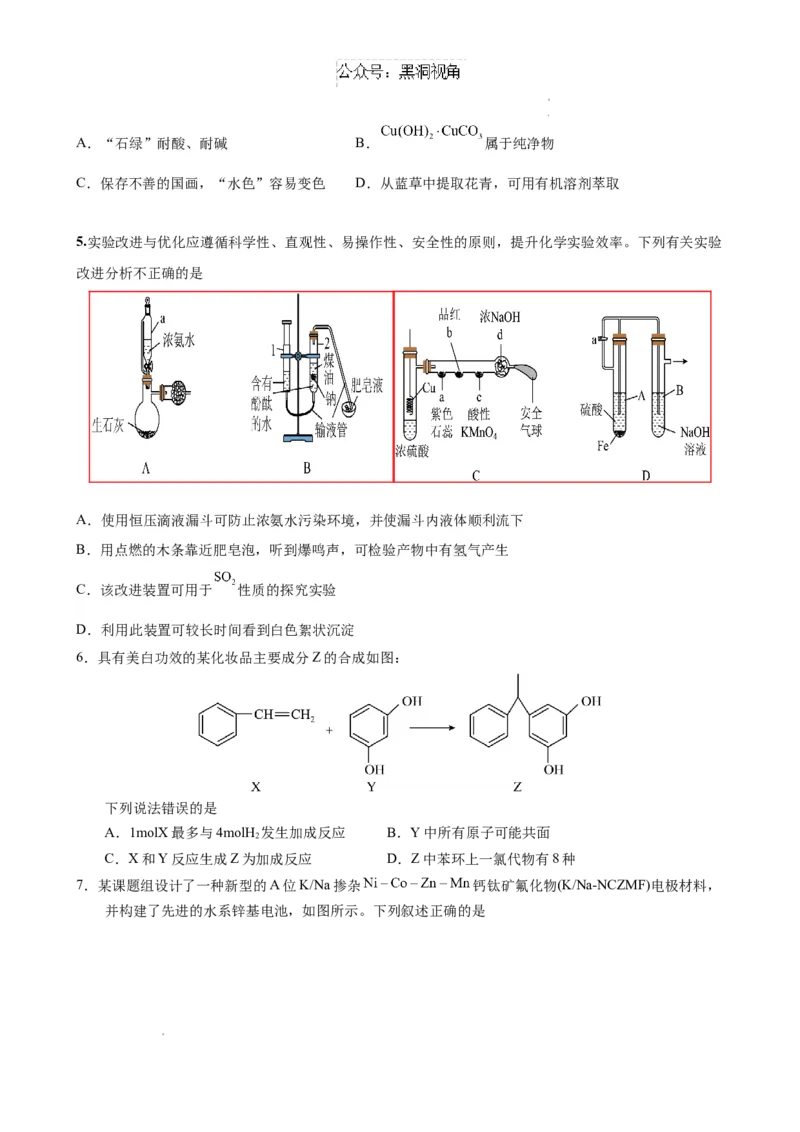
5.实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验
改进分析不正确的是
A.使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下
B.用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生
C.该改进装置可用于 性质的探究实验
D.利用此装置可较长时间看到白色絮状沉淀
6.具有美白功效的某化妆品主要成分Z的合成如图:
下列说法错误的是
A.1molX最多与4molH 发生加成反应 B.Y中所有原子可能共面
2
C.X和Y反应生成Z为加成反应 D.Z中苯环上一氯代物有8种
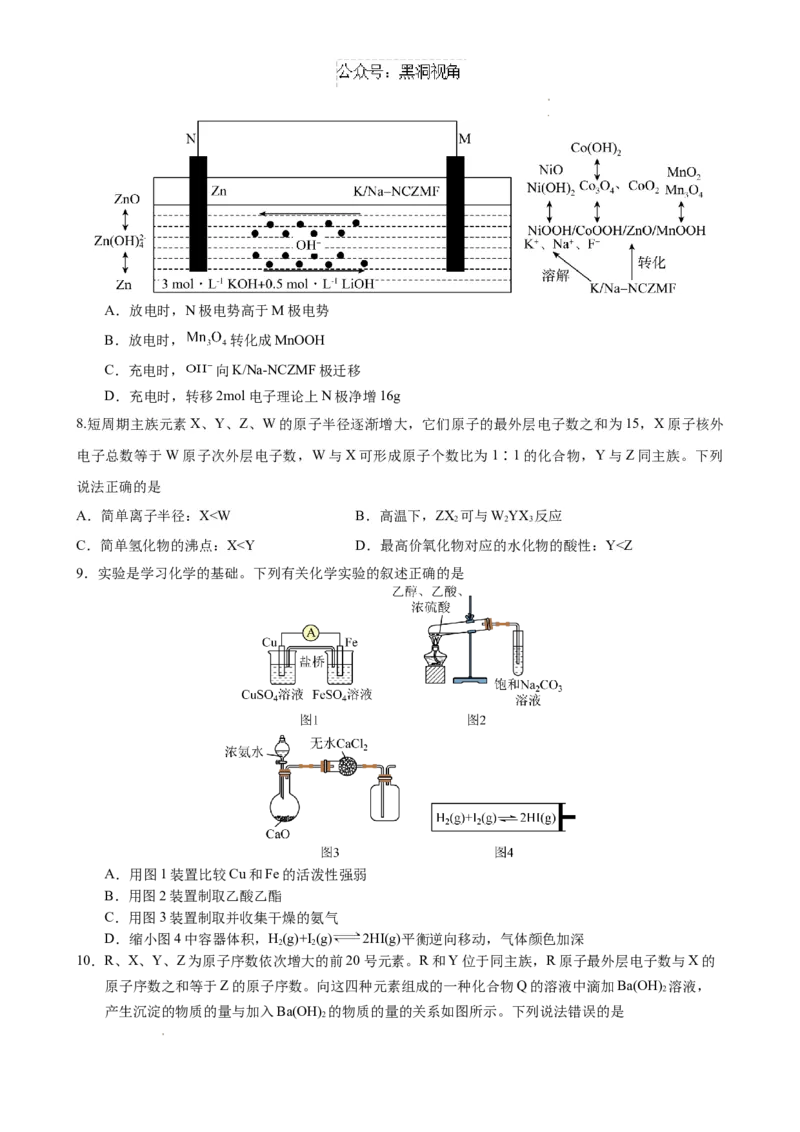
7.某课题组设计了一种新型的A位K/Na掺杂 钙钛矿氟化物(K/Na-NCZMF)电极材料,
并构建了先进的水系锌基电池,如图所示。下列叙述正确的是
学科网(北京)股份有限公司 学科网(北京)股份有限公司A.放电时,N极电势高于M极电势
B.放电时, 转化成MnOOH
C.充电时, 向K/Na-NCZMF极迁移
D.充电时,转移2mol电子理论上N极净增16g
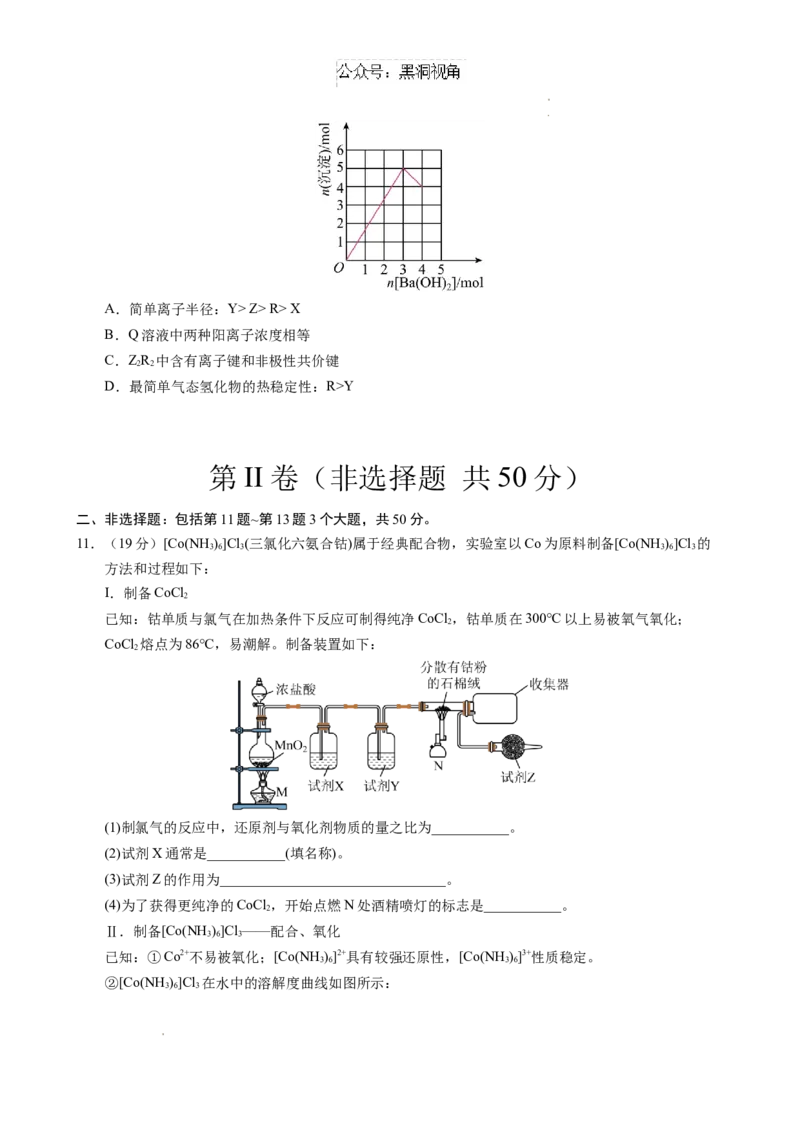
8.短周期主族元素X、Y、Z、W的原子半径逐渐增大,它们原子的最外层电子数之和为15,X原子核外
电子总数等于W原子次外层电子数,W与X可形成原子个数比为1∶1的化合物,Y与Z同主族。下列
说法正确的是
A.简单离子半径:X Z> R> X
B.Q溶液中两种阳离子浓度相等
C.ZR 中含有离子键和非极性共价键
2 2
D.最简单气态氢化物的热稳定性:R>Y
第 II 卷(非选择题 共 50 分)
二、非选择题:包括第11题~第13题3个大题,共50分。
11.(19分)[Co(NH )]Cl (三氯化六氨合钴)属于经典配合物,实验室以Co为原料制备[Co(NH )]Cl 的
3 6 3 3 6 3
方法和过程如下:
I.制备CoCl
2
已知:钴单质与氯气在加热条件下反应可制得纯净CoCl ,钴单质在300°C以上易被氧气氧化;
2
CoCl 熔点为86°C,易潮解。制备装置如下:
2
(1)制氯气的反应中,还原剂与氧化剂物质的量之比为___________。
(2)试剂X通常是___________(填名称)。
(3)试剂Z的作用为________________________________。
(4)为了获得更纯净的CoCl ,开始点燃N处酒精喷灯的标志是___________。
2
Ⅱ.制备[Co(NH )]Cl ——配合、氧化
3 6 3
已知:①Co2+不易被氧化;[Co(NH )]2+具有较强还原性,[Co(NH )]3+性质稳定。
3 6 3 6
②[Co(NH )]Cl 在水中的溶解度曲线如图所示:
3 6 3
学科网(北京)股份有限公司 学科网(北京)股份有限公司③加入少量浓盐酸有利于[Co(NH )]Cl 析出。
3 6 3
(5)按图组装好装置→___________(填序号,下同)→打开磁力搅拌器→控制温度在10°C以下
→___________→加热至60°C左右,恒温20min→在冰水中冷却所得混合物,即有晶体析出(粗产品)。
①缓慢加入HO 溶液
2 2
②滴加稍过量的浓氨水
③向三颈烧瓶中加入活性炭、CoCl 、NH Cl和适量水
2 4
(6)写出氧化阶段发生反应的离子方程式:_______________________________________。
(7)粗产品可用重结晶法提纯:向粗产品中加入80°C左右的热水,充分搅拌后,___________,冷却
后向滤液中加入少量___________,边加边搅拌,充分静置后过滤,用无水乙醇洗涤晶体2~3次,低
温干燥,得纯产品[Co(NH )]Cl 。
3 6 3
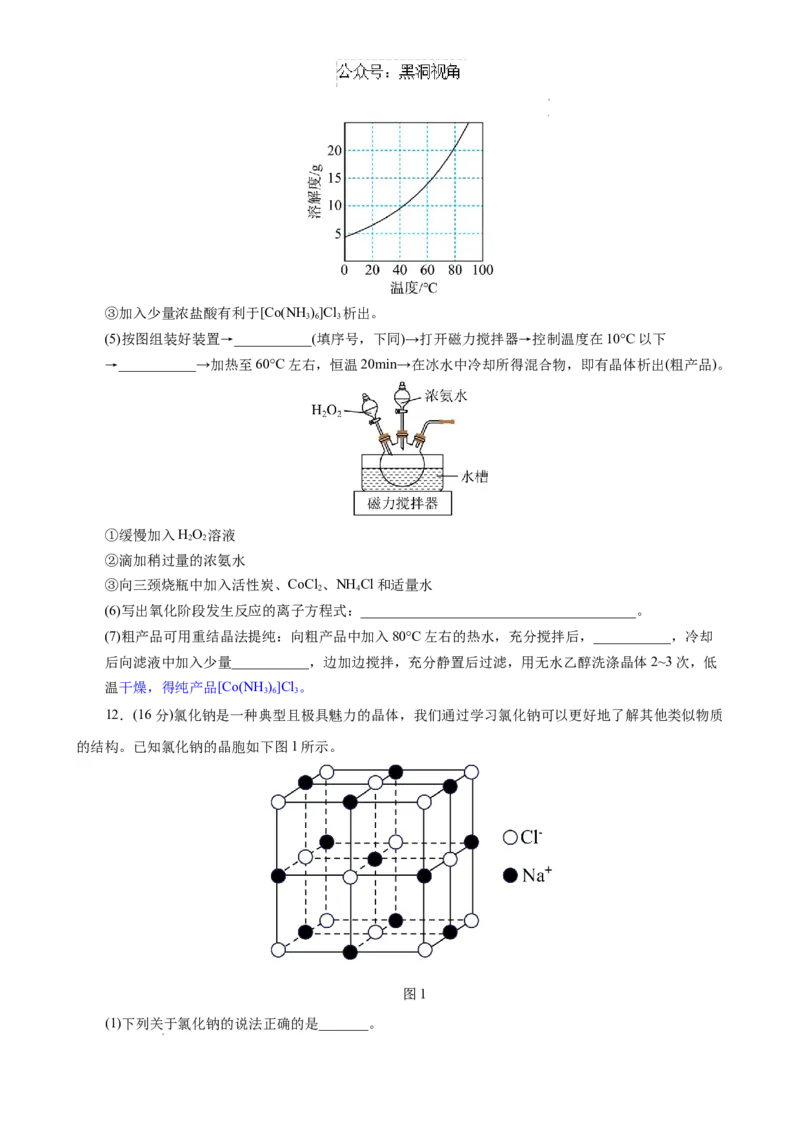
12.(16分)氯化钠是一种典型且极具魅力的晶体,我们通过学习氯化钠可以更好地了解其他类似物质
的结构。已知氯化钠的晶胞如下图1所示。
图1
(1)下列关于氯化钠的说法正确的是_______。
学科网(北京)股份有限公司 学科网(北京)股份有限公司A.基态 的电子有5种空间运动状态
B.钠是第一电离能最大的碱金属元素
C.氯原子的价电子排布式可写成 [Ne]3s23p5
D.每个氯离子周围与它最近且等距的氯离子有12个
(2)已知NaCl的密度为ρg· cm-3,NaCl的摩尔质量为 ,阿伏加德罗常数的值为N ,则在
A
NaCl晶体里 和 的最短距离为_______ 。
(3)温度升高时, 晶体出现缺陷,如图2所示,当图中方格内填入 时,恰好构成氯化钠晶胞
的1/8。 晶体出现缺陷时,其导电性大大增强,原因是___________________。
(4) NiO、FeO的晶体类型与氯化钠相同, 和 的离子半径分别为 和 ,则熔点:
NiO_______FeO (填“>”“<”或“=”)
(5)钡在氧气中燃烧时得到一种钡的氧化物BaO 晶体,其阴阳离子的排布与氯化钠相同,其中存在的
2
化学键的类型为___________________。
13. (15分)铋的化合物在电催化和光催化领域都有广泛应用。一种从含铋矿渣(主要成分是 、
、 、 、 等)中提取高纯 的工艺如下:
学科网(北京)股份有限公司 学科网(北京)股份有限公司已知:
①乙酰胺( )有臭味、有毒,熔点为82.3℃,沸点为221℃,可溶于水。
②常温下, , 。
③该工艺条件下,相关金属离子形成氢氧化物沉淀的 范围如下:
离子
开始沉淀的 1.5 3.6 4.5
沉淀完全的 3.2 4.7 6.7
回答下列问题:
(1) 中的 的化合价为 ,则 的化合价是_______。
(2)“沉铋”时加入 溶液, 转化为 沉淀的离子方程式是_____________________。往“沉
铋”所得滤液中加入铁粉可回收其中的_______(填化学式)金属。
(3)“洗涤”时先用水洗,再用稀硫酸洗涤。用稀硫酸洗涤的目的是为了除去滤饼中的______________(填
化学式)杂质。
(4)“转化”分两步进行:第一步 转化为 ,反应的离子方程式为_____________________;
第二步 受热分解, 。常温下,当 恰好完全转化成 时,溶
液中 浓度为 ,则此时溶液的 为______________。
(5)“合成”所得乙酰胺的水溶液经______________(填操作)可获得乙酰胺固体,以再生硫代乙酰胺(
)。
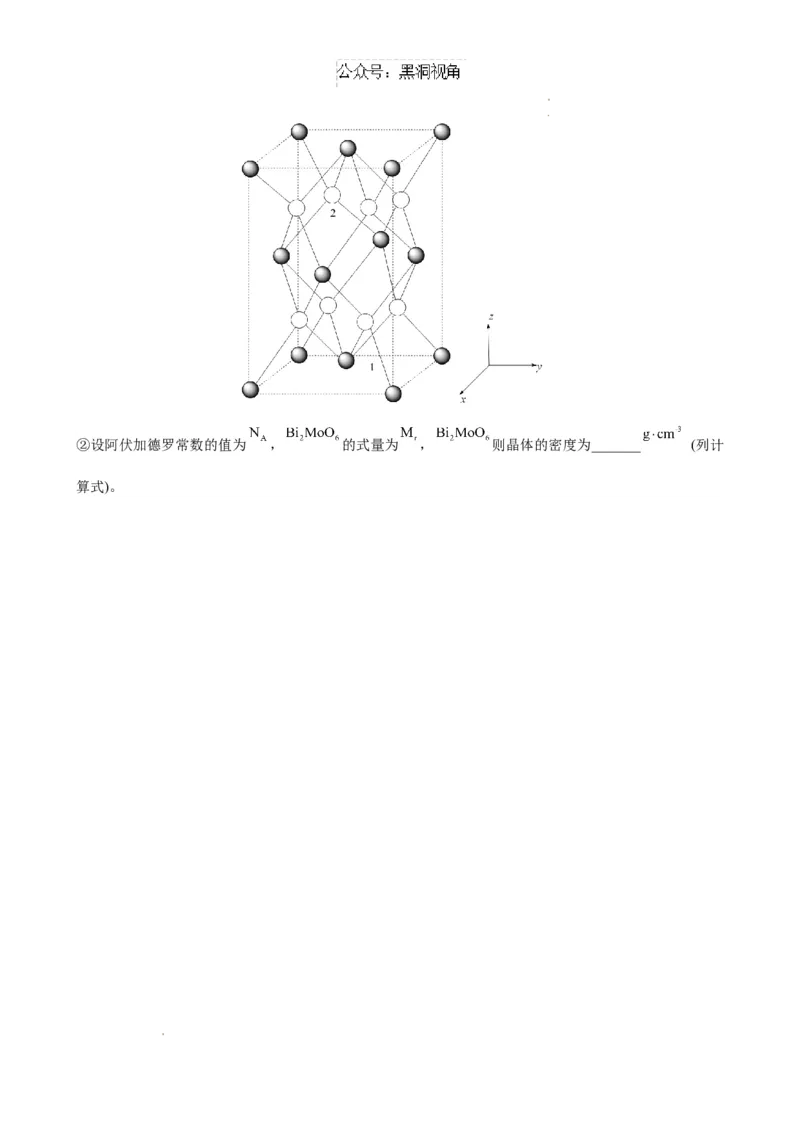
(6)钼酸铋( )可用于光催化水的分解,其晶胞结构(不含氧原子)如图所示,晶胞参数为 , ,
,晶胞棱边夹角均为90°。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。已知原子 1
的坐标为 ,则原子2的坐标为_______。
学科网(北京)股份有限公司 学科网(北京)股份有限公司②设阿伏加德罗常数的值为 , 的式量为 , 则晶体的密度为_______ (列计
算式)。
学科网(北京)股份有限公司 学科网(北京)股份有限公司