文档内容
河北省“五个一”名校联盟 2025 届高三第一次联考
化学
本试卷共8页,满分 100分,考试用时 75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写
在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:O16S32Zn65
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一
项符合题目要求。
1. 易县燕下都遗址出土的透雕龙凤纹铜铺首(如图)是战国时期青铜器,下列说法错误的是
A. 青铜是铜锡合金
B. 青铜的熔点高于纯铜
C. 青铜器表面的铜绿主要成分为Cu (OH) CO
2 2 3
D. 青铜器应保存在相对干燥的环境中
2. 下列说法错误的是
A. 氯酸钾和硫黄不能保存在同一药品柜中
B. 硝酸银溶液应保存在棕色细口瓶中
C. 镁条着火时应使用二氧化碳灭火器灭火
D. 滴定实验中的锥形瓶不需要润洗
3. 化学与生产、生活、能源、环境密切相关,下列说法正确的是
A. 电解氯化钾溶液可制得钾单质和氯气
B. 包装上有“OTC”标识的药物可以放心大量使用C. 太阳能电池板的主要成分为二氧化硅
D. 含酚废水可用二氧化氯进行氧化处理
4. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 1L 0.1molL1的NaHSO 溶液中含有0.1N 个SO2
3 A 3
B. 18g D O中含有10N 个中子
2 A
C. 1mol共价晶体CO 中含有2N 个CO健
2 A
D. 标准状况下11.2LHCHO中含有0.5N 个π键
A
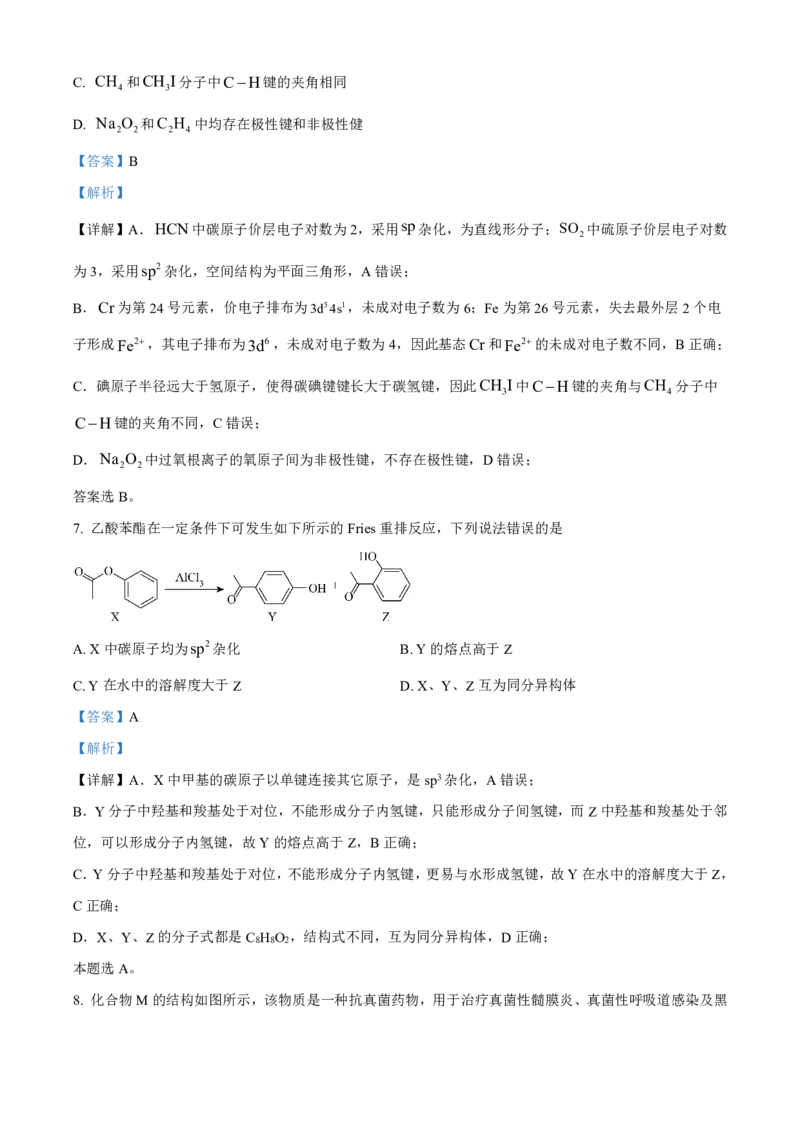
5. 中药材当归和白芷中提取得到的紫花前胡醇( )能提高人体免疫力。下列关于紫
花前胡醇的说法错误的是
A. 分子式为C H O
14 14 4
B 1mol该物质最多能与5mol H 发生反应
. 2
C. 能使酸性高锰酸钾溶液褪色
D. 能发生水解反应
6. 关于物质结构的下列说法正确的是
A. HCN和SO 均为直线形分子
2
B. 基态Cr和Fe2的未成对电子数不同
C. CH 和CH I分子中CH键的夹角相同
4 3
D. Na O 和C H 中均存在极性键和非极性健
2 2 2 4
7. 乙酸苯酯在一定条件下可发生如下所示的Fries重排反应,下列说法错误的是
A.X中碳原子均为sp2杂化 B.Y的熔点高于Z
C.Y在水中的溶解度大于Z D.X、Y、Z互为同分异构体
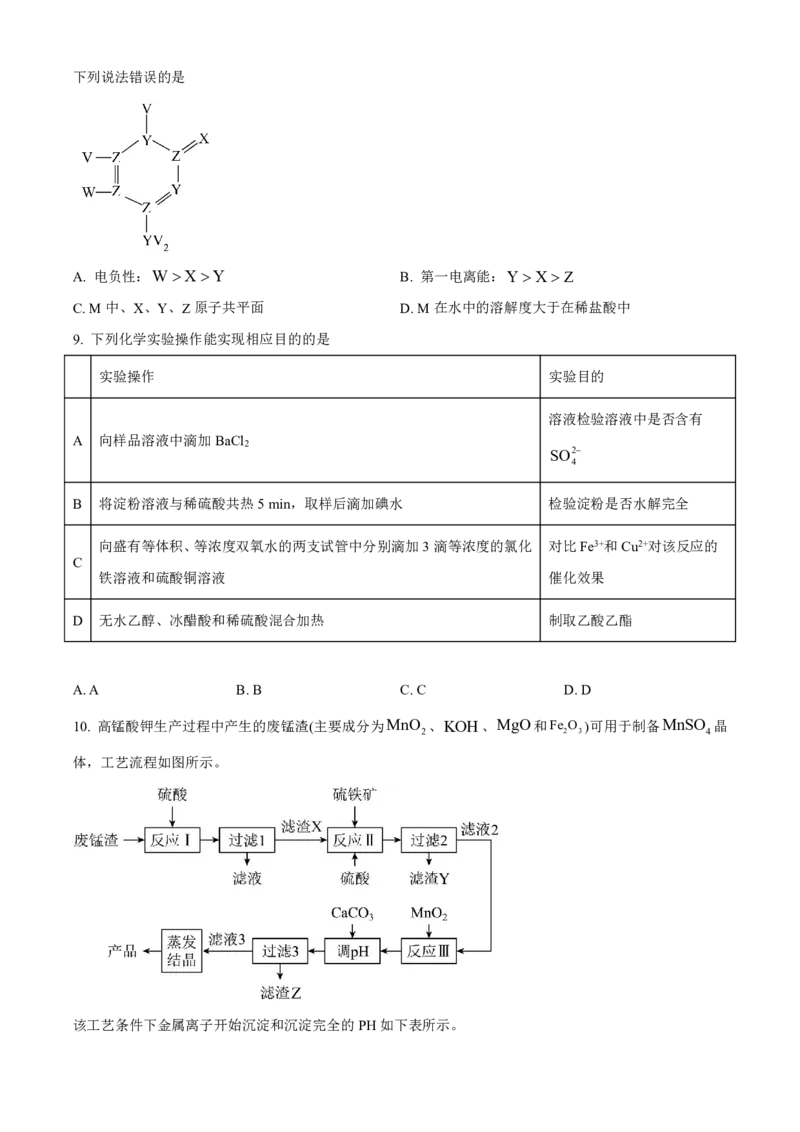
8. 化合物M的结构如图所示,该物质是一种抗真菌药物,用于治疗真菌性髓膜炎、真菌性呼吸道感染及黑
色真菌症。已知V、W、X、Y、Z为原子半径依次增大的短周期元素,且基态W原子的最高能层无空轨道。下列说法错误的是
A. 电负性:WXY B. 第一电离能:Y X Z
C.M中、X、Y、Z原子共平面 D.M在水中的溶解度大于在稀盐酸中
9. 下列化学实验操作能实现相应目的的是
实验操作 实验目的
溶液检验溶液中是否含有
A 向样品溶液中滴加BaCl
2
SO2
4
B 将淀粉溶液与稀硫酸共热5min,取样后滴加碘水 检验淀粉是否水解完全
向盛有等体积、等浓度双氧水的两支试管中分别滴加3滴等浓度的氯化 对比Fe3+和Cu2+对该反应的
C
铁溶液和硫酸铜溶液 催化效果
D 无水乙醇、冰醋酸和稀硫酸混合加热 制取乙酸乙酯
A.A B.B C.C D.D
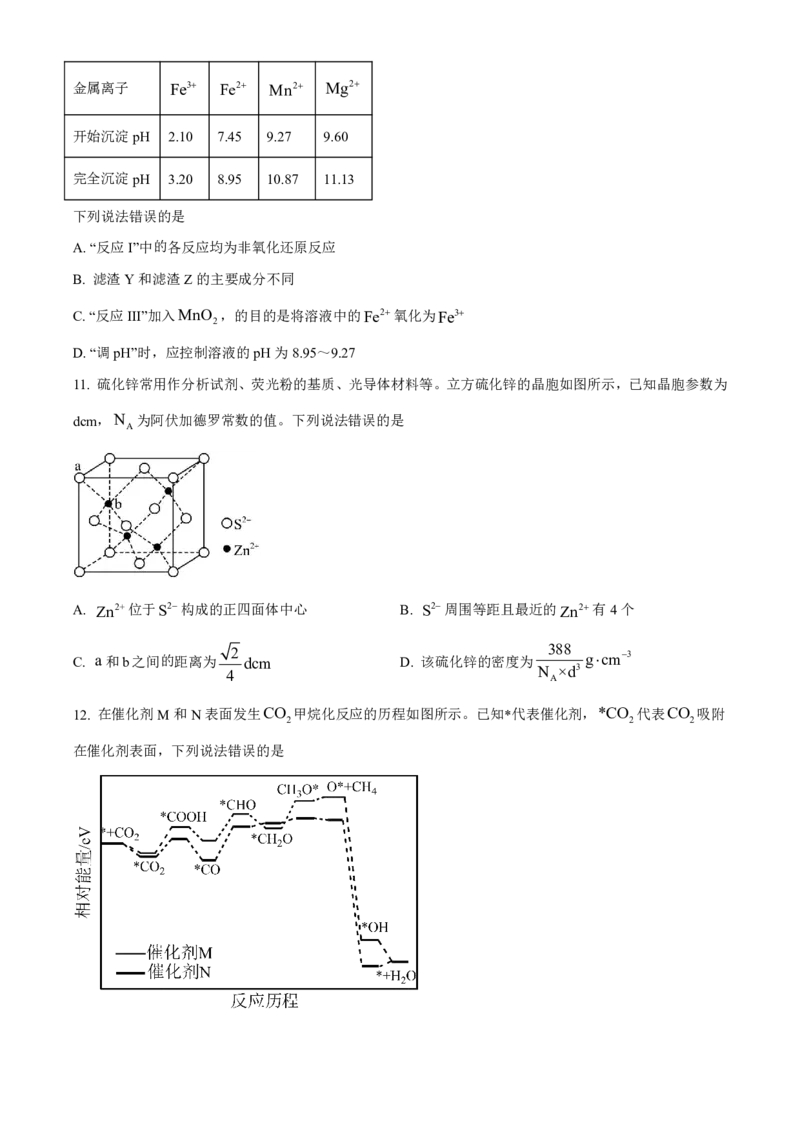
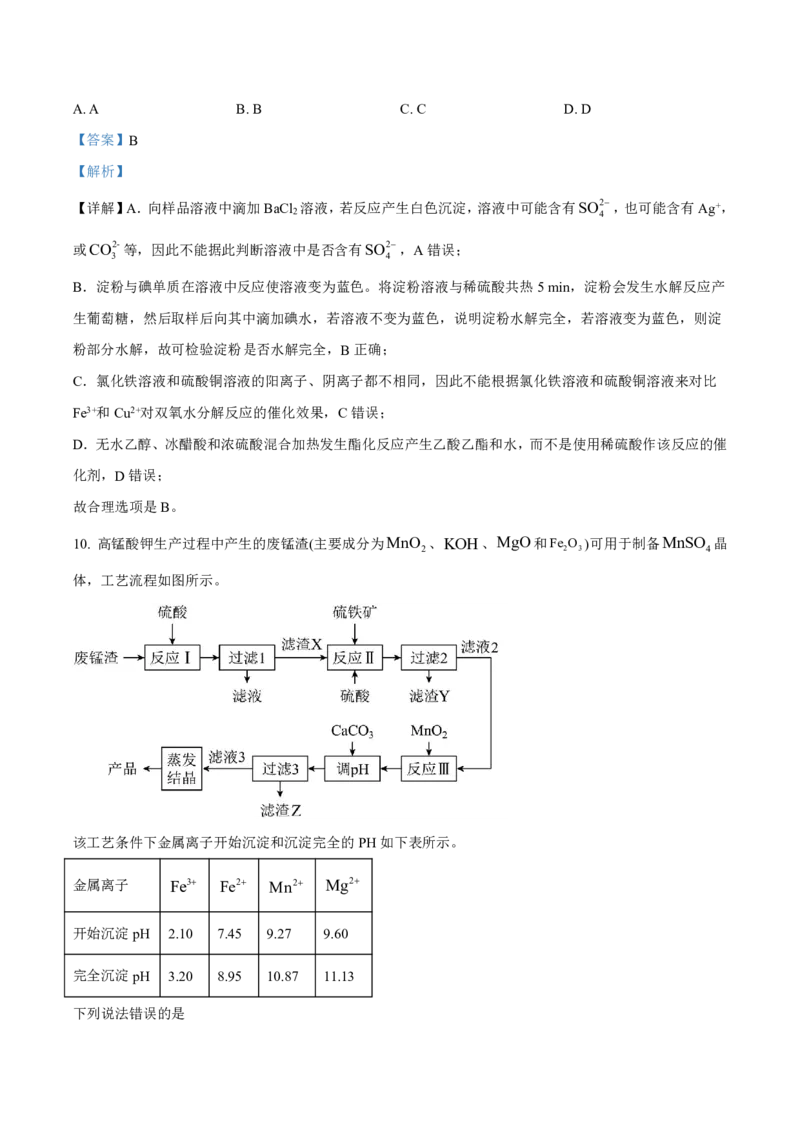
10. 高锰酸钾生产过程中产生的废锰渣(主要成分为MnO 、KOH、MgO和Fe O )可用于制备MnSO 晶
2 2 3 4
体,工艺流程如图所示。
该工艺条件下金属离子开始沉淀和沉淀完全的PH如下表所示。金属离子 Fe3 Fe2 Mn2 Mg2
开始沉淀pH 2.10 7.45 9.27 9.60
完全沉淀pH 3.20 8.95 10.87 11.13
下列说法错误的是
A.“反应I”中的各反应均为非氧化还原反应
B. 滤渣Y和滤渣Z的主要成分不同
C.“反应III”加入MnO ,的目的是将溶液中的Fe2氧化为Fe3
2
D.“调pH”时,应控制溶液的pH为8.95~9.27
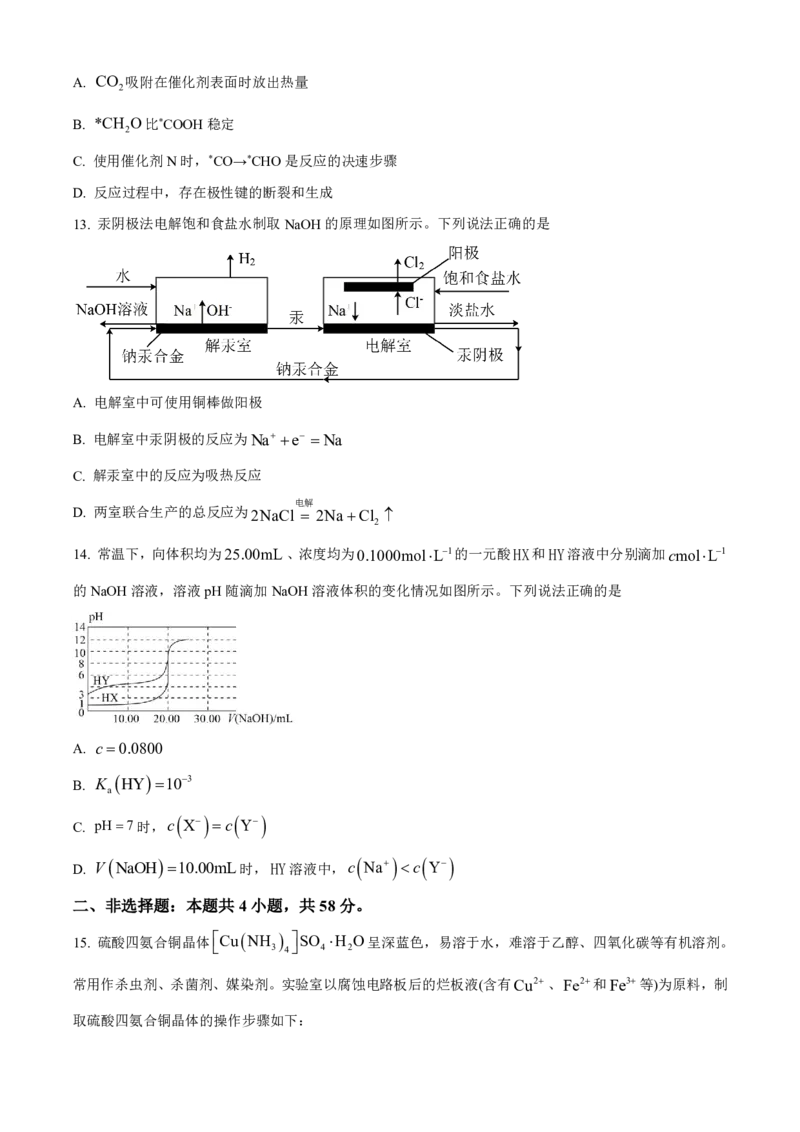
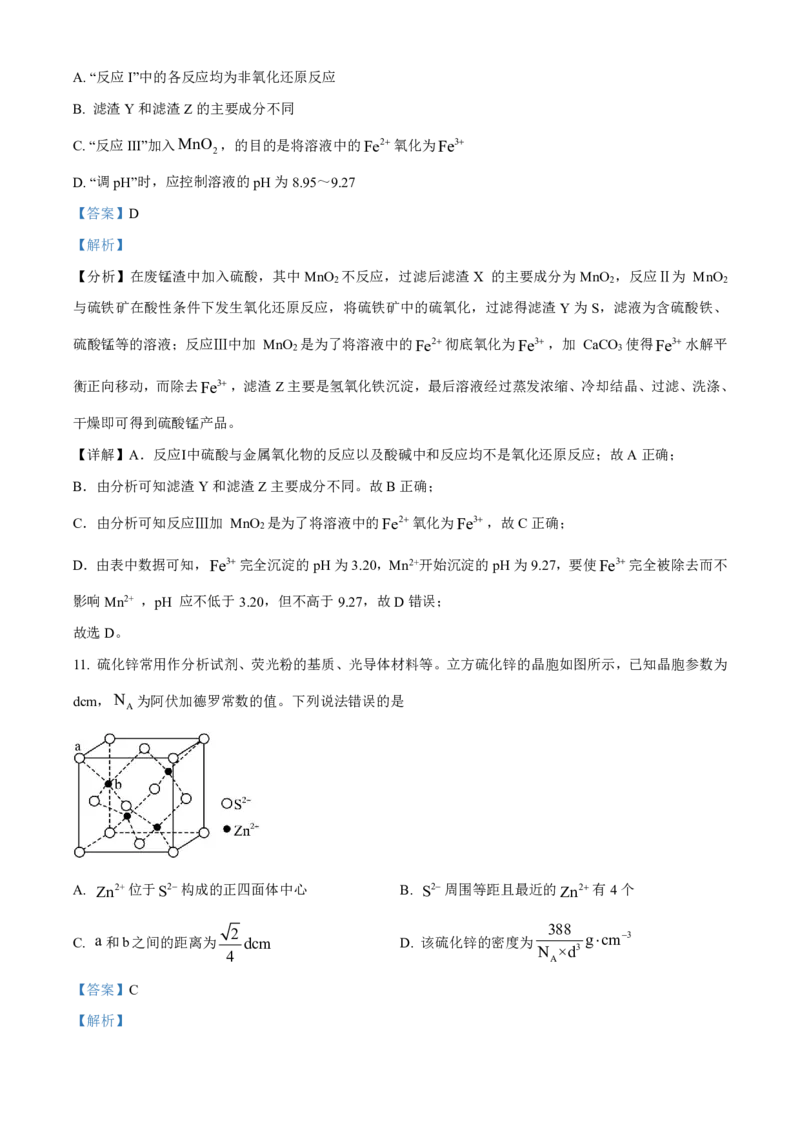
11. 硫化锌常用作分析试剂、荧光粉的基质、光导体材料等。立方硫化锌的晶胞如图所示,已知晶胞参数为
dcm,N 为阿伏加德罗常数的值。下列说法错误的是
A
A. Zn2+位于S2构成的正四面体中心 B. S2周围等距且最近的Zn2有4个
C. a和b之间的距离为 2 dcm D. 该硫化锌的密度为 388 gcm3
N ×d3
4
A
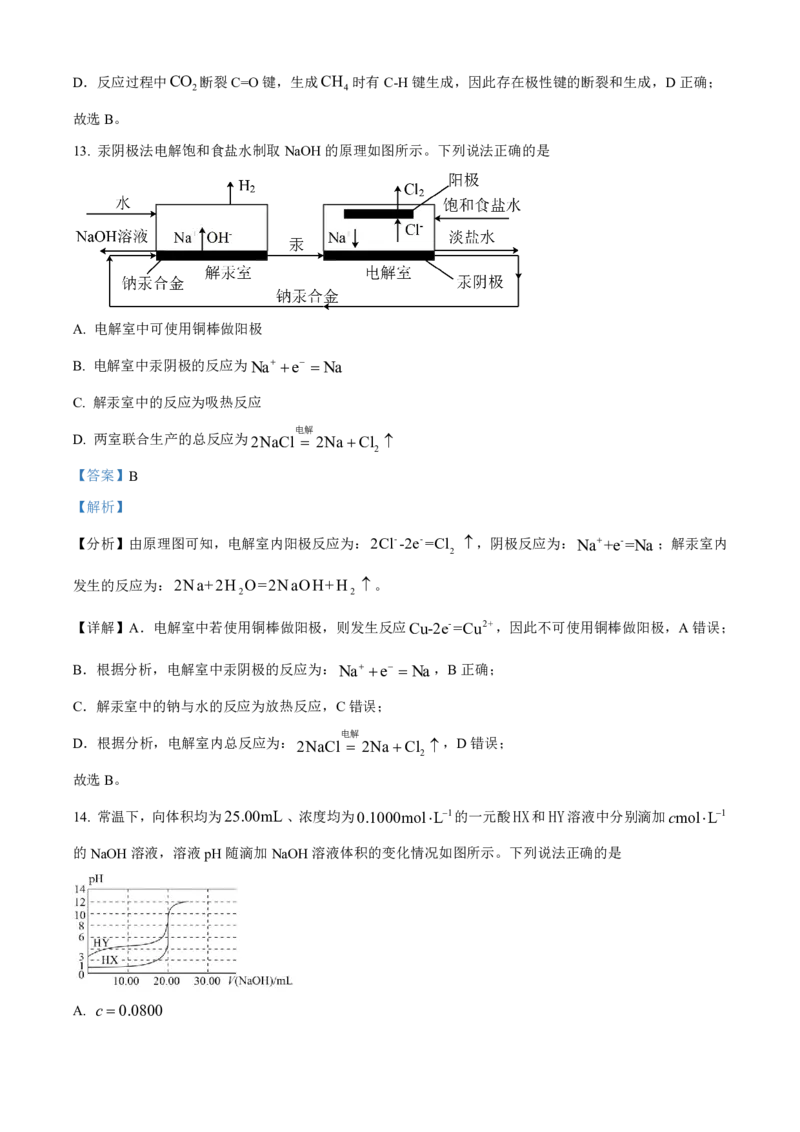
12. 在催化剂M和N表面发生CO 甲烷化反应的历程如图所示。已知*代表催化剂,*CO 代表CO 吸附
2 2 2
在催化剂表面,下列说法错误的是A. CO 吸附在催化剂表面时放出热量
2
B. *CH O比*COOH稳定
2
C. 使用催化剂N时,*CO→*CHO是反应的决速步骤
D. 反应过程中,存在极性键的断裂和生成
13. 汞阴极法电解饱和食盐水制取NaOH的原理如图所示。下列说法正确的是
A. 电解室中可使用铜棒做阳极
B. 电解室中汞阴极的反应为Na e Na
C. 解汞室中的反应为吸热反应
电解
D. 两室联合生产的总反应为 2NaCl 2NaCl
2
14. 常温下,向体积均为25.00mL、浓度均为0.1000molL1的一元酸HX和HY溶液中分别滴加cmolL1
的NaOH溶液,溶液pH随滴加NaOH溶液体积的变化情况如图所示。下列说法正确的是
A. c0.0800
B. K
HY
103
a
C. pH7时,c
X
c
Y
D. V NaOH 10.00mL时,HY溶液中,c Na c Y
二、非选择题:本题共 4小题,共 58分。
15. 硫酸四氨合铜晶体 Cu NH 3 4 SO 4 H 2 O呈深蓝色,易溶于水,难溶于乙醇、四氧化碳等有机溶剂。
常用作杀虫剂、杀菌剂、媒染剂。实验室以腐蚀电路板后的烂板液(含有Cu2、Fe2和Fe3等)为原料,制
取硫酸四氨合铜晶体的操作步骤如下:I.将铁片放入80mL烂板液中,小火加热。反应完成后,用倾析法倒掉溶液。得到的铜粉用自来水洗干净,
抽滤,小火炒干,冷却。
Ⅱ.称取3g铜粉,放在坩埚中大火灼烧,并不断搅拌使铜粉充分被氧化,反应完成后放置冷却。
Ⅲ.在蒸发皿中加入20mL1:4的H SO 溶液,将上一步所得CuO粉末慢慢加入其中,得到蓝色溶液。
2 4
Ⅳ.将CuSO 溶液趁热抽滤,除去不溶杂质。清液转移至蒸发皿中,浓缩至液面出现结晶膜,用冷水冷却
4
令其结晶。抽滤,得到CuSO 5H O晶体。
4 2
V.称取约2.5g CuSO 5H O晶体,溶于25mL蒸馏水中,在搅拌情况下缓慢加入足量浓氨水,制得
4 2
Cu NH
3
4
SO
4
溶液,加入等体积的95%的乙醇溶液,搅拌,并观察现象。
请回答下列问题:
(1)硫酸四氨合铜在水溶液中的电离方程式为___________。
(2)步骤I中主要反应的离子方程式为___________、___________。
(3)步骤Ⅲ中,为加快CuO粉末的溶解速率,可采取的方法有___________(任意答出两条)。
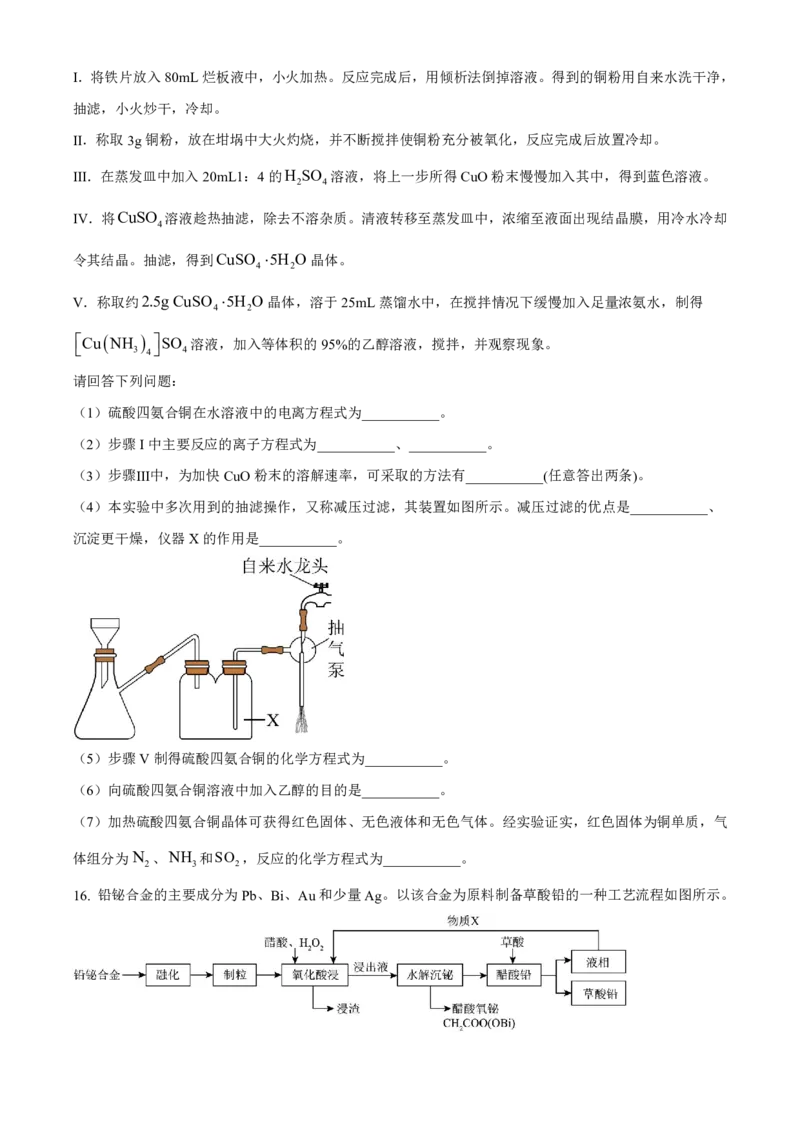
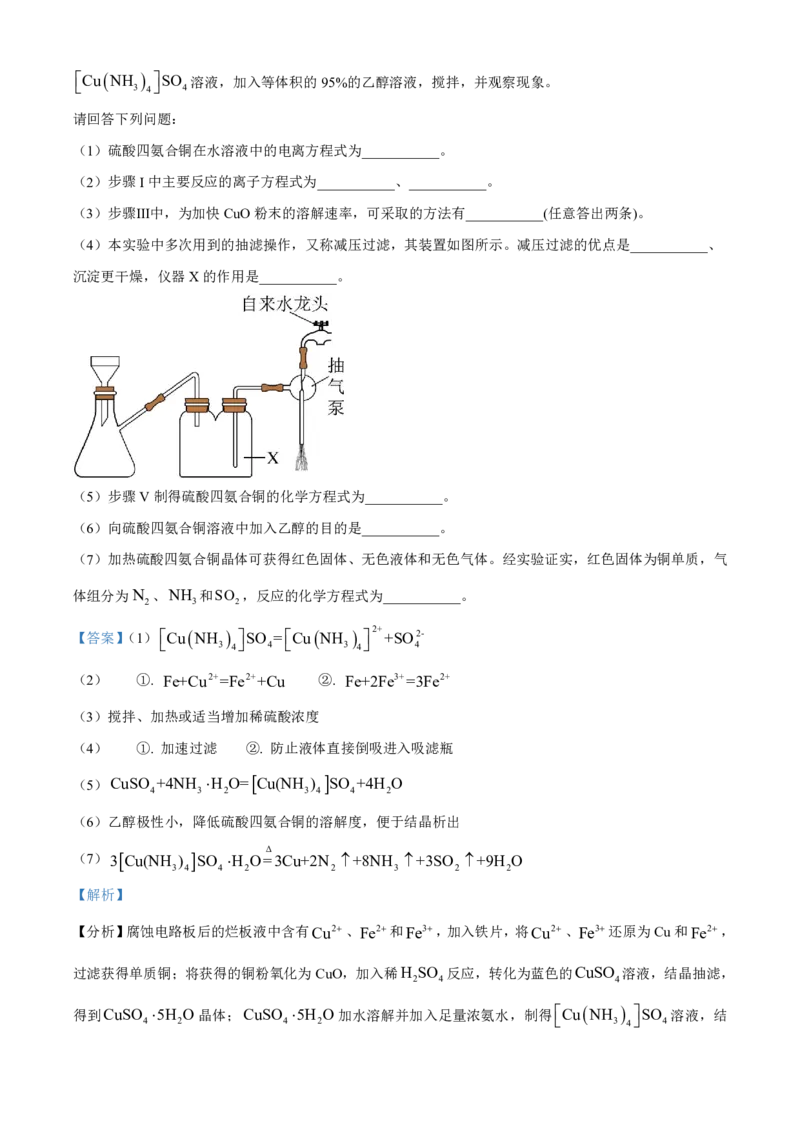
(4)本实验中多次用到的抽滤操作,又称减压过滤,其装置如图所示。减压过滤的优点是___________、
沉淀更干燥,仪器X的作用是___________。
(5)步骤V制得硫酸四氨合铜的化学方程式为___________。
(6)向硫酸四氨合铜溶液中加入乙醇的目的是___________。
(7)加热硫酸四氨合铜晶体可获得红色固体、无色液体和无色气体。经实验证实,红色固体为铜单质,气
体组分为N 、NH 和SO ,反应的化学方程式为___________。
2 3 2
16. 铅铋合金的主要成分为Pb、Bi、Au和少量Ag。以该合金为原料制备草酸铅的一种工艺流程如图所示。已知,“熔化”和“制粒”两步工序的具体操作为:将铅铋合金加热熔化后,以一定流速加入水中,形成
粒径2~4mm的合金颗粒。请回答下列问题:
(1)Bi为第6周期VA族元素,其基态原子的外围电子排布式为___________,Bi在化合物中的主要化合
价为___________。
(2)“熔化”和“制粒”两步工序的目的是___________。
(3)“氧化酸浸”时,Pb转化为 CH COO Pb,反应的化学方程式为___________,浸渣的主要成分为
3 2
___________。
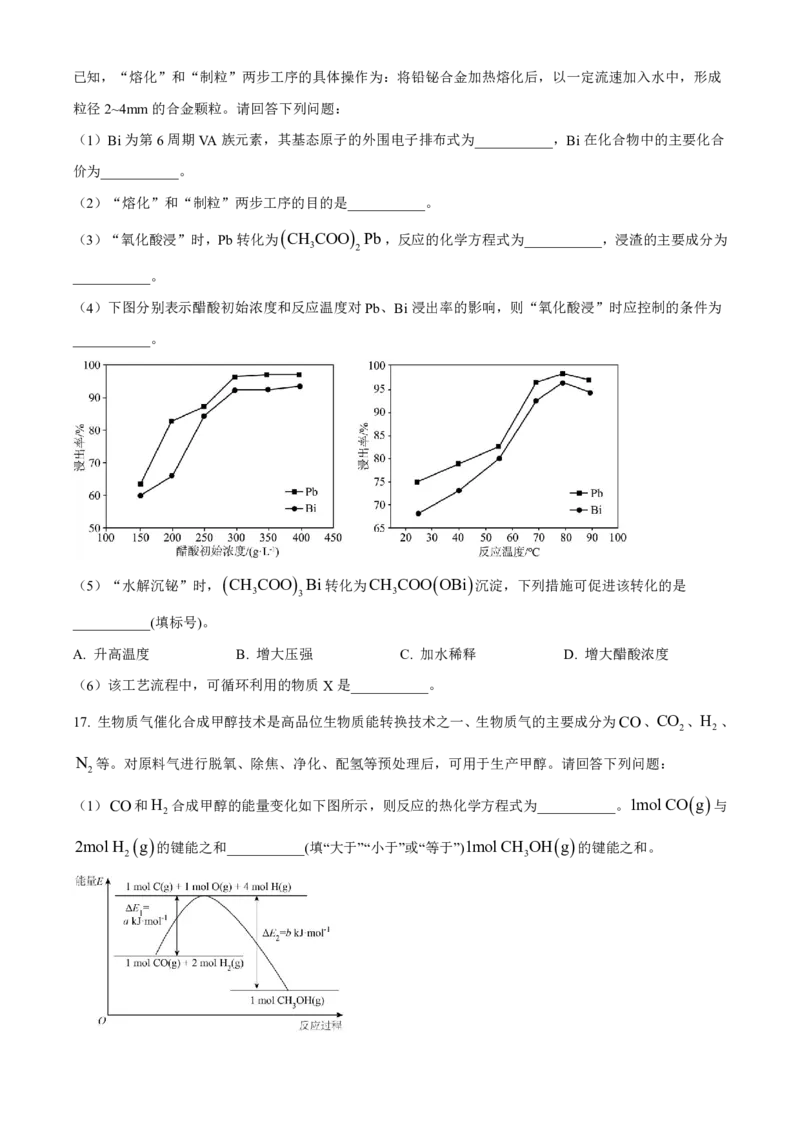
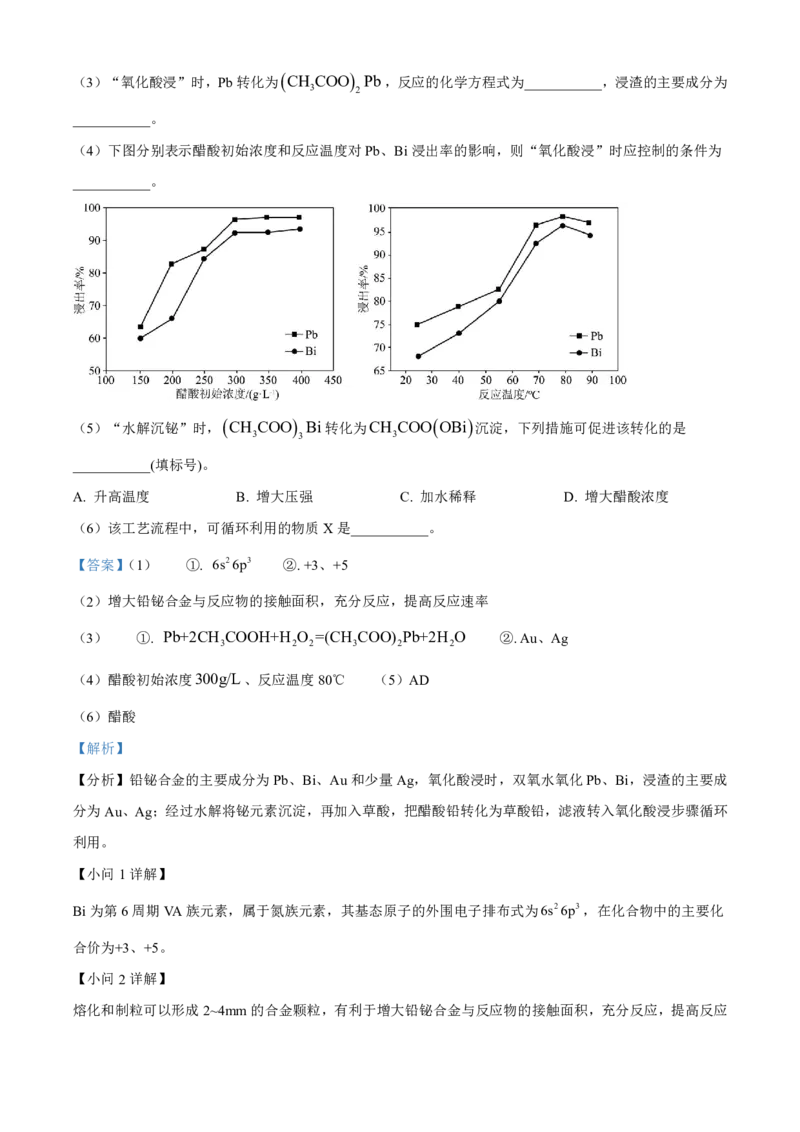
(4)下图分别表示醋酸初始浓度和反应温度对Pb、Bi浸出率的影响,则“氧化酸浸”时应控制的条件为
___________。
(5)“水解沉铋”时, CH COO Bi转化为CH COO OBi 沉淀,下列措施可促进该转化的是
3 3 3
___________(填标号)。
A. 升高温度 B. 增大压强 C. 加水稀释 D. 增大醋酸浓度
(6)该工艺流程中,可循环利用的物质X是___________。
17. 生物质气催化合成甲醇技术是高品位生物质能转换技术之一、生物质气的主要成分为CO、CO 、H 、
2 2
N 等。对原料气进行脱氧、除焦、净化、配氢等预处理后,可用于生产甲醇。请回答下列问题:
2
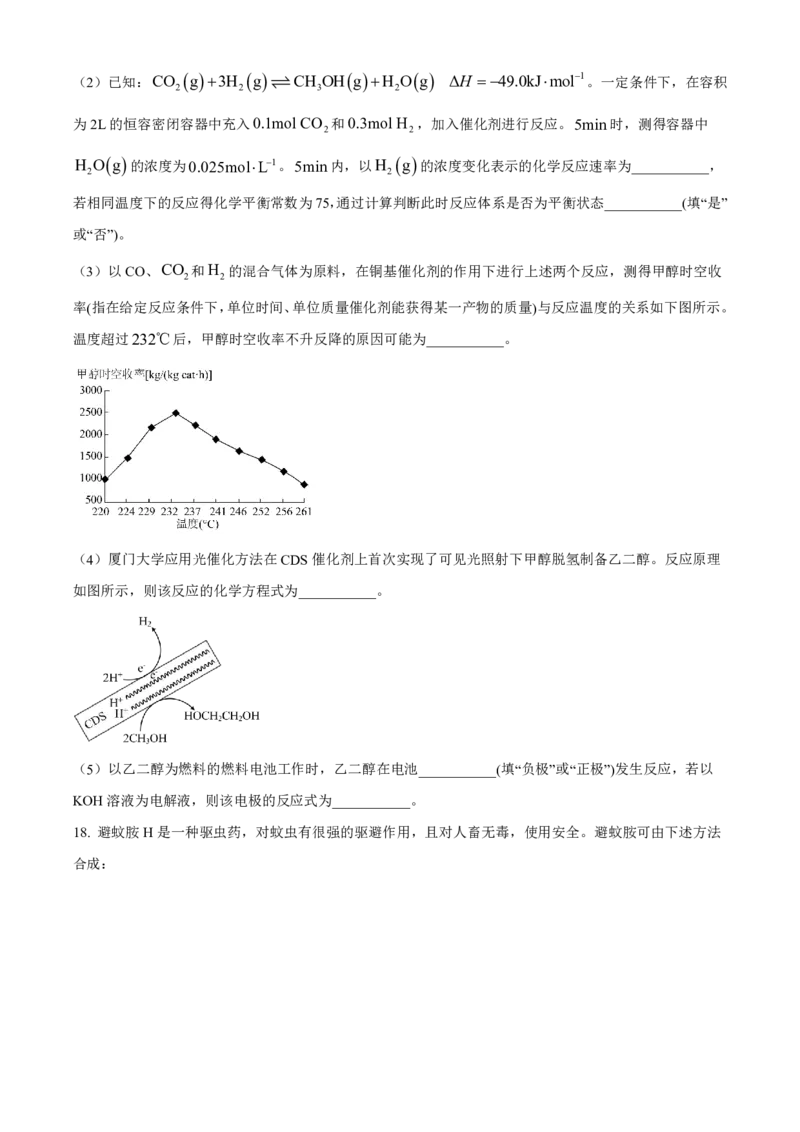
(1)CO和H 合成甲醇的能量变化如下图所示,则反应的热化学方程式为___________。1mol CO g 与
2
2mol H g 的键能之和___________(填“大于”“小于”或“等于”)1mol CH OH g 的键能之和。
2 3(2)已知:CO g 3H g CH OH g H O g ΔH 49.0kJmol1。一定条件下,在容积
2 2 3 2
为2L的恒容密闭容器中充入0.1mol CO 和0.3mol H ,加入催化剂进行反应。5min时,测得容器中
2 2
H O g 的浓度为0.025molL1。5min内,以H g 的浓度变化表示的化学反应速率为___________,
2 2
若相同温度下的反应得化学平衡常数为75,通过计算判断此时反应体系是否为平衡状态___________(填“是”
或“否”)。
(3)以CO、CO 和H 的混合气体为原料,在铜基催化剂的作用下进行上述两个反应,测得甲醇时空收
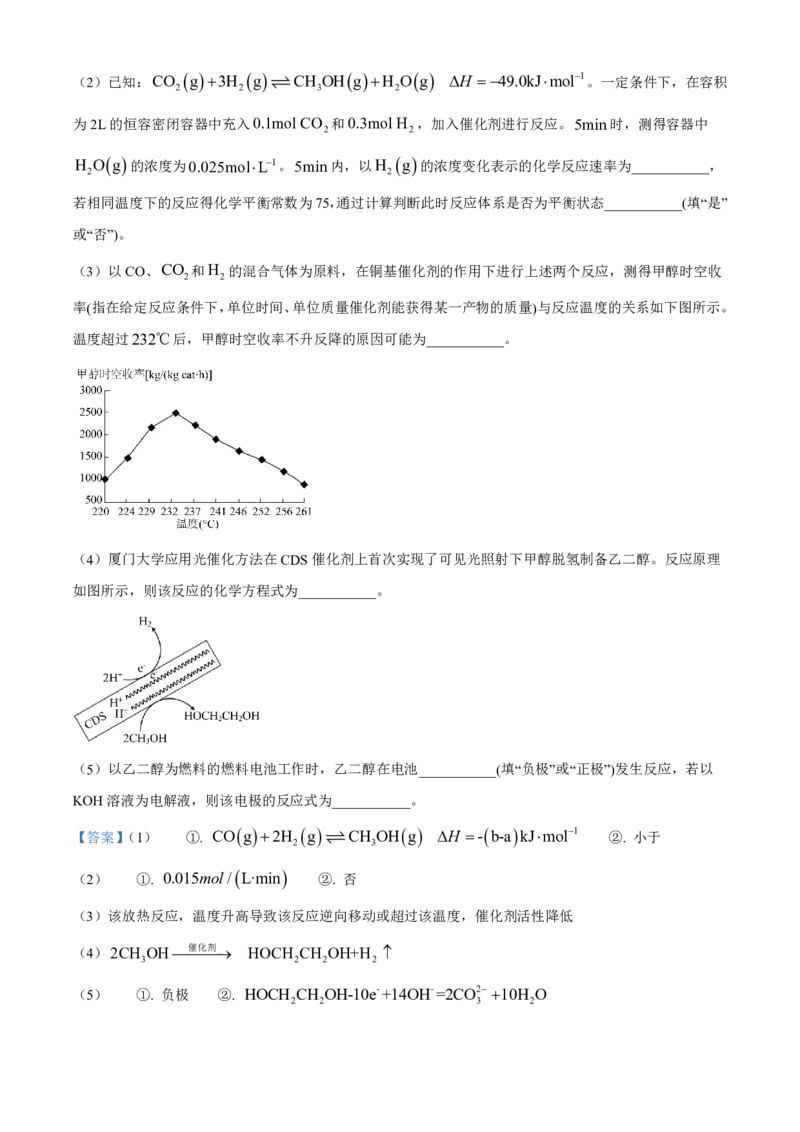
2 2
率(指在给定反应条件下,单位时间、单位质量催化剂能获得某一产物的质量)与反应温度的关系如下图所示。
温度超过232℃后,甲醇时空收率不升反降的原因可能为___________。
(4)厦门大学应用光催化方法在CDS催化剂上首次实现了可见光照射下甲醇脱氢制备乙二醇。反应原理
如图所示,则该反应的化学方程式为___________。
(5)以乙二醇为燃料的燃料电池工作时,乙二醇在电池___________(填“负极”或“正极”)发生反应,若以
KOH溶液为电解液,则该电极的反应式为___________。
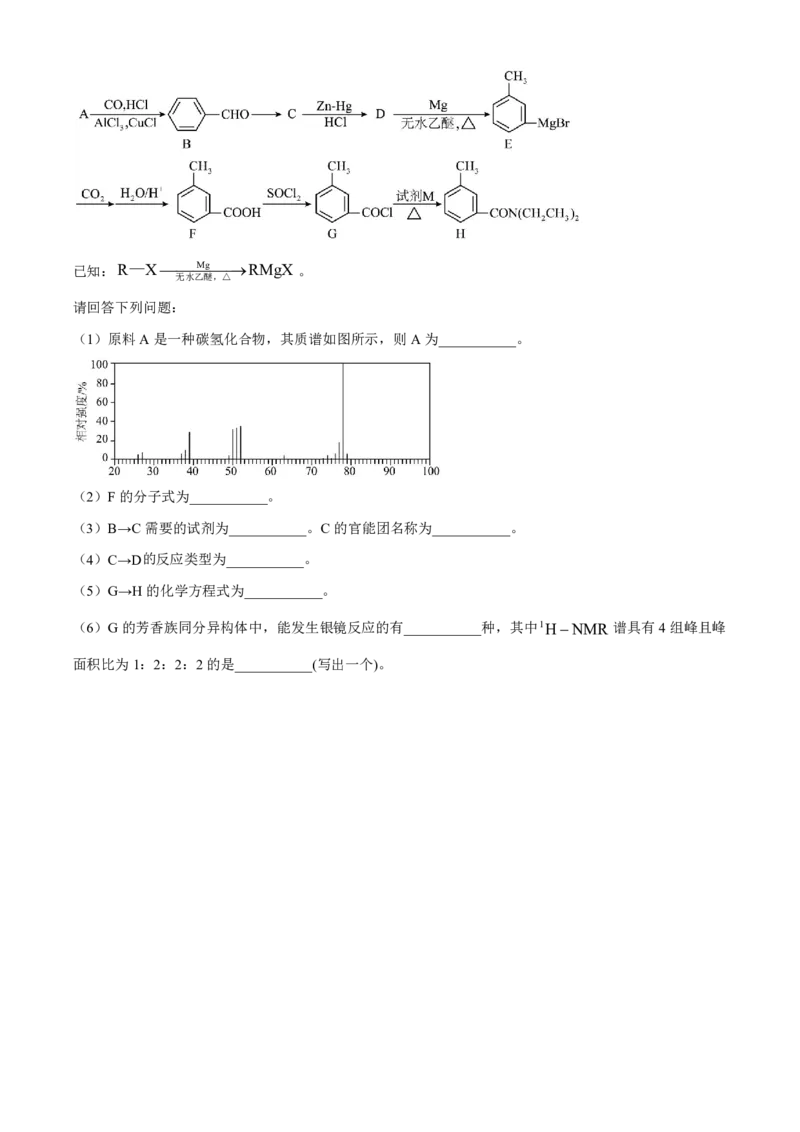
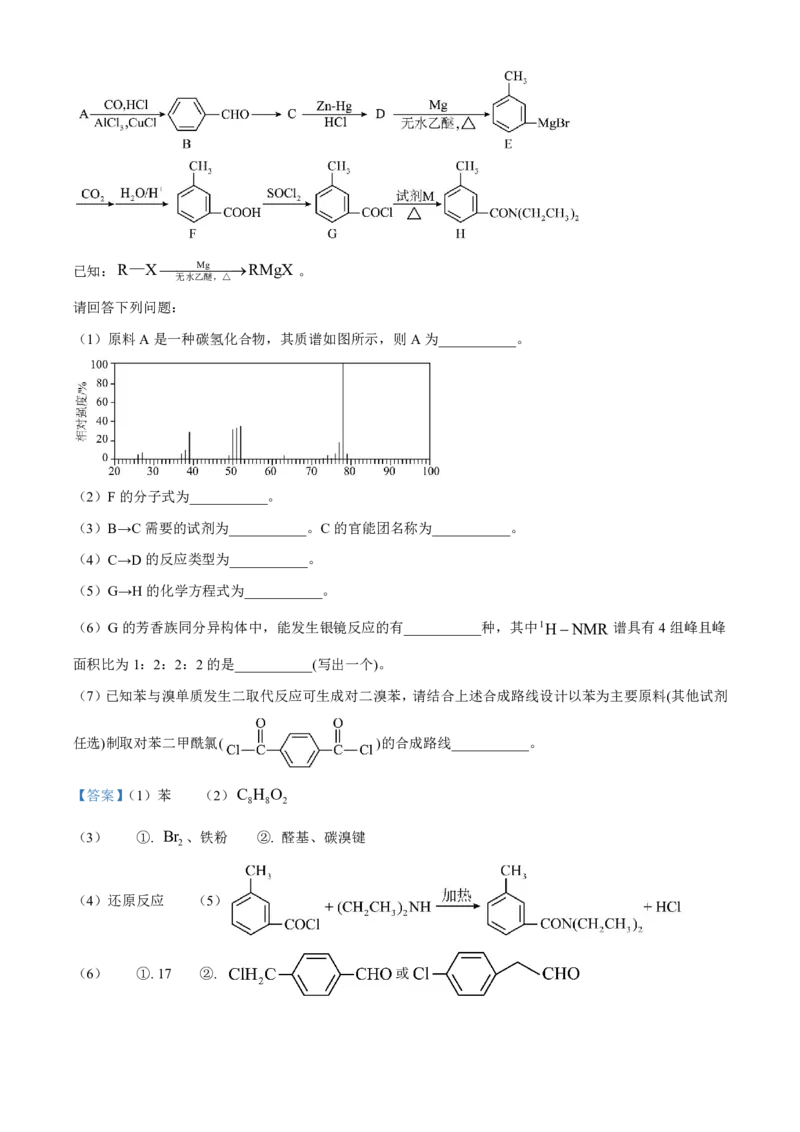
18. 避蚊胺H是一种驱虫药,对蚊虫有很强的驱避作用,且对人畜无毒,使用安全。避蚊胺可由下述方法
合成:已知:R—XMgRMgX 。
无水乙醚,△
请回答下列问题:
(1)原料A是一种碳氢化合物,其质谱如图所示,则A为___________。
(2)F的分子式为___________。
(3)B→C需要的试剂为___________。C的官能团名称为___________。
(4)C→D的反应类型为___________。
(5)G→H的化学方程式为___________。
(6)G的芳香族同分异构体中,能发生银镜反应的有___________种,其中1HNMR 谱具有4组峰且峰
面积比为1:2:2:2的是___________(写出一个)。河北省“五个一”名校联盟 2025 届高三第一次联考
化学
本试卷共8页,满分 100分,考试用时 75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写
在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:O16S32Zn65
一、选择题:本题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一
项符合题目要求。
1. 易县燕下都遗址出土的透雕龙凤纹铜铺首(如图)是战国时期青铜器,下列说法错误的是
A. 青铜是铜锡合金
B. 青铜的熔点高于纯铜
C. 青铜器表面的铜绿主要成分为Cu (OH) CO
2 2 3
D. 青铜器应保存在相对干燥的环境中
【答案】B
【解析】
【详解】A.青铜是由铜、锡等合金元素形成合金材料,因此属于青铜属于铜锡合金,A正确;
B.青铜是铜合金,合金的熔点低于成分金属,故合金青铜的熔点低于纯铜,B错误;
C.青铜器表面的铜绿是Cu、O 、H O发生反应产生的碱式碳酸铜,其主要成分为Cu (OH) CO ,C正确;
2 2 2 2 3
D.青铜器中的同单质与空气中的氧气、水发生反应产生碱式碳酸铜,因此青铜器应保存在相对干燥的环境
中,D正确;
故合理选项是B。2. 下列说法错误的是
A. 氯酸钾和硫黄不能保存在同一药品柜中
B. 硝酸银溶液应保存在棕色细口瓶中
C. 镁条着火时应使用二氧化碳灭火器灭火
D. 滴定实验中的锥形瓶不需要润洗
【答案】C
【解析】
【详解】A.氯酸钾具有氧化性,硫磺具有还原性,氧化剂和还原剂不能混放,A正确;
B.硝酸银见光会分解,储于棕色瓶中并置于暗处可以防止硝酸银见光分解,B正确;
C.镁与二氧化碳燃烧生成氧化镁和碳,会加剧火情,可使用沙土进行灭火,C错误;
D.锥形瓶内壁残留的水不会影响所加入溶液中溶质的物质的量,对滴定结果无影响,滴定实验中的锥形瓶
不需要润洗,D正确;
故选C。
3. 化学与生产、生活、能源、环境密切相关,下列说法正确的是
A. 电解氯化钾溶液可制得钾单质和氯气
B. 包装上有“OTC”标识的药物可以放心大量使用
C. 太阳能电池板的主要成分为二氧化硅
D. 含酚废水可用二氧化氯进行氧化处理
【答案】D
【解析】
【详解】A.电解氯化钾溶液可制得氢氧化钾、氯气和氢气,A错误;
B.“OTC”标识表示是非处方药,不可以过量使用,B错误;
C.太阳能电池板的成分是硅单质,光导纤维的主要成分是二氧化硅,C错误;
D.二氧化氯具有氧化性,可用于工业含酚废水的氧化处理,D正确;
答案选D。
4. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A. 1L 0.1molL1的NaHSO 溶液中含有0.1N 个SO2
3 A 3
B. 18g D O中含有10N 个中子
2 A
C 1mol共价晶体CO 中含有2N 个CO健
. 2 AD. 标准状况下11.2LHCHO中含有0.5N 个π键
A
【答案】D
【解析】
【详解】A.HSO部分电离出H+和SO2,1L 0.1molL1的NaHSO 溶液中所含SO2数目小于0.1N ,
3 3 3 3 A
A错误;
18
B.n(D O) mol0.9mol,所含中子数为9N ,B错误;
2 2216 A
C.CO 是分子晶体,不是共价晶体,C错误;
2
D.C=O中有1个π键,标准状况下11.2LHCHO的物质的量为0.5mol,含有0.5N 个π键,D正确;
A
故选D。
5. 中药材当归和白芷中提取得到的紫花前胡醇( )能提高人体免疫力。下列关于紫
花前胡醇的说法错误的是
A. 分子式为C H O
14 14 4
B. 1mol该物质最多能与5mol H 发生反应
2
C. 能使酸性高锰酸钾溶液褪色
D. 能发生水解反应
【答案】B
【解析】
【详解】A.根据紫花前胡醇的结构可知,其分子式为C H O ,A正确;
14 14 4
B.紫花前胡醇分子中,含有苯环结构和碳碳双键可以与氢气加成,因此1mol紫花前胡醇能够与4mol氢气
发生加成反应,B错误;
C.紫花前胡醇分子中含有羟基和碳碳双键,可以被酸性高锰酸钾溶液氧化而使其褪色,C正确;
D.紫花前胡醇分子中含有酯基,可以发生水解反应,D正确;
答案选B。
6. 关于物质结构的下列说法正确的是
A. HCN和SO 均为直线形分子
2
B. 基态Cr和Fe2的未成对电子数不同C. CH 和CH I分子中CH键的夹角相同
4 3
D. Na O 和C H 中均存在极性键和非极性健
2 2 2 4
【答案】B
【解析】
【详解】A.HCN中碳原子价层电子对数为2,采用sp杂化,为直线形分子;SO 中硫原子价层电子对数
2
为3,采用sp2杂化,空间结构为平面三角形,A错误;
B.Cr为第24号元素,价电子排布为3d54s1,未成对电子数为6;Fe为第26号元素,失去最外层2个电
子形成Fe2,其电子排布为3d6,未成对电子数为4,因此基态Cr和Fe2的未成对电子数不同,B正确;
C.碘原子半径远大于氢原子,使得碳碘键键长大于碳氢键,因此CH I中CH键的夹角与CH 分子中
3 4
CH键的夹角不同,C错误;
D.Na O 中过氧根离子的氧原子间为非极性键,不存在极性键,D错误;
2 2
答案选B。
7. 乙酸苯酯在一定条件下可发生如下所示的Fries重排反应,下列说法错误的是
A.X中碳原子均为sp2杂化 B.Y的熔点高于Z
C.Y在水中的溶解度大于Z D.X、Y、Z互为同分异构体
【答案】A
【解析】
【详解】A.X中甲基的碳原子以单键连接其它原子,是sp3杂化,A错误;
B.Y分子中羟基和羧基处于对位,不能形成分子内氢键,只能形成分子间氢键,而Z中羟基和羧基处于邻
位,可以形成分子内氢键,故Y的熔点高于Z,B正确;
C.Y分子中羟基和羧基处于对位,不能形成分子内氢键,更易与水形成氢键,故Y在水中的溶解度大于Z,
C正确;
D.X、Y、Z的分子式都是C H O ,结构式不同,互为同分异构体,D正确;
8 8 2
本题选A。
8. 化合物M的结构如图所示,该物质是一种抗真菌药物,用于治疗真菌性髓膜炎、真菌性呼吸道感染及黑色真菌症。已知V、W、X、Y、Z为原子半径依次增大的短周期元素,且基态W原子的最高能层无空轨道。
下列说法错误的是
A. 电负性:WXY B. 第一电离能:Y X Z
C.M中、X、Y、Z原子共平面 D.M在水中的溶解度大于在稀盐酸中
【答案】C
【解析】
【分析】由化合物M的结构可知,V为H元素,W原子的最高能层无空轨道,结合原子半径可知W为F
元素,X为O元素,Y为N元素,Z为S元素。
【详解】A.同周期元素非金属性越强电负性越大,故电负性:F>O>N;故A正确;
B.N元素2p能级为半满结构,第一电离能大于与之相邻的元素,同主族元素从上到下,第一电离能逐渐
减少,故N>O>S,故B正确;
C.化合物M含有-NH 结构,分子中原子不可能共面,故C错误;
2
D.化合物M含有-NH 结构,能与水分子形成氢键,故M在水中的溶解度大于在稀盐酸中溶解度,故D
2
正确;
故选C。
9. 下列化学实验操作能实现相应目的的是
实验操作 实验目的
溶液检验溶液中是否含有
A 向样品溶液中滴加BaCl
2
SO2
4
B 将淀粉溶液与稀硫酸共热5min,取样后滴加碘水 检验淀粉是否水解完全
向盛有等体积、等浓度双氧水的两支试管中分别滴加3滴等浓度的氯化 对比Fe3+和Cu2+对该反应的
C
铁溶液和硫酸铜溶液 催化效果
D 无水乙醇、冰醋酸和稀硫酸混合加热 制取乙酸乙酯A.A B.B C.C D.D
【答案】B
【解析】
【详解】A.向样品溶液中滴加BaCl 溶液,若反应产生白色沉淀,溶液中可能含有SO2,也可能含有Ag+,
2 4
或CO2-等,因此不能据此判断溶液中是否含有SO2,A错误;
3 4
B.淀粉与碘单质在溶液中反应使溶液变为蓝色。将淀粉溶液与稀硫酸共热5min,淀粉会发生水解反应产
生葡萄糖,然后取样后向其中滴加碘水,若溶液不变为蓝色,说明淀粉水解完全,若溶液变为蓝色,则淀
粉部分水解,故可检验淀粉是否水解完全,B正确;
C.氯化铁溶液和硫酸铜溶液的阳离子、阴离子都不相同,因此不能根据氯化铁溶液和硫酸铜溶液来对比
Fe3+和Cu2+对双氧水分解反应的催化效果,C错误;
D.无水乙醇、冰醋酸和浓硫酸混合加热发生酯化反应产生乙酸乙酯和水,而不是使用稀硫酸作该反应的催
化剂,D错误;
故合理选项是B。
10. 高锰酸钾生产过程中产生的废锰渣(主要成分为MnO 、KOH、MgO和Fe O )可用于制备MnSO 晶
2 2 3 4
体,工艺流程如图所示。
该工艺条件下金属离子开始沉淀和沉淀完全的PH如下表所示。
金属离子 Fe3 Fe2 Mn2 Mg2
开始沉淀pH 2.10 7.45 9.27 9.60
完全沉淀pH 3.20 8.95 10.87 11.13
下列说法错误的是A.“反应I”中的各反应均为非氧化还原反应
B. 滤渣Y和滤渣Z的主要成分不同
C.“反应III”加入MnO ,的目的是将溶液中的Fe2氧化为Fe3
2
D.“调pH”时,应控制溶液的pH为8.95~9.27
【答案】D
【解析】
【分析】在废锰渣中加入硫酸,其中MnO 不反应,过滤后滤渣X 的主要成分为MnO ,反应Ⅱ为 MnO
2 2 2
与硫铁矿在酸性条件下发生氧化还原反应,将硫铁矿中的硫氧化,过滤得滤渣Y为S,滤液为含硫酸铁、
硫酸锰等的溶液;反应Ⅲ中加 MnO 是为了将溶液中的Fe2彻底氧化为Fe3,加 CaCO 使得Fe3水解平
2 3
衡正向移动,而除去Fe3,滤渣Z主要是氢氧化铁沉淀,最后溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、
干燥即可得到硫酸锰产品。
【详解】A.反应Ⅰ中硫酸与金属氧化物的反应以及酸碱中和反应均不是氧化还原反应;故A正确;
B.由分析可知滤渣Y和滤渣Z主要成分不同。故B正确;
C.由分析可知反应Ⅲ加 MnO 是为了将溶液中的Fe2氧化为Fe3,故C正确;
2
D.由表中数据可知,Fe3完全沉淀的pH为3.20,Mn2+开始沉淀的pH为9.27,要使Fe3完全被除去而不
影响Mn2+ ,pH 应不低于3.20,但不高于9.27,故D错误;
故选D。
11. 硫化锌常用作分析试剂、荧光粉的基质、光导体材料等。立方硫化锌的晶胞如图所示,已知晶胞参数为
dcm,N 为阿伏加德罗常数的值。下列说法错误的是
A
A. Zn2+位于S2构成的正四面体中心 B. S2周围等距且最近的Zn2有4个
388
C. a和b之间的距离为
2
dcm D. 该硫化锌的密度为
gcm3
N ×d3
4
A
【答案】C
【解析】【详解】A.根据晶胞结构图,Zn2+位于由S2构成的正四面体空隙的中心,A正确;
B.根据晶胞结构图可知,一个S2周围等距且最近的Zn2有4个,B正确;
1 3
C.与a点S2距离最近的Zn2+位于体对角线的 处,已知晶胞参数为dcm,则a和b之间的距离为 dcm,
4 4
C错误;
1 1
D.晶胞中S2离子个数为8 +6 =4,Zn2+位于晶胞内部,个数为4,因此硫化锌的密度为
8 2
4(32+65) 388
ρ= gcm-3= gcm-3,D正确;
N d3 N d3
A A
故选C。
12. 在催化剂M和N表面发生CO 甲烷化反应的历程如图所示。已知*代表催化剂,*CO 代表CO 吸附
2 2 2
在催化剂表面,下列说法错误的是
A. CO 吸附在催化剂表面时放出热量
2
B. *CH O比*COOH稳定
2
C. 使用催化剂N时,*CO→*CHO是反应的决速步骤
D. 反应过程中,存在极性键的断裂和生成
【答案】B
【解析】
【详解】A.根据图中信息,CO 吸附在催化剂表面后能量降低,故放出热量,A正确;
2
B.根据图中信息,在催化剂N作用下,*CH O比*COOH能量高,*CH O更活泼,B错误;
2 2
C.使用催化剂N时,*CO→*CHO的活化能最大,反应速率最慢,是反应的决速步骤,C正确;D.反应过程中CO 断裂C=O键,生成CH 时有C-H键生成,因此存在极性键的断裂和生成,D正确;
2 4
故选B。
13. 汞阴极法电解饱和食盐水制取NaOH的原理如图所示。下列说法正确的是
A. 电解室中可使用铜棒做阳极
B. 电解室中汞阴极的反应为Na e Na
C. 解汞室中的反应为吸热反应
电解
D. 两室联合生产的总反应为 2NaCl 2NaCl
2
【答案】B
【解析】
【分析】由原理图可知,电解室内阳极反应为:2Cl--2e-=Cl ,阴极反应为:Na++e-=Na;解汞室内
2
发生的反应为:2Na+2H O=2NaOH+H 。
2 2
【详解】A.电解室中若使用铜棒做阳极,则发生反应Cu-2e-=Cu2+,因此不可使用铜棒做阳极,A错误;
B.根据分析,电解室中汞阴极的反应为:Na e Na,B正确;
C.解汞室中的钠与水的反应为放热反应,C错误;
电解
D.根据分析,电解室内总反应为: 2NaCl 2NaCl ,D错误;
2
故选B。
14. 常温下,向体积均为25.00mL、浓度均为0.1000molL1的一元酸HX和HY溶液中分别滴加cmolL1
的NaOH溶液,溶液pH随滴加NaOH溶液体积的变化情况如图所示。下列说法正确的是
A. c0.0800B. K
HY
103
a
C. pH7时,c
X
c
Y
D. V NaOH 10.00mL时,HY溶液中,c Na c Y
【答案】D
【解析】
【分析】由图可知,起点时HX的pH为1,说明HX为强酸,HY为弱酸;当NaOH溶液为20mL时恰好
0.0250.1
反应完,NaOH溶液的浓度c= mol/L=0.125mol/L;
0.02
【详解】A.由分析可知,c=0.125mol/L,故A错误;
c(H+)c(Y-) 103103
B.K HY =10-5,故B错误;
a c(HY) 0.1
C.pH=7时,溶液呈中性,则c(Na+) =c(Y-)、c(Na+) =c(X-),由于HY溶液中滴加NaOH至中性时溶质为
1 2
HY和NaY,即HY过量,加入的NaOH量少,即c(Na+) <c(Na+) ,所以c(X-)>c(Y-),故C错误;
1 2
D.V
NaOH
10.00mL时,HY溶液中的成分是NaY和HY等浓度的混合溶液,由图像可知,此时溶液
显酸性,根据电荷守恒,c
Na
c
Y
,故D正确;
答案选D。
二、非选择题:本题共 4小题,共 58分。
15. 硫酸四氨合铜晶体 Cu NH 3 4 SO 4 H 2 O呈深蓝色,易溶于水,难溶于乙醇、四氧化碳等有机溶剂。
常用作杀虫剂、杀菌剂、媒染剂。实验室以腐蚀电路板后的烂板液(含有Cu2、Fe2和Fe3等)为原料,制
取硫酸四氨合铜晶体的操作步骤如下:
I.将铁片放入80mL烂板液中,小火加热。反应完成后,用倾析法倒掉溶液。得到的铜粉用自来水洗干净,
抽滤,小火炒干,冷却。
Ⅱ.称取3g铜粉,放在坩埚中大火灼烧,并不断搅拌使铜粉充分被氧化,反应完成后放置冷却。
Ⅲ.在蒸发皿中加入20mL1:4的H SO 溶液,将上一步所得CuO粉末慢慢加入其中,得到蓝色溶液。
2 4
Ⅳ.将CuSO 溶液趁热抽滤,除去不溶杂质。清液转移至蒸发皿中,浓缩至液面出现结晶膜,用冷水冷却
4
令其结晶。抽滤,得到CuSO 5H O晶体。
4 2
V.称取约2.5g CuSO 5H O晶体,溶于25mL蒸馏水中,在搅拌情况下缓慢加入足量浓氨水,制得
4 2
Cu NH
3
4
SO
4
溶液,加入等体积的95%的乙醇溶液,搅拌,并观察现象。
请回答下列问题:
(1)硫酸四氨合铜在水溶液中的电离方程式为___________。
(2)步骤I中主要反应的离子方程式为___________、___________。
(3)步骤Ⅲ中,为加快CuO粉末的溶解速率,可采取的方法有___________(任意答出两条)。
(4)本实验中多次用到的抽滤操作,又称减压过滤,其装置如图所示。减压过滤的优点是___________、
沉淀更干燥,仪器X的作用是___________。
(5)步骤V制得硫酸四氨合铜的化学方程式为___________。
(6)向硫酸四氨合铜溶液中加入乙醇的目的是___________。
(7)加热硫酸四氨合铜晶体可获得红色固体、无色液体和无色气体。经实验证实,红色固体为铜单质,气
体组分为N 、NH 和SO ,反应的化学方程式为___________。
2 3 2
【答案】(1)
Cu NH
3
4
SO
4
=
Cu NH
3
4
2+ +SO
4
2-
(2) ①. Fe+Cu2+=Fe2++Cu ②. Fe+2Fe3+=3Fe2+
(3)搅拌、加热或适当增加稀硫酸浓度
(4) ①. 加速过滤 ②. 防止液体直接倒吸进入吸滤瓶
(5)CuSO +4NH H O= Cu(NH ) SO +4H O
4 3 2 3 4 4 2
(6)乙醇极性小,降低硫酸四氨合铜的溶解度,便于结晶析出
Δ
(7) 3 Cu(NH ) SO H O=3Cu+2N +8NH +3SO +9H O
3 4 4 2 2 3 2 2
【解析】
【分析】腐蚀电路板后的烂板液中含有Cu2、Fe2和Fe3,加入铁片,将Cu2、Fe3还原为Cu和Fe2,
过滤获得单质铜;将获得的铜粉氧化为CuO,加入稀H SO 反应,转化为蓝色的CuSO 溶液,结晶抽滤,
2 4 4
得到CuSO 5H O 晶体;CuSO 5H O 加水溶解并加入足量浓氨水,制得Cu NH SO 溶液,结
4 2 4 2 3 4 4晶获得Cu NH SO H O晶体。
3 4 4 2
【小问1详解】
硫酸四氨合铜在水溶液中电离生成Cu NH 2+ 和SO2-,电离方程式为:
3 4 4
Cu NH SO =Cu NH 2+ +SO2-。
3 4 4 3 4 4
【小问2详解】
根据分析,步骤I中将Cu2、Fe3还原为Cu和Fe2,主要反应的离子方程式为:Fe+Cu2+=Fe2++Cu 、
Fe+2Fe3+=3Fe2+。
【小问3详解】
步骤Ⅲ中,搅拌、加热或适当增加稀硫酸浓度,可以加快CuO粉末的溶解速率。
【小问4详解】
减压过滤可加速过滤,并使沉淀抽吸的较干燥;仪器X为安全瓶,其作用是防止液体直接倒吸进入吸滤瓶。
【小问5详解】
步骤V制得硫酸四氨合铜,其化学方程式为:CuSO +4NH H O= Cu(NH ) SO +4H O。
4 3 2 3 4 4 2
【小问6详解】
加入乙醇,可以降低硫酸四氨合铜的溶解度,便于结晶析出。
【小问7详解】
加热硫酸四氨合铜晶体可获得红色固体铜单质,无色气体N 、NH 和SO ,以及无色液体水,加热反应
2 3 2
Δ
的化学方程式为:3 Cu(NH ) SO H O=3Cu+2N +8NH +3SO +9H O。
3 4 4 2 2 3 2 2
16. 铅铋合金的主要成分为Pb、Bi、Au和少量Ag。以该合金为原料制备草酸铅的一种工艺流程如图所示。
已知,“熔化”和“制粒”两步工序的具体操作为:将铅铋合金加热熔化后,以一定流速加入水中,形成
粒径2~4mm的合金颗粒。请回答下列问题:
(1)Bi为第6周期VA族元素,其基态原子的外围电子排布式为___________,Bi在化合物中的主要化合
价为___________。
(2)“熔化”和“制粒”两步工序的目的是___________。
(3)“氧化酸浸”时,Pb转化为 CH COO Pb,反应的化学方程式为___________,浸渣的主要成分为
3 2
___________。
(4)下图分别表示醋酸初始浓度和反应温度对Pb、Bi浸出率的影响,则“氧化酸浸”时应控制的条件为
___________。
(5)“水解沉铋”时, CH COO Bi转化为CH COO OBi 沉淀,下列措施可促进该转化的是
3 3 3
___________(填标号)。
A. 升高温度 B. 增大压强 C. 加水稀释 D. 增大醋酸浓度
(6)该工艺流程中,可循环利用的物质X是___________。
【答案】(1) ①. 6s26p3 ②.+3、+5
(2)增大铅铋合金与反应物的接触面积,充分反应,提高反应速率
(3) ①. Pb+2CH COOH+H O =(CH COO) Pb+2H O ②.Au、Ag
3 2 2 3 2 2
(4)醋酸初始浓度300g/L、反应温度80℃ (5)AD
(6)醋酸
【解析】
【分析】铅铋合金的主要成分为Pb、Bi、Au和少量Ag,氧化酸浸时,双氧水氧化Pb、Bi,浸渣的主要成
分为Au、Ag;经过水解将铋元素沉淀,再加入草酸,把醋酸铅转化为草酸铅,滤液转入氧化酸浸步骤循环
利用。
【小问1详解】
Bi为第6周期VA族元素,属于氮族元素,其基态原子的外围电子排布式为6s26p3,在化合物中的主要化
合价为+3、+5。
【小问2详解】
熔化和制粒可以形成2~4mm的合金颗粒,有利于增大铅铋合金与反应物的接触面积,充分反应,提高反应速率。
【小问3详解】
氧化酸浸时,Pb被双氧水氧化为 CH COO Pb,反应的化学方程式为
3 2
Pb+2CH COOH+H O =(CH COO) Pb+2H O ;Au、Ag不参与反应,则浸渣的主要成分为Au、Ag。
3 2 2 3 2 2
【小问4详解】
根据Pb、Bi浸出率图像可知,醋酸初始浓度为300g/L时,浸出率达到最大,且随醋酸初始浓度增大,浸
出率基本不变;反应温度为80℃时,浸出率最大,且进一步升高温度,浸出率下降;因此“氧化酸浸”时应
控制的条件为醋酸初始浓度300g/L、反应温度80℃。
【小问5详解】
A.升高温度,水解为吸热反应,平衡正向移动,有利于 CH COO Bi转化为CH COO OBi 沉淀,A
3 3 3
符合题意;
B.增大压强不影响溶液体系下的水解、沉淀反应,B不符合题意;
C.加水稀释,离子浓度降低,不利于生成CH COO OBi 沉淀,C不符合题意;
3
D.增大醋酸浓度,醋酸根浓度增大,有利于生成CH COO OBi 沉淀,D符合题意;
3
答案选AD。
【小问6详解】
醋酸铅转化为草酸铅,发生复分解反应生成醋酸,因此液相中的物质X为醋酸,可转入氧化酸浸步骤循环
利用。
17. 生物质气催化合成甲醇技术是高品位生物质能转换技术之一、生物质气的主要成分为CO、CO 、H 、
2 2
N 等。对原料气进行脱氧、除焦、净化、配氢等预处理后,可用于生产甲醇。请回答下列问题:
2
(1)CO和H 合成甲醇的能量变化如下图所示,则反应的热化学方程式为___________。1mol CO g 与
2
2mol H g 的键能之和___________(填“大于”“小于”或“等于”)1mol CH OH g 的键能之和。
2 3(2)已知:CO g 3H g CH OH g H O g ΔH 49.0kJmol1。一定条件下,在容积
2 2 3 2
为2L的恒容密闭容器中充入0.1mol CO 和0.3mol H ,加入催化剂进行反应。5min时,测得容器中
2 2
H O g 的浓度为0.025molL1。5min内,以H g 的浓度变化表示的化学反应速率为___________,
2 2
若相同温度下的反应得化学平衡常数为75,通过计算判断此时反应体系是否为平衡状态___________(填“是”
或“否”)。
(3)以CO、CO 和H 的混合气体为原料,在铜基催化剂的作用下进行上述两个反应,测得甲醇时空收
2 2
率(指在给定反应条件下,单位时间、单位质量催化剂能获得某一产物的质量)与反应温度的关系如下图所示。
温度超过232℃后,甲醇时空收率不升反降的原因可能为___________。
(4)厦门大学应用光催化方法在CDS催化剂上首次实现了可见光照射下甲醇脱氢制备乙二醇。反应原理
如图所示,则该反应的化学方程式为___________。
(5)以乙二醇为燃料的燃料电池工作时,乙二醇在电池___________(填“负极”或“正极”)发生反应,若以
KOH溶液为电解液,则该电极的反应式为___________。
【答案】(1) ①. CO g 2H g CH OH g H - b-a kJmol1 ②. 小于
2 3
(2) ①. 0.015mol/ L·min ②. 否
(3)该放热反应,温度升高导致该反应逆向移动或超过该温度,催化剂活性降低
(4)2CH OH催化剂 HOCH CH OH+H
3 2 2 2
(5) ①. 负极 ②. HOCH CH OH-10e-+14OH-=2CO2 10H O
2 2 3 2【解析】
【小问1详解】
由图可知,该反应为放热反应,根据盖斯定律可知
CO g 2H g CH OH g H - b-a kJmol1,该反应为放热反应,反应物总键能-生成物总
2 3
键能<0;故答案为:CO g 2H g CH OH g H - b-a kJmol1;小于;
2 3
【小问2详解】
CO g 3H g CH OH g H O g
2 2 3 2
初始量mol/L 0.05 0.15 0 0
列三段式: 则
变化量mol /L 0.25 0.075 0.025 0.025
5min时mol/L 0.25 0.075 0.025 0.025
c 0.075mol/L 0.0250.025
vH g =0.015mol/ L·min ,此时浓度商Q 59<K,说明反
2 t 5min c 0.07530.025
应未达到平衡状态,平衡向正反应方向移动,故答案为0.015mol/ L·min ;否;
【小问3详解】
该反应为放热反应,温度升高导致该反应逆向移动,导致甲醇时空收率不升反降,也有可能是超过该温度,
导致催化剂活性降低,故答案为:该放热反应,温度升高导致该反应逆向移动或超过该温度,催化剂活性
降低;
【小问4详解】
该反应为利用甲醇合成乙二醇,反应化学方程式为:2CH OH催化剂 HOCH CH OH+H ;
3 2 2 2
【小问5详解】
燃料电池工作时,正极通入氧气,通入燃料的一端为负极,故乙二醇在电池负极发生失去电子的氧化反应,
以KOH溶液为电解液,电极产物为CO2-,故电极方程式为
3
HOCH CH OH-10e-+14OH-=2CO2 10H O,故答案为:负极;
2 2 3 2
HOCH CH OH-10e-+14OH-=2CO2 10H O。
2 2 3 2
18. 避蚊胺H是一种驱虫药,对蚊虫有很强的驱避作用,且对人畜无毒,使用安全。避蚊胺可由下述方法
合成:已知:R—XMgRMgX 。
无水乙醚,△
请回答下列问题:
(1)原料A是一种碳氢化合物,其质谱如图所示,则A为___________。
(2)F的分子式为___________。
(3)B→C需要的试剂为___________。C的官能团名称为___________。
(4)C→D的反应类型为___________。
(5)G→H的化学方程式为___________。
(6)G的芳香族同分异构体中,能发生银镜反应的有___________种,其中1HNMR 谱具有4组峰且峰
面积比为1:2:2:2的是___________(写出一个)。
(7)已知苯与溴单质发生二取代反应可生成对二溴苯,请结合上述合成路线设计以苯为主要原料(其他试剂
任选)制取对苯二甲酰氯( )的合成路线___________。
【答案】(1)苯 (2)C H O
8 8 2
(3) ①. Br 、铁粉 ②. 醛基、碳溴键
2
(4)还原反应 (5)
(6) ①.17 ②. 或(7)
【解析】
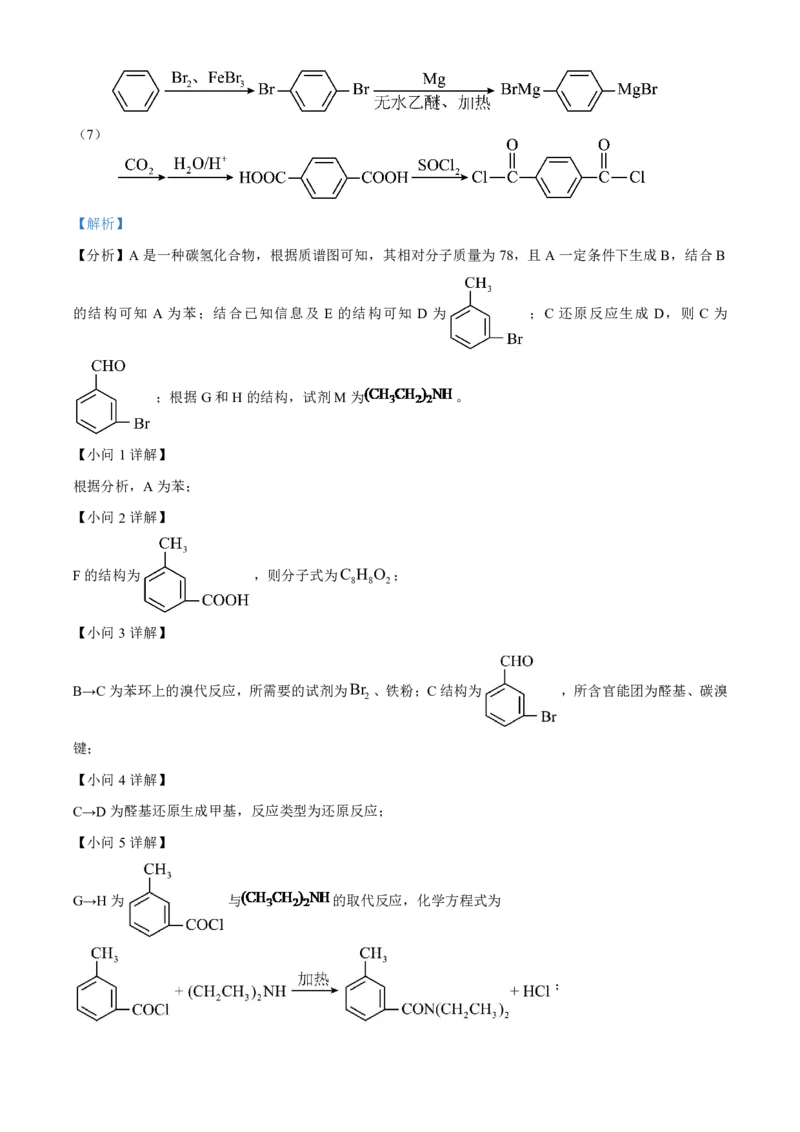
【分析】A是一种碳氢化合物,根据质谱图可知,其相对分子质量为78,且A一定条件下生成B,结合B
的结构可知 A 为苯;结合已知信息及 E 的结构可知 D 为 ;C 还原反应生成 D,则 C 为
;根据G和H的结构,试剂M为 。
【小问1详解】
根据分析,A为苯;
【小问2详解】
F的结构为 ,则分子式为C H O ;
8 8 2
【小问3详解】
B→C为苯环上的溴代反应,所需要的试剂为Br 、铁粉;C结构为 ,所含官能团为醛基、碳溴
2
键;
【小问4详解】
C→D为醛基还原生成甲基,反应类型为还原反应;
【小问5详解】
G→H为 与 的取代反应,化学方程式为
;【小问6详解】
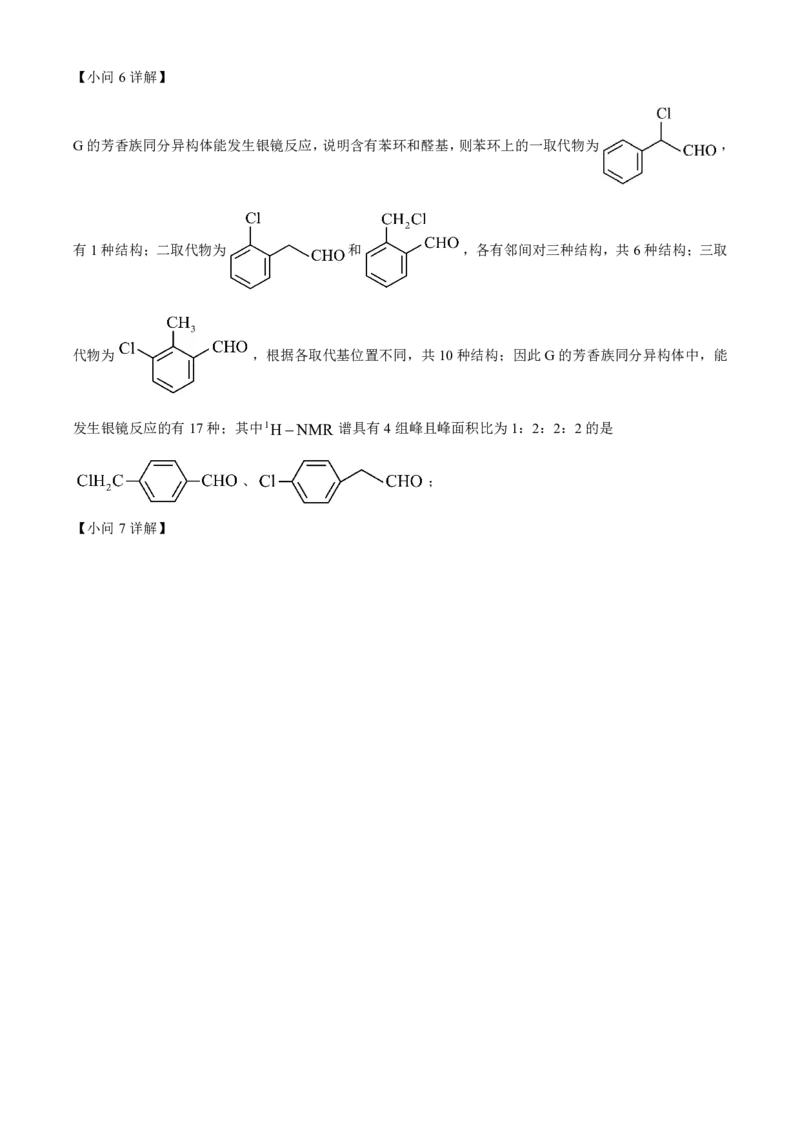
G的芳香族同分异构体能发生银镜反应,说明含有苯环和醛基,则苯环上的一取代物为 ,
有1种结构;二取代物为 和 ,各有邻间对三种结构,共6种结构;三取
代物为 ,根据各取代基位置不同,共10种结构;因此G的芳香族同分异构体中,能
发生银镜反应的有17种;其中1HNMR 谱具有4组峰且峰面积比为1:2:2:2的是
、 ;
【小问7详解】