文档内容
学年度首都师大附中 月阶段性练习
2024-2025 10
高三化学
命题人:高三化学备课组
本试卷共10页,100分。考试时长90分钟。考生务必将答案答在答题纸上,在试卷上作答无
效。考试结束后,将本试卷和答题纸一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Fe56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一项。
1. 杭州第19届亚运会使用到的材料属于无机非金属材料的是
A.“亚运莲花尊”莲花盆的青瓷 B.火炬“薪火”外壳的铝合金
C.棒垒球馆顶棚的聚四氟乙烯薄膜 D.亚运村衣橱内的由麦秸秆制成的衣架
2. 下列事实不 . 能 . 直接从原子结构角度解释的是
A.化合物ICl中I为 +1价 B.第一电离能:N>O
C.硬度:金刚石>石墨 D.热稳定性:NH >PH
3 3
3. 下列制备物质的转化关系不 . 合 . 理 . 的是
A.制HNO :N NH NO NO HNO
3 2 3 2 3
B.制H SO :S SO SO H SO
2 4 2 3 2 4
提纯 电解
C.制NaOH:海水 NaCl溶液 NaOH
电解
D.制Mg:海水 Mg(OH) MgCl 溶液 Mg
2 2
4. N 代表阿伏加德罗常数的值。下列说法正确的是
A
A.一定条件下2molSO 和1molO 充分反应后,可得到SO 的分子数为2N
2 2 3 A
B.用石灰乳完全吸收2molCl 时,转移电子的数目是4N
2 A
C.在常温常压下,44gN O与CO 混合物气体中所含的原子数目一定为3N
2 2 A
△
D. 5NH NO ====2HNO +4N +9H O反应中,生成2molHNO ,转移的电子数目为7.5N
4 3 3 2 2 3 A
第1页,共10页5. 下列各组离子在指定溶液中一定能大量共存的是
① 无色溶液中:K+、Na+、Cu2+、Cl-、SO 2-
4
② pH=13的溶液中:CO 2-、NO -、Na+、[Al(OH) ]-
3 3 4
③ 水电离出的c(H+)=10-12mol/L的溶液中:HCO -、NO -、NH +、Fe2+
3 3 4
④ 加入Al能放出H 的溶液中:Mg2+、NH +、Cl-、Na+、CO 2-
2 4 3
⑤ pH=1的溶液中:MnO -、NO -、SO 2-、Na+、Fe3+
4 3 4
A. ①③④ B.①④⑤ C.②⑤ D.③⑤
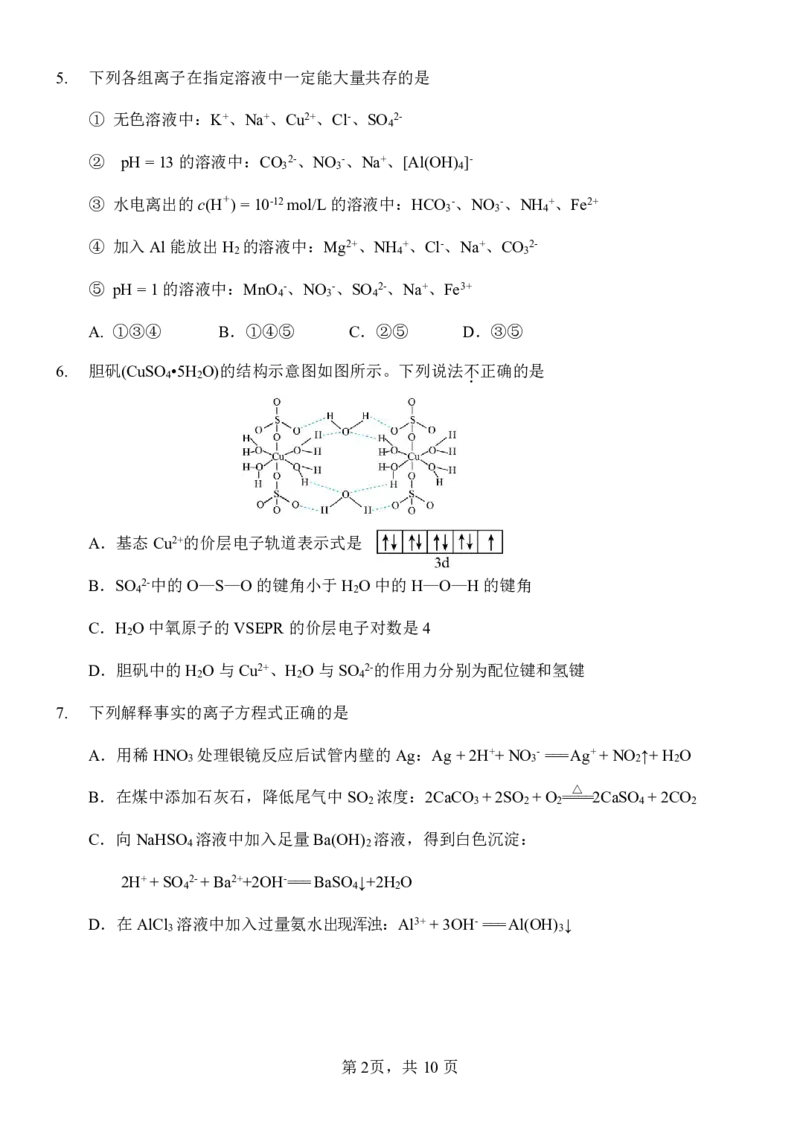
6. 胆矾(CuSO 4 •5H 2 O)的结构示意图如图所示。下列说法不 . 正确的是
A.基态Cu2+的价层电子轨道表示式是
B.SO 2-中的O—S—O的键角小于H O中的H—O—H的键角
4 2
C.H O中氧原子的VSEPR的价层电子对数是4
2
D.胆矾中的H O与Cu2+、H O与SO 2-的作用力分别为配位键和氢键
2 2 4
7. 下列解释事实的离子方程式正确的是
A.用稀HNO 处理银镜反应后试管内壁的Ag:Ag+2H++NO -===Ag++NO ↑+H O
3 3 2 2
△
B.在煤中添加石灰石,降低尾气中SO 浓度:2CaCO +2SO +O ====2CaSO +2CO
2 3 2 2 4 2
C.向NaHSO 溶液中加入足量Ba(OH) 溶液,得到白色沉淀:
4 2
2H++SO 2-+Ba2++2OH-===BaSO ↓+2H O
4 4 2
D.在AlCl 溶液中加入过量氨水出现浑浊:Al3++3OH-===Al(OH) ↓
3 3
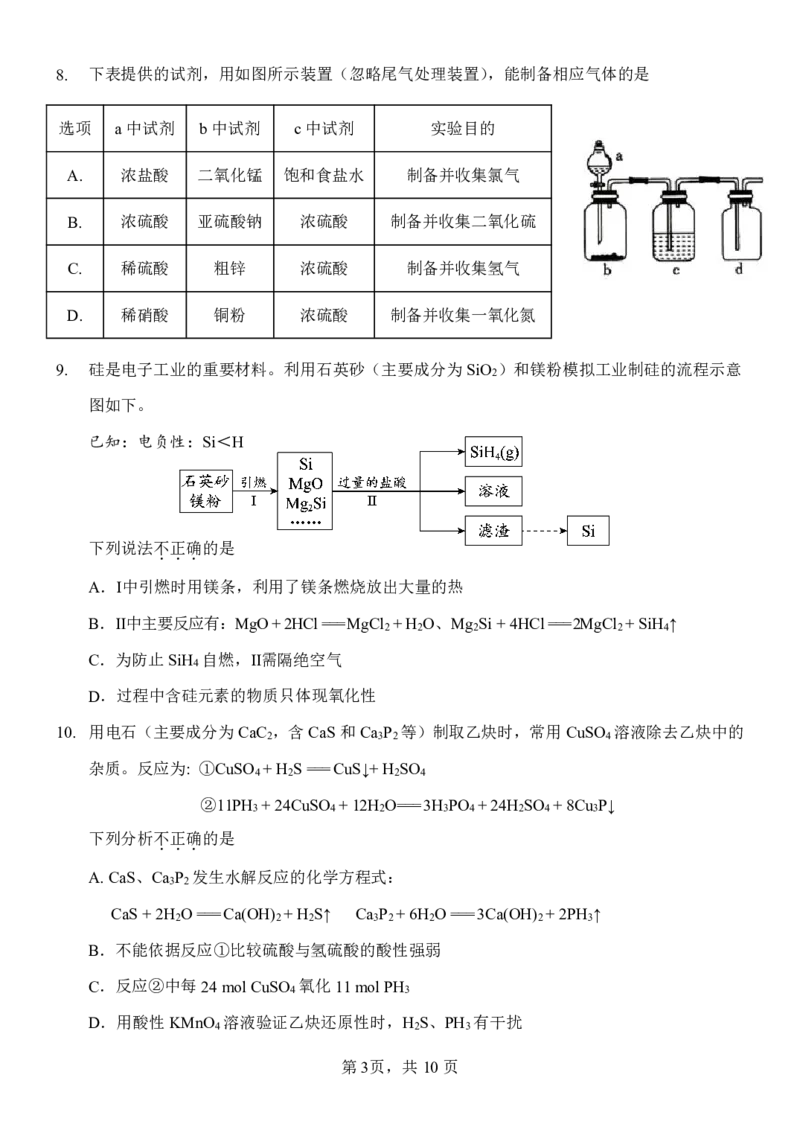
第2页,共10页8. 下表提供的试剂,用如图所示装置(忽略尾气处理装置),能制备相应气体的是
选项 a中试剂 b中试剂 c中试剂 实验目的
A. 浓盐酸 二氧化锰 饱和食盐水 制备并收集氯气
B. 浓硫酸 亚硫酸钠 浓硫酸 制备并收集二氧化硫
C. 稀硫酸 粗锌 浓硫酸 制备并收集氢气
D. 稀硝酸 铜粉 浓硫酸 制备并收集一氧化氮
9. 硅是电子工业的重要材料。利用石英砂(主要成分为SiO )和镁粉模拟工业制硅的流程示意
2
图如下。
已知:电负性:Si<H
下列说法不正确的是
...
A.Ⅰ中引燃时用镁条,利用了镁条燃烧放出大量的热
B.Ⅱ中主要反应有:MgO+2HCl===MgCl +H O、Mg Si+4HCl===2MgCl +SiH ↑
2 2 2 2 4
C.为防止SiH 自燃,Ⅱ需隔绝空气
4
D.过程中含硅元素的物质只体现氧化性
10. 用电石(主要成分为CaC ,含CaS和Ca P 等)制取乙炔时,常用CuSO 溶液除去乙炔中的
2 3 2 4
杂质。反应为: ①CuSO +H S===CuS↓+H SO
4 2 2 4
②11PH +24CuSO +12H O===3H PO +24H SO +8Cu P↓
3 4 2 3 4 2 4 3
下列分析不正确的是
...
A.CaS、Ca P 发生水解反应的化学方程式:
3 2
CaS+2H O===Ca(OH) +H S↑ Ca P +6H O===3Ca(OH) +2PH ↑
2 2 2 3 2 2 2 3
B.不能依据反应①比较硫酸与氢硫酸的酸性强弱
C.反应②中每24molCuSO 氧化11molPH
4 3
D.用酸性KMnO 溶液验证乙炔还原性时,H S、PH 有干扰
4 2 3
第3页,共10页11. ①~⑥是周期表中第二、三周期的元素,它们的主要化合价和原子半径如下表所示:
元素 ① ② ③ ④ ⑤ ⑥
主要化合价 +1 +1 +2 -2 -1 -1、+7
原子半径/nm 0.152 0.186 0.160 0.074 0.071 0.099
下列说法中正确的是
A. ①原子的半径是与它同主族的原子中最小 B. ②的氧化物中只含离子键
C. ③与⑥可以形成离子化合物 D. 非金属性④ > ⑤
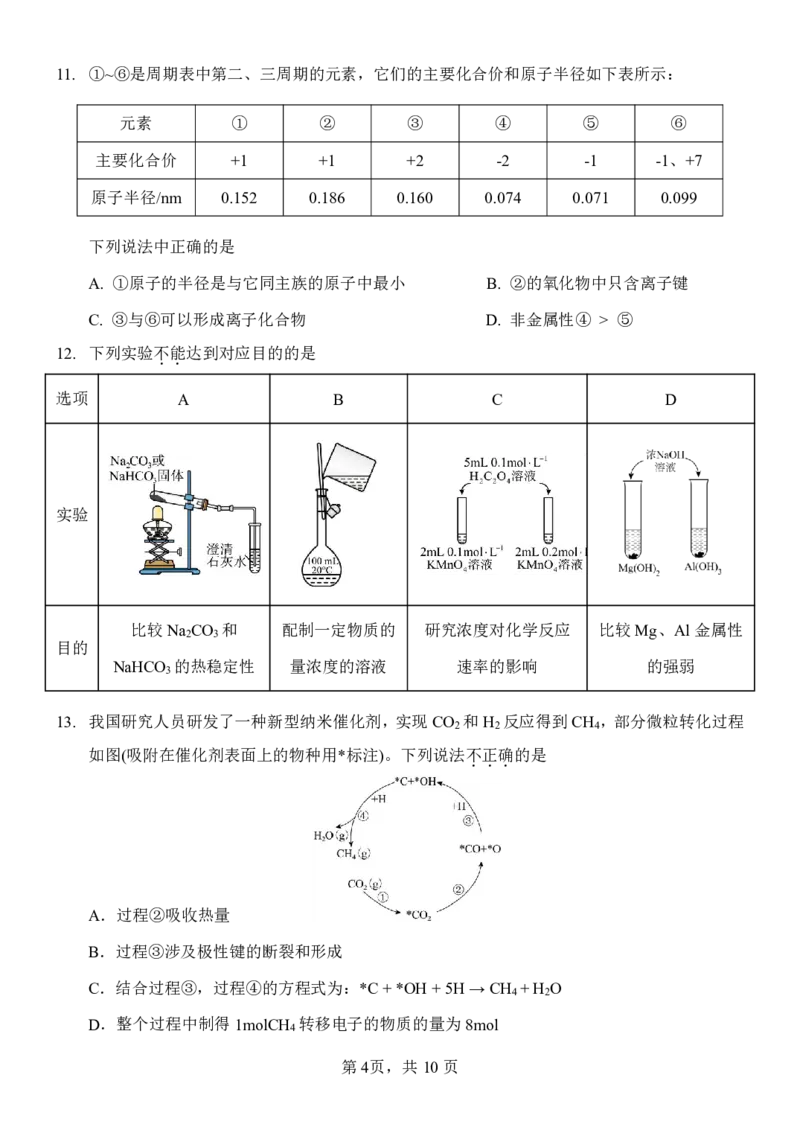
12. 下列实验不 . 能 . 达到对应目的的是
选项 A B C D
实验
比较Na CO 和 配制一定物质的 研究浓度对化学反应 比较Mg、Al金属性
2 3
目的
NaHCO 的热稳定性 量浓度的溶液 速率的影响 的强弱
3
13. 我国研究人员研发了一种新型纳米催化剂,实现CO 和H 反应得到CH ,部分微粒转化过程
2 2 4
如图(吸附在催化剂表面上的物种用*标注)。下列说法不
.
正
.
确
.
的是
A.过程②吸收热量
B.过程③涉及极性键的断裂和形成
C.结合过程③,过程④的方程式为:*C+*OH+5H→CH +H O
4 2
D.整个过程中制得1molCH 转移电子的物质的量为8mol
4
第4页,共10页14. 实验小组探究浓度对FeSO 溶液与AgNO 溶液反应的影响。实验如下:
4 3
试剂
编 沉淀物质的量之比
实验 试剂X 试剂Y
号 n(Ag SO )/n(Ag)
2 4
c(AgNO )/mol·L-1 c(FeSO )/mol·L-1
3 4
ⅰ 0.04 0.04 a
ⅱ 0.1 0.1 0.15
ⅲ 0.5 0.5 0.19
ⅳ 1.0 1.0 0.26
已知:①K (Ag SO )=1.2×10-5
sp 2 4
②取ⅰ~ⅳ充分反应后的上层清液,滴加浓盐酸均产生白色沉淀;滴加K [Fe(CN) ]溶液均产
3 6
生蓝色沉淀。下列说法不正确的是
...
A.分析 ⅰ 中数据可知:a=0
B.ⅱ 中沉淀加适量浓氨水充分反应,取上层清液滴加Ba(NO ) 溶液,产生白色沉淀
3 2
C.本实验中反应物浓度增大,对复分解反应的影响比对氧化还原反应的影响更大
D.取ⅲ中充分反应后的上层清液,滴加K [Fe(CN) ]溶液产生蓝色沉淀,可以作为
3 6
Fe2++Ag+ Ag+Fe3+为可逆反应的证据
⇌
第5页,共10页第二部分
本部分共5题,共58分
15. (12分)
自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水
消毒剂有二氧化氯(ClO )和高铁酸钾(K FeO )等。
2 2 4
(1)某研究小组用下图装置制备少量ClO (夹持装置已略去)。
2
资料:ClO 常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成
2
红棕色液体。以NaClO 和HCl的乙醇溶液为原料制备ClO 的反应为:2NaClO +4HCl=
3 2 3
2ClO ↑+Cl ↑+2NaCl+2H O。
2 2 2
① 冰水浴的作用是 。
② NaOH溶液中发生的主要反应的离子方程式为 。
(2)将ClO 水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl ,振荡、静置,
2 4
观察到 ,证明ClO 具有氧化性。
2
(3)ClO 在杀菌消毒过程中会产生副产物亚氯酸盐(ClO -),需将其转化为Cl-除去。下列
2 2
试剂中,可将ClO -转化为Cl-的是 (填字母序号)。
2
a.FeSO b.O c.KMnO d.SO
4 3 4 2
(4)K FeO 是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、
2 4
脱色、除臭等性能为一体。实验室制备K FeO 的方法如下:在冰水浴中,向KClO和
2 4
KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
① 上述制备K FeO 反应的离子方程式为 。
2 4
② 净水过程中,K FeO 起到吸附、絮凝作用的原理是 。
2 4
第6页,共10页16. (9分)
硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根(S O 2-)可看作是SO 2-中的一个O原
2 3 4
子被S原子取代的产物。
(1)基态S原子的核外电子排布式是 。
(2)比较S原子和O原子的电负性大小,从原子结构的角度说明理由: 。
(3)S O 2-的空间结构是 。
2 3
(4)同位素示踪实验可证实S O 2-中两个S原子的化学环境不同,实验过程为
2 3
过程ii中,S O 2-断裂的只有硫硫键,若过程i所用试剂是Na 32SO 和35S,过程ii含硫
2 3 2 3
产物是 。
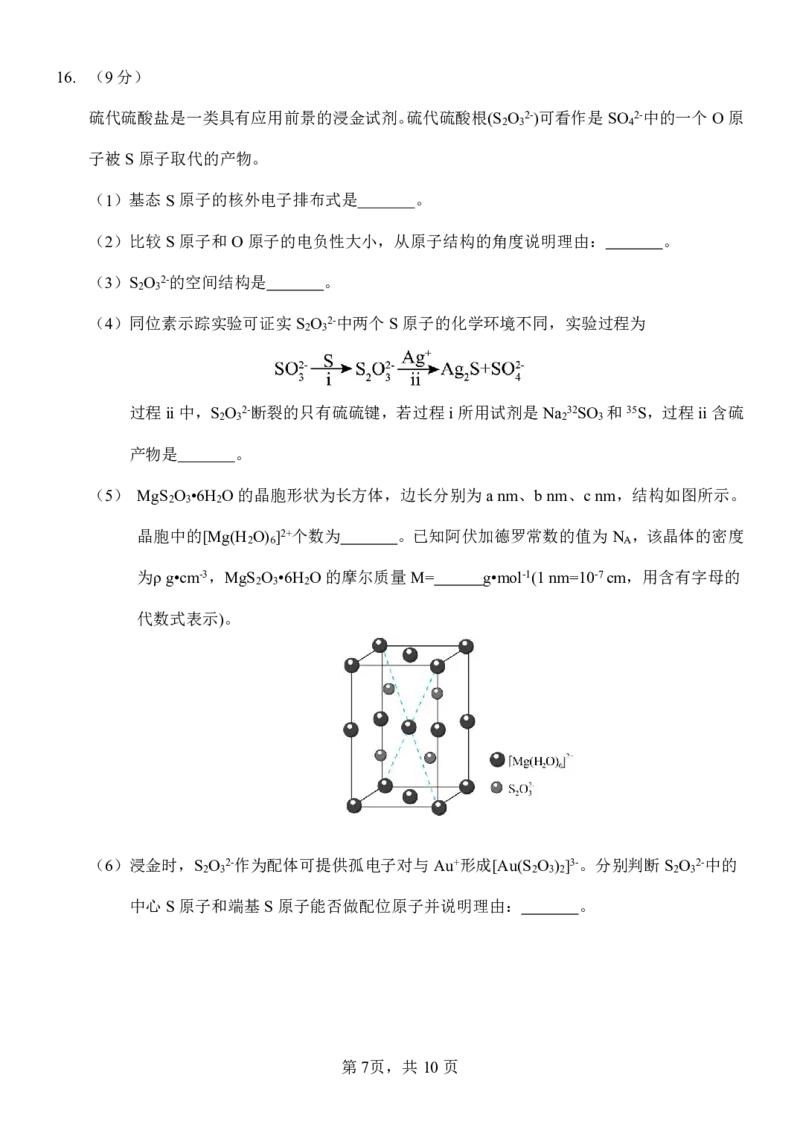
(5) MgS O •6H O的晶胞形状为长方体,边长分别为anm、bnm、cnm,结构如图所示。
2 3 2
晶胞中的[Mg(H O) ]2+个数为 。已知阿伏加德罗常数的值为N ,该晶体的密度
2 6 A
为ρg•cm-3,MgS O •6H O的摩尔质量M= g•mol-1(1nm=10-7cm,用含有字母的
2 3 2
代数式表示)。
(6)浸金时,S O 2-作为配体可提供孤电子对与Au+形成[Au(S O ) ]3-。分别判断S O 2-中的
2 3 2 3 2 2 3
中心S原子和端基S原子能否做配位原子并说明理由: 。
第7页,共10页17. (12分)
研究人员对Na SO 和Fe粉去除废水中的硝态氮进行研究。
2 3
已知:i. 某工厂排放的含氮废水中总氮=10mg·L-1,含有硝态氮(NO --N)=9.8mg·L-1、氨氮
3
(NH +-N)=0.2mg·L-1。
4
ii. 本实验中Na SO 在pH=1~3时,脱除硝态氮(转化为N )效果较强。
2 3 2
iii.Na SO 和Fe粉均可以脱除硝态氮,本实验中二者均为过量。
2 3
(1)Na SO 和Fe粉在去除废水中硝态氮的过程中表现 性(填“氧化”或“还原”)。
2 3
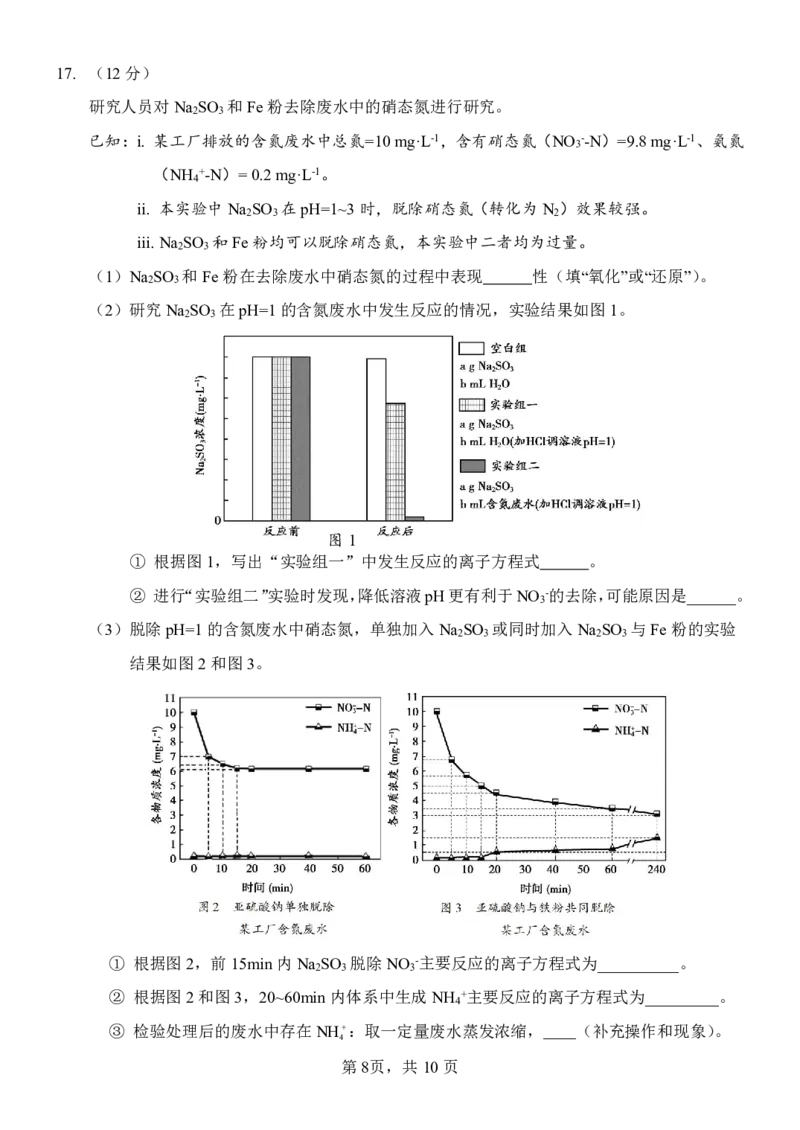
(2)研究Na SO 在pH=1的含氮废水中发生反应的情况,实验结果如图1。
2 3
图1
① 根据图1,写出“实验组一”中发生反应的离子方程式 。
② 进行“实验组二”实验时发现,降低溶液pH更有利于NO -的去除,可能原因是______。
3
(3)脱除pH=1的含氮废水中硝态氮,单独加入Na SO 或同时加入Na SO 与Fe粉的实验
2 3 2 3
结果如图2和图3。
① 根据图2,前15min内Na SO 脱除NO -主要反应的离子方程式为__________。
2 3 3
② 根据图2和图3,20~60min内体系中生成NH +主要反应的离子方程式为_________。
4
③ 检验处理后的废水中存在NH+:取一定量废水蒸发浓缩, (补充操作和现象)。
4
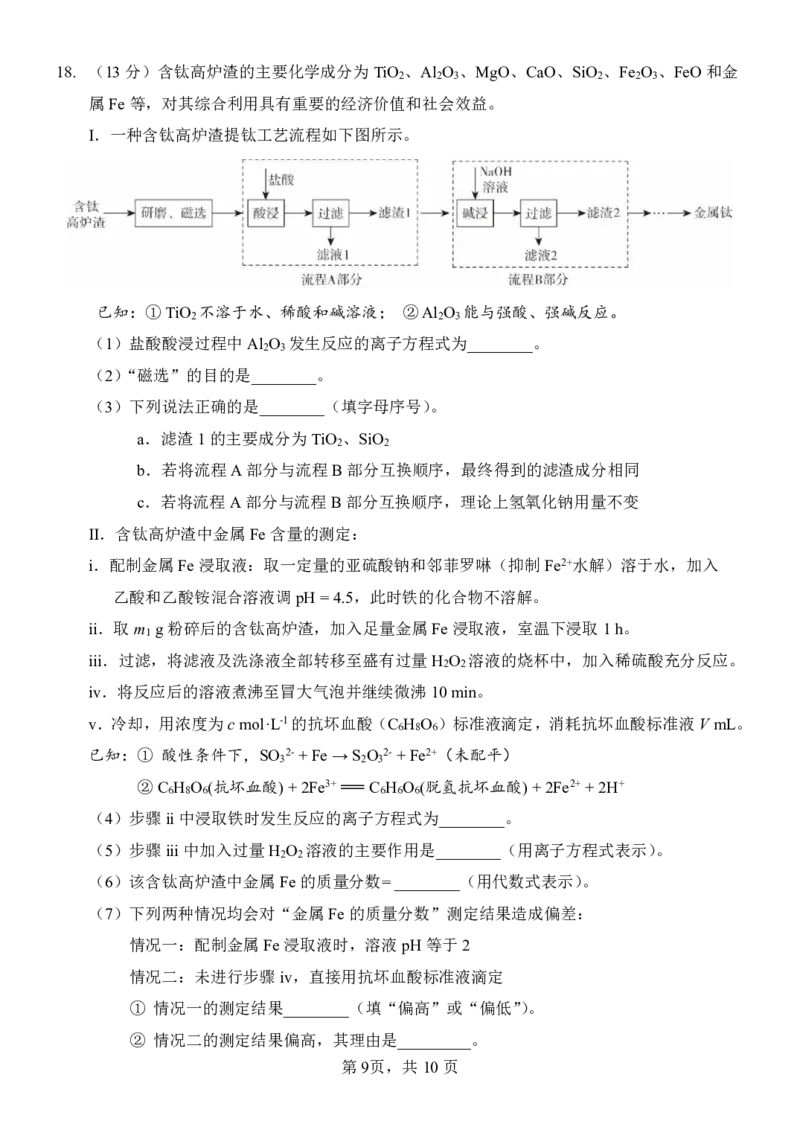
第8页,共10页18. (13分)含钛高炉渣的主要化学成分为TiO 、Al O 、MgO、CaO、SiO 、Fe O 、FeO和金
2 2 3 2 2 3
属Fe等,对其综合利用具有重要的经济价值和社会效益。
I.一种含钛高炉渣提钛工艺流程如下图所示。
已知:①TiO 不溶于水、稀酸和碱溶液; ②Al O 能与强酸、强碱反应。
2 2 3
(1)盐酸酸浸过程中Al O 发生反应的离子方程式为________。
2 3
(2)“磁选”的目的是________。
(3)下列说法正确的是________(填字母序号)。
a.滤渣1的主要成分为TiO 、SiO
2 2
b.若将流程A部分与流程B部分互换顺序,最终得到的滤渣成分相同
c.若将流程A部分与流程B部分互换顺序,理论上氢氧化钠用量不变
II.含钛高炉渣中金属Fe含量的测定:
i.配制金属Fe浸取液:取一定量的亚硫酸钠和邻菲罗啉(抑制Fe2+水解)溶于水,加入
乙酸和乙酸铵混合溶液调pH=4.5,此时铁的化合物不溶解。
ii.取m g粉碎后的含钛高炉渣,加入足量金属Fe浸取液,室温下浸取1h。
1
iii.过滤,将滤液及洗涤液全部转移至盛有过量H O 溶液的烧杯中,加入稀硫酸充分反应。
2 2
iv.将反应后的溶液煮沸至冒大气泡并继续微沸10min。
v.冷却,用浓度为cmol·L-1的抗坏血酸(C H O )标准液滴定,消耗抗坏血酸标准液VmL。
6 8 6
已知:① 酸性条件下,SO 2-+Fe→S O 2-+Fe2+(未配平)
3 2 3
②C H O (抗坏血酸)+2Fe3+=C H O (脱氢抗坏血酸)+2Fe2++2H+
6 8 6 6 6 6
(4)步骤ii中浸取铁时发生反应的离子方程式为________。
(5)步骤iii中加入过量H O 溶液的主要作用是________(用离子方程式表示)。
2 2
(6)该含钛高炉渣中金属Fe的质量分数=________(用代数式表示)。
(7)下列两种情况均会对“金属Fe的质量分数”测定结果造成偏差:
情况一:配制金属Fe浸取液时,溶液pH等于2
情况二:未进行步骤iv,直接用抗坏血酸标准液滴定
① 情况一的测定结果________(填“偏高”或“偏低”)。
② 情况二的测定结果偏高,其理由是_________。
第9页,共10页19.(12分)探究铁在某浓度H PO 和H O 的混合溶液中反应的情况,进行如下实验:
3 4 2 2
实验 操作 现象
将除去氧化膜的铁钉置于烧杯中, 一段时间后铁钉表面突然产生大量气泡,随后停止
Ⅰ 加入30mL1.0mol·L−1H PO 和 产生气泡;一段时间后再产生大量气泡,再停止,
3 4
3mL30%HO 的混合溶液(pH≈1)。 出现周而往复的现象。过程中,溶液保持澄清。
2 2
将与实验Ⅰ相同的铁钉放入烧杯中,
Ⅱ 片刻后铁钉表面持续产生气泡,溶液保持澄清。
加入30mL1.0mol·L−1H PO 和3mLH O。
3 4 2
已知:Fe (PO ) 难溶于水,Fe(H PO ) 溶于水。
3 4 2 2 4 2
(1)用85%H PO 配制100mL1.0mol·L−1H PO 所用的玻璃仪器有量筒、烧杯、玻璃棒、
3 4 3 4
胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀
HSO,振荡,静置,溶液呈红色。
2 4
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H O 氧化形成氧化膜,使聚集在
2 2
铁钉表面的H 脱离铁钉表面。
2
① 实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO 溶液后,立即测定pH,pH迅速降低。
4
② 形成氧化膜(以Fe O 计)的离子方程式是______。
2 3
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
第10页,共10页参考答案
1-5 ACDCC 6-10 BBBDC 11-14 CCCD
15. (12分) 分离Cl2 和ClO2 Cl2+2OH-=Cl-+ClO-+H2O 溶液分层,下层为紫色 ad 3ClO-+10OH-
+2Fe3+=2FeO4 2-+3Cl-+5H2O 净水过程中,FeO4 2-发挥氧化作用,被还原成Fe3+,Fe3+水解生成Fe(OH)3 胶
体,起到吸附、絮凝作用
16.(9分)(1)1s22s22p63s23p4或[Ne]3s23p4
(2)电负性O>S,O和S为同主族元素,电子层数S>O,原子半径S>O,原子核对最外层电子的吸引作
用O>S
(3)四面体形
(4) Ag2 35S、32SO4 2-
abcρN 10-21
(5)4 A
4
(6)端基S原子有孤电子对可以做配位原子,而中心S原子无孤电子对不可以做配位原子
17.(12分)(1)还原
(2) SO 3 2−+H+ =HSO 3 − c(H+)较大时,NO 3 -的氧化性较强;或增大c(H+)有利于提高SO 3 2-和NO 3 -反应速
率
2NO−+5SO2−+2H+ =N +5SO2−+H O 4Fe+NO−+10H+ =NH++4Fe2++3H O
(3) 3 3 2 4 2 3 4 2 加入浓NaOH溶液
并加热,产生能使湿润的红色石蕊试纸变蓝的气体
18.(13分)
(1)6H+ + Al O =2Al3+ + 3H O (1分)
2 3 2
(2)可除去含钛高炉渣中的单质铁,从而减少“酸浸”时盐酸的用量 (2分)
(3)a b (2分)
(4)2SO2- + 2Fe + 6CH COOH=S O2- + 2Fe2+ + 6CH COO- + 3H O
3 3 2 3 3 2
或2HSO- + 2Fe + 4CH COOH=S O2- + 2Fe2+ + 4CH COO- + 3H O (2分)
3 3 2 3 3 2
(5)2H+ + 2Fe2+ + H O=2Fe3+ + 2H O (2分)
2 2 2
(6)112𝑐𝑉 ×100% (1分)
1000𝑚1
(7)①偏高(1分)
②情况二:若未煮沸,残留H O 氧化抗坏血酸,滴定时消耗更多抗坏血酸,所以结果偏高
2 2
(注:任选一种情况作答,答案要与所选的情况相对应) (2分)
19.(每空2分,共12分)
(1)100 mL容量瓶
(2)Fe+2HPO == Fe(H PO ) +H↑
3 4 2 4 2 2
(3)未排除O 的干扰
2
(4)① 取与实验Ⅰ初始时pH和浓度均相同的H O 溶液于试管中
2 2
第1页/共2页② 2Fe2++H O+H O == FeO +4H+
2 2 2 2 3
(5)铁与磷酸反应生成H 和Fe2+,在铁钉表面Fe2+迅速被HO 氧化形成氧化膜,使聚集在铁钉表面
2 2 2
的 H 脱离铁钉表面;随后发生磷酸溶解氧化膜的慢反应,氧化膜覆盖铁钉表面时不产生气体,
2
当氧化膜溶解后,铁又与磷酸反应产生H
2
第2页/共2页