文档内容
绝密★考试结束前
2024 学年第一学期浙江省 9+1 高中联盟高三年级期中考试
化学
命题:慈溪中学 潘银聪
新昌中学 黄小莲 桐乡市高级中学 柴圣元
考生须知:
1.本卷满分 100分,考试时间 90分钟;
2.答题前,在答题卷指定区域填写班级、姓名、考场、座位号及准考证号并核对条形码信息;
3.所有答案必须写在答题卷上,写在试卷上无效,考试结束后,只需上交答题卷;
4.参加联批学校的学生可关注“启望教育”公众号查询个人成绩分析。
5.本卷可能用到的相对原子质量:H-l C-12 N-14 O-16 Na-23 P-31 S-32 Cl-35.5
Fe-56 Cu-64
一、选择题(本大题共 16题。每小题 3 分,共48分。每小题列出的四个备选项中只有一个是
符合题目要求的,不选、多选、错选均不得分)
1.[Ag(NH ) ]OH(氢氧化二氨合银)属于
3 2
A.碱 B.酸 C.盐 D.氧化物
2.下列说法不正确的是
A.ClO 具有强氧化性,能用于杀菌、消毒
2
B.Na CO 溶液呈碱性,可用作厨房油污的清洗剂
2 3
CrO2-
C.绿矾(FeSO ·7H O)有氧化性,可用于重铬酸根( 2 7 )处理剂
4 2
D.Ti-Fe合金和La-Ni合金能大量吸收H 生成金属氢化物,可用作储氢材料3.下列化学用语不正确的是
2
A.用电子云轮廓图示意P-Pπ键的形成:
B.石膏的化学式:2CaSO ·H O
4 2
C.SO 的价层电子对互斥(VSEPR)模型:
2
D.2,3,3-三甲基戊烷的键线式:
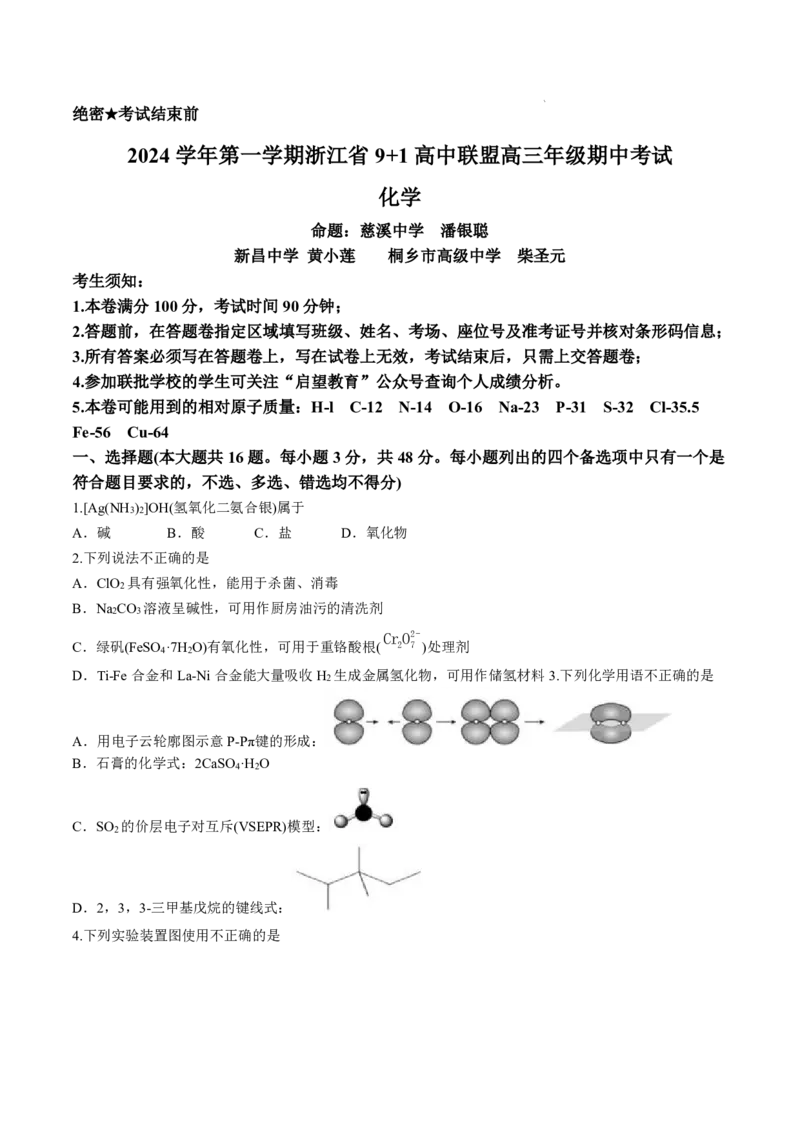
4.下列实验装置图使用不正确的是
学科网(北京)股份有限公司A.图①装置可用于测气体的体积 B.图②装置可用于胆矾晶体的分解
C.图③装置可用于测定中和热 D.装置④可用于测定醋酸的浓度
5.下列说法不正确的是
A.通过石油的裂化和裂解可以得到乙烯、丙烯、甲烷等化工原料
B.A1(OH) 、BaCO 、Mg(OH) 都能与胃酸反应可制成抗酸药
3 3 2
C.柠檬黄、碳酸氢铵、亚硝酸钠、硫酸锌和维生素C是常见的食品添加剂
D.煤、石油燃烧生成的SO 及汽车尾气排放的氮氧化合物是酸雨的主要成因6.白磷有毒,不慎沾到皮肤上
2
可用稀硫酸铜溶液解毒,可能发生如下两个反应:
①2P +20CuSO +32H O=20Cu↓+8H PO +20H SO
4 4 2 3 4 2 4
②11P +60CuSO +96H O=20X↓+24H PO +60H SO ,下列说法不正确的是
4 4 2 3 4 2 4
A.X是Cu P
3
B.H PO 均是氧化产物
3 4
C.若反应①有lmolP 参与反应,转移20mol电子
4
D.反应②中氧化剂与还原剂的物质的量之比为6:65
7.N 为阿伏加德罗常数的值。下列说法正确的是
A
A.46g14N16O 和12C16O 混合气体所含的电子数为23N
2 2 A
B.1L0.1mol/LCH;COONH溶液(pH=7)中NH,*数目为0.1NA
C.常温常压下,2.24LCH 含有的原子数大于0.5N
4 A
D.0.1mol苯中含有σ键数目为0.6N
A
8.下列反应的离子方程式正确的是
A.NaAl(OH) 溶液中通入过量CO 气体:2[Al(OH) ]-+CO =2Al(OH) ]+CO2-+H O
4 2 4 2 3 3 2
B.Na S溶液中加入稀硫酸:SO2-+3S2-+8H+=4S↓+4H O
2 4 2
C.阿司匹林与足量NaOH溶液共热: +2OH-→ +CH COO-+H O
3 2
D.硫酸酸化的KI溶液露置在空气中:4I-+O +4H+=2I +2H O
2 2 2
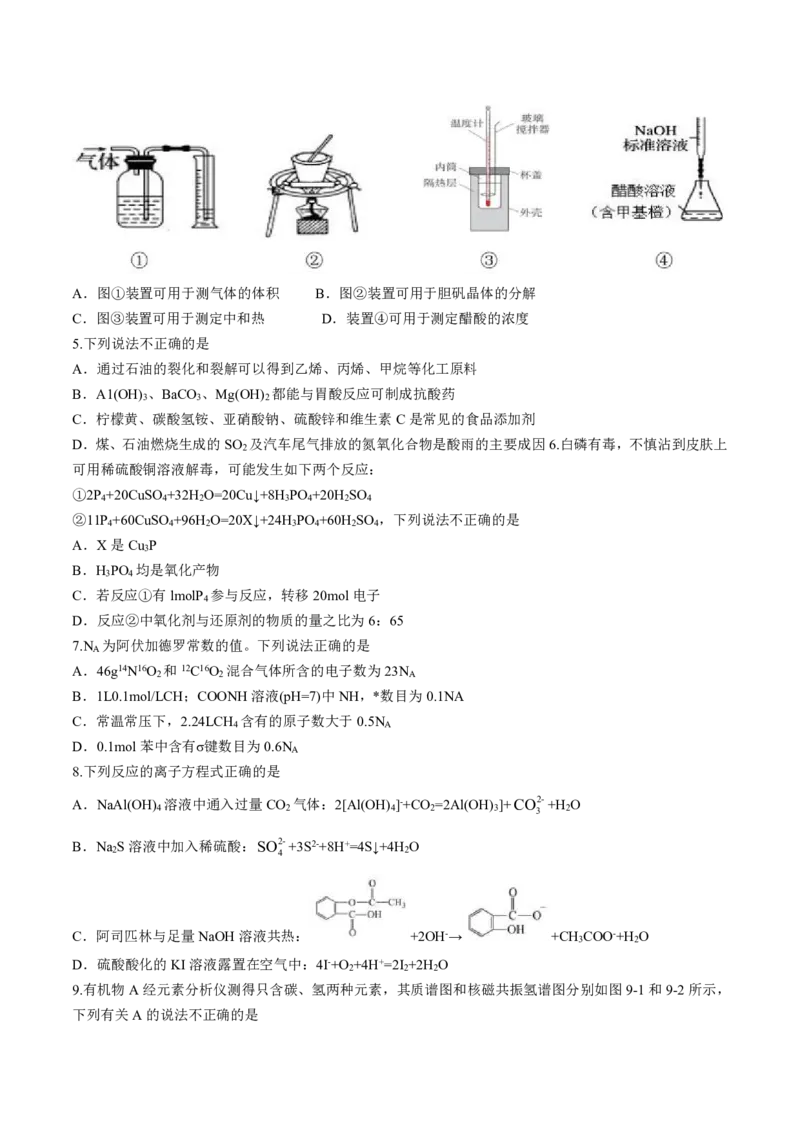
9.有机物A经元素分析仪测得只含碳、氢两种元素,其质谱图和核磁共振氢谱图分别如图9-1和9-2所示,
下列有关A的说法不正确的是
学科网(北京)股份有限公司A.分子式为C H B.不可能所有碳原子均为sp3杂化
6 12
C.可能能发生加聚反应 D.满足条件的结构共有两种
10.X、Y、Z、M是原子序数依次增大的短周期元素。其中X是宇宙中含量最多的元素;Y元素原子最高能
级的不同轨道都有电子,并且自旋方向相同;Y和z相邻;M元素原子中只有两种形状的电子云,最外层
只有一个电子。下列说法不正确的是
A.化合物M2Z:共价键成分>离子键成分B.单质熔点M>Z>X
C.原子半径:M>Y>Z>X D.YX 、X Z+空间构型均为三角锥形
3 3
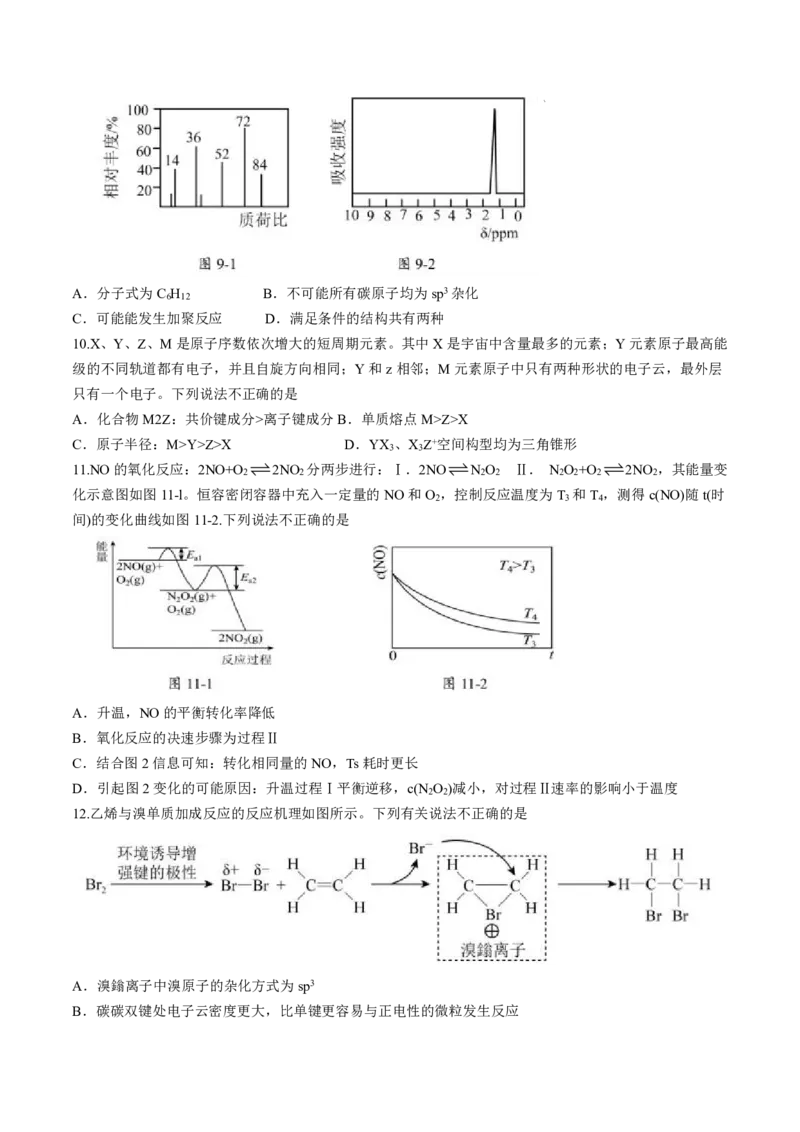
11.NO的氧化反应:2NO+O 2NO 分两步进行:Ⅰ.2NON O Ⅱ. N O +O 2NO ,其能量变
2 2 2 2 2 2 2 2
化示意图如图11-l。恒容密闭容器中充入一定量的NO和O ,控制反应温度为T 和T ,测得c(NO)随t(时
2 3 4
间)的变化曲线如图11-2.下列说法不正确的是
A.升温,NO的平衡转化率降低
B.氧化反应的决速步骤为过程Ⅱ
C.结合图2信息可知:转化相同量的NO,Ts耗时更长
D.引起图2变化的可能原因:升温过程Ⅰ平衡逆移,c(N O )减小,对过程Ⅱ速率的影响小于温度
2 2
12.乙烯与溴单质加成反应的反应机理如图所示。下列有关说法不正确的是
A.溴鎓离子中溴原子的杂化方式为sp3
B.碳碳双键处电子云密度更大,比单键更容易与正电性的微粒发生反应
学科网(北京)股份有限公司C.相同条件下乙烯分别与溴的CCl 溶液和溴水反应,速率:前者>后者
4
D.乙烯与溴水反应的产物可能包含
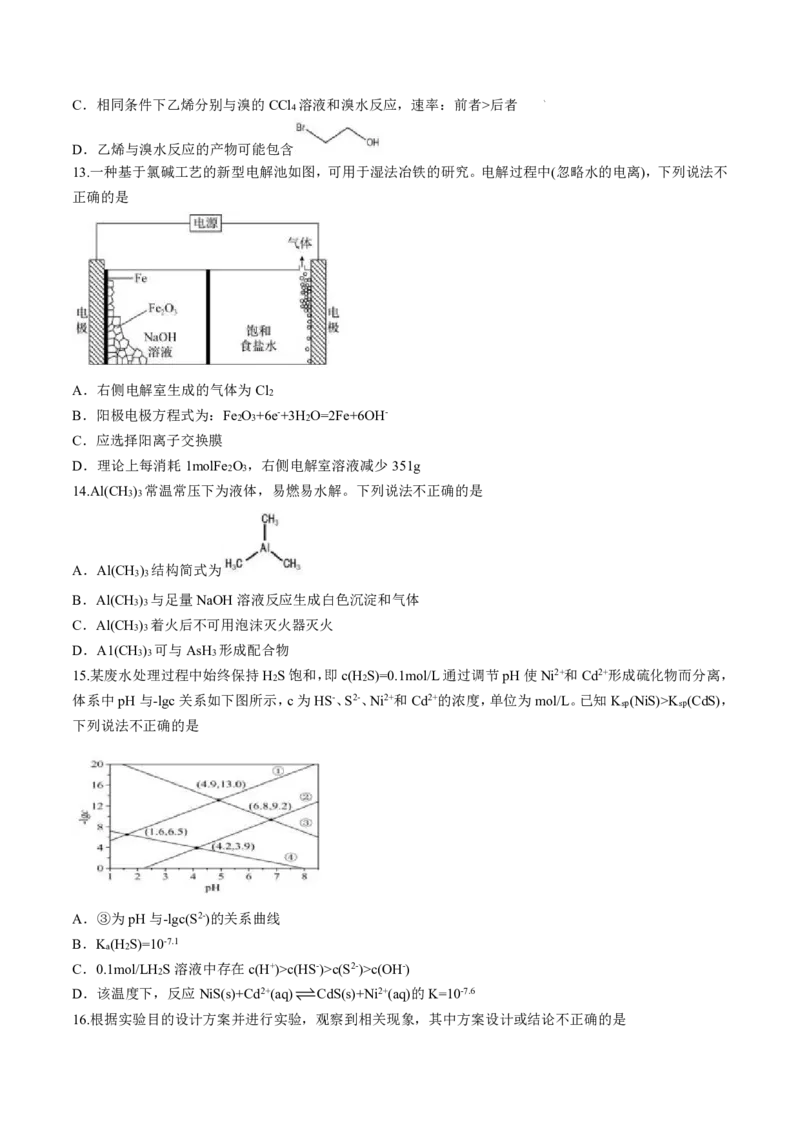
13.一种基于氯碱工艺的新型电解池如图,可用于湿法冶铁的研究。电解过程中(忽略水的电离),下列说法不
正确的是
A.右侧电解室生成的气体为Cl
2
B.阳极电极方程式为:Fe O +6e-+3H O=2Fe+6OH-
2 3 2
C.应选择阳离子交换膜
D.理论上每消耗1molFe O ,右侧电解室溶液减少351g
2 3
14.Al(CH ) 常温常压下为液体,易燃易水解。下列说法不正确的是
3 3
A.Al(CH ) 结构简式为
3 3
B.Al(CH ) 与足量NaOH溶液反应生成白色沉淀和气体
3 3
C.Al(CH ) 着火后不可用泡沫灭火器灭火
3 3
D.A1(CH ) 可与AsH 形成配合物
3 3 3
15.某废水处理过程中始终保持H S饱和,即c(H S)=0.1mol/L通过调节pH使Ni2+和Cd2+形成硫化物而分离,
2 2
体系中pH与-lgc关系如下图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol/L。已知K (NiS)>K (CdS),
sp sp
下列说法不正确的是
A.③为pH与-lgc(S2-)的关系曲线
B.K (H S)=10-7.1
a 2
C.0.1mol/LH S溶液中存在c(H+)>c(HS-)>c(S2-)>c(OH-)
2
D.该温度下,反应NiS(s)+Cd2+(aq)CdS(s)+Ni2+(aq)的K=10-7.6
16.根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确的是
学科网(北京)股份有限公司实验目的 实验设计 现象 结论
A 探究浓度对平 向2ml0.1mol/L的K Cr O 溶液中滴加 溶液由橙色变为黄色 减小生成物浓度,化
2 2 7
衡的影响 5滴6mol/LNaOH溶液 学平衡正向移动
B 比较F-与SCN- 向等物质的量浓度的KF和KSCN混 溶液颜色无明显变化 结合Fe3+的能力:
结合Fe3+的能力 合溶液中滴加几滴FeCl 溶液,振荡 F->SCN-
3
C 探究Fe2+是否有 向2mLFeCl 溶液中滴加几滴酸性 紫红色褪去 Fe2+有还原性
2
还原性 KMnO 溶液
4
D 比较Mg、Al金 分别向Mg(OH) 、Al(OH) 固体中加入 Mg(OH) 固体不溶解、 金属性:Mg>A1
2 3 2
属性强弱 过量NaOH溶液 A1(OH) 固体溶解
3
二、非选择题((本大题共 5题,共 52分)
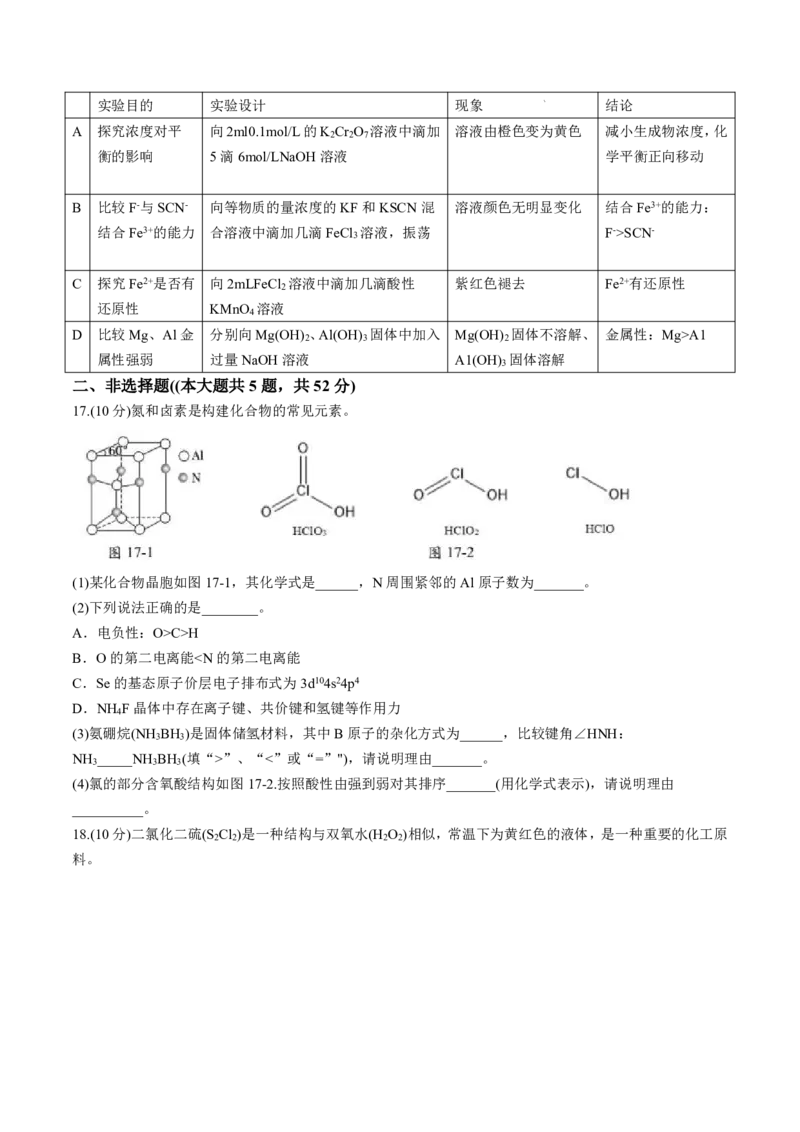
17.(10分)氮和卤素是构建化合物的常见元素。
(1)某化合物晶胞如图17-1,其化学式是______,N周围紧邻的Al原子数为_______。
(2)下列说法正确的是________。
A.电负性:O>C>H
B.O的第二电离能”、“<”或“=”"),请说明理由_______。
3 3 3
(4)氯的部分含氧酸结构如图17-2.按照酸性由强到弱对其排序_______(用化学式表示),请说明理由
__________。
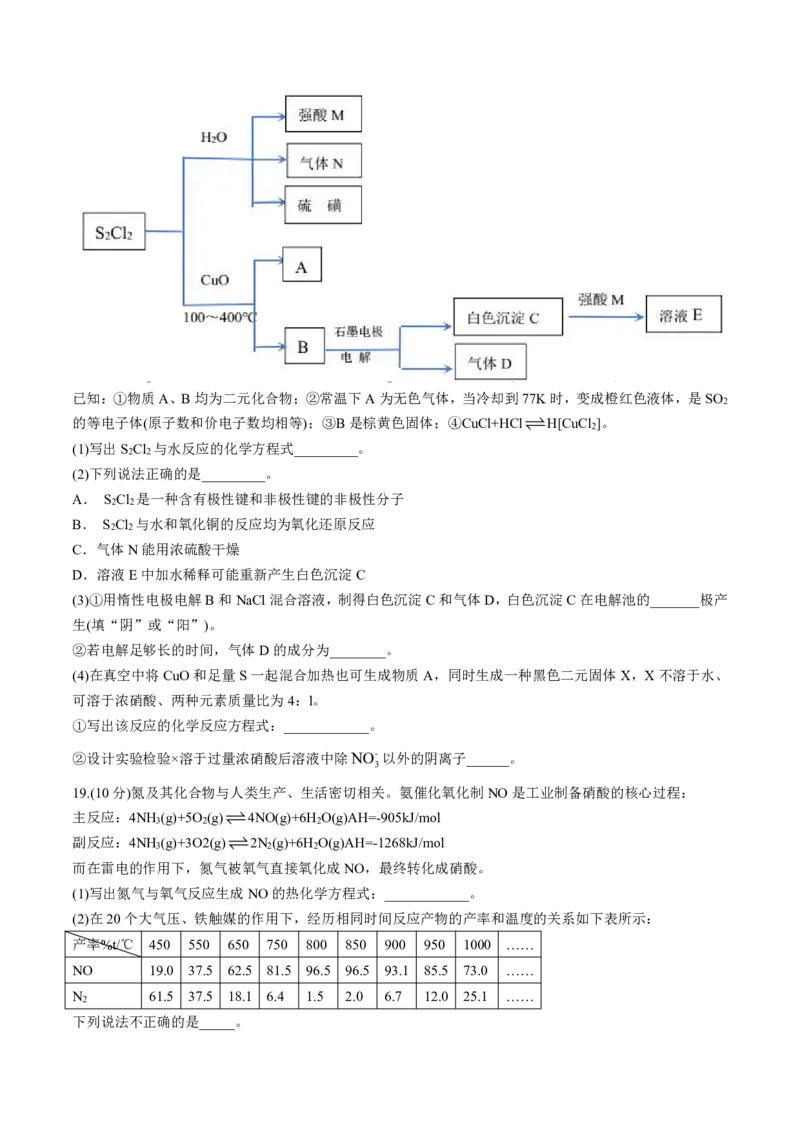
18.(10分)二氯化二硫(S Cl )是一种结构与双氧水(H O )相似,常温下为黄红色的液体,是一种重要的化工原
2 2 2 2
料。
学科网(北京)股份有限公司已知:①物质A、B均为二元化合物;②常温下A为无色气体,当冷却到77K时,变成橙红色液体,是SO
2
的等电子体(原子数和价电子数均相等);③B是棕黄色固体;④CuCl+HClH[CuCl ]。
2
(1)写出S Cl 与水反应的化学方程式_________。
2 2
(2)下列说法正确的是_________。
A. S Cl 是一种含有极性键和非极性键的非极性分子
2 2
B. S Cl 与水和氧化铜的反应均为氧化还原反应
2 2
C.气体N能用浓硫酸干燥
D.溶液E中加水稀释可能重新产生白色沉淀C
(3)①用惰性电极电解B和NaCl混合溶液,制得白色沉淀C和气体D,白色沉淀C在电解池的_______极产
生(填“阴”或“阳”)。
②若电解足够长的时间,气体D的成分为________。
(4)在真空中将CuO和足量S一起混合加热也可生成物质A,同时生成一种黑色二元固体X,X不溶于水、
可溶于浓硝酸、两种元素质量比为4:l。
①写出该反应的化学反应方程式:____________。
②设计实验检验×溶于过量浓硝酸后溶液中除NO-以外的阴离子______。
3
19.(10分)氮及其化合物与人类生产、生活密切相关。氨催化氧化制NO是工业制备硝酸的核心过程:
主反应:4NH (g)+5O (g)4NO(g)+6H O(g)AH=-905kJ/mol
3 2 2
副反应:4NH (g)+3O2(g)2N (g)+6H O(g)AH=-1268kJ/mol
3 2 2
而在雷电的作用下,氮气被氧气直接氧化成NO,最终转化成硝酸。
(1)写出氮气与氧气反应生成NO的热化学方程式:____________。
(2)在20个大气压、铁触媒的作用下,经历相同时间反应产物的产率和温度的关系如下表所示:
产率%t/℃ 450 550 650 750 800 850 900 950 1000 ……
NO 19.0 37.5 62.5 81.5 96.5 96.5 93.1 85.5 73.0 ……
N 61.5 37.5 18.1 6.4 1.5 2.0 6.7 12.0 25.1 ……
2
下列说法不正确的是_____。
学科网(北京)股份有限公司A.工业上进行氨催化氧化生成NO时,温度应控制在800C~850℃
B.活化能大小:主反应≤副反应
C.降温降压一定能提高NO的平衡产率
D.选择合适的催化剂,可以提高NO的选择性
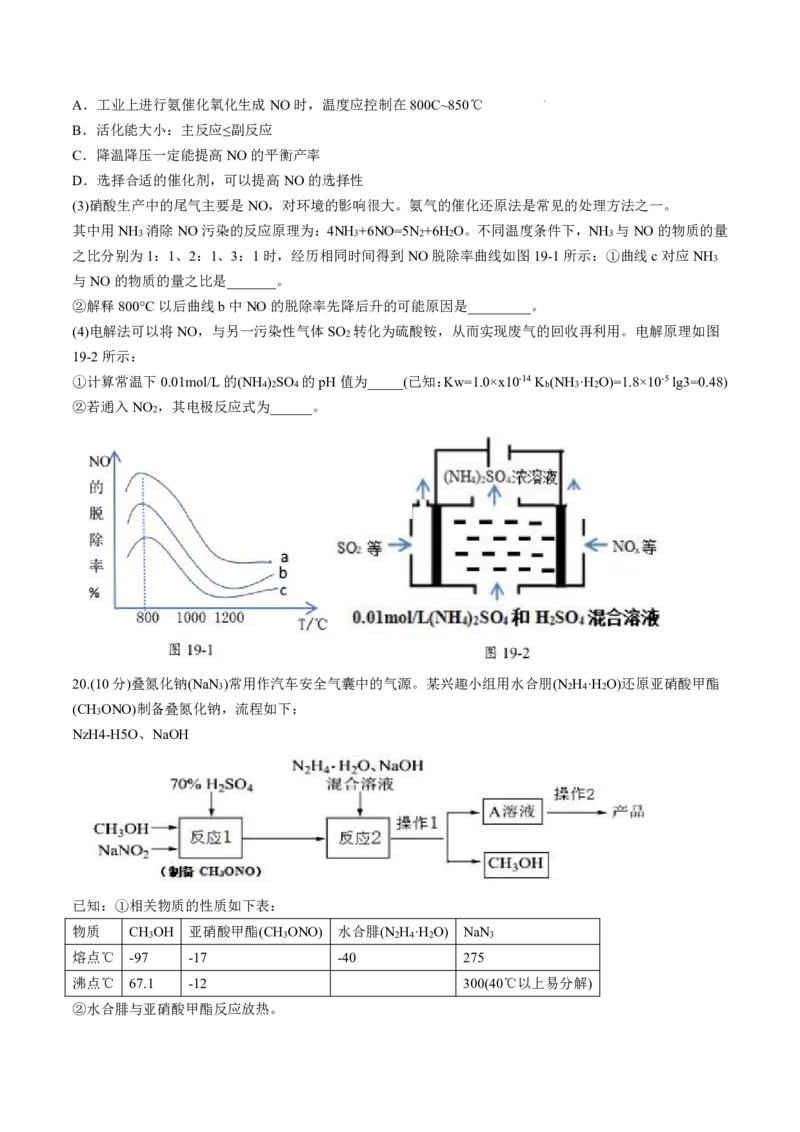
(3)硝酸生产中的尾气主要是NO,对环境的影响很大。氨气的催化还原法是常见的处理方法之一。
其中用NH 消除NO污染的反应原理为:4NH +6NO=5N +6H O。不同温度条件下,NH 与NO的物质的量
3 3 2 2 3
之比分别为1:1、2:1、3:1时,经历相同时间得到NO脱除率曲线如图19-1所示:①曲线c对应NH
3
与NO的物质的量之比是_______。
②解释800°C以后曲线b中NO的脱除率先降后升的可能原因是_________。
(4)电解法可以将NO,与另一污染性气体SO 转化为硫酸铵,从而实现废气的回收再利用。电解原理如图
2
19-2所示:
①计算常温下0.01mol/L的(NH ) SO 的pH值为_____(已知:Kw=1.0×x10-14K (NH ·H O)=1.8×10-5lg3=0.48)
4 2 4 b 3 2
②若通入NO ,其电极反应式为______。
2
20.(10分)叠氮化钠(NaN )常用作汽车安全气囊中的气源。某兴趣小组用水合朋(N H ·H O)还原亚硝酸甲酯
3 2 4 2
(CH ONO)制备叠氮化钠,流程如下:
3
NzH4-H5O、NaOH
已知:①相关物质的性质如下表:
物质 CH OH 亚硝酸甲酯(CH ONO) 水合腓(N H ·H O) NaN
3 3 2 4 2 3
熔点℃ -97 -17 -40 275
沸点℃ 67.1 -12 300(40℃以上易分解)
②水合腓与亚硝酸甲酯反应放热。
学科网(北京)股份有限公司(1)写出反应2的化学方程式__________。
(2)下列说法正确的是__。
A.为控制反应2的温度,可采用冷水浴或缓慢通入CH ONO气体
3
B.操作2包含蒸发结晶、趁热过滤、洗涤、低温干燥等步骤
C.为加快反应1速率,可用98%浓硫酸替代70%硫酸
D.可用重结晶法提纯NaN 粗产品
3
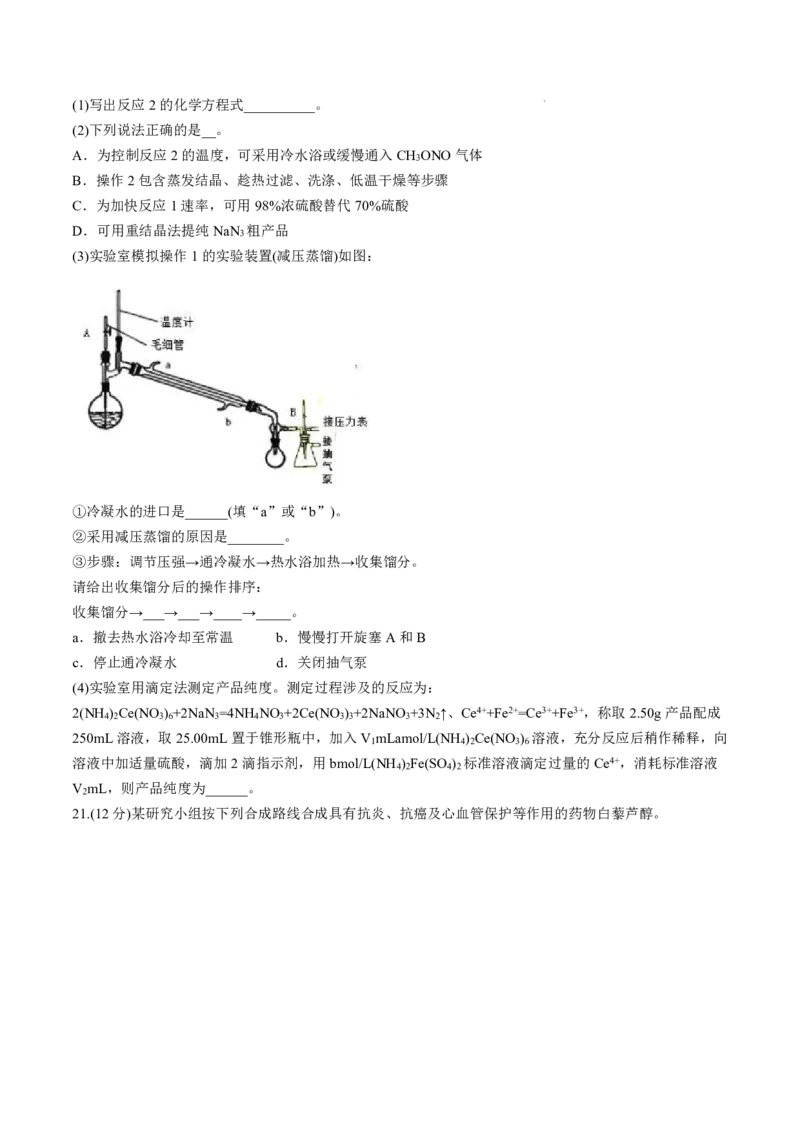
(3)实验室模拟操作1的实验装置(减压蒸馏)如图:
①冷凝水的进口是______(填“a”或“b”)。
②采用减压蒸馏的原因是________。
③步骤:调节压强→通冷凝水→热水浴加热→收集馏分。
请给出收集馏分后的操作排序:
收集馏分→___→___→____→_____。
a.撤去热水浴冷却至常温 b.慢慢打开旋塞A和B
c.停止通冷凝水 d.关闭抽气泵
(4)实验室用滴定法测定产品纯度。测定过程涉及的反应为:
2(NH ) Ce(NO ) +2NaN =4NH NO +2Ce(NO ) +2NaNO +3N ↑、Ce4++Fe2+=Ce3++Fe3+,称取2.50g产品配成
4 2 3 6 3 4 3 3 3 3 2
250mL溶液,取25.00mL置于锥形瓶中,加入V mLamol/L(NH ) Ce(NO ) 溶液,充分反应后稍作稀释,向
1 4 2 3 6
溶液中加适量硫酸,滴加2滴指示剂,用bmol/L(NH ) Fe(SO ) 标准溶液滴定过量的Ce4+,消耗标准溶液
4 2 4 2
V mL,则产品纯度为______。
2
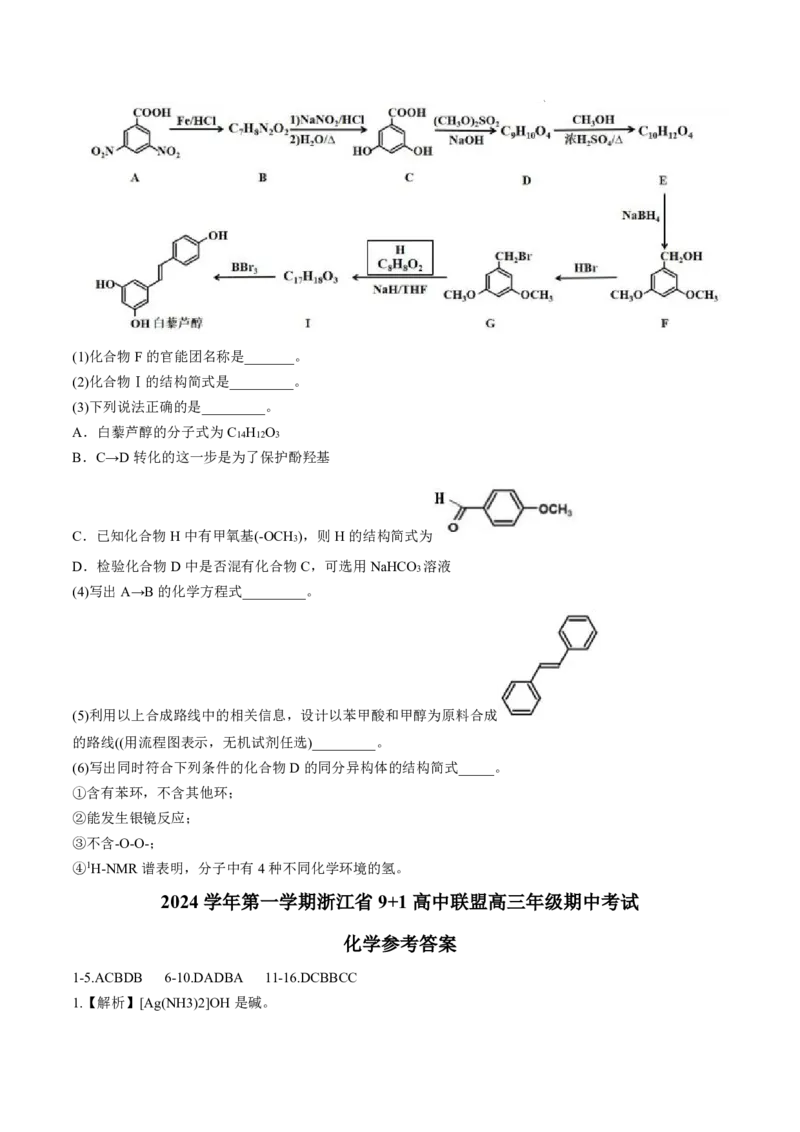
21.(12分)某研究小组按下列合成路线合成具有抗炎、抗癌及心血管保护等作用的药物白藜芦醇。
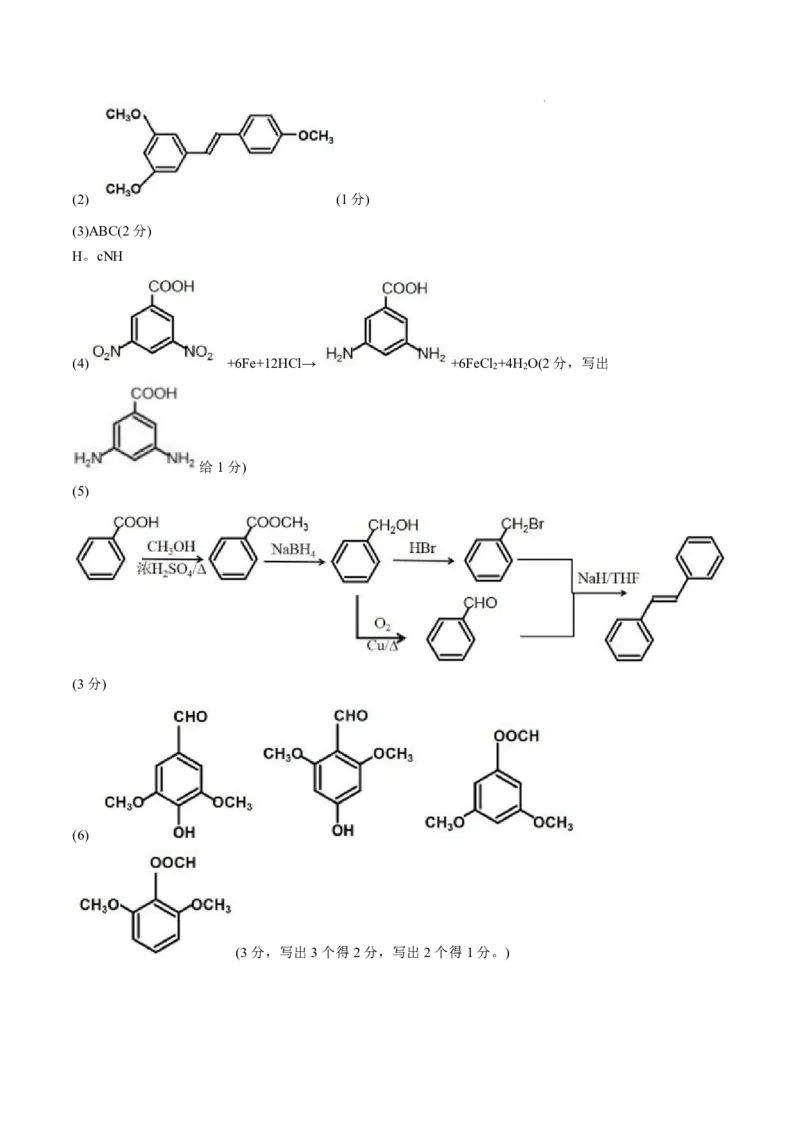
学科网(北京)股份有限公司(1)化合物F的官能团名称是_______。
(2)化合物Ⅰ的结构简式是_________。
(3)下列说法正确的是_________。
A.白藜芦醇的分子式为C H O
14 12 3
B.C→D转化的这一步是为了保护酚羟基
C.已知化合物H中有甲氧基(-OCH ),则H的结构简式为
3
D.检验化合物D中是否混有化合物C,可选用NaHCO 溶液
3
(4)写出A→B的化学方程式_________。
(5)利用以上合成路线中的相关信息,设计以苯甲酸和甲醇为原料合成
的路线((用流程图表示,无机试剂任选)_________。
(6)写出同时符合下列条件的化合物D的同分异构体的结构简式_____。
①含有苯环,不含其他环;
②能发生银镜反应;
③不含-O-O-;
④1H-NMR谱表明,分子中有4种不同化学环境的氢。
2024 学年第一学期浙江省 9+1 高中联盟高三年级期中考试
化学参考答案
1-5.ACBDB 6-10.DADBA 11-16.DCBBCC
1.【解析】[Ag(NH3)2]OH是碱。
学科网(北京)股份有限公司2.【解析】绿矾有还原性。
3.【解析】石膏的化学式:CaSO ·2H O
4 2
4.【解析】指示剂应选择酚酞。
5.【解析】BaCO 能与胃酸反应而引起中毒。
3
6.【解析】反应②中氧化剂与还原剂的物质的量之比为65:6.
7.【解析】B中NH+有部分水解数目小于0.1N ;C中常温常压下,气体摩尔体积大于22.4L/mol;D中o
4 A
键有碳碳键和碳氢键共1.2N
A.
8.【解析】A中过量CO 应生成HCO- ;B中稀硫酸不具备强氧化性,不能与S2-发生归中反应;C中酚羟
2 3
基能与NaOH反应。
9.【解析】结合信息可知分子式为C H ,结构只有 或(CH ) C=C(CH ) 两种可能,满足所有碳原子为sp3
6 12 3 2 3 2
杂化,故B错误。
10.【解析】推知X、Y、Z、M分别为H、N、O、Na元素;Na O为离子化合物,离子键成分大于共价键,
2
故A错误。
11.【解析】根据能量图可知过程I H<0,升温平衡逆移,转化率降低,故A正确;活化能Ea1K (CdS),
sp sp
即当c(S2-)相同时,c(Ni2+)>c(Cd2+),由此可知曲线①代表Cd2+、②代表Ni2+、③代表S2-,④代表HS-,故A
正确;选择点(4.2,3.9),可知c(H+)=10-4.2mol/L,c(HS-)=10-3.9mol/L,c(H S)=0.1mol/L,则有
2
c(H+)c(HS-) 10-4.2mol/L10-3.9mol/L
K (H S)= = 107.1,故B正确;已知
a1 2
c(H S) 0.1mol/L
2
c(H+)c(HS-) c(H+)c(S2-) c2(H+)c(S2-)
K ∙K = ,由曲线③两点坐标可知,当c(H+)=10-4.9mol/L时,
a1 a2
c(H S) c(HS-) c(H S)
2 2
c(S2-)=10-13mol/L,或者当c(H+)==10-6.8mol/L时,c(S2-)=10-9.23mol/L,故有
学科网(北京)股份有限公司c2(H+)c(S2-) (104.9mol/L)21013mol/L (106.8mol/L)2109.2mol/L
c(H S) 0.1mol/L 0.1mol/L
2
=10-21.8,故有K (H S)≈10-14.7,则c(S2-)≈10-14.7,根据K H S)结合三段式计算溶液中c(H+)≈10-4,c(OH-)≈10-10,
a2 2 a1( 2
Ksp NiS
则c(OH-)>c(S2-),故C错误;根据计算可知Ksp(CdS)=10-26,Kg(NiS)=10-18.4,可知K= =107.6,
Ksp CdS
故D正确。
16.【解析】Cl-也能使酸性高锰酸钾褪色,对Fe2+造成干扰故C错误。17.(1)AlN(1分);4(1分)
(2)AD(2分)
(3)sp3(l分);<(1分);NH 中有孤对电子,孤对电子对成键电子排斥力大,键角变小(1分)
3
(4)HClO >HClO>HClO(1分);氧电负性强于氯,氯氧双键数目越多,羟基的极性越大,越容易电离出H+,
3
酸性越强。(其他合理答案也可取,2分)。
【解析】
(2)О的第二电离能>N的第二电离能,故B错误;Se基态原子价层电子排布式为4s24p2,故C错误。
(3)NH BH 中存在N与B原子配位键,故为sp3杂化。
3 3
18.(1)2S Cl +2H O=4HCl↑+SO2↑+3S↓(2分)
2 2 2
(2)CD(2分)
(3)①阴(1分)
②Cl 、O 、H (1分)
2 2 2
Δ
(4)①2CuO+5S 2S O+Cu S(2分)
2 2
②取反应后的溶液加入氯化钡溶液,若生成白色沉淀,则含有SO2-(其他合理答案也可取,2分)。
4
【解析】根据信息,流程图中的各物质为A:S O B:CuCl C:CuCl D:Cl (O 、H )E:HCuCl M:
2 2 2 2 2 2
盐酸 N:SO
2
(1)2S Cl +2H O=4HCl↑+SO ↑+3S
2 2 2 2
(2)S Cl 结构与双氧水相似,是极性分子,所以A错误;
2 2
S Cl 与氧化铜反应无化合价变化,为非氧化还原反应,所以B错误;
2 2
SO 与H SO 中硫的化合价分别为+4和+6的相邻价态,两者不发生氧化还原反应,因此C正确;
2 2 4
据平衡移动原理,当F中加入水后,CuCl+HClH[CuCl ]逆向移动,因此D正确。
2
(3)①根据电解原理,Cu2+在阴极得电子,所以CuCl在阴极产生;
②氯离子在阳极失电子变成Cl 、当氯化铜浓度越来越小则开始电解氯化钠溶液,最后电解氢氧化钠溶液,
2
因而在两极开始产生O 、H
2 2.
(4)①由于黑色固体X是铜的硫化物,根据两者的质量比为4:1可推断其为CuS,即可写出方程式:
Δ
2CuO+5S 2S O+Cu S。
2 2
学科网(北京)股份有限公司②取反应后的溶液加入氯化钡(硝酸钡或氢氧化钡)溶液,若生成白色沉淀,则含有SO2-。
4
19.(1)N (g)+O (g)2NO(g) H=+181.5kJ/mol(2分)
2 2
(2)BC(2分)
△
(3)①1:1(1分)
②800℃以后NO脱除率下降的原因可能是温度过高,导致催化剂活性下降;1200℃以后NO的脱除率略有
升高可能是高温下NO自身分解程度增加。(其他合理答案也可取,2分)
(4)15.48(1分)
②NO+7e-+8H+=NH +2H O(2分)
4 2
【解析】
(1)根据盖斯定理把主副反应消掉氨气即可得到答案:
N (g)+O (g)2NO(g) H=+181.5kJ/mol。
2 2
(2)根据表格数据可知,800℃--850℃时NO的产率较高,所以A正确;
△
根据表格可知,副反应的速率大于主反应,故副反应的活化能较小,因此B错误;
由于体系中两个反应的同时存在,压强的减小对两个反应的影响程度不同,有可能造成对副反应的影响更
大,则NO的选择性下降,因此C错误;合适的催化剂可以提高反应的选择性,所以D正确。
(3)①氨气的浓度越大,速率越快,NO的脱除率越高;c曲线NO的脱除率最低,因此投料比为1:1;
②脱除率下降的原因是800℃以后NO脱除率下降的原因可能是温度过高,导致催化剂活性下降;1200℃以
后NO的脱除率略有升高可能是高温下NO自身分解程度增加。
c(NH+)K
(4)①根据铵根离子的水解方程式可得c(H+)=[ 4 w ]0.5,即可计算得出pH=5.48;
K
b
②NO 在阴极失电子转变成铵根离子,根据元素守恒和电荷守恒即可得NO +7e-+8H+=NH +2H O
2 2 4 2
20.(1)CH ONO+N H ·H O+NaOH=NaN +CH OH+3H O(2分)
3 2 4 2 3 3 2
(2)AD(2分)
(3)①b(1分) ②减压蒸馏能降低甲醇沸点,使甲醇能在较低温度下蒸出,减少NaN 分解(1分)③acbd(2分)
3
(4)①26(aV -bV )%(2分)
1 2
【解析】
(2)A.由已知信息该反应放热,可通过降温或减慢反应速率来控制温度;B.NaN 受热易分解,通过降温结
3
晶获得;C.98%浓硫酸中H+浓度较小,同时可能氧化NO- 或可能生成硫酸甲酯;D.提纯粗产品用重结
2
晶方法。
(4)②减压蒸馏的优点能降低蒸馏时温度减小分解。
③减压蒸馏结束时先撤去酒精灯冷却至常温时,撤去冷凝水,恢复至常压时再关闭抽气泵。
21.(1)羟基、醚键(1分)
学科网(北京)股份有限公司(2) (1分)
(3)ABC(2分)
H。cNH
(4) +6Fe+12HCl→ +6FeCl +4H O(2分,写出
2 2
给1分)
(5)
(3分)
(6)
(3分,写出3个得2分,写出2个得1分。)
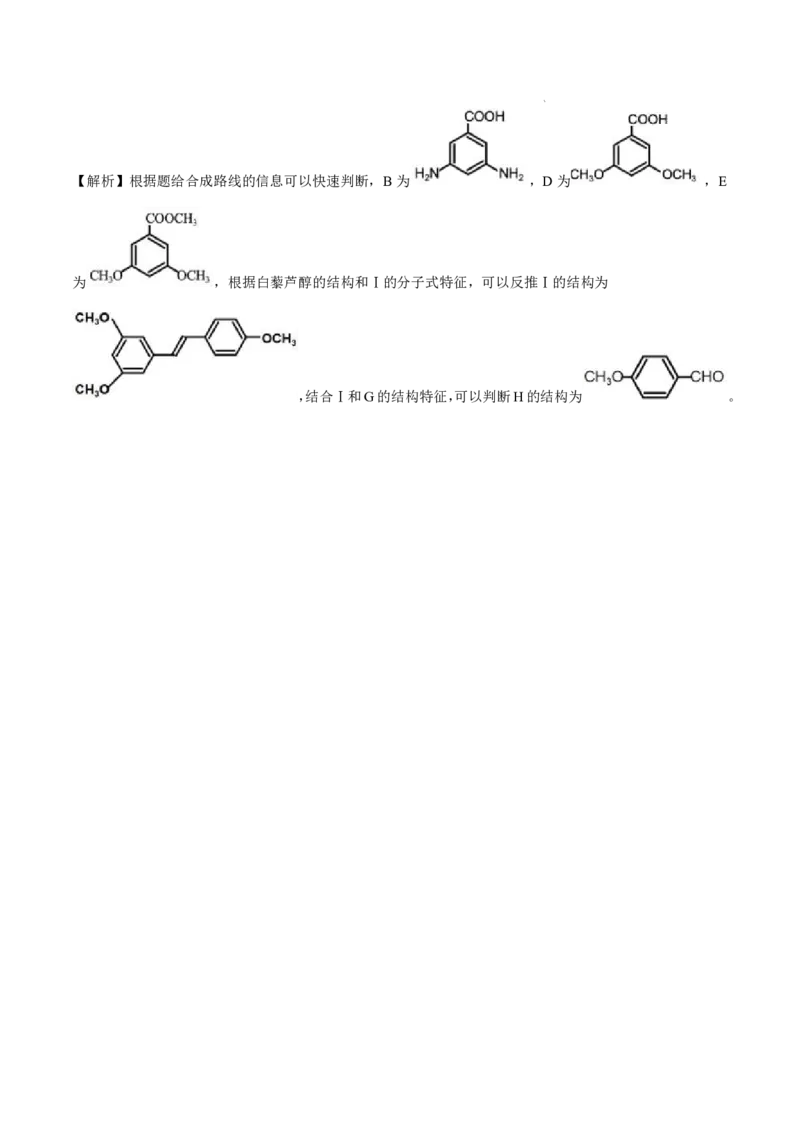
学科网(北京)股份有限公司【解析】根据题给合成路线的信息可以快速判断,B为 ,D为 ,E
为 ,根据白藜芦醇的结构和Ⅰ的分子式特征,可以反推Ⅰ的结构为
,结合Ⅰ和G的结构特征,可以判断H的结构为 。
学科网(北京)股份有限公司