文档内容
定远育才学校 2025-2026 学年高二(上)12 月月考
化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 K-39 Ca-40
一、选择题:本题共14小题,每小题3分,共42分.每小题只有一个选项符合题目要求.
1. NO 是一种新型硝化剂,在T 温度下可发生下列反应:2NO(g) 4NO (g)+O(g)
2 5 1 2 5 2 2
ΔH>0。T 温度下的平衡常数为K =125。下列说法错误的是 ( )
1 1
A. 该反应的ΔS>0
B. 该反应在高温下可自发进行
C. T 温度下的平衡常数为K ,T 温度下的平衡常数为K ,若K T
1 1 2 2 1 2 1 2
D. T 温度下,在体积为1 L的恒温密闭容器中充入2 mol NO,4 mol NO ,1 mol O,此时反应将
1 2 5 2 2
向正反应方向进行
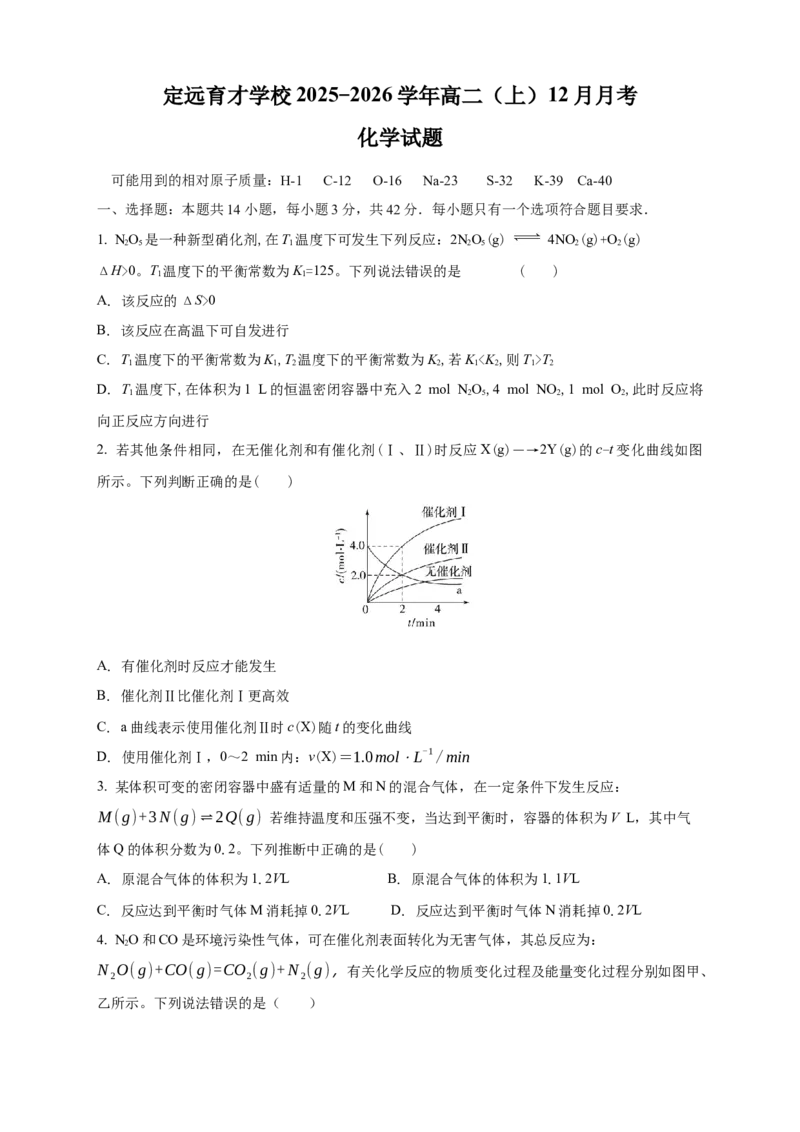
2. 若其他条件相同,在无催化剂和有催化剂(Ⅰ、Ⅱ)时反应X(g)―→2Y(g)的c-t变化曲线如图
所示。下列判断正确的是( )
A. 有催化剂时反应才能发生
B. 催化剂Ⅱ比催化剂Ⅰ更高效
C. a曲线表示使用催化剂Ⅱ时c(X)随t的变化曲线
D. 使用催化剂Ⅰ,0~2 min内:v(X)=1.0mol⋅L-1/min
3. 某体积可变的密闭容器中盛有适量的M和N的混合气体,在一定条件下发生反应:
M(g)+3N(g)⇌2Q(g) 若维持温度和压强不变,当达到平衡时,容器的体积为V L,其中气
体Q的体积分数为0.2。下列推断中正确的是( )
A. 原混合气体的体积为1.2VL B. 原混合气体的体积为1.1VL
C. 反应达到平衡时气体M消耗掉0.2VL D. 反应达到平衡时气体N消耗掉0.2VL
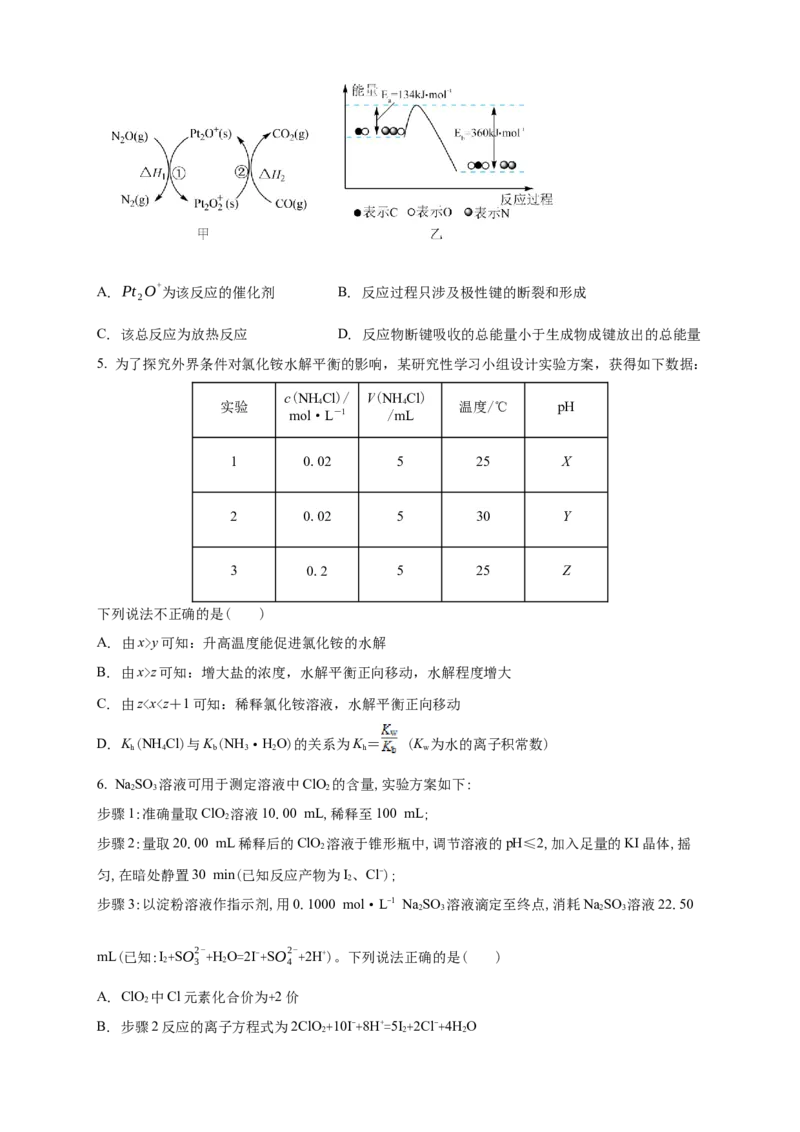
4. NO和CO是环境污染性气体,可在催化剂表面转化为无害气体,其总反应为:
2
N O(g)+CO(g)=CO (g)+N (g),有关化学反应的物质变化过程及能量变化过程分别如图甲、
2 2 2
乙所示。下列说法错误的是( )A. Pt O+ 为该反应的催化剂 B. 反应过程只涉及极性键的断裂和形成
2
C. 该总反应为放热反应 D. 反应物断键吸收的总能量小于生成物成键放出的总能量
5. 为了探究外界条件对氯化铵水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
c(NH Cl)/ V(NH Cl)
实验 4 4 温度/℃ pH
mol·L-1 /mL
1 0.02 5 25 X
2 0.02 5 30 Y
3 0.2 5 25 Z
下列说法不正确的是( )
A. 由x>y可知:升高温度能促进氯化铵的水解
B. 由x>z可知:增大盐的浓度,水解平衡正向移动,水解程度增大
C. 由zHSO->HCO-
3 3
B. 加水稀释亚硫酸溶液,溶液中所有离子浓度均减小
C. 漂白液生效的原理:ClO-+CO +H O=HClO+HCO-
2 2 3
D. 将足量醋酸滴入Na CO 溶液中,发生反应的离子方程式:H++CO2-=HCO-
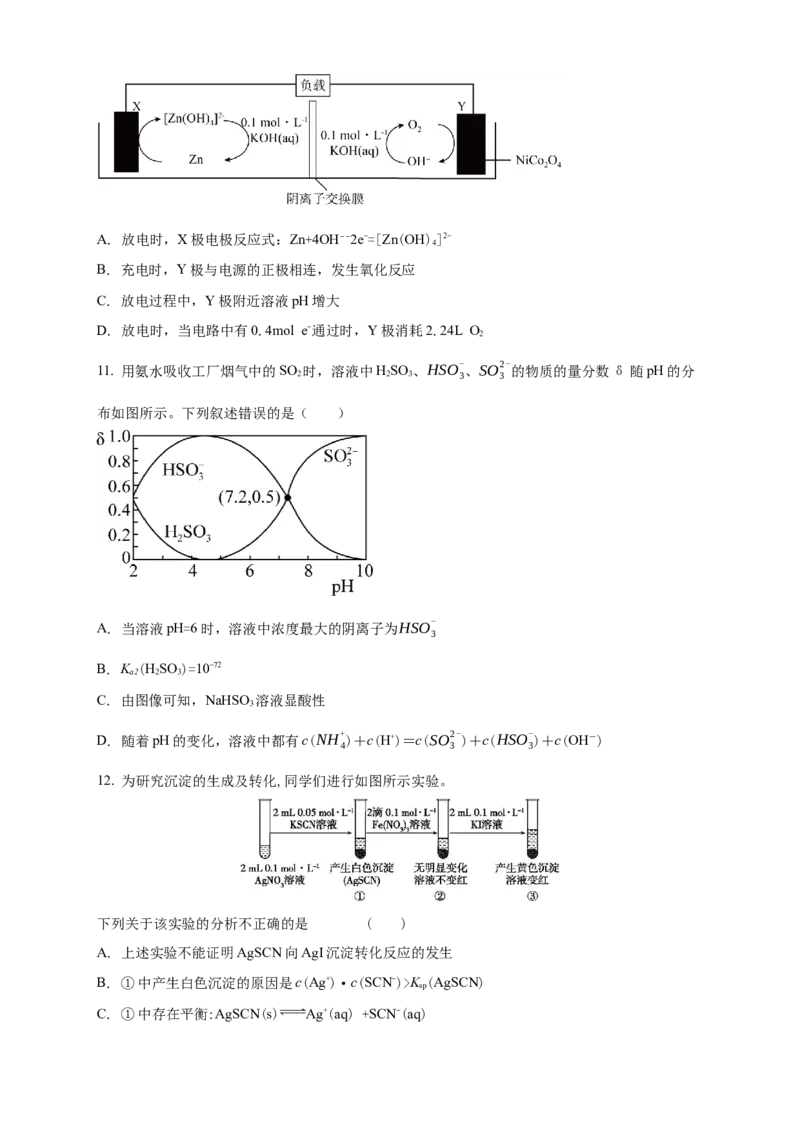
2 3 3 3
10. 我国化学家通过对过渡金属基尖晶石氧化物(NiCOO)进行性能优化,成功开发出锌—空气二
2 4
次电池,其工作原理如图所示。下列说法错误的是( )A. 放电时,X极电极反应式:Zn+4OH−−2e-=[Zn(OH)]2-
4
B. 充电时,Y极与电源的正极相连,发生氧化反应
C. 放电过程中,Y极附近溶液pH增大
D. 放电时,当电路中有0.4mol e-通过时,Y极消耗2.24L O
2
11. 用氨水吸收工厂烟气中的SO 时,溶液中HSO
、HSO- 、SO2-
的物质的量分数δ随pH的分
2 2 3 3 3
布如图所示。下列叙述错误的是( )
A.
当溶液pH=6时,溶液中浓度最大的阴离子为HSO-
3
B. K (HSO )=10-72
a2 2 3
C. 由图像可知,NaHSO 溶液显酸性
3
D. 随着pH的变化,溶液中都有c(NH+ )+c(H+)=c(SO2- )+c(HSO- )+c(OH-)
4 3 3
12. 为研究沉淀的生成及转化,同学们进行如图所示实验。
下列关于该实验的分析不正确的是 ( )
A. 上述实验不能证明AgSCN向AgI沉淀转化反应的发生
B. ①中产生白色沉淀的原因是c(Ag+)·c(SCN-)>K (AgSCN)
sp
C. ①中存在平衡:AgSCN(s) Ag+(aq) +SCN-(aq)D. ②中无明显变化是因为溶液中的c(SCN-)过低
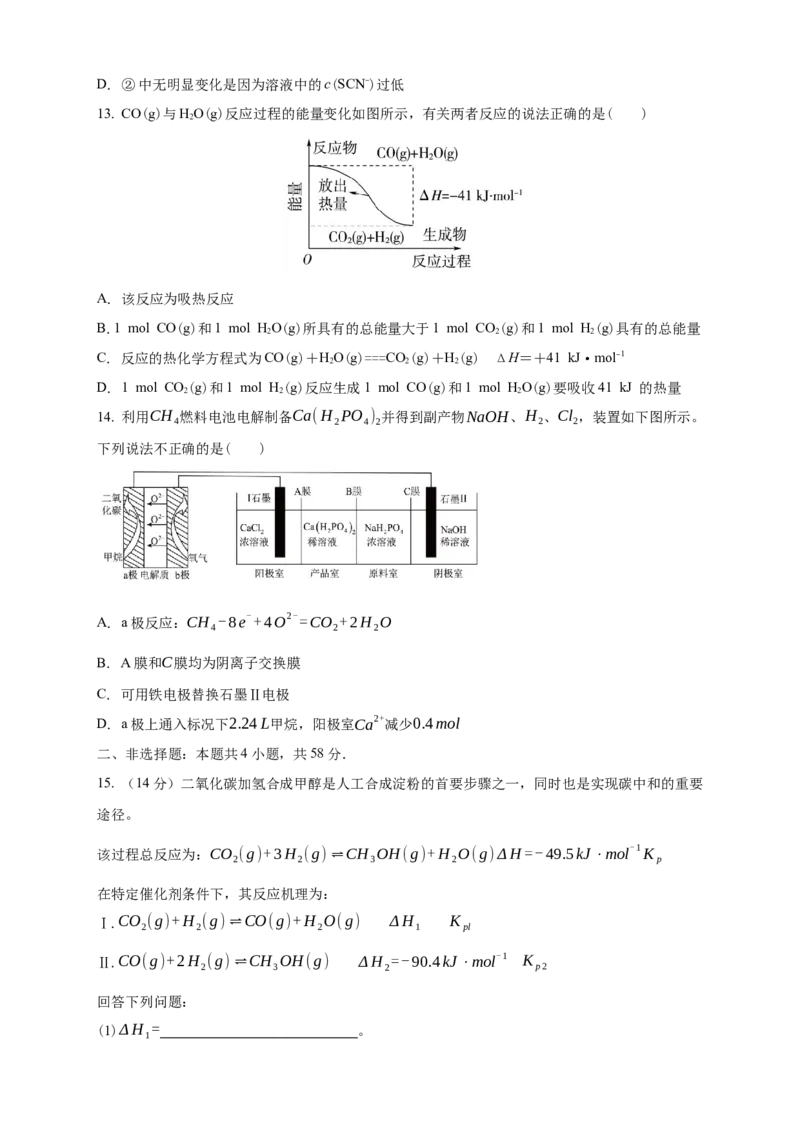
13. CO(g)与HO(g)反应过程的能量变化如图所示,有关两者反应的说法正确的是( )
2
A. 该反应为吸热反应
B.1 mol CO(g)和1 mol HO(g)所具有的总能量大于1 mol CO(g)和1 mol H(g)具有的总能量
2 2 2
C. 反应的热化学方程式为CO(g)+HO(g)===CO(g)+H(g) ΔH=+41 kJ·mol-1
2 2 2
D. 1 mol CO(g)和1 mol H(g)反应生成1 mol CO(g)和1 mol HO(g)要吸收41 kJ 的热量
2 2 2
14. 利用CH 燃料电池电解制备Ca(H PO ) 并得到副产物NaOH、H 、Cl ,装置如下图所示。
4 2 4 2 2 2
下列说法不正确的是( )
A. a极反应:CH -8e-+4O2-=CO +2H O
4 2 2
B. A膜和C膜均为阴离子交换膜
C. 可用铁电极替换石墨Ⅱ电极
D. a极上通入标况下2.24L甲烷,阳极室Ca2+减少0.4mol
二、非选择题:本题共4小题,共58分.
15. (14分)二氧化碳加氢合成甲醇是人工合成淀粉的首要步骤之一,同时也是实现碳中和的重要
途径。
该过程总反应为:CO (g)+3H (g)⇌CH OH(g)+H O(g)ΔH=-49.5kJ⋅mol-1K
2 2 3 2 p
在特定催化剂条件下,其反应机理为:
Ⅰ.CO (g)+H (g)⇌CO(g)+H O(g) ΔH K
2 2 2 1 pl
Ⅱ.CO(g)+2H (g)⇌CH OH(g) ΔH =-90.4kJ⋅mol-1 K
2 3 2 p2
回答下列问题:
(1)ΔH = 。
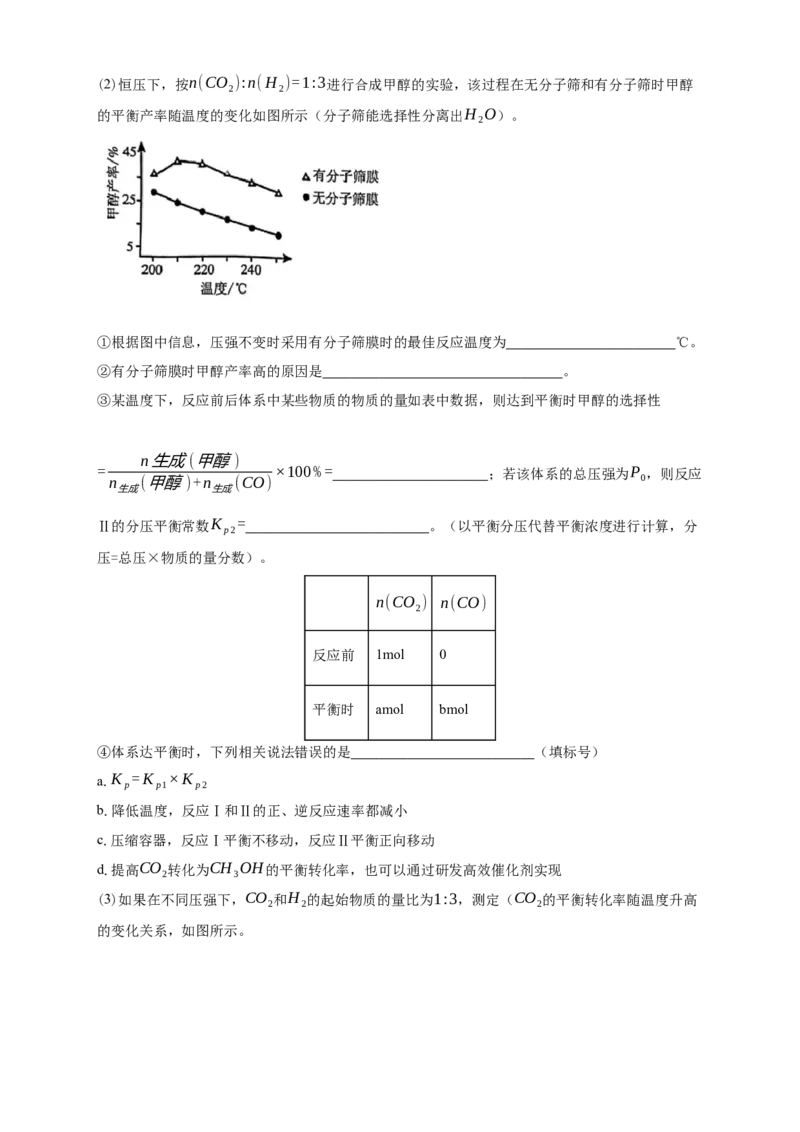
1(2)恒压下,按n(CO ):n(H )=1:3进行合成甲醇的实验,该过程在无分子筛和有分子筛时甲醇
2 2
的平衡产率随温度的变化如图所示(分子筛能选择性分离出H O)。
2
①根据图中信息,压强不变时采用有分子筛膜时的最佳反应温度为 ℃。
②有分子筛膜时甲醇产率高的原因是 。
③某温度下,反应前后体系中某些物质的物质的量如表中数据,则达到平衡时甲醇的选择性
n生成(甲醇)
= ×100%= ;若该体系的总压强为P ,则反应
n (甲醇)+n (CO) 0
生成 生成
Ⅱ的分压平衡常数K = 。(以平衡分压代替平衡浓度进行计算,分
p2
压=总压×物质的量分数)。
n(CO ) n(CO)
2
反应前 1mol 0
平衡时 amol bmol
④体系达平衡时,下列相关说法错误的是 (填标号)
a.K =K ×K
p p1 p2
b.降低温度,反应Ⅰ和Ⅱ的正、逆反应速率都减小
c.压缩容器,反应Ⅰ平衡不移动,反应Ⅱ平衡正向移动
d.提高CO 转化为CH OH的平衡转化率,也可以通过研发高效催化剂实现
2 3
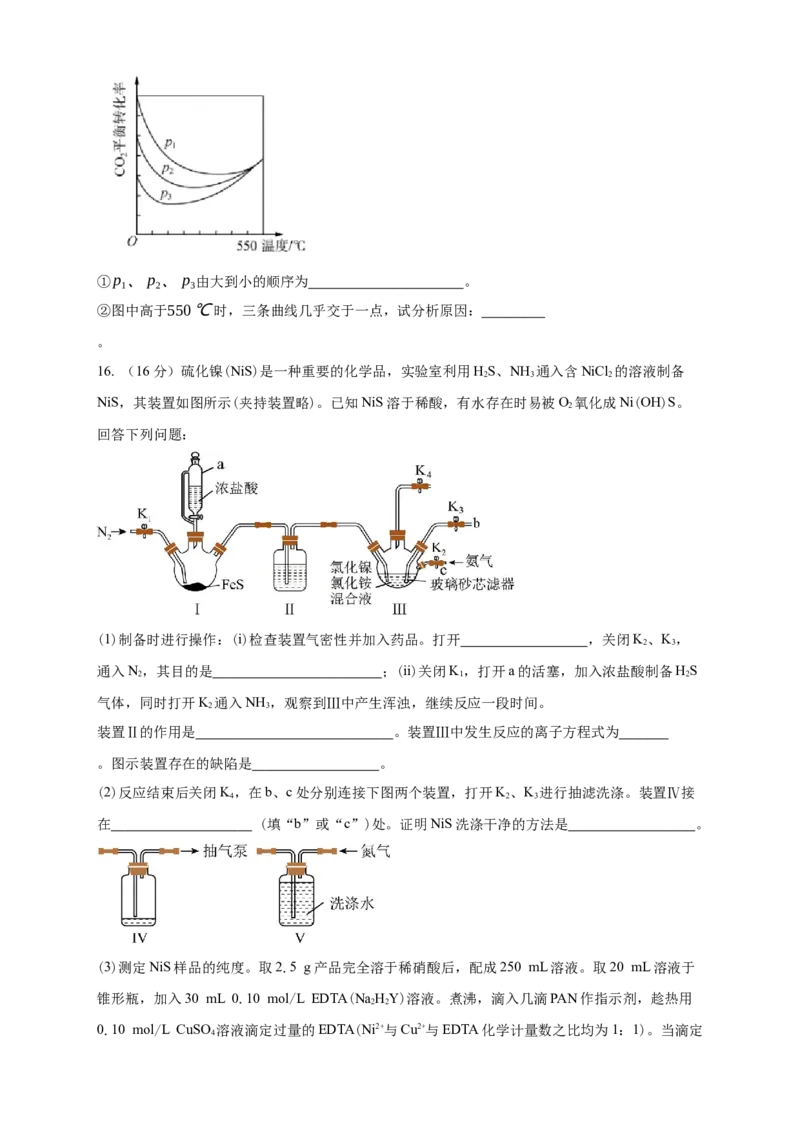
(3)如果在不同压强下,CO 和H 的起始物质的量比为1:3,测定(CO 的平衡转化率随温度升高
2 2 2
的变化关系,如图所示。①p 、p 、p 由大到小的顺序为 。
1 2 3
②图中高于550℃时,三条曲线几乎交于一点,试分析原因:
。
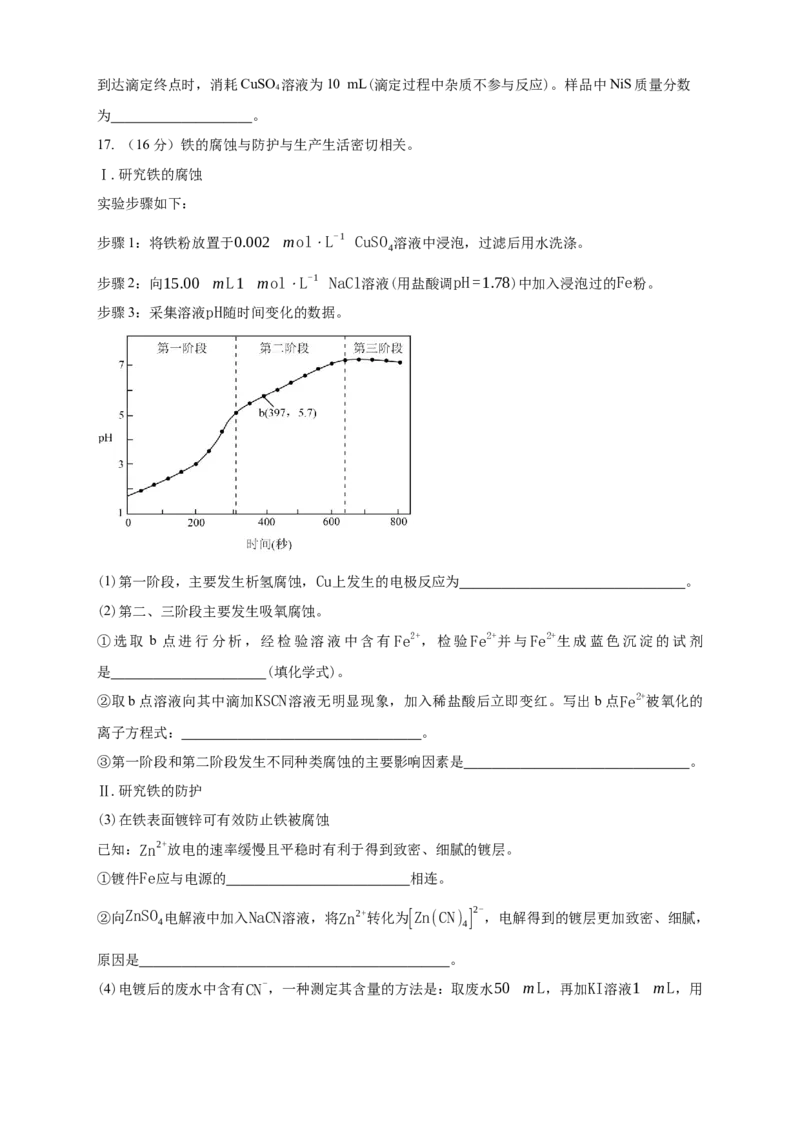
16. (16分)硫化镍(NiS)是一种重要的化学品,实验室利用HS、NH 通入含NiCl 的溶液制备
2 3 2
NiS,其装置如图所示(夹持装置略)。已知NiS溶于稀酸,有水存在时易被O 氧化成Ni(OH)S。
2
回答下列问题:
(1)制备时进行操作:(i)检查装置气密性并加入药品。打开 ,关闭K、K,
2 3
通入N,其目的是 ;(ii)关闭K,打开a的活塞,加入浓盐酸制备HS
2 1 2
气体,同时打开K 通入NH ,观察到Ⅲ中产生浑浊,继续反应一段时间。
2 3
装置Ⅱ的作用是 。装置Ⅲ中发生反应的离子方程式为
。图示装置存在的缺陷是 。
(2)反应结束后关闭K,在b、c处分别连接下图两个装置,打开K、K 进行抽滤洗涤。装置Ⅳ接
4 2 3
在 (填“b”或“c”)处。证明NiS洗涤干净的方法是 。
(3)测定NiS样品的纯度。取2.5 g产品完全溶于稀硝酸后,配成250 mL溶液。取20 mL溶液于
锥形瓶,加入30 mL 0.10 mol/L EDTA(NaHY)溶液。煮沸,滴入几滴PAN作指示剂,趁热用
2 2
0.10 mol/L CuSO 溶液滴定过量的EDTA(Ni2+与Cu2+与EDTA化学计量数之比均为1:1)。当滴定
4到达滴定终点时,消耗CuSO 溶液为10 mL(滴定过程中杂质不参与反应)。样品中NiS质量分数
4
为 。
17. (16分)铁的腐蚀与防护与生产生活密切相关。
Ⅰ.研究铁的腐蚀
实验步骤如下:
步骤1:将铁粉放置于0.002 mol⋅L-1 CuSO 溶液中浸泡,过滤后用水洗涤。
4
步骤2:向15.00 mL1 mol⋅L-1 NaCl溶液(用盐酸调pH=1.78)中加入浸泡过的Fe粉。
步骤3:采集溶液pH随时间变化的数据。
(1)第一阶段,主要发生析氢腐蚀,Cu上发生的电极反应为 。
(2)第二、三阶段主要发生吸氧腐蚀。
①选取 b 点进行分析,经检验溶液中含有Fe2+,检验Fe2+并与Fe2+生成蓝色沉淀的试剂
是 (填化学式)。
②取b点溶液向其中滴加KSCN溶液无明显现象,加入稀盐酸后立即变红。写出b点Fe2+被氧化的
离子方程式: 。
③第一阶段和第二阶段发生不同种类腐蚀的主要影响因素是 。
Ⅱ.研究铁的防护
(3)在铁表面镀锌可有效防止铁被腐蚀
已知:Zn2+放电的速率缓慢且平稳时有利于得到致密、细腻的镀层。
①镀件Fe应与电源的 相连。
②向ZnSO 电解液中加入NaCN溶液,将Zn2+转化为[Zn(CN) ] 2- ,电解得到的镀层更加致密、细腻,
4 4
原因是 。
(4)电镀后的废水中含有CN-,一种测定其含量的方法是:取废水50 mL,再加KI溶液1 mL,用c mol⋅L-1AgNO 溶 液 滴 定 , 达 到 滴 定 终 点 时 , 消 耗 AgNO 溶 液 V mL。 已 知 :
3 3
Ag+ (aq)+2CN- (aq)⇌ [Ag(CN) ] - (aq)( 无 色 ) K=1.0×1021;
2
Ag+ (aq)+I- (aq)⇌ AgI(s) K=1.2×1016 。
①滴定终点的现象是 。
②废水中CN-的含量是 g⋅L-1(用含c、V的代数式表示)。
18. (12分) 工业废渣中Ca(OH) 的综合利用。
2
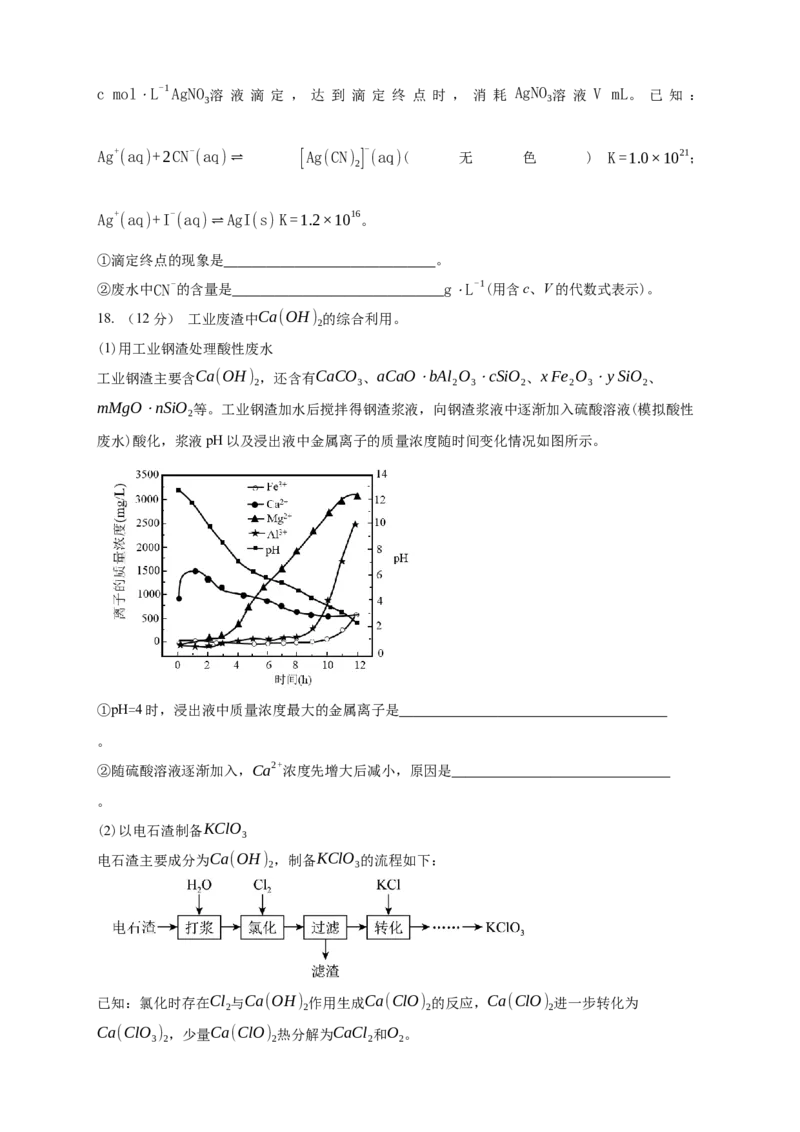
(1)用工业钢渣处理酸性废水
工业钢渣主要含Ca(OH) ,还含有CaCO 、aCaO⋅bAl O ⋅cSiO 、xFe O ⋅ySiO 、
2 3 2 3 2 2 3 2
mMgO⋅nSiO 等。工业钢渣加水后搅拌得钢渣浆液,向钢渣浆液中逐渐加入硫酸溶液(模拟酸性
2
废水)酸化,浆液pH以及浸出液中金属离子的质量浓度随时间变化情况如图所示。
①pH=4时,浸出液中质量浓度最大的金属离子是
。
②随硫酸溶液逐渐加入,Ca2+浓度先增大后减小,原因是
。
(2)以电石渣制备KClO
3
电石渣主要成分为Ca(OH) ,制备KClO 的流程如下:
2 3
已知:氯化时存在Cl 与Ca(OH) 作用生成Ca(ClO) 的反应,Ca(ClO) 进一步转化为
2 2 2 2
Ca(ClO ) ,少量Ca(ClO) 热分解为CaCl 和O 。
3 2 2 2 2①生成Ca(ClO) 的化学方程式为 。
2
②“分解比”是衡量氯化程度的标准,氯化后溶液中CaCl 总质量与Ca(ClO ) 总质量的比值称为
2 3 2
“分解比”,随氯化温度升高,分解比的实际值增大的原因可能是 。
③“转化”时向滤液中加入KCl固体将Ca(ClO ) 转化为KClO ,可能的原因是
3 2 3
。
④该流程制得的KClO 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取5.049 g
3
样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,加入适量葡萄糖,加热使
ClO- 全部转化为Cl-,加入少量K CrO 溶液作指示剂,用0.20mol/LAgNO 溶液进行滴定至终
3 2 4 3
点,消耗AgNO 溶液体积21.00mL。计算KClO 样品的纯度。(请写出计算过程)
3 3
化学试题答案
一、
单选题
1. C 2. D 3. A 4. B 5. B 6. B 7. B 8. B 9. C 10. D
11. D 12. A 13. BD 14. B
二、
非选择题
15. (1)+40.9kJ⋅mol-1
(2)210 分子筛膜从反应体系中不断分离出H O,减少了生成物,平衡向正向移动,甲醇产率
2
b (1-a-b)(2+2a+2b) 2
升高 (1- )×100% cd
1-a b(3a+2b) 2P2
0
(3)p >p >p 反应Ⅰ为吸热反应,反应Ⅱ为放热反应。550℃时温度高,体系中以反应Ⅰ为
1 2 3
主,反应Ⅰ前后分子数相等,压强改变对平衡没有影响。(评分细则时注明以反应Ⅰ为主即可)
16. (1) K 、K 反应都处在氮气氛围下,防止NiS被氧气氧化为Ni(OH)S 除去中HS的
1 4 2HCl杂质气体 H S+Ni2++2NH =NiS↓+2NH+ 没有H S、NH 的尾气处理装置
2 3 4 2 3
(2) b 取最后一次抽滤洗涤液少许与试管中,先加入稀硝酸,再加入硝酸银溶液,若无白色沉淀
产生,则证明洗涤干净
(3)91%
17. (1)2H++2e-=H ↑
2
(2)K [Fe(CN) ] 4Fe2++O +10H O=4Fe(OH) (胶体)+8H+ 溶液的酸碱性(或溶液的pH值)
3 6 2 2 3
(3)负极 通过反应Zn2++4CN- ⇌[Zn(CN) ] 2- 降低c(Zn2+),使得Zn2+放电速率减缓,同时通过平
4
衡的移动补充放电消耗的Zn2+,使其浓度保持相对稳定,达到放电速率平稳的作用
26c V
(4)加入最后半滴硝酸银溶液,溶液中产生黄色沉淀,且半分钟内沉淀不消失 (或
25
1.04c V)
18. (1)①Mg2+;
②开始时加入的硫酸会促进Ca(OH) 溶解,溶液中Ca2+浓度增加;随着硫酸加入量增加,SO2- 浓
2 4
度增大,Ca2+与SO2- 结合生成的CaSO 沉淀逐渐增多,浸出液中Ca2+浓度逐渐减小,故随硫酸溶
4 4
液逐渐加入,Ca2+浓度先增大后减小;
(2)①2Cl +2Ca(OH) =Ca(ClO) +CaCl +2H O;
2 2 2 2 2
②升高温度Ca(ClO) 分解增多,使CaCl 的量变多,Ca(ClO ) 的量变少
2 2 3 2
③相同温度下,KClO 的溶解度比Ca(ClO ) 小
3 3 2
④在25.00 mL溶液中:n(AgNO )=0.20mol/L×0.021L=0.0042mol,
3
n(KCl) =0.0042mol,n(KClO )+n(KCl)=0.0042mol,
总 3
n(KClO )×122.5g/mol+n(KCl)×74.5g/mol=0.5049g,两式联立,解得
3
n(KClO )=0.0040mol,m(KClO )=0.004mol×122.5g/mol=0.49g,KClO 样品的纯度
3 3 3
=(0.49g×10÷5.049g)×100%=97.05%。