文档内容
化学试题
(考试时间:75分钟 满分:100分)
注意事项:
1.答题前,务必在答题卡和答题卷规定的地方填写自己的姓名、准考证号和座位号后两位。
2.答题时,每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。
3.答题时,必须使用 0.5毫米的黑色墨水签字笔在答题卷上书写,要求字体工整、笔迹清
晰。作图题可先用铅笔在答
.
题
.
卷
.
规定的位置绘出,确认后再用 0.5毫米的黑色墨水签字笔描
清楚。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿
.....................
纸
.
上
.
答
.
题
.
无
.
效
.
。
4.考试结束,务必将答题卡和答题卷一并上交。
5.可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 S:32
一、选择题(本题共 14 小题,每小题 3分;共 42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。)
1.下列化学品的用途不
.
正
.
确
.
的是
A.石油焦制备碳素电极用于电解工业
B.醋酸纤维不易燃烧用于纺织工业
C.葡萄糖酸-δ-内酯用于制作豆腐的凝固剂
D.谷氨酸钠是非处方药,用于解热镇痛
2.下列化学用语或图示表达正确的是
A.顺-2-丁烯的结构简式:
B.H-H形成的σ键:
C.基态溴原子简化电子排布式:[Ar]3d104s24p5
D.p 轨道的电子云轮廓图:
x
3.某学校“云上农场”给学生提供场地种植花卉果蔬,既可以培养劳动习惯,也能将化学知识应用于实
践。下列有关说法正确的是
A.浸种时用0.5%的高锰酸钾酒精溶液浸泡花卉种子,能有效杀灭种子表面病原菌
B.石灰硫黄合剂呈碱性,可侵蚀害虫表皮蜡质层,杀死害虫及虫卵
C.劳动结束应立即清洗农铲并用盐水浸泡,减缓因发生吸氧腐蚀而生锈
D.施用草木灰和磷酸二氢钙制成的复合肥,可有效提供植物生长需要的钾、磷、钙元素
4.化合物XY(ZW ) 可作食品膨松剂,W、X、Y、Z为原子序数依次增大的短周期元素,W的基态原子s
4 2
学科网(北京)股份有限公司能级上的电子总数与p能级上的电子总数相等,W和Z同族,X的焰色为黄色,下列说法不
.
正
.
确
.
的是
A.简单氢化物沸点:ZW>X>Y
D.ZW 和W 的空间结构均为V形
2 3
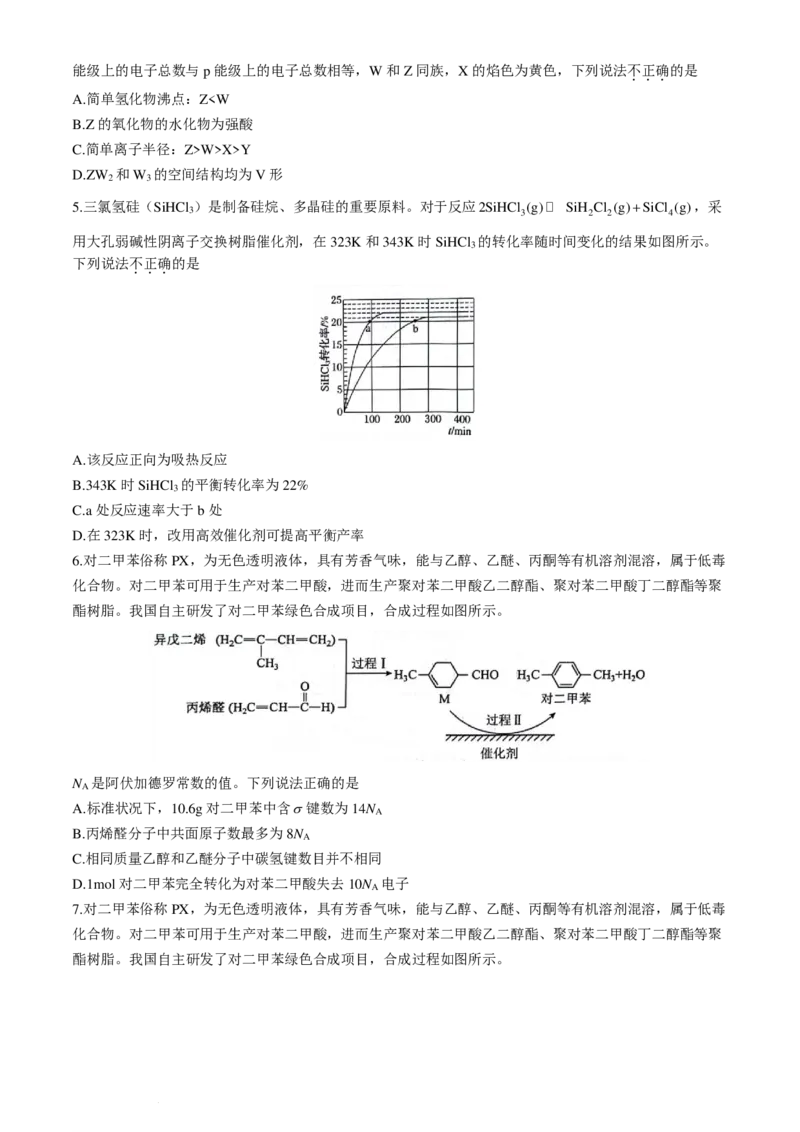
5.三氯氢硅(SiHCl )是制备硅烷、多晶硅的重要原料。对于反应2SiHCl (g) SiH Cl (g)+SiCl (g),采
3 3 2 2 4
用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl 的转化率随时间变化的结果如图所示。
3
下列说法不
.
正
.
确
.
的是
A.该反应正向为吸热反应
B.343K时SiHCl 的平衡转化率为22%
3
C.a处反应速率大于b处
D.在323K时,改用高效催化剂可提高平衡产率
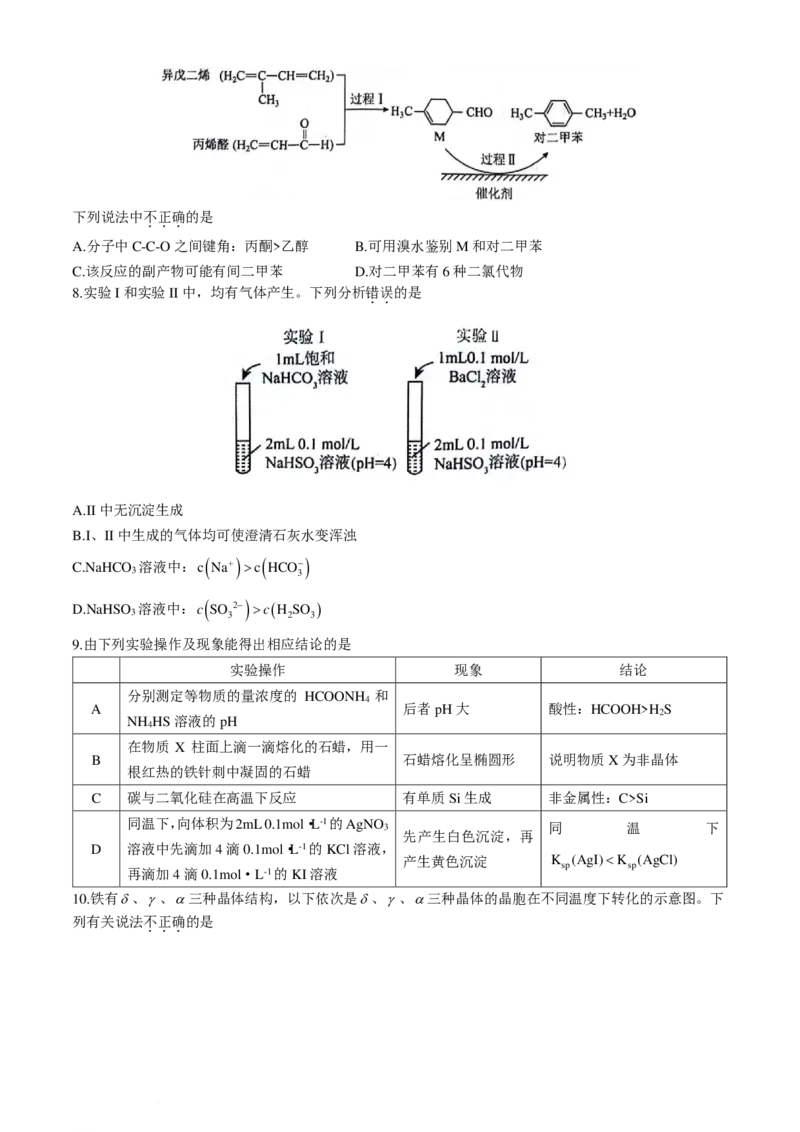
6.对二甲苯俗称PX,为无色透明液体,具有芳香气味,能与乙醇、乙醚、丙酮等有机溶剂混溶,属于低毒
化合物。对二甲苯可用于生产对苯二甲酸,进而生产聚对苯二甲酸乙二醇酯、聚对苯二甲酸丁二醇酯等聚
酯树脂。我国自主研发了对二甲苯绿色合成项目,合成过程如图所示。
N 是阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下,10.6g对二甲苯中含σ键数为14N
A
B.丙烯醛分子中共面原子数最多为8N
A
C.相同质量乙醇和乙醚分子中碳氢键数目并不相同
D.1mol对二甲苯完全转化为对苯二甲酸失去10N 电子
A
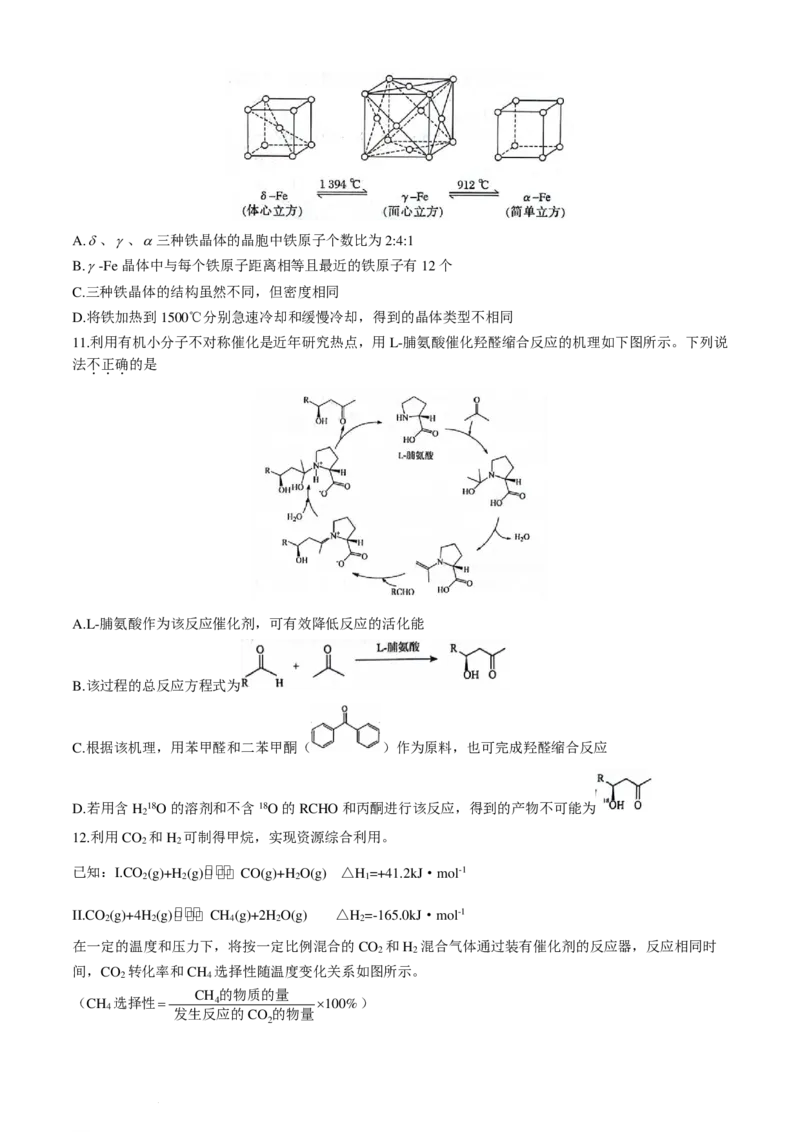
7.对二甲苯俗称PX,为无色透明液体,具有芳香气味,能与乙醇、乙醚、丙酮等有机溶剂混溶,属于低毒
化合物。对二甲苯可用于生产对苯二甲酸,进而生产聚对苯二甲酸乙二醇酯、聚对苯二甲酸丁二醇酯等聚
酯树脂。我国自主研发了对二甲苯绿色合成项目,合成过程如图所示。
学科网(北京)股份有限公司下列说法中不
.
正
.
确
.
的是
A.分子中C-C-O之间键角:丙酮>乙醇 B.可用溴水鉴别M和对二甲苯
C.该反应的副产物可能有间二甲苯 D.对二甲苯有6种二氯代物
8.实验I和实验II中,均有气体产生。下列分析错
.
误
.
的是
A.II中无沉淀生成
B.I、II中生成的气体均可使澄清石灰水变浑浊
C.NaHCO 溶液中:c
( Na+)
>c
( HCO−)
3 3
D.NaHSO 溶液中:c ( SO 2−) >c(H SO )
3 3 2 3
9.由下列实验操作及现象能得出相应结论的是
实验操作 现象 结论
分别测定等物质的量浓度的 HCOONH 和
4
A 后者pH大 酸性:HCOOH>H S
2
NH HS溶液的pH
4
在物质 X 柱面上滴一滴熔化的石蜡,用一
B 石蜡熔化呈椭圆形 说明物质X为非晶体
根红热的铁针刺中凝固的石蜡
C 碳与二氧化硅在高温下反应 有单质Si生成 非金属性:C>Si
同温下,向体积为2mL 0.1mol·L-1的AgNO
3 同 温 下
先产生白色沉淀,再
D 溶液中先滴加4滴0.1mol·L-1的KCl溶液,
产生黄色沉淀 K (AgI)Ea(逆)
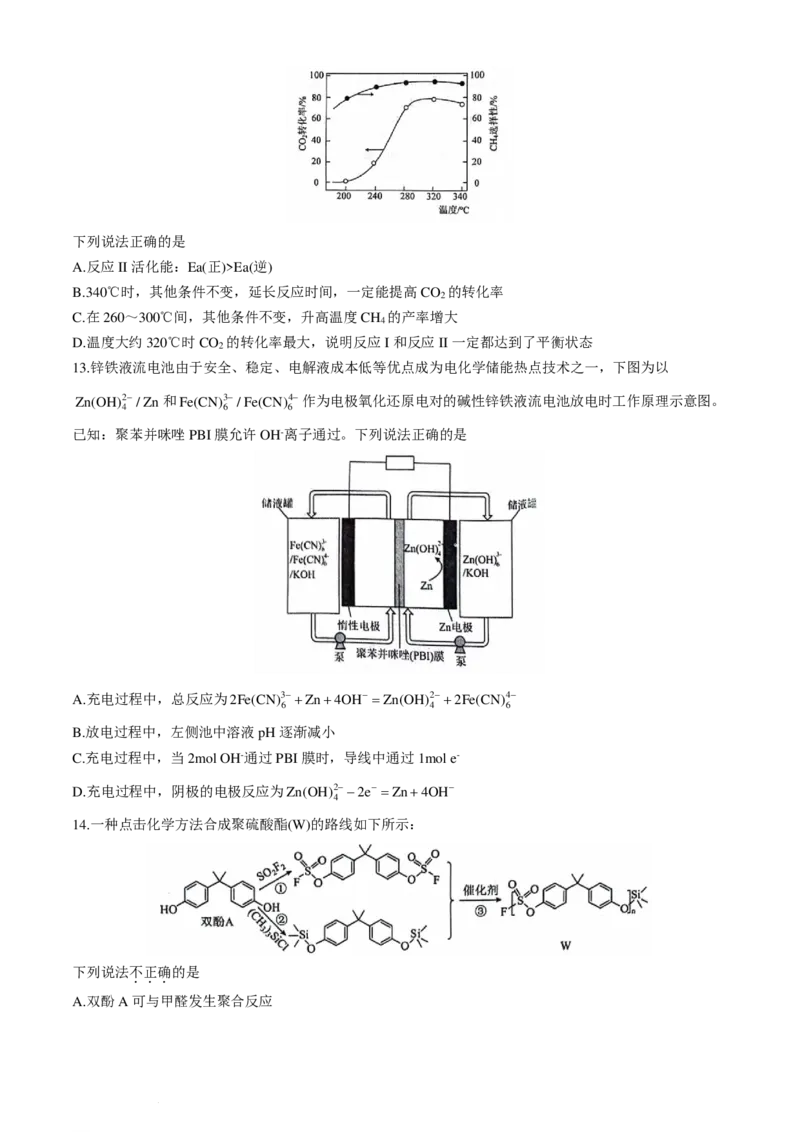
B.340℃时,其他条件不变,延长反应时间,一定能提高CO 的转化率
2
C.在260~300℃间,其他条件不变,升高温度CH 的产率增大
4
D.温度大约320℃时CO 的转化率最大,说明反应I和反应II一定都达到了平衡状态
2
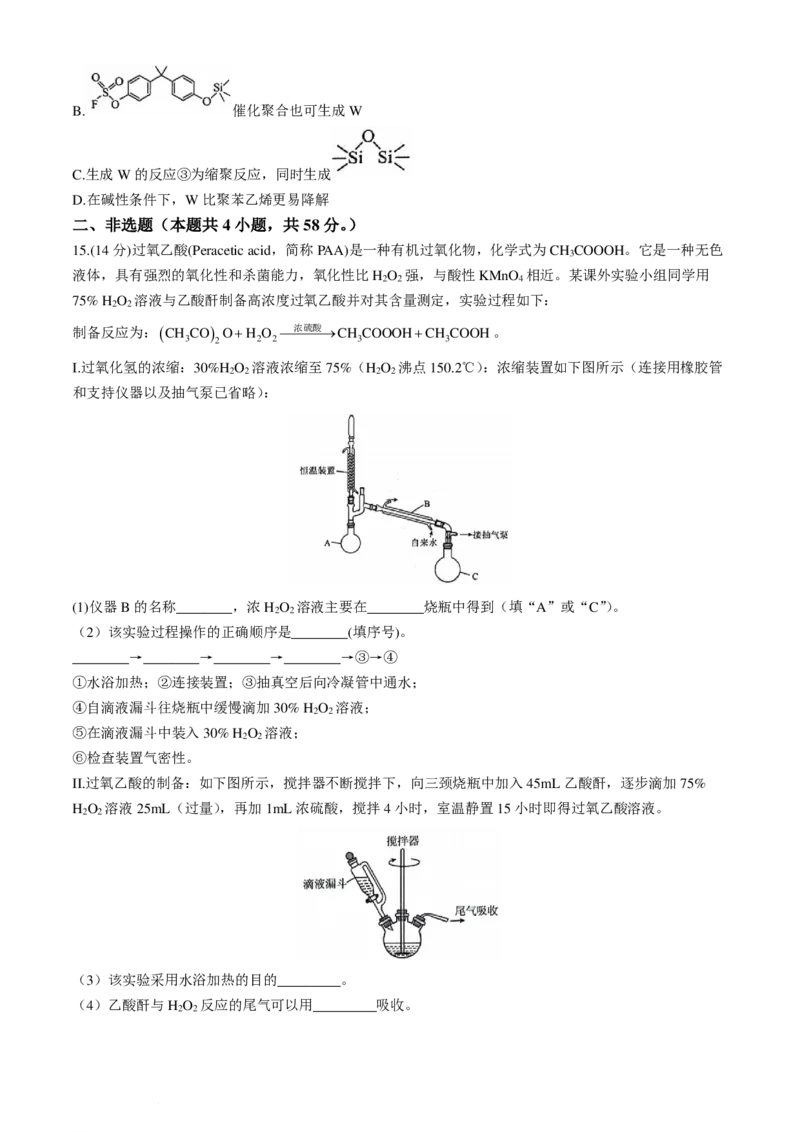
13.锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之一,下图为以
Zn(OH)2− /Zn和Fe(CN)3− /Fe(CN)4−作为电极氧化还原电对的碱性锌铁液流电池放电时工作原理示意图。
4 6 6
已知:聚苯并咪唑PBI膜允许OH-离子通过。下列说法正确的是
A.充电过程中,总反应为2Fe(CN)3−+Zn+4OH− =Zn(OH)2−+2Fe(CN)4−
6 4 6
B.放电过程中,左侧池中溶液pH逐渐减小
C.充电过程中,当2mol OH-通过PBI膜时,导线中通过1mol e-
D.充电过程中,阴极的电极反应为Zn(OH)2−−2e− =Zn+4OH−
4
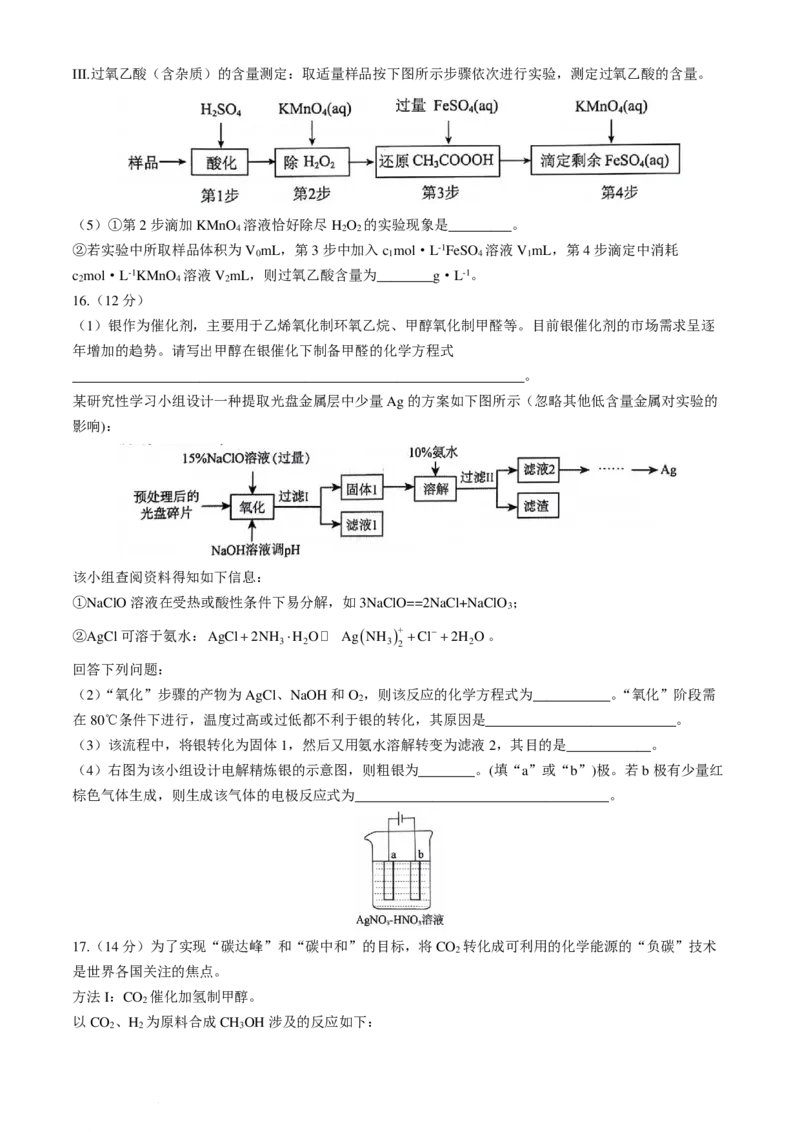
14.一种点击化学方法合成聚硫酸酯(W)的路线如下所示:
下列说法不
.
正
.
确
.
的是
A.双酚A可与甲醛发生聚合反应
学科网(北京)股份有限公司B. 催化聚合也可生成W
C.生成W的反应③为缩聚反应,同时生成
D.在碱性条件下,W比聚苯乙烯更易降解
二、非选题(本题共 4小题,共 58分。)
15.(14分)过氧乙酸(Peracetic acid,简称PAA)是一种有机过氧化物,化学式为CH COOOH。它是一种无色
3
液体,具有强烈的氧化性和杀菌能力,氧化性比H O 强,与酸性KMnO 相近。某课外实验小组同学用
2 2 4
75% H O 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下:
2 2
制备反应为:(CH CO) O+H O 浓硫酸→CH COOOH+CH COOH。
3 2 2 2 3 3
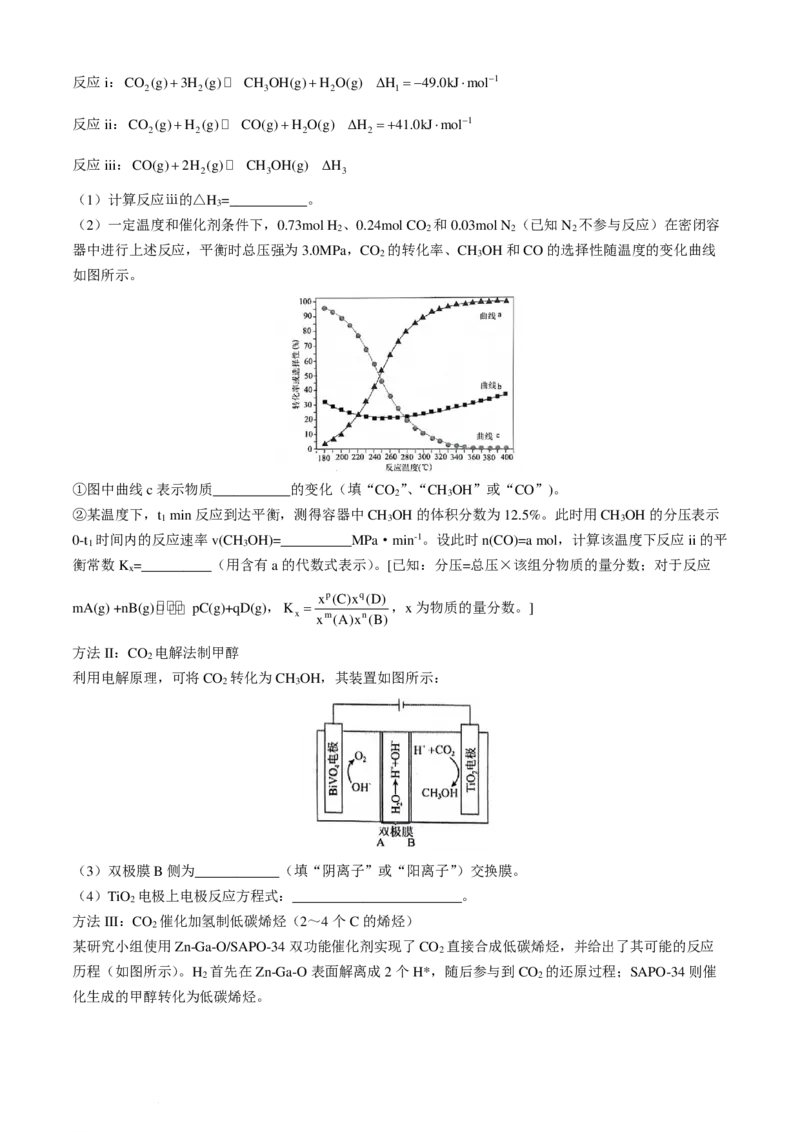
I.过氧化氢的浓缩:30%H O 溶液浓缩至75%(H O 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管
2 2 2 2
和支持仪器以及抽气泵已省略):
(1)仪器B的名称________,浓H O 溶液主要在________烧瓶中得到(填“A”或“C”)。
2 2
(2)该实验过程操作的正确顺序是________(填序号)。
________→________→________→________→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加30% H O 溶液;
2 2
⑤在滴液漏斗中装入30% H O 溶液;
2 2
⑥检查装置气密性。
II.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加75%
H O 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得过氧乙酸溶液。
2 2
(3)该实验采用水浴加热的目的_________。
(4)乙酸酐与H O 反应的尾气可以用_________吸收。
2 2
学科网(北京)股份有限公司III.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。
(5)①第2步滴加KMnO 溶液恰好除尽H O 的实验现象是_________。
4 2 2
②若实验中所取样品体积为V mL,第3步中加入c mol·L-1FeSO 溶液V mL,第4步滴定中消耗
0 1 4 1
c mol·L-1KMnO 溶液V mL,则过氧乙酸含量为________g·L-1。
2 4 2
16.(12分)
(1)银作为催化剂,主要用于乙烯氧化制环氧乙烷、甲醇氧化制甲醛等。目前银催化剂的市场需求呈逐
年增加的趋势。请写出甲醇在银催化下制备甲醛的化学方程式
________________________________________________________________。
某研究性学习小组设计一种提取光盘金属层中少量Ag的方案如下图所示(忽略其他低含量金属对实验的
影响):
该小组查阅资料得知如下信息:
①NaClO溶液在受热或酸性条件下易分解,如3NaClO==2NaCl+NaClO ;
3
②AgCl可溶于氨水:AgCl+2NH ⋅H O Ag(NH )+ +Cl−+2H O。
3 2 3 2 2
回答下列问题:
(2)“氧化”步骤的产物为AgCl、NaOH和O ,则该反应的化学方程式为___________。“氧化”阶段需
2
在80℃条件下进行,温度过高或过低都不利于银的转化,其原因是___________________________。
(3)该流程中,将银转化为固体1,然后又用氨水溶解转变为滤液2,其目的是____________。
(4)右图为该小组设计电解精炼银的示意图,则粗银为________。(填“a”或“b”)极。若b极有少量红
棕色气体生成,则生成该气体的电极反应式为____________________________________。
17.(14分)为了实现“碳达峰”和“碳中和”的目标,将CO 转化成可利用的化学能源的“负碳”技术
2
是世界各国关注的焦点。
方法I:CO 催化加氢制甲醇。
2
以CO 、H 为原料合成CH OH涉及的反应如下:
2 2 3
学科网(北京)股份有限公司反应i:CO (g)+3H (g) CH OH(g)+H O(g) ΔH =−49.0kJ⋅mol−1
2 2 3 2 1
反应ii:CO (g)+H (g) CO(g)+H O(g) ΔH =+41.0kJ⋅mol−1
2 2 2 2
反应iii:CO(g)+2H (g) CH OH(g) ΔH
2 3 3
(1)计算反应ⅲ的△H =___________。
3
(2)一定温度和催化剂条件下,0.73mol H 、0.24mol CO 和0.03mol N (已知N 不参与反应)在密闭容
2 2 2 2
器中进行上述反应,平衡时总压强为3.0MPa,CO 的转化率、CH OH和CO的选择性随温度的变化曲线
2 3
如图所示。
①图中曲线c表示物质___________的变化(填“CO ”、“CH OH”或“CO”)。
2 3
②某温度下,t min反应到达平衡,测得容器中CH OH的体积分数为12.5%。此时用CH OH的分压表示
1 3 3
0-t 时间内的反应速率v(CH OH)=__________MPa·min-1。设此时n(CO)=a mol,计算该温度下反应ii的平
1 3
衡常数K =__________(用含有a的代数式表示)。[已知:分压=总压×该组分物质的量分数;对于反应
x
xp(C)xq(D)
mA(g) +nB(g) pC(g)+qD(g),K = ,x为物质的量分数。]
x xm(A)xn(B)
方法II:CO 电解法制甲醇
2
利用电解原理,可将CO 转化为CH OH,其装置如图所示:
2 3
(3)双极膜B侧为____________(填“阴离子”或“阳离子”)交换膜。
(4)TiO 电极上电极反应方程式:________________________。
2
方法III:CO 催化加氢制低碳烯烃(2~4个C的烯烃)
2
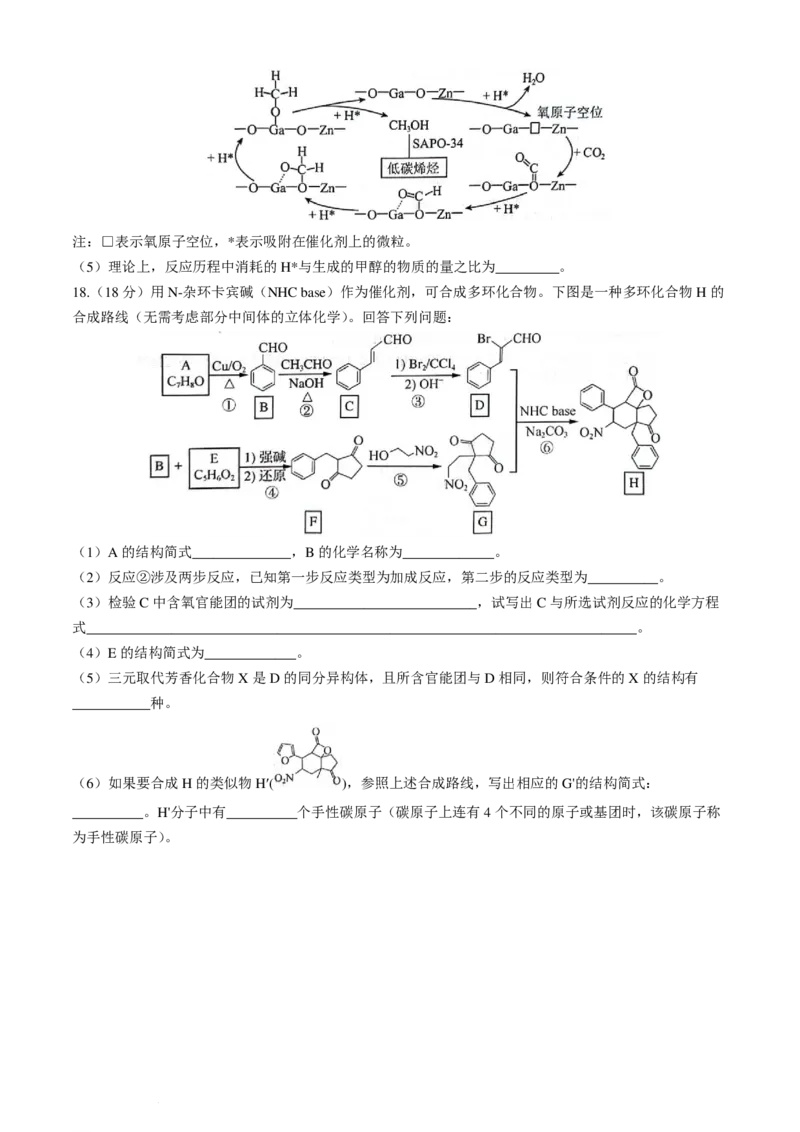
某研究小组使用Zn-Ga-O/SAPO-34双功能催化剂实现了CO 直接合成低碳烯烃,并给出了其可能的反应
2
历程(如图所示)。H 首先在Zn-Ga-O表面解离成2个H*,随后参与到CO 的还原过程;SAPO-34则催
2 2
化生成的甲醇转化为低碳烯烃。
学科网(北京)股份有限公司注:□表示氧原子空位,*表示吸附在催化剂上的微粒。
(5)理论上,反应历程中消耗的H*与生成的甲醇的物质的量之比为_________。
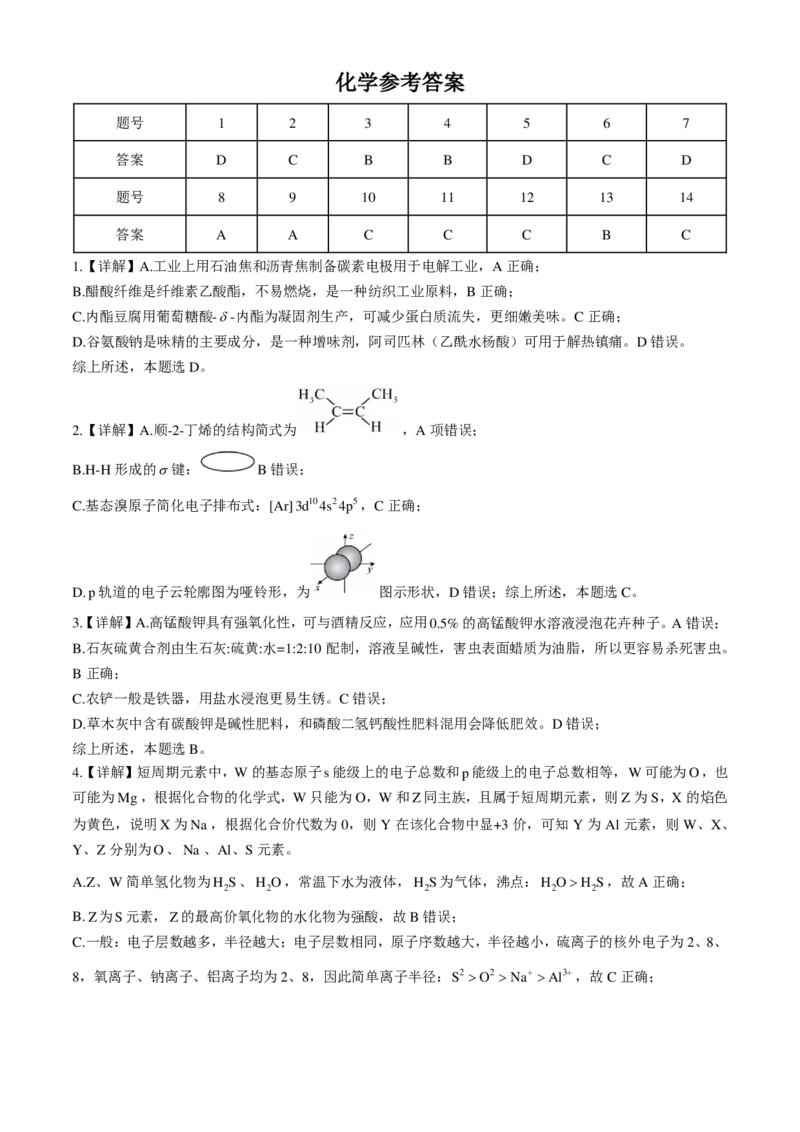
18.(18分)用N-杂环卡宾碱(NHC base)作为催化剂,可合成多环化合物。下图是一种多环化合物H的
合成路线(无需考虑部分中间体的立体化学)。回答下列问题:
(1)A的结构简式______________,B的化学名称为_____________。
(2)反应②涉及两步反应,已知第一步反应类型为加成反应,第二步的反应类型为__________。
(3)检验C中含氧官能团的试剂为__________________________,试写出C与所选试剂反应的化学方程
式______________________________________________________________________________。
(4)E的结构简式为_____________。
(5)三元取代芳香化合物X是D的同分异构体,且所含官能团与D相同,则符合条件的X的结构有
___________种。
(6)如果要合成H的类似物H′( ),参照上述合成路线,写出相应的G'的结构简式:
__________。H'分子中有__________个手性碳原子(碳原子上连有4个不同的原子或基团时,该碳原子称
为手性碳原子)。
学科网(北京)股份有限公司化学参考答案
题号 1 2 3 4 5 6 7
答案 D C B B D C D
题号 8 9 10 11 12 13 14
答案 A A C C C B C
1.【详解】A.工业上用石油焦和沥青焦制备碳素电极用于电解工业,A正确;
B.醋酸纤维是纤维素乙酸酯,不易燃烧,是一种纺织工业原料,B正确;
C.内酯豆腐用葡萄糖酸-δ-内酯为凝固剂生产,可减少蛋白质流失,更细嫩美味。C正确;
D.谷氨酸钠是味精的主要成分,是一种增味剂,阿司匹林(乙酰水杨酸)可用于解热镇痛。D错误。
综上所述,本题选D。
2.【详解】A.顺-2-丁烯的结构简式为 ,A项错误;
B.H-H形成的σ键: B错误;
C.基态溴原子简化电子排布式:[Ar]3d104s24p5,C正确;
D.p轨道的电子云轮廓图为哑铃形,为 图示形状,D错误;综上所述,本题选C。
3.【详解】A.高锰酸钾具有强氧化性,可与酒精反应,应用0.5%的高锰酸钾水溶液浸泡花卉种子。A错误;
B.石灰硫黄合剂由生石灰:硫黄:水=1:2:10 配制,溶液呈碱性,害虫表面蜡质为油脂,所以更容易杀死害虫。
B正确;
C.农铲一般是铁器,用盐水浸泡更易生锈。C错误;
D.草木灰中含有碳酸钾是碱性肥料,和磷酸二氢钙酸性肥料混用会降低肥效。D错误;
综上所述,本题选B。
4.【详解】短周期元素中,W的基态原子s能级上的电子总数和p能级上的电子总数相等,W可能为O,也
可能为Mg,根据化合物的化学式,W只能为O,W和Z同主族,且属于短周期元素,则Z为S,X的焰色
为黄色,说明X为Na,根据化合价代数为0,则Y在该化合物中显+3价,可知Y为Al元素,则W、X、
Y、Z分别为O、Na、Al、S元素。
A.Z、W简单氢化物为H S、H O,常温下水为液体,H S为气体,沸点:H O>H S,故A正确;
2 2 2 2 2
B.Z为S元素,Z的最高价氧化物的水化物为强酸,故B错误;
C.一般:电子层数越多,半径越大;电子层数相同,原子序数越大,半径越小,硫离子的核外电子为2、8、
8,氧离子、钠离子、铝离子均为2、8,因此简单离子半径:S2 >O2 >Na+ >Al3+,故C正确;
学科网(北京)股份有限公司6−2×2
D.W 为O ,ZW 为SO ,价层电子对数为2+ =3,空间构型为V形,SO 、O 互为等电子体,空
3 3 2 2 2 3
2
间构型相同,均为V形,故D正确;
综上所述,本题选B。
5.【详解】A.曲线a反应速率快,a表示343K时SiHCl 的转化率随时间变化;曲线b表示323K时SiHCl 的
3 3
转化率随时间变化;升高温度,SiHCl 的平衡转化率增大,该反应正向为吸热反应,故A正确;
3
B.温度越高,反应速率越快,图象中点a所在曲线先建立平衡,温度高,表示的是343K时的曲线,由图示
可知343K时反应2SiHCl (g) SiH Cl (g)+SiCl (g)的平衡转化率α=22%,故B正确;
3 2 2 4
C.a点温度高于b,a、b处反应物浓度相等,a处反应速率大于b处,故C正确;
D.催化剂可缩短反应到达平衡的时间,但不影响平衡,故D错误;
综上所述,本题选D。
6.【详解】A.质量与标准状况与否无关,10.6g对二甲苯物质的量为1mol,其中含σ键数为18N ;A错误;
A
B.丙烯醛分子中形成一个Π4键,所有原子均共面,1mol分子中共面原子数为8N 。B错误;
4 A
C.乙醇分子中含5个碳氢键,乙醚分子中含10个碳氢键,所以相同质量乙醇和乙醚分子中碳氢键数目并不
相同。C正确;
D.1mol对二甲苯完全转化为对苯二甲酸失去12N 电子。D错误;
A
综上所述,答案为C。
7.【详解】A.乙醇分子中中心C为sp3杂化,丙酮分子中中心C为sp2杂化,所以C−C−O之间键角:丙酮
>乙醇。A正确;
B.M含有碳碳双键、醛基可以使溴水褪色,对二甲苯和溴水反应褪色只能萃取分层褪色,能鉴别,B正确;
C.该反应过程I中可能得到 ,则 在反应II中会得到副产物间二甲苯,C正确;
D.对二甲苯的二氯代物情况为: ,共7种,D错误;故选D。
8.【详解】A.II中氯化钡和亚硫酸钠反应生成二氧化硫、水、亚硫酸钡和氯化钠,有亚硫酸钡沉淀生成,故
A错误;
B.I、II中生成的气体分别为二氧化碳、二氧化硫,这两者均可使澄清石灰水变浑浊,故B正确;
C.NaHCO 溶液中HCO−会水解和电离,因此c ( Na+) >c ( HCO−) ,故C正确;
3 3 3
D.NaHSO 溶液pH=4,说明亚硫酸氢根电离程度大于水解程度,则c ( SO 2− ) >c(H SO ),故D正确。
3 3 2 3
学科网(北京)股份有限公司综上所述,答案为A。
9.【详解】A.比较HCOOH和H S的酸性,应选择同浓度HCOO−和HS−的盐溶液进行比较,测定等物质的
2
量浓度的HCOONH 和NH HS溶液的pH,后者pH大,说明甲酸酸性强,A正确;
4 4
B.在物质 X 柱面上滴一滴熔化的石蜡,用一根红热的铁针刺中凝固的石蜡,石蜡熔化呈椭圆形,说明石蜡
在不同方向熔化的快慢不同,这是由于X的导热性的各向异性决定的,说明物质X为晶体,B错误;
高温
C.碳与二氧化硅在高温下反应方程式为SiO +2C Si+2CO↑,碳作还原剂,无法证明非金属性:C>Si,
2
C错误;
D.加入氯化钾反应后银离子过量,再加入碘离子生成碘化银沉淀,不能说明同温下,K (AgI)