文档内容
东莞外国语学校 2024-2025 学年第一学期第 2 次月考
高三化学
命题人:胡志敏 审题人:黄伟平
说明:本试卷共4页,21小题,满分150分,考试用时120分钟。
注意事项:
1.答卷前,考生请用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填写在答题卡上。
2.选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑。
可能用到的相对原子质量:H-1 C-12 O-16 Al-27
一、选择题(本大题共16小题,满分44分,其中第1-10题,每小题2分;第11-16题,每小题4分,
在每小题给出的四个选项中,只有一项是符合题目要求的)
1.“葡萄美酒夜光杯”,酒具体现了历史进展。下列酒具中,主要由硅酸盐材料制成的是
A.清代彩绘龙纹蓝瓷壶 B.犀角雕玉兰花果纹杯 C.斫木云纹漆耳杯 D.青铜兽面纹爵
2.化学助力北京2022年冬奥会。下列说法中错误的是
A.运动员的滑雪服面料(尼龙)属于有机合成高分子材料
B.晶体硅光伏发电将化学能转化为电能为冬奥场馆供电
C.颁奖礼服使用的智能发热材料石墨烯,属于新型无机非金属材料
D.火炬“飞扬”在出火口格栅喷涂碱金属,目的是利用焰色反应让火焰可视化
3.“幸福不会从天降,美好生活靠劳动创造”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 家务劳动:用小苏打蒸馒头 能与酸反应产生气体
B 烹饪活动:向煮沸的豆浆中加入卤水制作豆腐 电解质溶液使胶体聚沉
C 学工活动:给铁制钥匙镀上铜层 在阴极放电生成铜单质
D 学农活动:施肥时,应将铵态氮肥及时埋在土中避免日晒 铵盐受热易分解
第 1 页
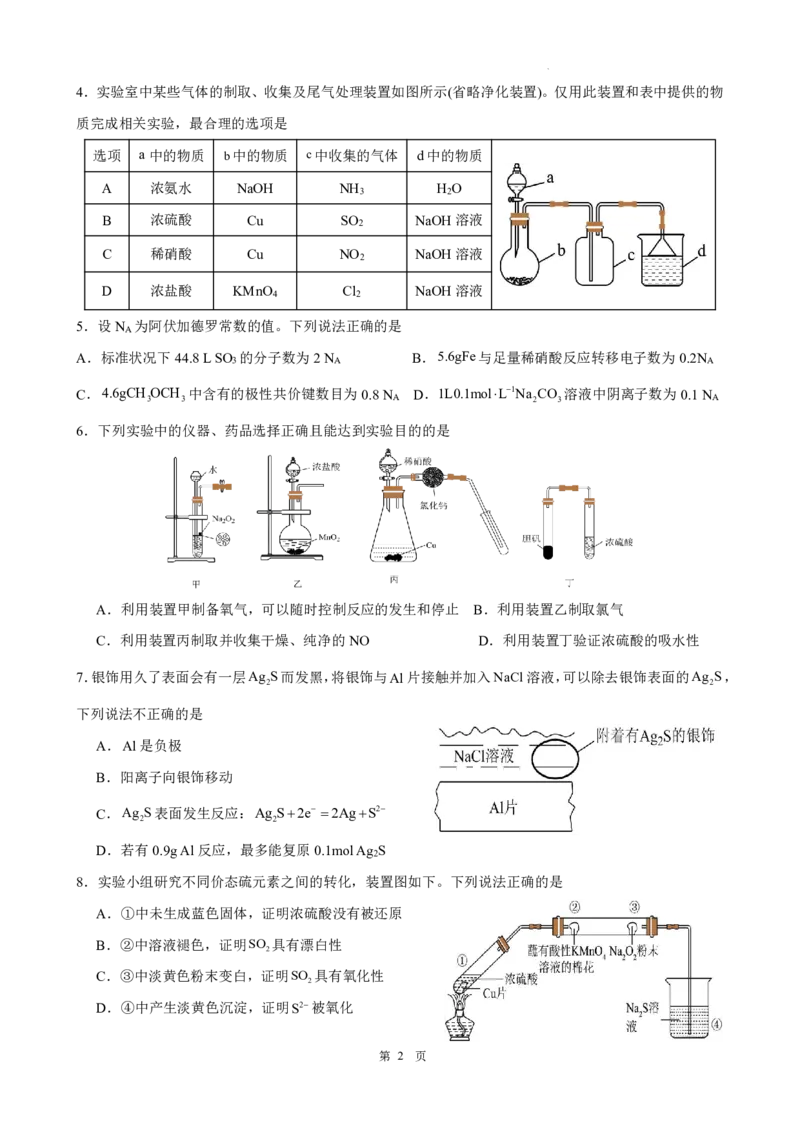
学科网(北京)股份有限公司4.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略净化装置)。仅用此装置和表中提供的物
质完成相关实验,最合理的选项是
选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水 NaOH NH H O
3 2
B 浓硫酸 Cu SO NaOH溶液
2
C 稀硝酸 Cu NO NaOH溶液
2
D 浓盐酸 KMnO Cl NaOH溶液
4 2
5.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.标准状况下44.8LSO 的分子数为2N B.5.6gFe与足量稀硝酸反应转移电子数为0.2N
3 A A
C.4.6gCH OCH 中含有的极性共价键数目为0.8N D.1L0.1molL1Na CO 溶液中阴离子数为0.1N
3 3 A 2 3 A
6.下列实验中的仪器、药品选择正确且能达到实验目的的是
A.利用装置甲制备氧气,可以随时控制反应的发生和停止 B.利用装置乙制取氯气
C.利用装置丙制取并收集干燥、纯净的NO D.利用装置丁验证浓硫酸的吸水性
7.银饰用久了表面会有一层Ag S而发黑,将银饰与Al片接触并加入NaCl溶液,可以除去银饰表面的Ag S,
2 2
下列说法不正确的是
A.Al是负极
B.阳离子向银饰移动
C.Ag S表面发生反应:Ag S2e 2AgS2
2 2
D.若有0.9gAl反应,最多能复原0.1molAg S
2
8.实验小组研究不同价态硫元素之间的转化,装置图如下。下列说法正确的是
A.①中未生成蓝色固体,证明浓硫酸没有被还原
B.②中溶液褪色,证明SO 具有漂白性
2
C.③中淡黄色粉末变白,证明SO 具有氧化性
2
D.④中产生淡黄色沉淀,证明S2被氧化
第 2 页
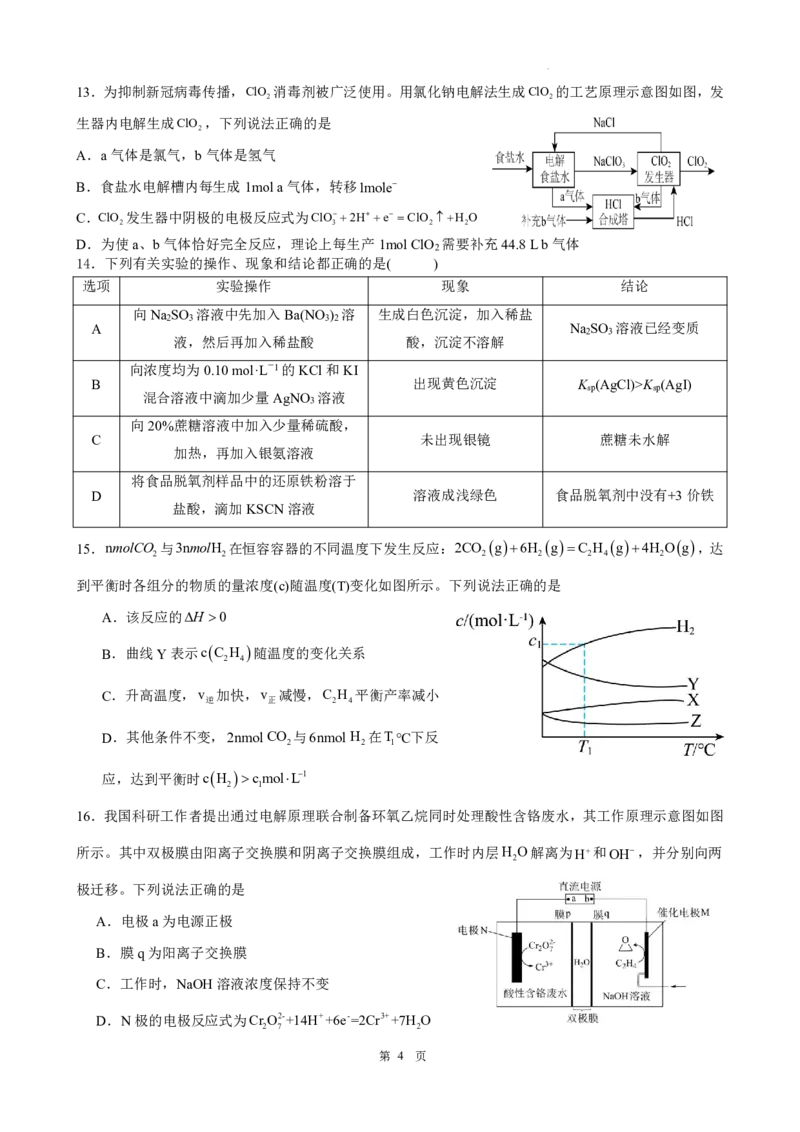
学科网(北京)股份有限公司9.部分含S和Cl的物质分类与相应化合价的关系如图所示。下列说法正
.
确
.
的是
A.a和e都是强酸
B.c和g都具有漂白性,其使品红溶液褪色的原理相同
C.b或f与金属Cu反应的产物中Cu的化合价均为2
D.向f的水溶液中通入c,溶液的酸性增强
10.下列条件下,对应离子一定能大量共存的是
A.0.1mol·L-1的NaHCO 溶液中:Al3+、K+、Cl-、NO
3 3
B.使甲基橙变红的溶液中:NH、Al3+、Cl-、Mg2+
4
C.新制饱和氯水溶液中:
D.
c(OH)
=1×1012的溶液中:Fe2+、NO、HCO、Na+
c(H) 3 3
11.下列离子方程式书写正
.
确
.
的是
A.浓硝酸和铁在常温下反应:Fe+6H++3NO-=Fe3++3NO ↑+3H O
3 2 2
B.向硫酸铜溶液中加入氢氧化钡溶液:
向 :
C. Ba(HCO ) 溶液中滴入NaHSO 溶液使 恰好完全沉淀
3 2 4
D.向NaClO溶液中通入少量SO :ClO-+SO +H O=SO2-+Cl-+2H+
2 2 2 4
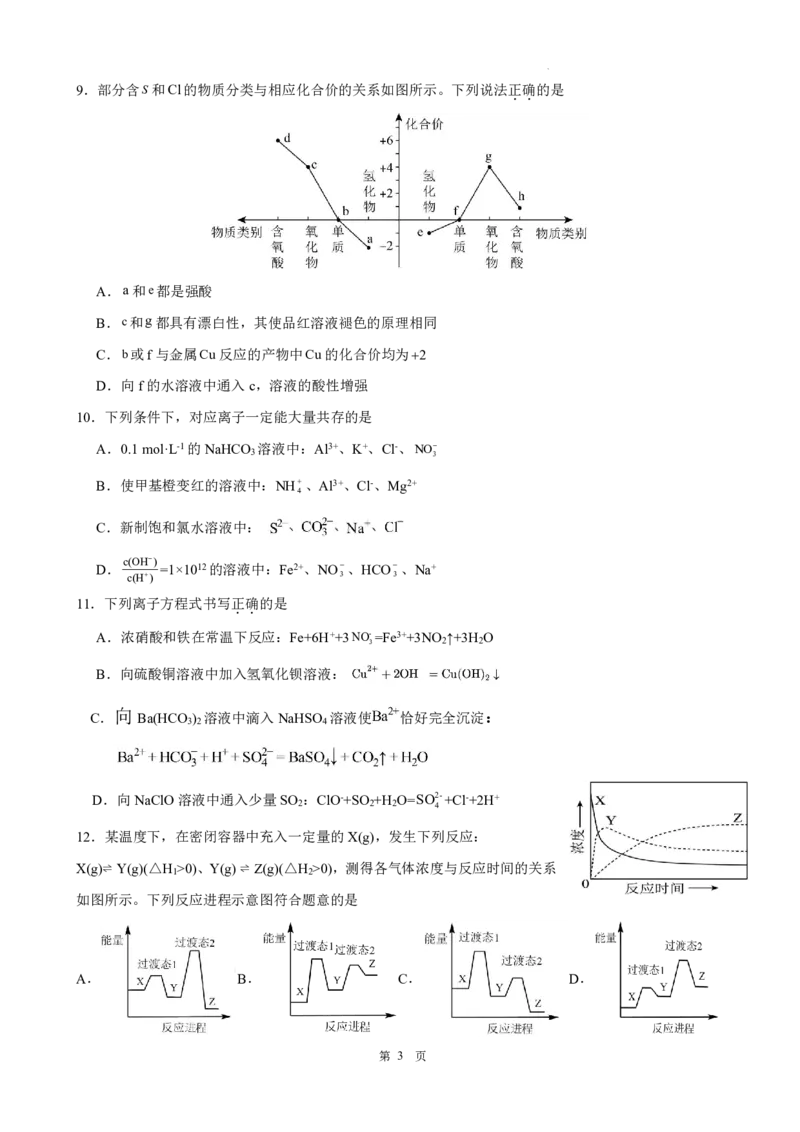
12.某温度下,在密闭容器中充入一定量的X(g),发生下列反应:
X(g)⇌ Y(g)(△H >0)、Y(g)⇌ Z(g)(△H >0),测得各气体浓度与反应时间的关系
1 2
如图所示。下列反应进程示意图符合题意的是
A. B. C. D.
第 3 页
学科网(北京)股份有限公司13.为抑制新冠病毒传播,ClO 消毒剂被广泛使用。用氯化钠电解法生成ClO 的工艺原理示意图如图,发
2 2
生器内电解生成ClO ,下列说法正确的是
2
A.a气体是氯气,b气体是氢气
B.食盐水电解槽内每生成1mola气体,转移1mole
C.ClO 发生器中阴极的电极反应式为ClO2He ClO H O
2 3 2 2
D.为使a、b气体恰好完全反应,理论上每生产1molClO 需要补充44.8Lb气体
2
14.下列有关实验的操作、现象和结论都正确的是( )
选项 实验操作 现象 结论
向Na SO 溶液中先加入Ba(NO ) 溶 生成白色沉淀,加入稀盐
2 3 3 2
A Na 2 SO 3 溶液已经变质
液,然后再加入稀盐酸 酸,沉淀不溶解
向浓度均为0.10mol·L-1的KCl和KI
B 出现黄色沉淀 K (AgCl)>K (AgI)
sp sp
混合溶液中滴加少量AgNO 溶液
3
向20%蔗糖溶液中加入少量稀硫酸,
C 未出现银镜 蔗糖未水解
加热,再加入银氨溶液
将食品脱氧剂样品中的还原铁粉溶于
D 溶液成浅绿色 食品脱氧剂中没有+3价铁
盐酸,滴加KSCN溶液
15.nmolCO 与3nmolH 在恒容容器的不同温度下发生反应:2CO g6H gC H g4H Og,达
2 2 2 2 2 4 2
到平衡时各组分的物质的量浓度(c)随温度(T)变化如图所示。下列说法正确的是
A.该反应的H 0
B.曲线Y表示cC H 随温度的变化关系
2 4
C.升高温度,v 加快,v 减慢,C H 平衡产率减小
逆 正 2 4
D.其他条件不变,2nmolCO 与6nmol H 在T℃下反
2 2 1
应,达到平衡时cH cmolL1
2 1
16.我国科研工作者提出通过电解原理联合制备环氧乙烷同时处理酸性含铬废水,其工作原理示意图如图
所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H O解离为H和OH,并分别向两
2
极迁移。下列说法正确的是
A.电极a为电源正极
B.膜q为阳离子交换膜
C.工作时,NaOH溶液浓度保持不变
D.N极的电极反应式为CrO2-+14H++6e-=2Cr3++7H O
2 7 2
第 4 页
学科网(北京)股份有限公司二、填空题:本大题共4题,每题14分,满分56分.
17.(14分)为研究FeCl 溶液的性质,某小组同学进行了如下探究实验。
3
Ⅰ.配制FeCl 溶液
3
(1)FeCl 溶液的配制:取FeCl 固体溶于 (填试剂名称),再稀释至指定浓度。
3 3
(2)将5.00molL1 FeCl 溶液稀释成250mL 0.50molL1 FeCl 溶液,稀释过程中一定不需要使用的仪器有
3 3
(填仪器名称)。
Ⅱ.FeCl 溶液与锌粉反应的探究
3
小组同学进行如下实验探究,操作及现象如下:
操作 现象
向反应瓶中加入过量锌粉,然后加入50ml 一段时间后有气泡产生,反应缓慢,pH逐渐增大,产生
0.5mol/L的FeCl 溶液,搅拌,充分反应 了大量红褐色沉淀后,无气泡冒出,此时溶液pH为3~4
3
收集检验反应过程中产生的气体 集气管口靠近火焰,有爆鸣声
(3)结合实验现象和平衡移动原理解释出现红褐色沉淀的原因 。
(4)取实验后的溶液,滴加 (填化学式)溶液,证明有Fe2生成。
原体系中生成Fe2的离子方程式: 。
(5)分离出固体,甲同学提出固体中除了有FeOH ,可能还有铁单质,于是设计下列实验检验固体的成分:
3
i.用蒸馏水洗涤固体后、加入足量的稀盐酸并加热,产生气泡,固体全部溶解。
ii.向i反应后的溶液中滴加KSCN溶液,无变化。
由此甲同学得出结论,一定含有铁单质。但乙同学认为不严谨,他的理由是: 。
乙同学用很简单的方法证明了沉淀中不含铁单质,方法是: 。
(6)针对原实验中为何没有产生铁单质查阅资料,得知可能是产生的红褐色沉淀包裹在Zn粉上,阻碍了Zn
与Fe2的反应。实验证实了Zn粉被包裹。资料:0.50molL1 Fe3开始沉淀的pH约为1.2,完全沉淀的pH
约为3。于是重新做实验,当溶液pH为3~4时,不取出固体,向固-液混合物中持续加入盐酸,控制pH<1.2,
_
(填实验操作和现象),停止加入盐酸,待pH为3~4时,取出固体,固体中检测到Fe单质。
第 5 页
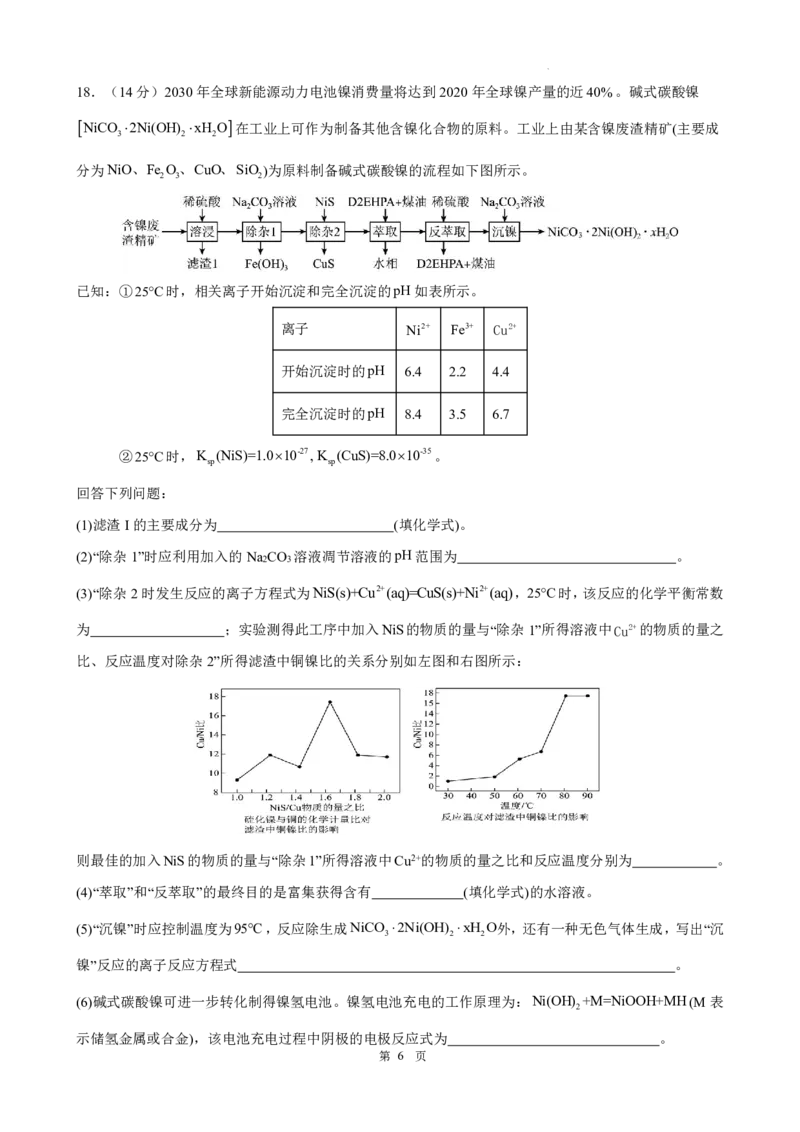
学科网(北京)股份有限公司18.(14分)2030年全球新能源动力电池镍消费量将达到2020年全球镍产量的近40%。碱式碳酸镍
NiCO 2Ni(OH) xH O 在工业上可作为制备其他含镍化合物的原料。工业上由某含镍废渣精矿(主要成
3 2 2
分为NiO、Fe O、CuO、SiO )为原料制备碱式碳酸镍的流程如下图所示。
2 3 2
已知:①25C时,相关离子开始沉淀和完全沉淀的pH如表所示。
离子 Ni2+ Fe3+ Cu2+
开始沉淀时的pH 6.4 2.2 4.4
完全沉淀时的pH 8.4 3.5 6.7
②25C时,K (NiS)=1.010-27, K (CuS)=8.010-35。
sp sp
回答下列问题:
(1)滤渣I的主要成分为 (填化学式)。
(2)“除杂1”时应利用加入的Na CO 溶液凋节溶液的pH范围为 。
2 3
(3)“除杂2时发生反应的离子方程式为NiS(s)+Cu2+(aq)=CuS(s)+Ni2+(aq),25C时,该反应的化学平衡常数
为 ;实验测得此工序中加入NiS的物质的量与“除杂1”所得溶液中Cu2+的物质的量之
比、反应温度对除杂2”所得滤渣中铜镍比的关系分别如左图和右图所示:
则最佳的加入NiS的物质的量与“除杂1”所得溶液中Cu2+的物质的量之比和反应温度分别为 。
(4)“萃取”和“反萃取”的最终目的是富集获得含有 (填化学式)的水溶液。
(5)“沉镍”时应控制温度为95C,反应除生成NiCO 2Ni(OH) xH O外,还有一种无色气体生成,写出“沉
3 2 2
镍”反应的离子反应方程式 。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池充电的工作原理为:Ni(OH) +M=NiOOH+MH(M表
2
示储氢金属或合金),该电池充电过程中阴极的电极反应式为 。
第 6 页
学科网(北京)股份有限公司第 7 页
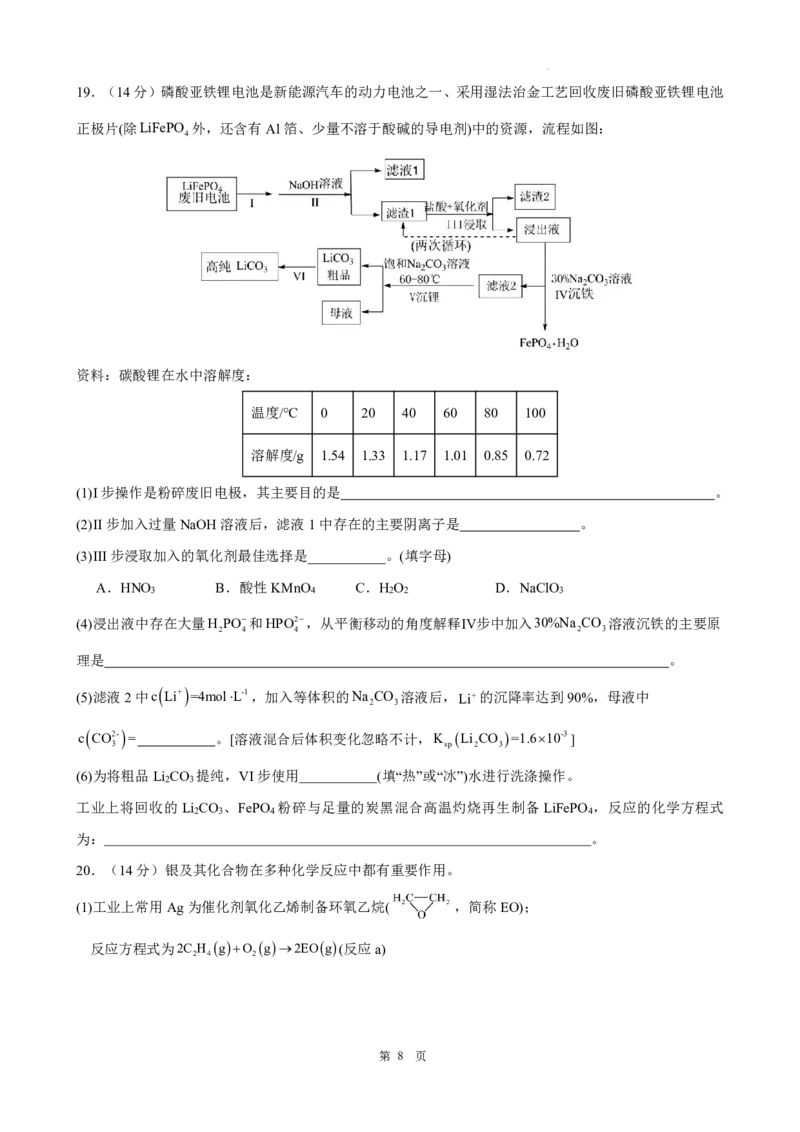
学科网(北京)股份有限公司19.(14分)磷酸亚铁锂电池是新能源汽车的动力电池之一、采用湿法治金工艺回收废旧磷酸亚铁锂电池
正极片(除LiFePO 外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,流程如图:
4
资料:碳酸锂在水中溶解度:
温度/℃ 0 20 40 60 80 100
溶解度/g 1.54 1.33 1.17 1.01 0.85 0.72
(1)I步操作是粉碎废旧电极,其主要目的是 。
(2)II步加入过量NaOH溶液后,滤液1中存在的主要阴离子是 。
(3)III步浸取加入的氧化剂最佳选择是___________。(填字母)
A.HNO B.酸性KMnO C.H O D.NaClO
3 4 2 2 3
(4)浸出液中存在大量H PO和HPO2,从平衡移动的角度解释Ⅳ步中加入30%Na CO 溶液沉铁的主要原
2 4 4 2 3
理是 。
(5)滤液2中c Li+ =4molL-1,加入等体积的Na CO 溶液后,Li的沉降率达到90%,母液中
2 3
c CO2- = 。[溶液混合后体积变化忽略不计,K Li CO =1.610-3]
3 sp 2 3
(6)为将粗品Li CO 提纯,VI步使用 (填“热”或“冰”)水进行洗涤操作。
2 3
工业上将回收的 Li CO 、FePO 粉碎与足量的炭黑混合高温灼烧再生制备LiFePO ,反应的化学方程式
2 3 4 4
为: 。
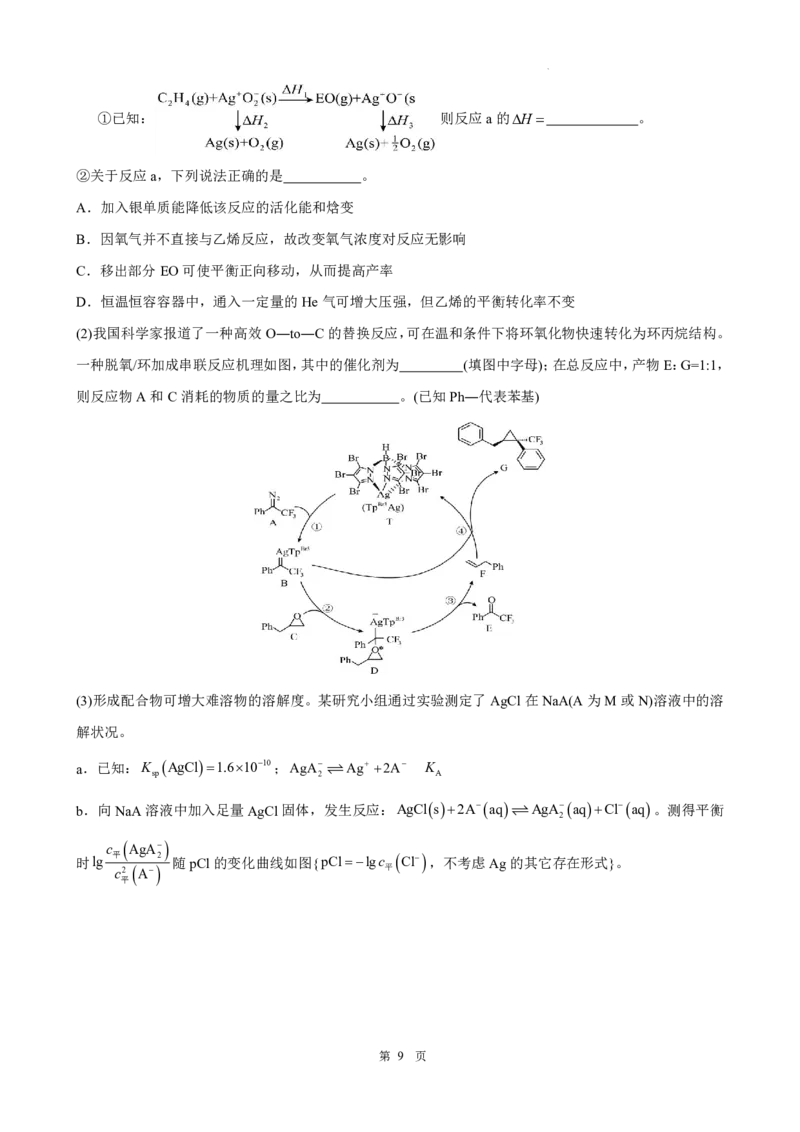
20.(14分)银及其化合物在多种化学反应中都有重要作用。
(1)工业上常用Ag为催化剂氧化乙烯制备环氧乙烷( ,简称EO);
反应方程式为2C H gO g2EOg (反应a)
2 4 2
第 8 页
学科网(北京)股份有限公司①已知: 则反应a的H 。
②关于反应a,下列说法正确的是 。
A.加入银单质能降低该反应的活化能和焓变
B.因氧气并不直接与乙烯反应,故改变氧气浓度对反应无影响
C.移出部分EO可使平衡正向移动,从而提高产率
D.恒温恒容容器中,通入一定量的He气可增大压强,但乙烯的平衡转化率不变
(2)我国科学家报道了一种高效O―to―C的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。
一种脱氧/环加成串联反应机理如图,其中的催化剂为 (填图中字母);在总反应中,产物E:G=1:1,
则反应物A和C消耗的物质的量之比为 。(已知Ph―代表苯基)
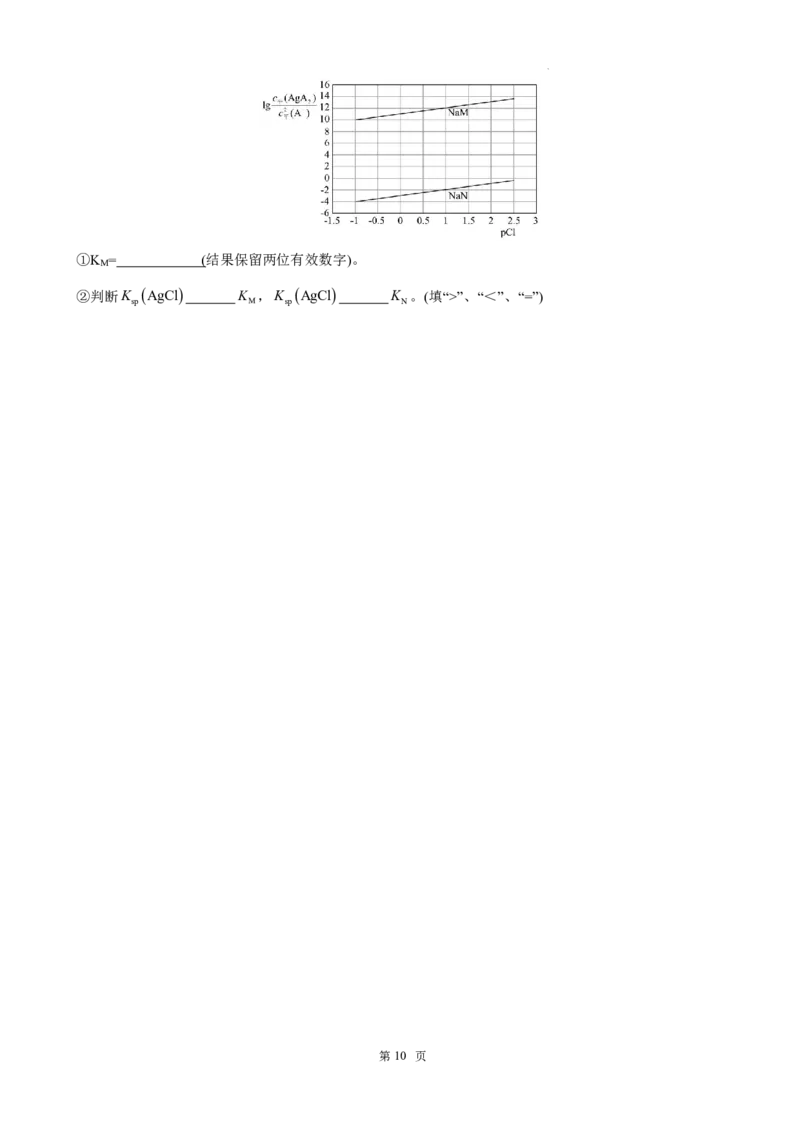
(3)形成配合物可增大难溶物的溶解度。某研究小组通过实验测定了AgCl在NaA(A为M或N)溶液中的溶
解状况。
a.已知:K AgCl1.61010;AgA Ag 2A K
sp 2 A
b.向NaA溶液中加入足量AgCl固体,发生反应:AgCls2Aaq AgAaqClaq。测得平衡
2
c
AgA
时lg 平 2 随pCl的变化曲线如图{pCllgc Cl ,不考虑Ag的其它存在形式}。
c2 A 平
平
第 9 页
学科网(北京)股份有限公司①K = (结果保留两位有效数字)。
M
②判断K AgCl K ,K AgCl K 。(填“>”、“<”、“=”)
sp M sp N
第10 页
学科网(北京)股份有限公司东莞外国语学校 2024-2025 学年第一学期第 2 次月考
高三化学 参考答案
1-5 ABADC 6-10ADDDB 11-16CDCBDD
17.(14分,除特殊说明外,每空2分)
(1)浓盐酸(1分)
(2)漏斗、分液漏斗
(3)Fe3++3H OFeOH +3H+,Zn与H反应使溶液中cH+ 降低,会促进上述平衡正向移动,出现红褐色
2 3
FeOH 沉淀
3
(4) K 3 FeCN 6 (1分) 2Fe3++Zn=2Fe2++Zn2+
(5) 过量的锌粉也会与盐酸反应产生气体,也能还原Fe3 用磁铁吸引固体
(6)加入几滴KSCN溶液,待溶液红色消失后
18.(14分,除特殊说明外,每空2分)
(1)SiO
2
(2)3.5pH<4.4
(3) 1.25107 1.6、80℃
(4)NiSO
4
(5)3Ni2++3CO 2-+(2+x)H O==NiCO •2Ni(OH) •xH O+2CO ↑
3 2 3 2 2 2
(6)M+H O+e-=MH+OH-
2
19.(14分,除特殊说明外,每空2分)
(1)增大接触面积,提高溶解效率 (2)OH、 Al(OH)
4
- (3)C
(4)CO2结合H,使c H 减小,H PO HPO2H,HPO2 PO3H两个电离平衡均向右移
3 2 4 4 4 4
动,c
PO3
增大,与Fe3结合形成磷酸铁
4
高温
(5)0.04molL1 (6) 热 LiCO +2FePO +2C 2LiFePO +3CO↑
2 3 4 4
20.(14分,除特殊说明外,每空2分)
(1) 2H H H CD (2) T 2∶1
1 3 2
(3) 1.6×10-21 > <
第 1 页
学科网(北京)股份有限公司