文档内容
化学参考答案和评分标准
答案及解析
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
A
C
A
C
A
B
D
D
C
B
A
B
D
B
C
1.【答案】A
【详解】电解海水需要消耗能量,A 错误;青蒿素(C15H22O5)是一种烃的衍生物,B 正确;稀土元素或称稀土
金属,是元素周期表上第3 族之钪、钇和镧系元素共17 种金属化学元素的合称,皆属于副族元素,稀土全部是
金属元素,C 正确;过氧化氢是一种极性分子,D 正确。
2.【答案】C
【详解】陶瓷和碳纤维复合材料属于新型的无机非金属材料,A 错误;氟化钾镁属于化合物,不属于合金,故B
错误;碳化硅是一种新型无机非金属材料,C 正确;用于光热电站的保温材料陶瓷纤维属于新型无机非金属材料,
D 错误。
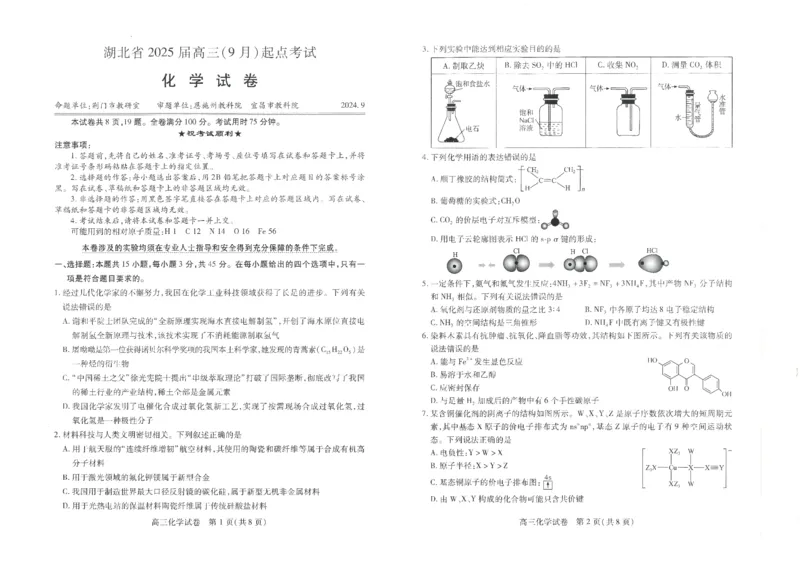
3.【答案】A
【详解】用电石和饱和食盐水反应制乙炔,A 正确;饱和食盐水会将SO2 和HCl 都吸收掉,B 错误;NO2 密度比
空气大,用向上排空气法收集,C 错误;二氧化碳能溶于水,不能用排水法测体积,D 错误。
4.【答案】C
【详解】顺丁橡胶是顺-1,4-聚丁二烯橡胶,结构简式为
,A 正确;实验式是指有机化合物各元素
原子的最简整数比,葡萄糖的分子式为C6H12O6,实验式为CH2O,B 正确;CO2 的价层电子对互斥(VSEPR)模型
为
直线形,C 错误;s 电子云轮廓图为球形,p 电子云轮廓图为哑铃状,用电子云轮廓图表示HCl 的σ
键为
,D 正确。
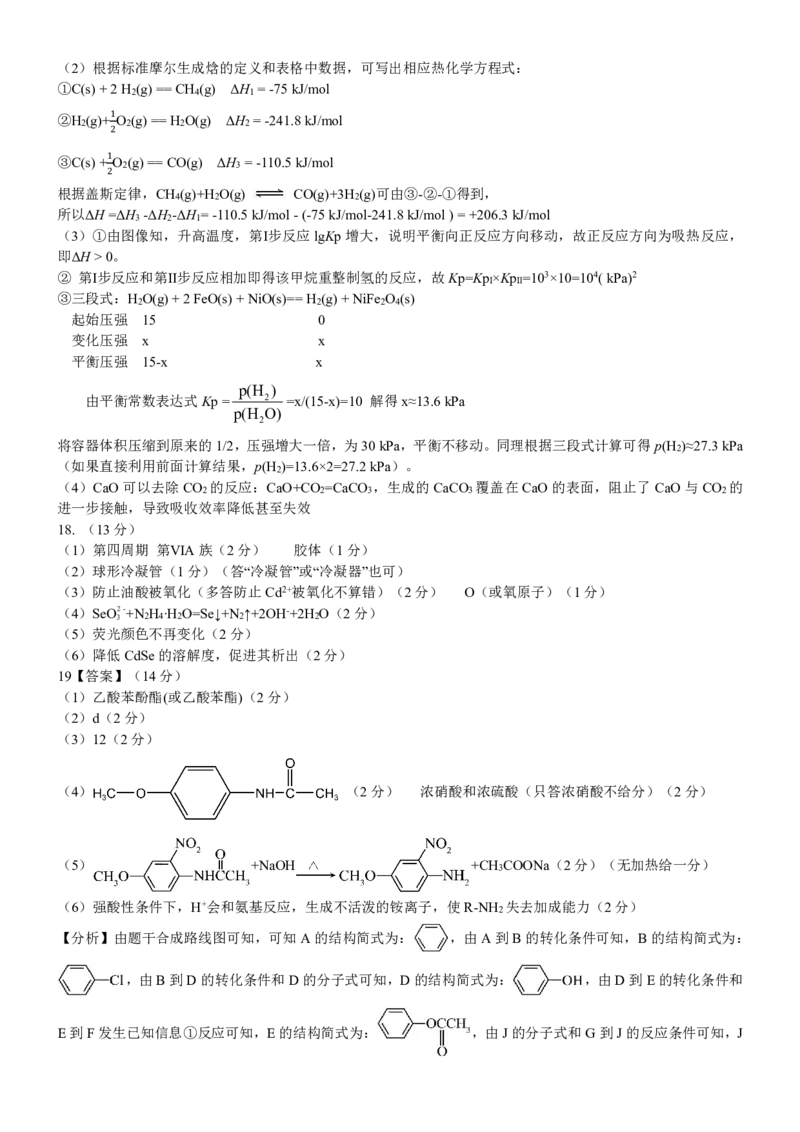
5.【答案】A
【详解】由方程式可知,氧化剂与还原剂物质的量之比3:1,A 错误;NF3 中N 原子与3 个F 原子形成3 对共用
电子对,使分子中各原子均满足8 电子稳定结构,B 正确;NH3 的空间结构是三角锥形,键角107°,C 正确;
NH4F 是离子化合物,含有离子键,NH
+
4 中有N-H 共价键,D 正确。
6.【答案】B
【详解】染料木素含有酚羟基,能与Fe3+发生显色反应,A 正确;染料木素易溶于乙醇,但是难溶于水,B 错误;
染料木素含有酚羟基,与空气接触易被氧化变质,C 正确;加成后的产物含6 个手性碳用*表示如图:
,D 正确。
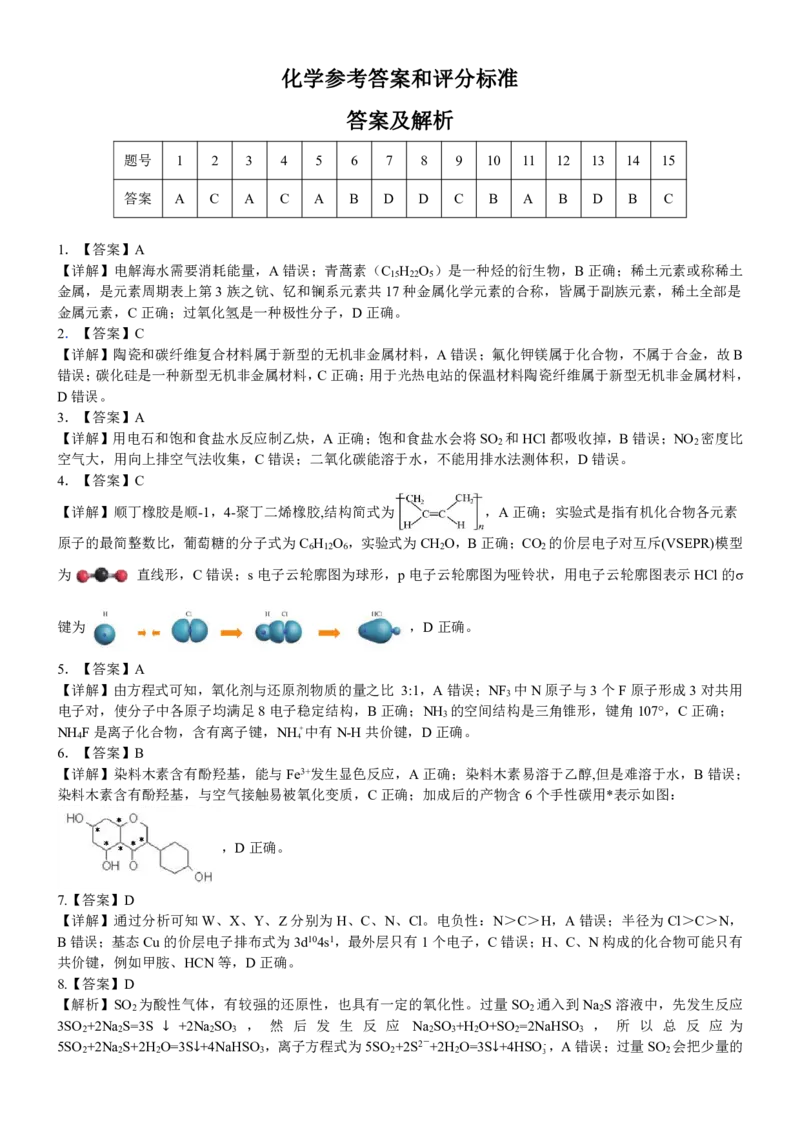
7.【答案】D
【详解】通过分析可知W、X、Y、Z 分别为H、C、N、Cl。电负性:N>C>H,A 错误;半径为Cl>C>N,
B 错误;基态Cu 的价层电子排布式为3d104s1,最外层只有1 个电子,C 错误;H、C、N 构成的化合物可能只有
共价键,例如甲胺、HCN 等,D 正确。
8.【答案】D
【解析】SO2 为酸性气体,有较强的还原性,也具有一定的氧化性。过量SO2 通入到Na2S 溶液中,先发生反应
3SO2+2Na2S=3S ↓+2Na2SO3 ,然后发生反应
Na2SO3+H2O+SO2=2NaHSO3 ,所以总反应为
5SO2+2Na2S+2H2O=3S↓+4NaHSO3,离子方程式为5SO2+2S2-+2H2O=3S↓+4HSO -
3 ,A 错误;过量SO2 会把少量的
Ca(ClO)2 反应完全,化学方程式为Ca(ClO)2+2H2O+2SO2== CaSO4↓+2HCl+H2SO4,所以离子方程式为
Ca2++2ClO−+2SO2+2H2O=CaSO4↓+2Cl−+ 4H++SO2 -
4 ,B 错误;SO2 有一定的还原性,通入CuCl2 溶液产生白色沉
淀,说明生成CuCl,化学方程式为SO2+2CuCl2+2H2O=2CuCl↓+H2SO4+2HCl,所以离子方程式为SO2+2Cu2+
+2Cl−+2H2O=2CuCl↓+4H
++ SO2 -
4 +2Cl−,C 错误;SO2 有较强的还原性,通入到Fe2(SO4)3 溶液中,溶液由浅黄
色变为浅绿色,反应的化学方程式为SO2+Fe2(SO4)3+2H2O===2FeSO4+2H2SO4,所以离子方程式为SO2+2Fe3+
+2H2O=== SO2 -
4 +2Fe2++4H
+,D 正确。
9.【答案】C
【解析】HNO3 分子内的羟基氢与非羟基氧形成氢键,即分子内氢键,导致HNO3 沸点较低。A 正确;石墨为层
状结构,层与层之间的碳原子平面相隔较远,电子不易跨越,所以未杂化的p 轨道重叠使电子几乎只能在整个碳
原子平面中运动,石墨的导电性只能沿石墨平面的方向,B 正确;CO2 中有两组3 中心4 电子π键,电子云分布
更均匀,分子较为稳定,能量较低,C 错误;Cl 的电负性较大,是吸电子基团,使双键电子云向中间碳原子偏
移,电荷相反基团相互吸引,所以HClO 分子中带正电性的Cl 易连在带负电性中心碳原子上,D 正确。
10.【答案】B
【解析】装置X 中的长颈漏斗作用是平衡气压,换成长玻璃导管也可起到相同作用,A 正确;存在转化关系
Cr2O2 -
7 (橙色)+H2O
2CrO2 -
4 (黄色)+2H+,通入氨气后c(H+)减小,平衡正向移动,溶液颜色应该由橙色变
为黄色,B 错误;装置b 的作用是吸收过量氨气,酸性固体干燥剂P2O5 可以吸收氨气,C 正确;随着反应进行,
溶解度较小K2Cr2O7 的转化为溶解度较大的K2CrO4,可观察到装置Y 中晶体减少或者消失,D 正确。
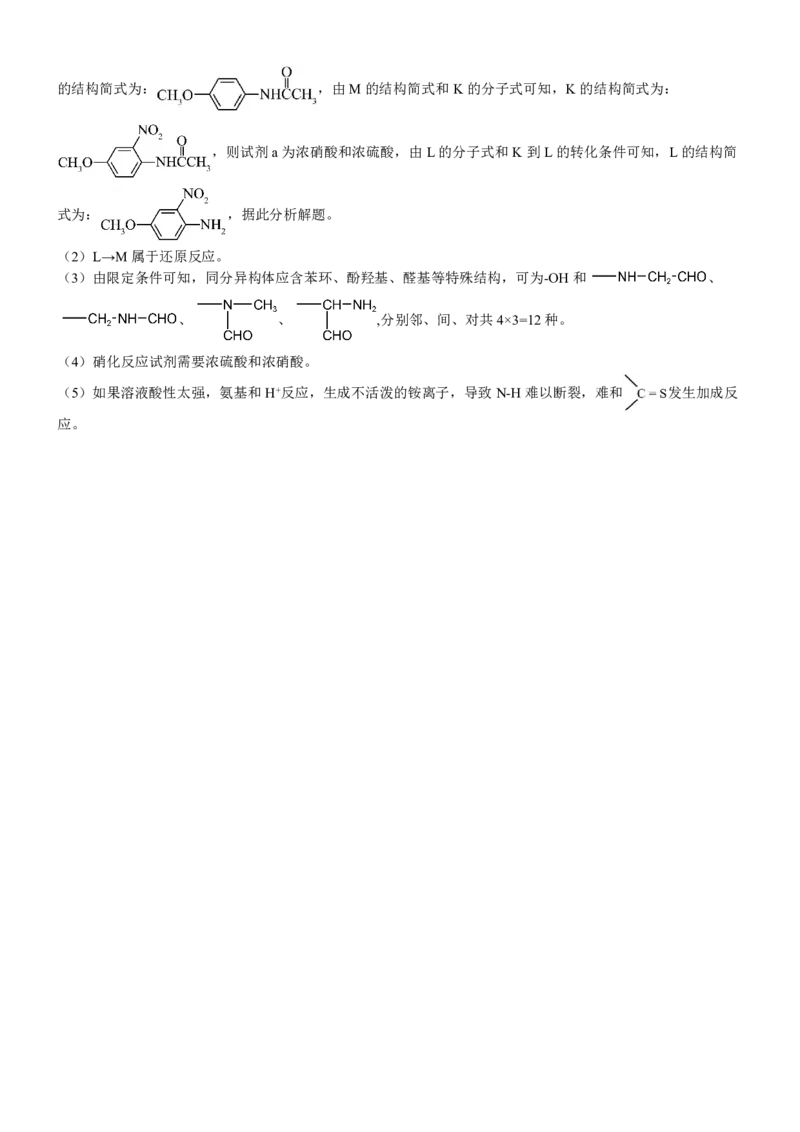
11.【答案】A
【解析】由该物质结构可以推知对应单体具有碳碳双键,单体发生加聚反应制得该物质,A 正确;该物质兼具离
子液体良好导电性的性能,高分子为混合物,不属于电解质,B 错误;该物质具有若干sp3 杂化的C 原子,所有
原子不能在同一平面内,C、D 均错误。
12.【答案】B
【解析】在通常状况下,N2 分子内部以极强的共价键结合,分子间以较弱的范德华作用力结合。随着压强的不
断增大,分子间距离不断被压缩。固体分子中分子间距逐渐接近于原子尺寸级别,且不同分子中相邻原子之间的
相互作用逐渐增强。当分子间相互作用与分子内部的原子间共价作用相当时,分子内部原有的共价键会被破坏发
生断裂,从而使得双原子分子结构发生解离,转变为原子相,A 项正确;α相晶胞是立方晶胞,分子配位数为12,
γ晶胞是四方晶系晶胞,分子配位数为4,B 项错误;α相晶胞中平均含有
4
2
1
6
8
1
8
个分子,γ相晶胞中平
均含有
2
1
1
8
1
8
个分子,此时原子个数之比= 分子个数之比=2:1 ,C 项正确;α 相晶体密度
=
3
10
10
28
4
)
(
a
NA
=
A
N
a3
32
10
12
1
.
g▪cm-3,D 项正确。
13.【答案】D
【详解】含1 mol 乳酸(HLac) 和1 mol 乳酸钠(NaLac) 的溶液的pH 为3.85 ,则
-
+
HLac
Lac +H
,
-
3.85
c Lac c H
K=
=10
c HLac
,数量级为10
-4,A 正确;原缓冲溶液中由电荷守恒得:c(Na+)+c(H+)=c(Lac-)+c(H+)
;
由物料守恒得:c(Lac-)+c(Hac)=2c(Na+) ,两边消c(Na+)得c(HLac)+2c(H+)=c(Lac-)+2c(OH-) ,B 正确;根据图像
可以判断,M 点溶液pH 发生突变,则已失去缓冲能力,C 正确;加入0.5 molNaOH 后,由电荷守恒可知显
c(H+)>c(OH-),则c(Na+)<c(Lac-),D 错误。
14.【答案】B
【分析】放电时,锌箔电极为原电池的负极,电极反应式为Zn—2e—+4OH—=[Zn(OH)4]2-,
2
Mo C/NiCu
C
@
电极
为正极,水分子在正极得到电子发生还原反应生成氢气和氢氧根离子,电极反应式为2H2O+2e—=H2↑+2OH—,氢
氧根离子通过阴离子交换膜由正极移向负极;充电时,与直流电源负极相连的锌箔电极为阴极,四羟基合锌离子
在阴极得到电子发生还原反应生成锌和氢氧根离子,电极反应式为[Zn(OH)4]2-+2e—=Zn+4OH—,
2
Mo C/NiCu
C
@
电
极为阳极,碱性条件下氨分子在阳极失去电子发生氧化反应生成氮气和水,电极反应式为
2NH3—6e—+6OH—=N2+6H2O,氢氧根离子通过阴离子交换膜由阴极移向阳极。
【详解】由分析可知,放电时,锌箔电极为原电池的负极,
2
Mo C/NiCu
C
@
电极为正极,则锌箔电极的电势小于
2
Mo C/NiCu
C
@
电极,A 正确;由分析可知,放电时,
2
Mo C/NiCu
C
@
电极为正极,水分子在正极得到电子发生
还原反应生成氢气和氢氧根离子,电极反应式为2H2O+2e—=H2↑+2OH—,B 错误;由分析可知,放电时,氢氧根
离子通过阴离子交换膜由正极移向负极,充电时,与直流电源负极相连的锌箔电极为阴极,氢氧根离子通过阴离
子交换膜由阴极移向阳极,C、D 正确。
15.【答案】C
【详解】强相互作用指形成化学键,此处不是,A 正确;排挤出水分子,使得腔外更多水分子聚集,增加了水分
子间的氢键,降低体系的能量,B 正确;排挤出水分子,使呈自由状态的水分子数增加,无序度增加,是熵增的
过程,C 错误;基团换成“-C6H4C(CH3)3 后可进入到下一个环六糊精的空腔,从而形成链状结构,D 正确。
16.(14 分)
【答案】(1)3 (1 分)
(2)b(1 分)
(3)[Al(OH)4]
-+CO2=Al(OH)3↓+HCO
3 (2 分)(或写成AlO
2 +CO2+2H2O=Al(OH)3↓+HCO
3 )
(4)防止高温下H2O2 分解(2 分)
2(2 分)
(5)Li2SO4 + 2NaHCO3 = Li2CO3↓+ CO2↑+ H2O+Na2SO4 (2 分)(加热符号写不写也可以)
写分步反应:Li2SO4 + 2NaHCO3 = 2LiHCO3 +Na2SO4
2LiHCO3 =Li2CO3↓+ CO2↑+ H2O 也可以得分
(6)趁热过滤(2 分,只答“过滤”不给分)
(7)
1.68�
�(2 分)
【详解】(1)电子在回到基态的过程中,有2p→2s,2p→1s,2s→1s 三种情况,所以最多可以发出3 种不同波长的
光。
(2)在“碱浸”时,适当提高浸出温度、适当提高氢氧化钠的浓度可加快浸出速率;增大废料的颗粒会减慢反应
速率。所以选b。
(3)碱浸后,正极材料中的铝会和氢氧化钠反应生成Na[Al(OH)4],所以“滤液1”中有大量[Al(OH)4]
-,当通入
过量CO2 后,会生成Al(OH)3 沉淀。离子方程式为[Al(OH)4]
-+CO2=Al(OH)3↓+HCO
3
(4)酸浸时的离子方程式为:2 LiFePO4+ H2O2+2H+=2 Li++2Fe3++2PO3 -
4 +2H2O,温度不宜过高是为了防止高温下
H2O2 分解,由以上离子方程式可知,当释放4 molLi+时,至少需要消耗H2O2 的物质的量为2 mol。
(5)氨水处理后的“滤液3”中含有大量Li+,加入饱和NaHCO3反应生成Li2CO3沉淀,方程式为Li2SO4 + 2NaHCO3
= Li2CO3↓+ CO2↑+ H2O+Na2SO4。
(6)由于Li2CO3 的溶解度随温度的升高而减小,所以在制备的过程中,水浴加热可促进Li2CO3 的生成和析出,
趁热过滤可以减少因Li2CO3 的溶解造成的损失。
(7)K2Cr2O 滴定Fe2+时将Fe2+氧化为Fe3+,自身被还原为Cr3+。反应为Cr2O2 -
7 + 6Fe2+ + 14H+ == 6Fe3+ + 2Cr3+ +
7H2O,50 ml 样品消耗的n(Cr2O2 -
7 )=0.01V×10-3 mol=10-5 V mol,则n(Fe2+)=6×10-5 V mol。最终计算样品中铁的质
量分数为
�(Fe)
�(总)×100%=
250
50 ×6×10−5 V mol×56 g/mol
��
×100%=
1.68�
�%。
17.【答案】(14 分)
(1)CH4 + NiFe2O4
CO + 2H2 + 2 FeO + NiO(2 分)
(2)+206.3(2 分)
(3)①>(2 分)
②104(2 分)
③13.6 (2 分)
27.3(或者27.2)(2 分)
(4)CaO 可以去除CO2 的反应:CaO+CO2=CaCO3,生成的CaCO3 覆盖在CaO 的表面,阻止了CaO 与CO2 的
进一步接触,导致吸收效率降低甚至失效(2 分)
【解析】(1)根据甲烷重整制氢反应分步示意图,找出第Ⅰ步反应的反应物为CH4 和NiFe2O4 ,生成物为CO、
H2 、FeO 和NiO,配平即得到第Ⅰ步反应的化学反应方程式为:CH4 + NiFe2O4
CO + 2H2 + 2 FeO + NiO
(2)根据标准摩尔生成焓的定义和表格中数据,可写出相应热化学方程式:
①C(s) + 2 H2(g) == CH4(g)
ΔH1 = -75 kJ/mol
②H2(g)+
1
2O2(g) == H2O(g)
ΔH2 = -241.8 kJ/mol
③C(s) +
1
2O2(g) == CO(g)
ΔH3 = -110.5 kJ/mol
根据盖斯定律,CH4(g)+H2O(g)
CO(g)+3H2(g)可由③-②-①得到,
所以ΔH =ΔH3 -ΔH2-ΔH1= -110.5 kJ/mol - (-75 kJ/mol-241.8 kJ/mol ) = +206.3 kJ/mol
(3)①由图像知,升高温度,第Ⅰ步反应lgKp 增大,说明平衡向正反应方向移动,故正反应方向为吸热反应,
即ΔH > 0。
②第Ⅰ步反应和第Ⅱ步反应相加即得该甲烷重整制氢的反应,故Kp=KpⅠ×KpⅡ=103×10=104( kPa)2
③三段式:H2O(g) + 2 FeO(s) + NiO(s)== H2(g) + NiFe2O4(s)
起始压强
15
0
变化压强
x
x
平衡压强
15-x
x
由平衡常数表达式Kp =
O)
p(H
)
p(H
2
2
=x/(15-x)=10 解得x≈13.6 kPa
将容器体积压缩到原来的1/2,压强增大一倍,为30 kPa,平衡不移动。同理根据三段式计算可得p(H2)≈27.3 kPa
(如果直接利用前面计算结果,p(H2)=13.6×2=27.2 kPa)。
(4)CaO 可以去除CO2 的反应:CaO+CO2=CaCO3,生成的CaCO3 覆盖在CaO 的表面,阻止了CaO 与CO2 的
进一步接触,导致吸收效率降低甚至失效
18. (13 分)
(1)第四周期第ⅥA 族(2 分)
胶体(1 分)
(2)球形冷凝管(1 分)(答“冷凝管”或“冷凝器”也可)
(3)防止油酸被氧化(多答防止Cd2+被氧化不算错)(2 分)
O(或氧原子)(1 分)
(4)SeO
2 -
3 +N2H4∙H2O=Se↓+N2↑+2OH-+2H2O(2 分)
(5)荧光颜色不再变化(2 分)
(6)降低CdSe 的溶解度,促进其析出(2 分)
19【答案】(14 分)
(1)乙酸苯酚酯(或乙酸苯酯)(2 分)
(2)d(2 分)
(3)12(2 分)
(4)
(2 分)
浓硝酸和浓硫酸(只答浓硝酸不给分)(2 分)
(5)
+NaOH
+CH3COONa(2 分)(无加热给一分)
(6)强酸性条件下,H+会和氨基反应,生成不活泼的铵离子,使R-NH2 失去加成能力(2 分)
【分析】由题干合成路线图可知,可知A 的结构简式为:
,由A 到B 的转化条件可知,B 的结构简式为:
,由B 到D 的转化条件和D 的分子式可知,D 的结构简式为:
,由D 到E 的转化条件和
E 到F 发生已知信息①反应可知,E 的结构简式为:
,由J 的分子式和G 到J 的反应条件可知,J
的结构简式为:
,由M 的结构简式和K 的分子式可知,K 的结构简式为:
,则试剂a 为浓硝酸和浓硫酸,由L 的分子式和K 到L 的转化条件可知,L 的结构简
式为:
,据此分析解题。
(2)L→M 属于还原反应。
(3)由限定条件可知,同分异构体应含苯环、酚羟基、醛基等特殊结构,可为-OH 和
、
、
、
,分别邻、间、对共4×3=12 种。
(4)硝化反应试剂需要浓硫酸和浓硝酸。
(5)如果溶液酸性太强,氨基和H+反应,生成不活泼的铵离子,导致N-H 难以断裂,难和
发生加成反
应。