文档内容
2024-2025学年度第一学期高二期末教学质量检测 Ig
D.为防止反应过程中有 大量累积,应选择合适的催化剂降低反应②的活化能
化学试题
H gI g 2HIg
5.相同温度下,在三个密闭容器中分别进行反应: 2 2 。达到化学平衡状态
一、单选题(每题3分,共42分)
时,相关数据如下表。下列说法不正确的是
1.下列说法或表示方法中正确的是
平衡时物质的浓度
A.等质量的硫蒸气和硫磺固体分别燃烧,后者放出的热量多
/
molL1
起始时各物质的浓度 / molL1
B.已知强酸强碱的中和热为57.3kJ/mol,若将含 1molCH
3
COOH 的醋酸稀溶液与含1molNaOH 实
验
的稀碱溶液混合,放出的热量小于57.3kJ
cH cI cHI cHI
C.乙炔的燃烧热为1366.8kJ/mol,则乙炔燃烧的热化学方程式为: 2 2
2C H (g)+5O (g)=4CO (g)+2H O(l) 1molCH COOH
2 2 2 2 2 3 ΔH=-1366.8kJ/mol Ⅰ 0.01 0.01 0 0.004
D.Ba(OH)
2
8H
2
O(s)+2NH
4
Cl(s)=BaCl
2
(s)+2NH
3
(g)+10H
2
O(l) H0
Ⅱ 0.02 0.02 0 a
2.氯原子对
O
3的分解有催化作用:
O
3
gClgClOgO
2
g ΔH
1,
Ⅲ 0.02 0.02 0.02
ClOgOgClgO g ΔH
2 2。大气臭氧层被消耗的反应 A.该温度下,反应的平衡常数为0.25 B.实验Ⅱ达平衡时,a=0.008
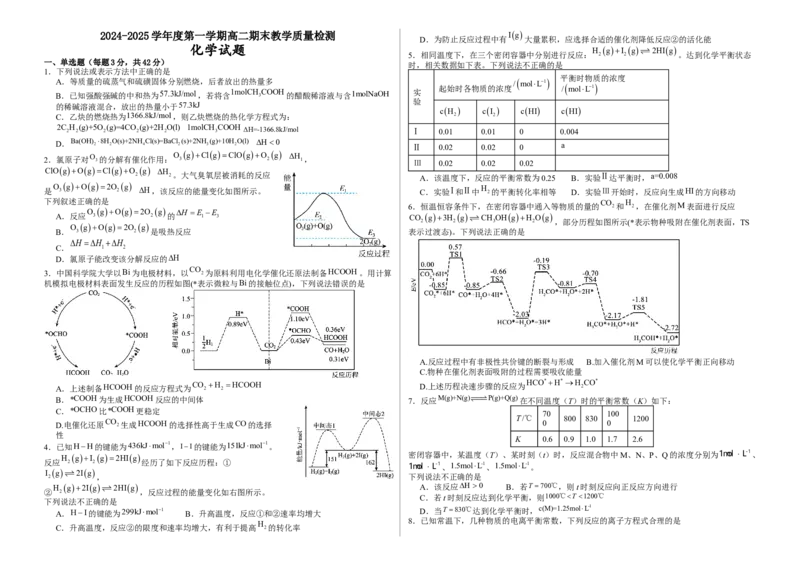
是 O 3 gOg2O 2 g H,该反应的能量变化如图所示。 C.实验Ⅰ和Ⅱ中 H 2的平衡转化率相等 D.实验Ⅲ开始时,反应向生成HI的方向移动
下列叙述正确的是 CO H
6.恒温恒容条件下,在密闭容器中通入等物质的量的 2和 2,在催化剂M表面进行反应
O gOg2O g H E E
A.反应 3 2 的 1 3 CO g3H g CH OHgH Og
2 2 3 2 ,部分历程如图所示(*表示物种吸附在催化剂表面,TS
O gOg2O g
B. 3 2 是吸热反应 表示过渡态)。下列说法正确的是
H H H
C. 1 2
D.氯原子能改变该分解反应的H
3.中国科学院大学以Bi为电极材料,以 CO 2为原料利用电化学催化还原法制备HCOOH。用计算
机模拟电极材料表面发生反应的历程如图(*表示微粒与Bi的接触位点),下列说法错误的是
A.反应过程中有非极性共价键的断裂与形成 B.加入催化剂M可以使化学平衡正向移动
C.物种在催化剂表面吸附的过程需要吸收能量
A.上述制备HCOOH的反应方程式为 CO 2 H 2 HCOOH D.上述历程决速步骤的反应为 HCO*H* H 2 CO*
B.COOH为生成HCOOH反应的中间体 7.反应M(g)+N(g) P(g)+Q(g)在不同温度(T)时的平衡常数(K)如下:
C.OCHO比COOH更稳定
70 100
T/℃ 800 830 1200
D.电催化还原 CO 2生成HCOOH的选择性高于生成CO的选择 0 0
性
K 0.6 0.9 1.0 1.7 2.6
4.已知HH的键能为436kJmol1,II的键能为151kJmol1。
H gI g2HIg
密闭容器中,某温度(T)、某时刻(t)时,反应混合物中M、N、P、Q的浓度分别为1mol L-1、
反应 2 2 经历了如下反应历程:① 1mol L-1、1.5molL-1、1.5molL-1。
I g 2Ig
2 , 下列说法不正确的是
H g2Ig 2HIg A.该反应H0 B.若T 700℃,则t时刻反应向正反应方向进行
② 2 ,反应过程的能量变化如右图所示。
C.若t时刻反应达到化学平衡,则1000℃T 1200℃
下列说法不正确的是
A.HI的键能为299kJmol1 B.升高温度,反应①和②速率均增大 D.当T
830℃达到化学平衡时,c(M)=1.25molL-1
8.已知常温下,几种物质的电离平衡常数,下列反应的离子方程式合理的是
H
C.升高温度,反应②的限度和速率均增大,有利于提高 2的转化率弱酸 甲酸(HCOOH) H
2
SO
3
H
2
CO
3
HClO 13.利用 CH 4燃料电池电解制备 CaH 2 PO 4 2并得到副产物NaOH、 H 2、 Cl 2,装置如下图所示。
下列说法不正确的是
K 1.54102 K 4.3107
K K1.77104 1 1 K2.98108
25℃ K 1.02107 K 5.61011
2 2
2ClOH OCO 2HClOCO2
A.次氯酸钠溶液中通入少量二氧化碳: 2 2 3
3ClOSO H O2HClO+ClSO2
B.次氯酸钠溶液中通入足量二氧化硫: 2 2 4
C.碳酸钠溶液中通入足量SO 2: 2SO 2 H 2 OCO 3 2 2HSO 3 CO 2
2HCOOHCO2 2HCOOH OCO
D.纯碱溶液中滴加少量甲酸: 3 2 2
V CH -8e-+4O2-=CO +2H O
9.常温下,pH均为2、体积均为 0的HA、HB、HC溶液,分别加水稀释至体积为V,溶液pH A.a极反应: 4 2 2
V
B.A膜为阳离子交换膜,C膜为阴离子交换膜
lg
随 V 的变化关系如图所示,下列叙述正确的是
C.可用铁电极替换石墨Ⅱ电极
0
A.a点水的电离程度大于c点
D.a极上通入标况下2.24L甲烷,阳极室Ca2
减少
0.4mol
B.中和a点和b点HC,消耗等浓度氢氧化钠溶液的体积相 14.前四周期主族元素W、X、Y、Z、Q的原子序数依次增大,其中X、Y、Z同周期,Y、Q同
同 主族,Q的最高能层有16个轨道,基态X原子s轨道上的电子数是p轨道上的电子数的2倍,且
V 与基态Z原子具有相同的未成对电子数,下列说法不正确的是
lg 6
V
A.第一电离能:Z>Y>X
C.当 0 时,HA溶液的pH为8
B.简单氢化物的沸点:Z>Y>Q
c
A
C.最高价氧化物对应水化物的酸性:Y>X
V
lg 3 c C D.X、Y、Z分别与W形成的化合物可能均含极性键和非极性键
D.当 V 0 时,三种溶液同时升高温度, 变大 二、解答题(共58分)
pOHlgc OH TiO
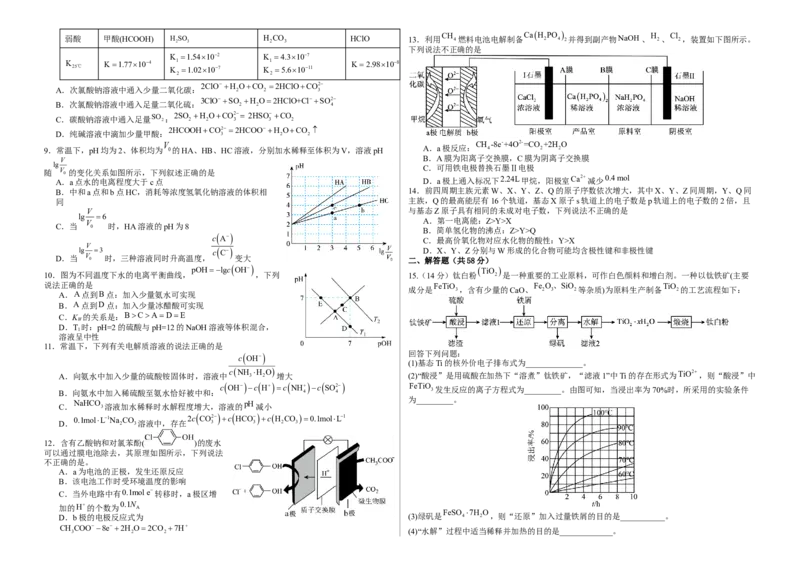
10.图为不同温度下水的电离平衡曲线, ,下列 15.(14分)钛白粉 2 是一种重要的工业原料,可作白色颜料和增白剂。一种以钛铁矿(主要
说法正确的是 FeTiO Fe O、SiO TiO
成分是 3,含有少量的CaO、 2 3 2等杂质)为原料生产制备 2的工艺流程如下:
A.A点到B点:加入少量氨水可实现
B.A点到D点:加入少量冰醋酸可实现
C.K 的关系是:BCADE
W
D.T 时:pH=2的硫酸与pH=12的NaOH溶液等体积混合,
1
溶液呈中性
11.常温下,下列有关电解质溶液的说法正确的是
回答下列问题:
c
OH
(1)基态Ti的核外价电子排布式为______________。
A.向氨水中加入少量的硫酸铵固体时,溶液中
cNH
3
H
2
O
增大
(2)“酸浸”是用硫酸在加热下“溶煮”钛铁矿,“滤液1”中Ti的存在形式为TiO2
,则“酸浸”中
B.向氨水中加入稀硫酸至氨水恰好被中和:
c OH c H c NH
4
c SO
4
2 FeTiO 3发生反应的离子方程式为_________。由图可知,当浸出率为70%时,所采用的实验条件
为_________。
NaHCO pH
C. 3溶液加水稀释时水解程度增大,溶液的 减小
0.1molL1Na CO 2c CO2 c HCO cH CO 0.1molL1
D. 2 3溶液中,存在 3 3 2 3
12.含有乙酸钠和对氯苯酚( )的废水
可以通过膜电池除去,其原理如图所示,下列说法
不正确的是。
A.a为电池的正极,发生还原反应
B.该电池工作时受环境温度的影响
C.当外电路中有0.1mol e 转移时,a极区增
加的H的个数为 0.1N
A
FeSO 7H O
D.b极的电极反应式为 (3)绿矾是 4 2 ,则“还原”加入过量铁屑的目的是___________。
CH COO8e2H O2CO 7H
3 2 2 (4)“水解”过程中适当稀释并加热的目的是_____________。(5)钛是一种性能非常优越的金属。工业上可利用Mg与 TiCl 4反应制备金属钛。下列金属冶炼方法 H / kJmol1 890.3 283.0 285.8
与Mg冶炼Ti的方法相似的是___________。
该催化重整反应的H __________________kJmol1。
Ag O
A.高炉炼铁 B.电解熔融NaCl制钠 C.铝热反应制锰 D. 2 分解制银
CO H
(2) 2与 2在催化作用下生成可再生资源甲醇,相关反应如下:
(6) TiO 2转化为 TiCl 4有以下两种方法。在1000℃时反应的热化学方程式如下:
TiO s2Cl gTiCl gO gΔH 172kJmol1 反应Ⅰ: CO 2 g3H 2 g CH 3 OHgH 2 Og H 1 0
① 2 2 4 2 1
TiO s2Cl g2CsTiCl g2COgΔH 51kJmol1 反应Ⅱ: CO 2 gH 2 g COgH 2 Og ΔH 2
② 2 2 4 2
ΔH
请分析方法②加入C(s)的目的是______________。 ①反应Ⅱ在低温或常温下不能自发进行,则 2____________(填“>”“<”或“=”)0。
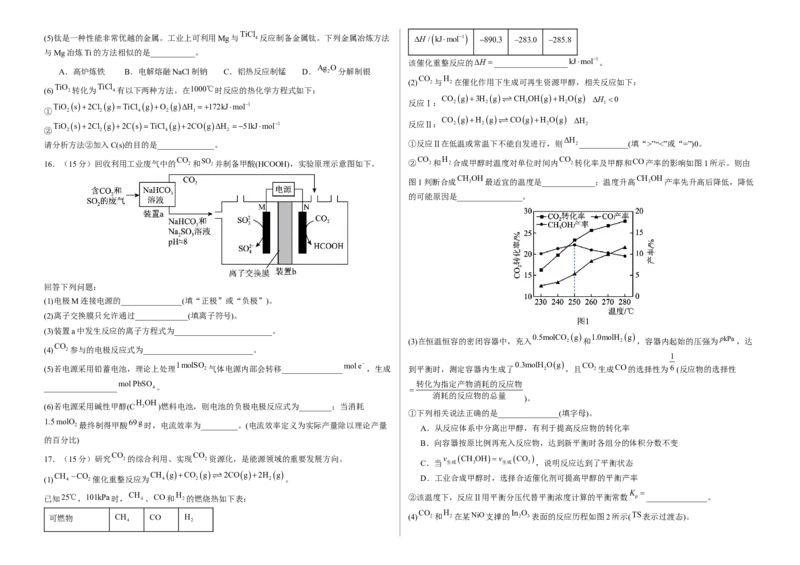
16.(15分)回收利用工业废气中的 CO 2和SO 2并制备甲酸(HCOOH),实验原理示意图如下。 ② CO 2和 H 2合成甲醇时温度对单位时间内 CO 2转化率及甲醇和CO产率的影响如图1所示。则由
CH OH CH OH
图1判断合成 3 最适宜的温度是_____________;温度升高 3 产率先升高后降低,降低
的可能原因是________________。
回答下列问题:
(1)电极M连接电源的_______________(填“正极”或“负极”)。
(2)离子交换膜只允许通过_____________(填离子符号)。
(3)装置a中发生反应的离子方程式为________________________。
(3)在恒温恒容的密闭容器中,充入 0.5molCO 2 g 和 1.0molH 2 g ,容器内起始的压强为pkPa,达
CO
(4) 2参与的电极反应式为___________________________。
1
(5)若电源采用铅蓄电池,理论上处理 1molSO 2气体电源内部会转移_______________ mole ,生成 到平衡时,测定容器内生成了 0.3molH 2 Og ,且 CO 2生成CO的选择性为6 (反应物的选择性
molPbSO 转化为指定产物消耗的反应物
__________________ 4。
消耗的反应物的总量
)。
H OH
(6)若电源采用碱性甲醇(C 3 )燃料电池,则电池的负极电极反应式为________;当消耗
①下列相关说法正确的是_______________(填字母)。
1.5molO 69g
2最终制得甲酸 时,电流效率为_________。(电流效率定义为实际产量除以理论产量
A.从反应体系中分离出甲醇,有利于提高反应物的转化率
的百分比)
B.向容器按原比例再充入反应物,达到新平衡时各组分的体积分数不变
17.(15分)研究 CO 2的综合利用、实现 CO 2资源化,是能源领域的重要发展方向。 v CH OHv CO
C.当 生成 3 生成 2 ,说明反应达到了平衡状态
(1) CH 4 CO 2催化重整反应为 CH 4 gCO 2 g 2COg2H 2 g 。 D.工业合成甲醇时,选择合适催化剂可提高甲醇的平衡产率
已知25℃,101kPa时, CH 4、CO和 H 2的燃烧热如下表: ②该温度下,反应Ⅱ用平衡分压代替平衡浓度计算的平衡常数 K p _______________。
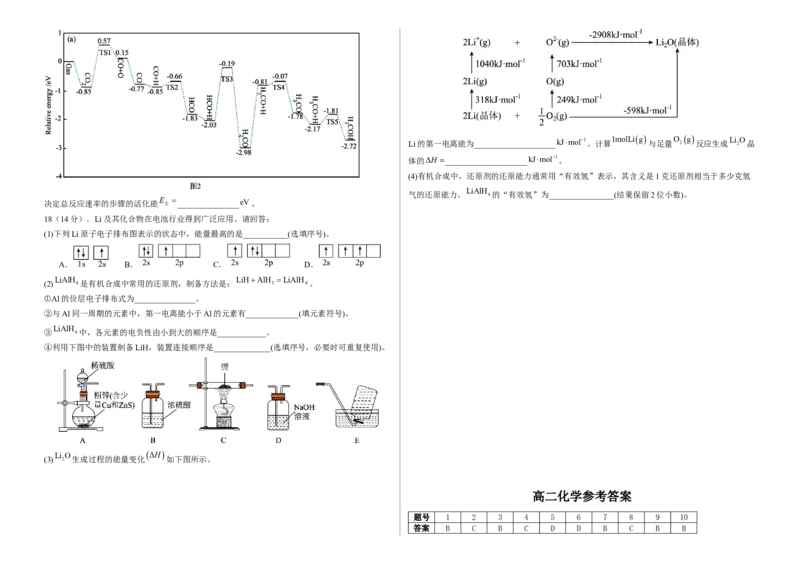
可燃物 CH CO H (4) CO 2和 H 2在某NiO支撑的 In 2 O 3表面的反应历程如图2所示(TS表示过渡态)。
4 2Li的第一电离能为____________________kJmol1。计算 1molLig 与足量 O 2 g 反应生成 Li 2 O 晶
体的ΔH ____________________kJmol1。
(4)有机合成中,还原剂的还原能力通常用“有效氢”表示,其含义是1克还原剂相当于多少克氢
LiAlH
气的还原能力。 4的“有效氢”为________________(结果保留2位小数)。
决定总反应速率的步骤的活化能 E 主 _______________eV。
18(14分).Li及其化合物在电池行业得到广泛应用。请回答:
(1)下列Li原子电子排布图表示的状态中,能量最高的是___________(选填序号)。
A. B. C. D.
LiAlH LiHAlH LiAlH
(2) 4是有机合成中常用的还原剂,制备方法是: 3 4。
①Al的价层电子排布式为_______________。
②与Al同一周期的元素中,第一电离能小于Al的元素有_____________(填元素符号)。
LiAlH
③ 4中,各元素的电负性由小到大的顺序是____________。
④利用下图中的装置制备LiH,装置连接顺序是______________(选填序号,必要时可重复使用)。
Li O
ΔH
(3) 2 生成过程的能量变化 如下图所示。
高二化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B C B C D D B C B B题号 11 12 13 14
答案 C C B A
15.(1)3d24s2
Δ
FeTiO +4H+ TiO2++Fe2++2H O
(2)
3 2 100℃、2h、90℃、5h
(3)将Fe3+全部还原为Fe2+ ,同时防止Fe2+
被氧化
TiO xH O
(4)促进水解,防止形成胶体,便于 2 2 过滤分离
(5)AC
(6)提高反应的(热力学)趋势,提高四氯化钛的产率
16.(1)正极
(2)H+
SO +2HCO-=SO2-+2CO H O
(3) 2 3 3 2 2
CO +2e-+2H+=HCOOH
(4) 2
(5) 2 2
CH OH-6e-+8OH-=CO26H O
(6) 3 3 2 50%
17.(1)+247.3
(2) > 250°C 反应Ⅰ的正反应为放热反应,升高温度平衡逆向移动,CHOH产率降
3
低;(或温度升高,催化剂的活性下降,CHOH产率降低或温度升高,反应Ⅱ占主导,CO产率升
3
高,CHOH产率降低)
3
3375
(3) A
32P2
(4)2.17
18.(1)C
(2)
3s23p1
Na LiAlH ADBCBE
(3) 520 458
(4)0.21