文档内容
2024—2025 学年上学期期中考试
高三化学试题
时间:75分钟 分值:100分
注意事项:
1. 答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准
考证号条形码粘贴在答题卡上的指定位置。
2. 选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。写
在试卷、草稿纸和答题卡上的非答题区域均无效。
3. 非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸
和答题卡上的非答题区域均无效。
可能用到的相对原子质量:Hl C12 N14 O16 S32 Cl35.5 Fe56 Zn65 Sn119
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括15小题,每小题3分,共计45分。每小题只有一个选项符合题目要求。)
1. 2023年9月,习近平总书记在黑龙江考察调研期间首次提出加快发展“新质生产力”。“新
质生产力”的核心在于科技创新。下列有关说法正确的是( )
A.“嫦娥五号”使用的月球钻杆是铝基复合材料,该材料具有硬度大、耐磨损、抗腐蚀及
密度小等性能
B.“嫦娥六号”着陆器携带的五星红旗由超细玄武岩纤维纺织而成,玄武岩纤维属于有机
高分子
C.歼-20上采用的氮化镓涂层,属于新型金属材料
D.华为公司自主研发的“麒麟9000”芯片与中国天眼传输信息用的光导纤维材料的主要成
分相同
2. N 是阿伏加德罗常数的值,下列说法正确的是( )
A
A.16.25gFeCl 水解形成的Fe(OH) 胶体粒子数为0.1N
3 3 A
B.2.24L(标准状况)HF中σ键数目为0.1N
A
C.1molNa O 与足量的CO 反应转移的电子数为2N
2 2 2 A
D.锌与某浓度的浓硫酸反应,生成混合气体22.4L(标准状况),锌失去电子数目为2N
A
3. 下列实验方案中,不能测定出Na CO 和NaHCO 混合物中Na CO 质量分数的是( )
2 3 3 2 3
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量NaOH溶液充分反应,得到bg溶液
C.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
D.取ag混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加bg
高三化学试卷(共 8 页)第 1 页4. 下列指定反应的化学方程式或离子方程式书写错误的是( )
A.向氨水中滴入少量硝酸银溶液:Ag++2NH ·H O=[Ag(NH ) ]++2H O
3 2 3 2 2
B.焦炭与石英砂反应: SiO 2C高温Si2CO
2
C.向烧碱溶液中加入一小段铝片:2Al+2OH-+6H O==2[Al(OH) ]-+3H ↑
2 4 2
D.向Ca(ClO) 溶液中通入少量SO :Ca2++2ClO-+SO +H O=CaSO ↓+2HClO
2 2 2 2 3
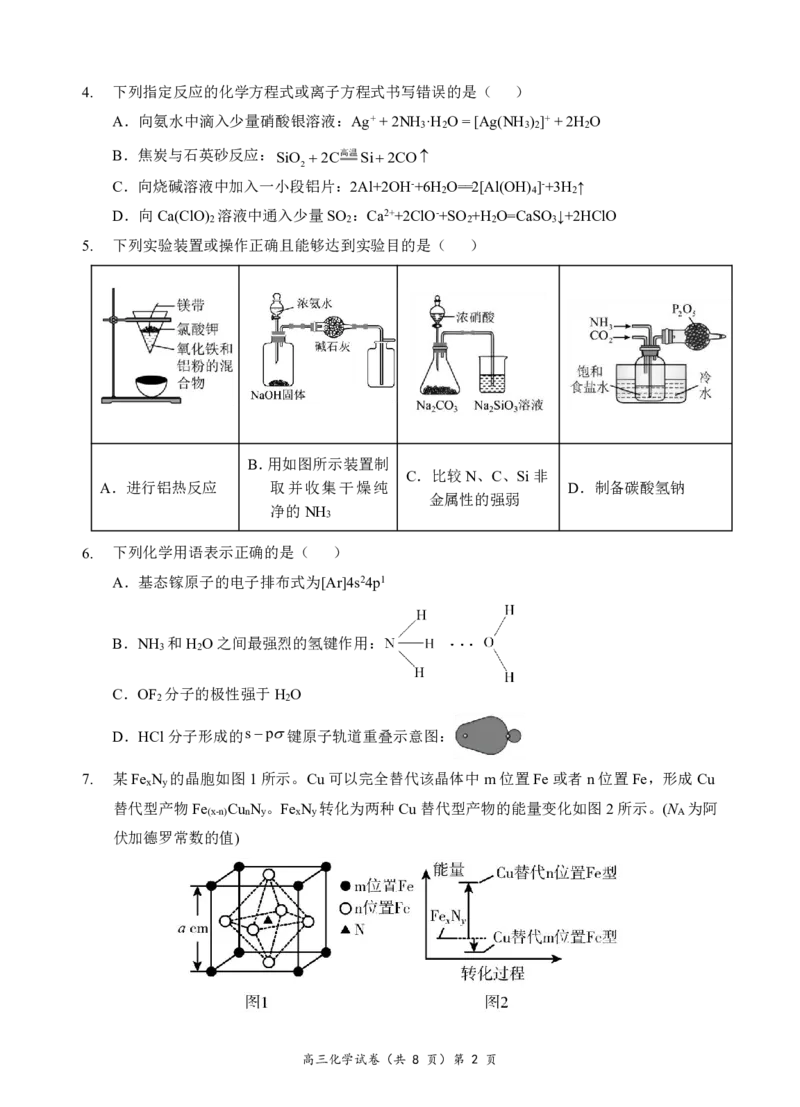
5. 下列实验装置或操作正确且能够达到实验目的是( )
B.用如图所示装置制
C.比较N、C、Si非
A.进行铝热反应 取并收集干燥纯 D.制备碳酸氢钠
金属性的强弱
净的NH
3
6. 下列化学用语表示正确的是( )
A.基态镓原子的电子排布式为[Ar]4s24p1
B.NH 和H O之间最强烈的氢键作用:
3 2
C.OF 分子的极性强于H O
2 2
D.HCl分子形成的sp键原子轨道重叠示意图:
7. 某Fe N 的晶胞如图1所示。Cu可以完全替代该晶体中m位置Fe或者n位置Fe,形成Cu
x y
替代型产物Fe Cu N 。Fe N 转化为两种Cu替代型产物的能量变化如图2所示。(N 为阿
(x-n) n y x y A
伏加德罗常数的值)
高三化学试卷(共 8 页)第 2 页下列相关说法中错误的是( )
A.Fe N 晶胞中当m位置的Fe位于体心时,n位置的Fe位于棱心
x y
B.Fe N 晶胞中N原子的配位数为6
x y
70
C.Fe N 晶胞的密度为 g/cm3
x y N a3
A
D.两种产物中更稳定的Cu替代型产物的化学式为Fe CuN
3
8. 某工厂采用如下工艺制备Cr(OH) ,已知焙烧后Cr元素以+6价形式存在,下列说法正确的
3
是( )
A.若在实验室中进行“焙烧”,可选择陶瓷坩埚作反应容器
高温
B.“焙烧”时Cr O 参与的反应为2CrO 4Na CO 3O 4Na CrO 4CO
2 3 2 3 2 3 2 2 4 2
C.滤渣的主要成分为Fe(OH)
2
D.淀粉水解液中的葡萄糖起氧化作用
9. 化学上常用标准电极电势φθ(氧化型/还原型)比较物质氧化能力的大小。φθ值越高,氧化型的
氧化能力越强。利用表格所给的数据进行分析,下列说法错误的是( )
氧化型/还原型 φθ(Co3+/Co2+) φθ(Fe3+/Fe2+) φθ(Cl /Cl-)
2
酸性介质 1.84V 0.77V 1.36V
氧化型/还原型 φθ[Co(OH) /Co(OH) ] φθ[Fe(OH) /Fe(OH) ] φθ(ClO-/Cl-)
3 2 3 2
碱性介质 0.17V -0.56V 0.89V
A.Co O 与浓盐酸发生反应:Co O +8HCl(浓)=3CoCl +Cl ↑+4H O
3 4 3 4 2 2 2
B.Fe O 与浓盐酸发生反应:Fe O +8HCl(浓)=FeCl +2FeCl +4H O
3 4 3 4 2 3 2
C.碱性条件下可发生反应:2Co(OH) +NaClO+H O=2Co(OH) +NaCl
2 2 3
D.在等浓度的Co2+、Fe2+、Cl-的混合液中,还原性:Co2+>Cl->Fe2+
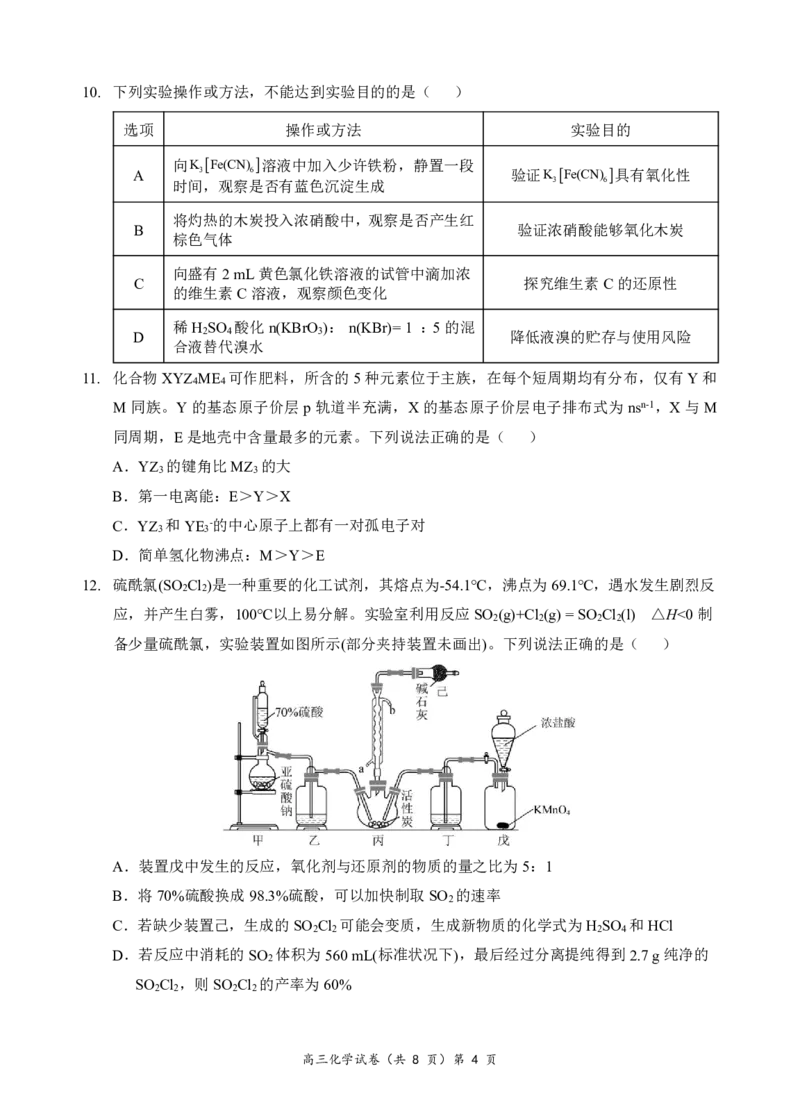
高三化学试卷(共 8 页)第 3 页10. 下列实验操作或方法,不能达到实验目的的是( )
选项 操作或方法 实验目的
向K Fe(CN) 溶液中加入少许铁粉,静置一段
A 3 6 验证K Fe(CN) 具有氧化性
时间,观察是否有蓝色沉淀生成 3 6
将灼热的木炭投入浓硝酸中,观察是否产生红
B 验证浓硝酸能够氧化木炭
棕色气体
向盛有2mL黄色氯化铁溶液的试管中滴加浓
C 探究维生素C的还原性
的维生素C溶液,观察颜色变化
稀H SO 酸化n(KBrO ): n(KBr)=1 :5的混
D 2 4 3 降低液溴的贮存与使用风险
合液替代溴水
11. 化合物XYZ ME 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和
4 4
M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为nsn-1,X与M
同周期,E是地壳中含量最多的元素。下列说法正确的是( )
A.YZ 的键角比MZ 的大
3 3
B.第一电离能:E>Y>X
C.YZ 和YE -的中心原子上都有一对孤电子对
3 3
D.简单氢化物沸点:M>Y>E
12. 硫酰氯(SO Cl )是一种重要的化工试剂,其熔点为-54.1℃,沸点为69.1℃,遇水发生剧烈反
2 2
应,并产生白雾,100℃以上易分解。实验室利用反应SO (g)+Cl (g)=SO Cl (l) △H<0制
2 2 2 2
备少量硫酰氯,实验装置如图所示(部分夹持装置未画出)。下列说法正确的是( )
A.装置戊中发生的反应,氧化剂与还原剂的物质的量之比为5:1
B.将70%硫酸换成98.3%硫酸,可以加快制取SO 的速率
2
C.若缺少装置己,生成的SO Cl 可能会变质,生成新物质的化学式为H SO 和HCl
2 2 2 4
D.若反应中消耗的SO 体积为560mL(标准状况下),最后经过分离提纯得到2.7g纯净的
2
SO Cl ,则SO Cl 的产率为60%
2 2 2 2
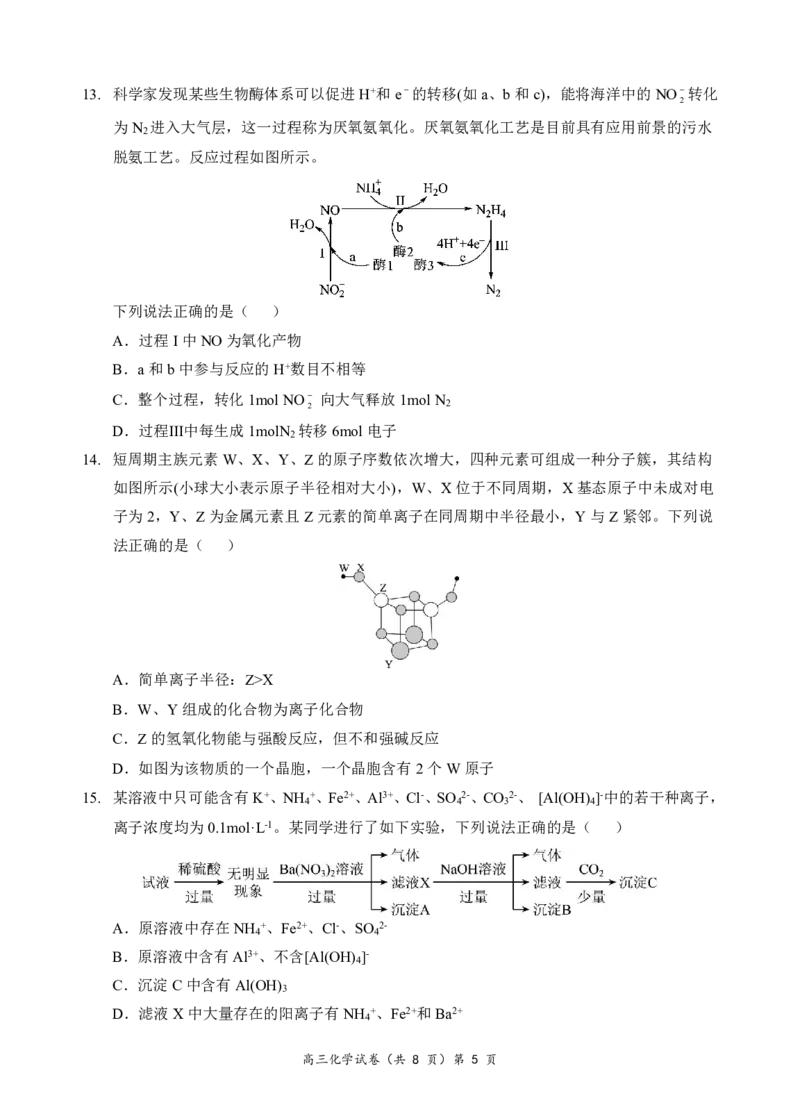
高三化学试卷(共 8 页)第 4 页13. 科学家发现某些生物酶体系可以促进H+和e的转移(如a、b和c),能将海洋中的NO转化
2
为N 进入大气层,这一过程称为厌氧氨氧化。厌氧氨氧化工艺是目前具有应用前景的污水
2
脱氨工艺。反应过程如图所示。
下列说法正确的是( )
A.过程I中NO为氧化产物
B.a和b中参与反应的H+数目不相等
C.整个过程,转化1molNO 向大气释放1molN
2 2
D.过程Ⅲ中每生成1molN 转移6mol电子
2
14. 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素可组成一种分子簇,其结构
如图所示(小球大小表示原子半径相对大小),W、X位于不同周期,X基态原子中未成对电
子为2,Y、Z为金属元素且Z元素的简单离子在同周期中半径最小,Y与Z紧邻。下列说
法正确的是( )
A.简单离子半径:Z>X
B.W、Y组成的化合物为离子化合物
C.Z的氢氧化物能与强酸反应,但不和强碱反应
D.如图为该物质的一个晶胞,一个晶胞含有2个W原子
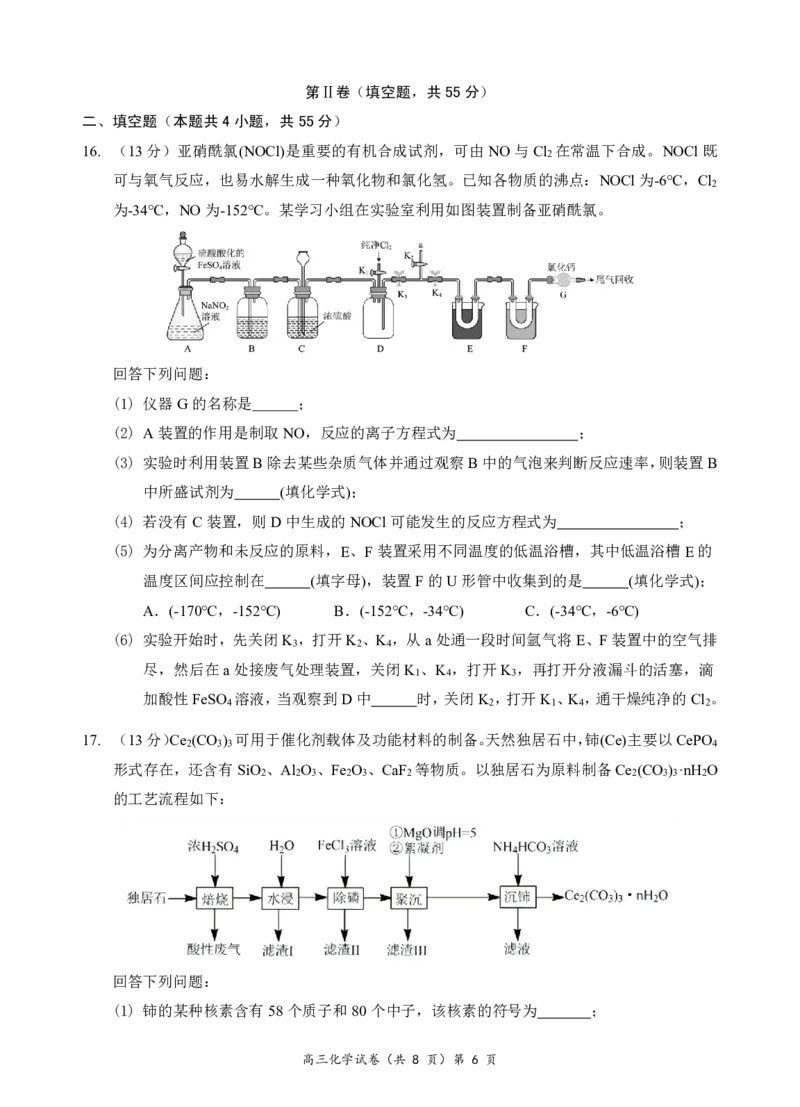
15. 某溶液中只可能含有K+、NH +、Fe2+、Al3+、Cl-、SO 2-、CO 2-、 [Al(OH) ]-中的若干种离子,
4 4 3 4
离子浓度均为0.1mol·L-1。某同学进行了如下实验,下列说法正确的是( )
A.原溶液中存在NH +、Fe2+、Cl-、SO 2-
4 4
B.原溶液中含有Al3+、不含[Al(OH) ]-
4
C.沉淀C中含有Al(OH)
3
D.滤液X中大量存在的阳离子有NH +、Fe2+和Ba2+
4
高三化学试卷(共 8 页)第 5 页第Ⅱ卷(填空题,共55分)
二、填空题(本题共4小题,共55分)
16. (13分)亚硝酰氯(NOCl)是重要的有机合成试剂,可由NO与Cl 在常温下合成。NOCl既
2
可与氧气反应,也易水解生成一种氧化物和氯化氢。已知各物质的沸点:NOCl为-6℃,Cl
2
为-34℃,NO为-152℃。某学习小组在实验室利用如图装置制备亚硝酰氯。
回答下列问题:
(1) 仪器G的名称是 ;
(2) A装置的作用是制取NO,反应的离子方程式为 ;
(3) 实验时利用装置B除去某些杂质气体并通过观察B中的气泡来判断反应速率,则装置B
中所盛试剂为 (填化学式);
(4) 若没有C装置,则D中生成的NOCl可能发生的反应方程式为 ;
(5) 为分离产物和未反应的原料,E、F装置采用不同温度的低温浴槽,其中低温浴槽E的
温度区间应控制在 (填字母),装置F的U形管中收集到的是 (填化学式);
A.(-170℃,-152℃) B.(-152℃,-34℃) C.(-34℃,-6℃)
(6) 实验开始时,先关闭K ,打开K 、K ,从a处通一段时间氩气将E、F装置中的空气排
3 2 4
尽,然后在a处接废气处理装置,关闭K 、K ,打开K ,再打开分液漏斗的活塞,滴
1 4 3
加酸性FeSO 溶液,当观察到D中 时,关闭K ,打开K 、K ,通干燥纯净的Cl 。
4 2 1 4 2
17. (13分)Ce (CO ) 可用于催化剂载体及功能材料的制备。天然独居石中,铈(Ce)主要以CePO
2 3 3 4
形式存在,还含有SiO 、Al O 、Fe O 、CaF 等物质。以独居石为原料制备Ce (CO ) ·nH O
2 2 3 2 3 2 2 3 3 2
的工艺流程如下:
回答下列问题:
(1) 铈的某种核素含有58个质子和80个中子,该核素的符号为 ;
高三化学试卷(共 8 页)第 6 页(2) 焙烧过程中产生的酸性废气为 (填化学式);
(3) 为提高“水浸”效率,可采取的措施有 (写两条);
(4) 滤渣Ⅲ的主要成分是 (填化学式);
(5) 加入絮凝剂的目的是 ;
(6) “沉铈”过程中,生成Ce (CO ) ·nH O的离子方程式为 ;
2 3 3 2
(7) 滤渣Ⅱ的主要成分为FePO ,在高温条件下,Li CO 、葡萄糖 (C H O )和FePO 可制
4 2 3 6 12 6 4
备电极材料LiFePO ,同时生成等物质的量的两种常见碳氧化物和H O,该反应的化学
4 2
方程式为 。
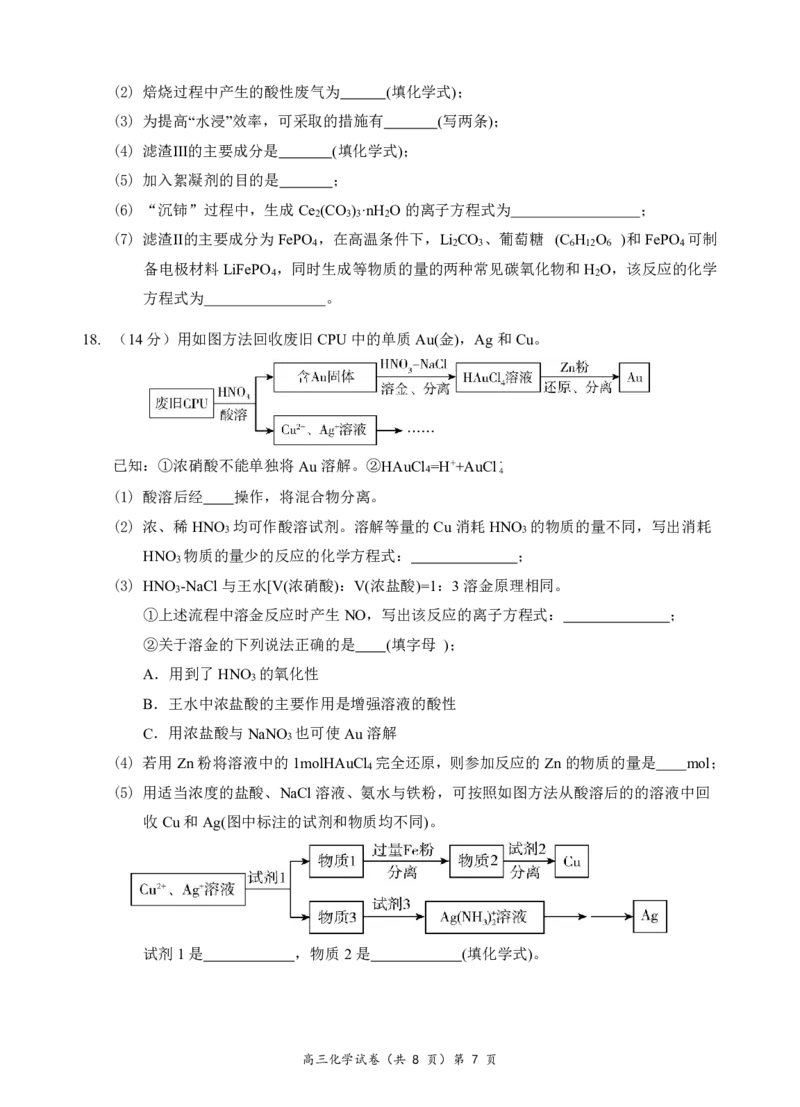
18. (14分)用如图方法回收废旧CPU中的单质Au(金),Ag和Cu。
已知:①浓硝酸不能单独将Au溶解。②HAuCl =H++AuCl-
4 4
(1) 酸溶后经 操作,将混合物分离。
(2) 浓、稀HNO 均可作酸溶试剂。溶解等量的Cu消耗HNO 的物质的量不同,写出消耗
3 3
HNO 物质的量少的反应的化学方程式: ;
3
(3) HNO -NaCl与王水[V(浓硝酸):V(浓盐酸)=1:3溶金原理相同。
3
①上述流程中溶金反应时产生NO,写出该反应的离子方程式: ;
②关于溶金的下列说法正确的是 (填字母 );
A.用到了HNO 的氧化性
3
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO 也可使Au溶解
3
(4) 若用Zn粉将溶液中的1molHAuCl 完全还原,则参加反应的Zn的物质的量是 mol;
4
(5) 用适当浓度的盐酸、NaCl溶液、氨水与铁粉,可按照如图方法从酸溶后的的溶液中回
收Cu和Ag(图中标注的试剂和物质均不同)。
试剂1是 ,物质2是 (填化学式)。
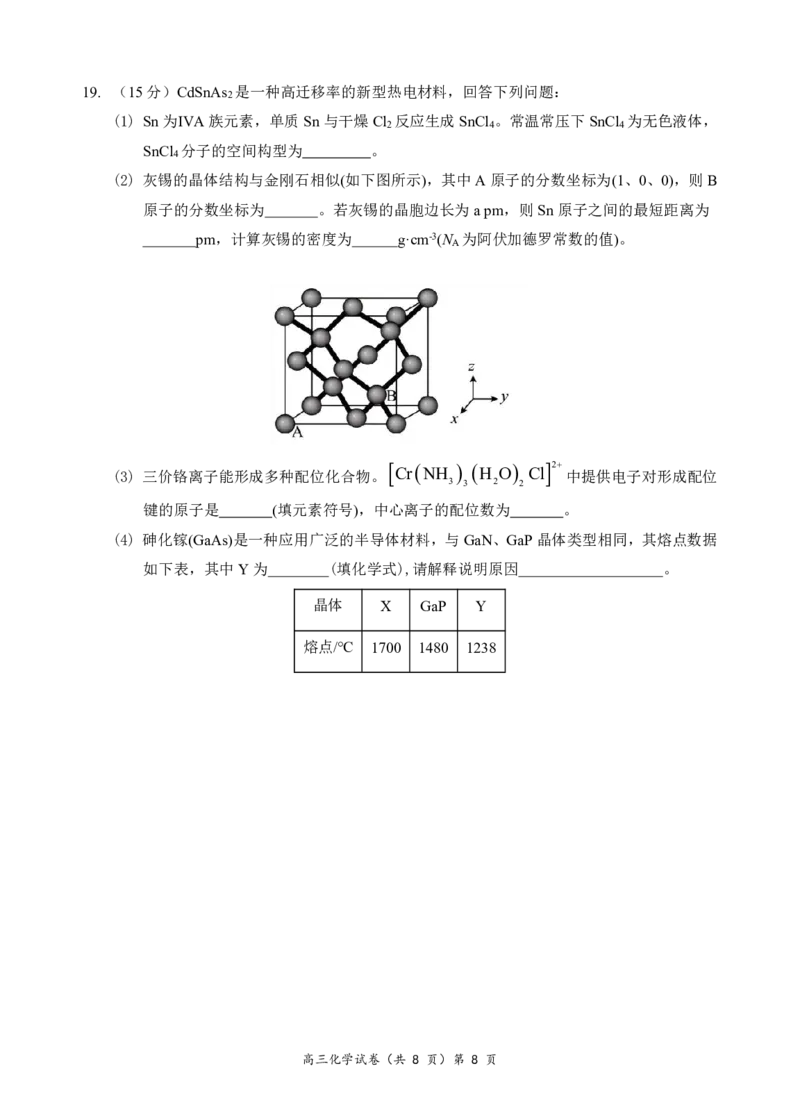
高三化学试卷(共 8 页)第 7 页19. (15分)CdSnAs 是一种高迁移率的新型热电材料,回答下列问题:
2
(1) Sn为ⅣA族元素,单质Sn与干燥Cl 反应生成SnCl 。常温常压下SnCl 为无色液体,
2 4 4
SnCl 分子的空间构型为 。
4
(2) 灰锡的晶体结构与金刚石相似(如下图所示),其中A原子的分数坐标为(1、0、0),则B
原子的分数坐标为 。若灰锡的晶胞边长为apm,则Sn原子之间的最短距离为
pm,计算灰锡的密度为 g·cm-3(N 为阿伏加德罗常数的值)。
A
2
(3) 三价铬离子能形成多种配位化合物。 Cr NH H O Cl 中提供电子对形成配位
3 3 2 2
键的原子是 (填元素符号),中心离子的配位数为 。
(4) 砷化镓(GaAs)是一种应用广泛的半导体材料,与GaN、GaP晶体类型相同,其熔点数据
如下表,其中Y为 (填化学式),请解释说明原因 。
晶体 X GaP Y
熔点/℃ 1700 1480 1238
高三化学试卷(共 8 页)第 8 页