文档内容
漳州市 2024 届高三毕业班第二次质量检测
化学试题
本试题卷共8页,14题.全卷满分100分.考试时间75分钟.
可能用到的相对原子质量:C 12 O 16 Na 23 Ti 48
一、选择题:本题共10小题,每小题4分,共40分.在每小题给出的四个选项中,只有一个选
项是合题目要求的.
1.化学与社会、生产、生活、环境等密切相关.下列说法正确的是( )
A.量子通信材料螺旋碳纳米管与石墨烯互为同素异形体
B.建造“福厦高铁”跨海大桥所采用的钢材的熔点、硬度均比纯铁高
C.我国科学家利用电催化实现了醇到醛的高选择性转化,该过程体现了醇的氧化性
D.华为手机配备的玻璃屏幕属于有机高分子材料
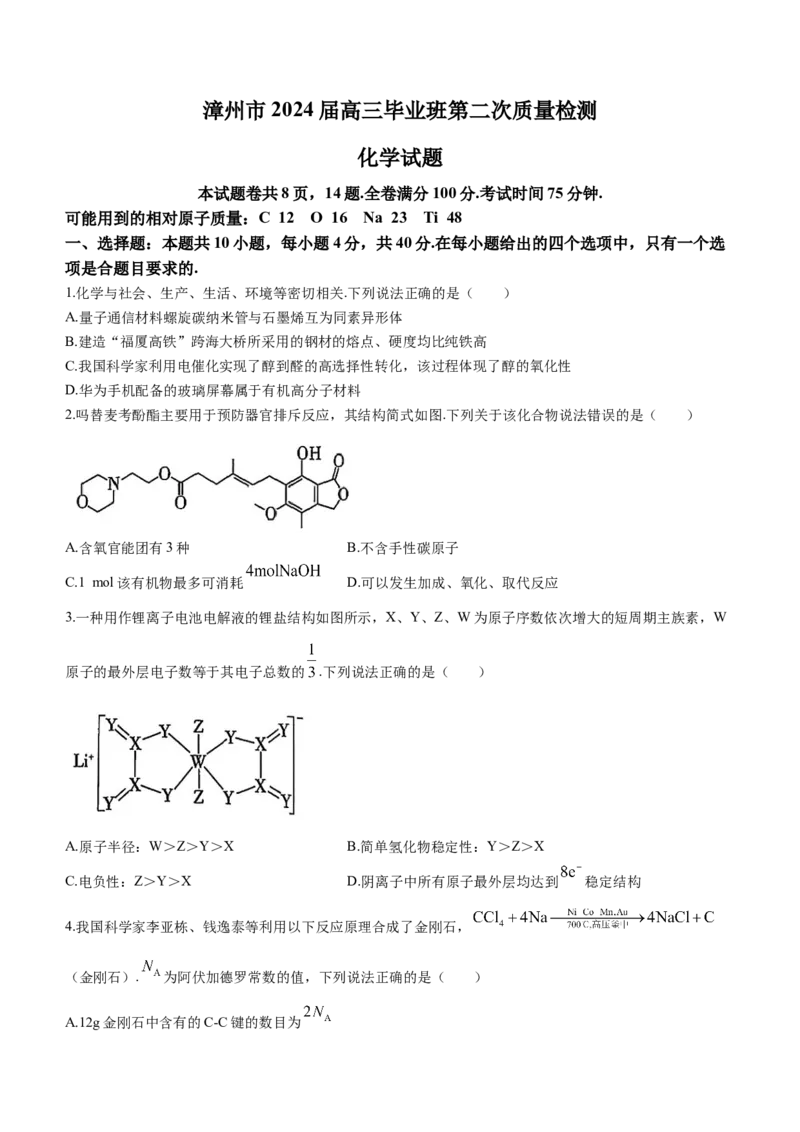
2.吗替麦考酚酯主要用于预防器官排斥反应,其结构简式如图.下列关于该化合物说法错误的是( )
A.含氧官能团有3种 B.不含手性碳原子
C.1 mol该有机物最多可消耗 D.可以发生加成、氧化、取代反应
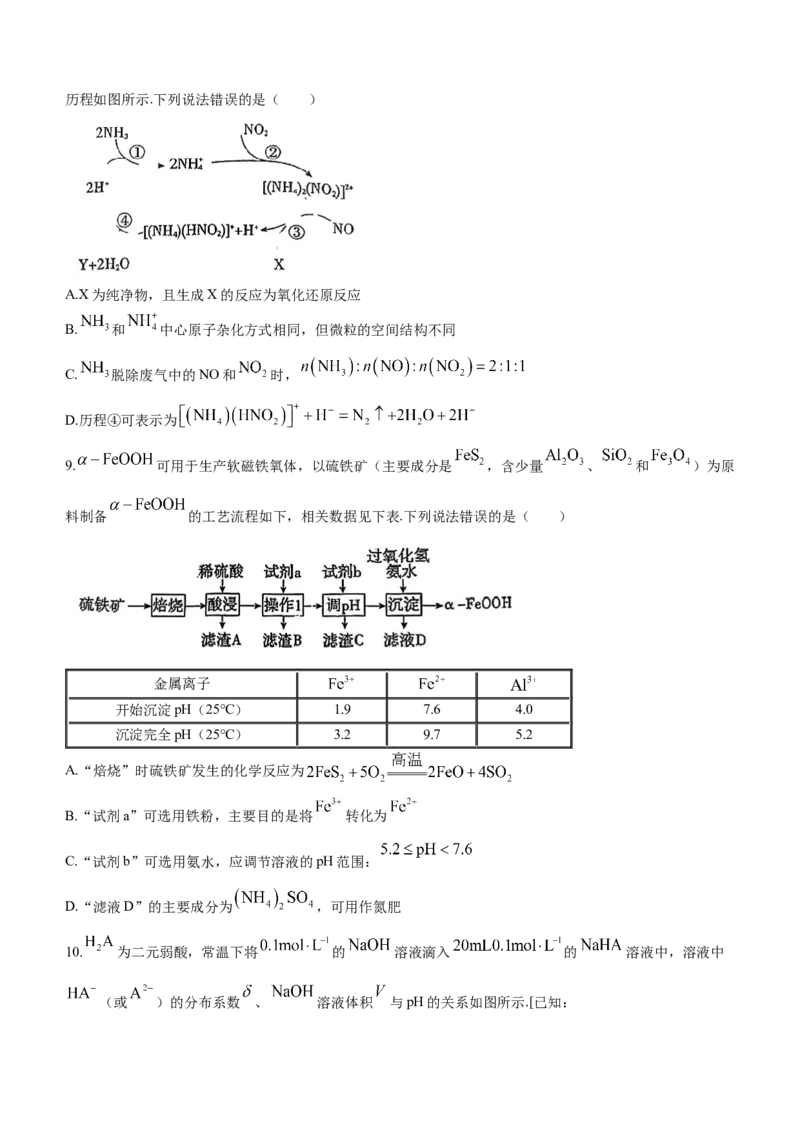
3.一种用作锂离子电池电解液的锂盐结构如图所示,X、Y、Z、W为原子序数依次增大的短周期主族素,W
原子的最外层电子数等于其电子总数的 .下列说法正确的是( )
A.原子半径:W>Z>Y>X B.简单氢化物稳定性:Y>Z>X
C.电负性:Z>Y>X D.阴离子中所有原子最外层均达到 稳定结构
4.我国科学家李亚栋、钱逸泰等利用以下反应原理合成了金刚石,
(金刚石). 为阿伏加德罗常数的值,下列说法正确的是( )
A.12g金刚石中含有的C-C键的数目为
学科网(北京)股份有限公司B.标准状况下, 含有 键数目为
C. 溶液中 和 数目之和为
D.每消耗46g的钠单质,转移的电子数目为
5.下列离子方程式书写正确的是( )
A.明矾溶液与过量氨水混合:
B.将铜丝插入稀硝酸中:
C. 溶液中滴加 至 完全沉淀:
D.以铁为电极电解饱和食盐水:
6.下列实验正确的是( )
A.除去 气体中少量的
B.分离固体 和 C.用苯萃取碘水中的 D.模拟工业制备
7.膜电极反应器具有电阻低、能耗低、结构紧凑等优点,研究人员设计了一种(碱性)膜电极反应器(如图
所示)用于持续制备 ,下列说法中正确的是( )
A.电极M上,反应物和生成物中碳原子的杂化方式相同
B.电极N的电极反应式:
C.反应后溶液的pH变大
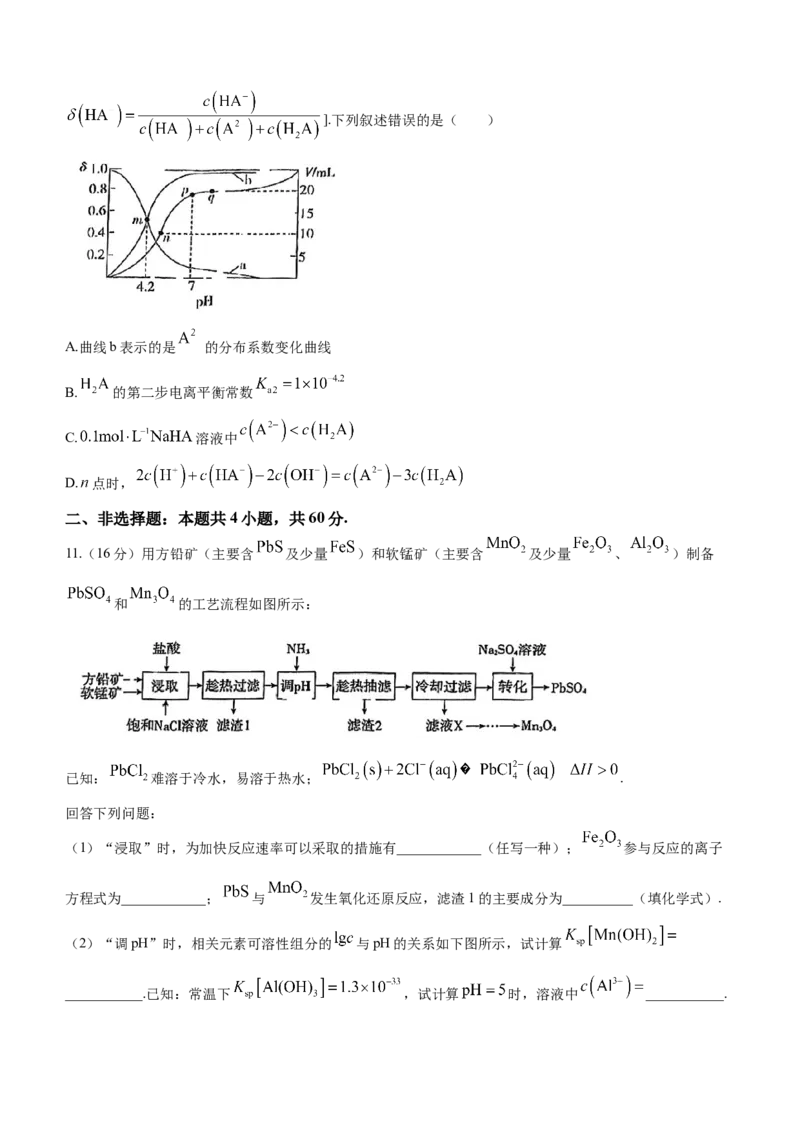
D.电极M上产生 ,转移电子的数目为
8.在化工生产中常利用某分子筛作催化剂,催化 脱除废气中的NO和 ,生成两种无毒物质,其反应
学科网(北京)股份有限公司历程如图所示.下列说法错误的是( )
A.X为纯净物,且生成X的反应为氧化还原反应
B. 和 中心原子杂化方式相同,但微粒的空间结构不同
C. 脱除废气中的NO和 时,
D.历程④可表示为
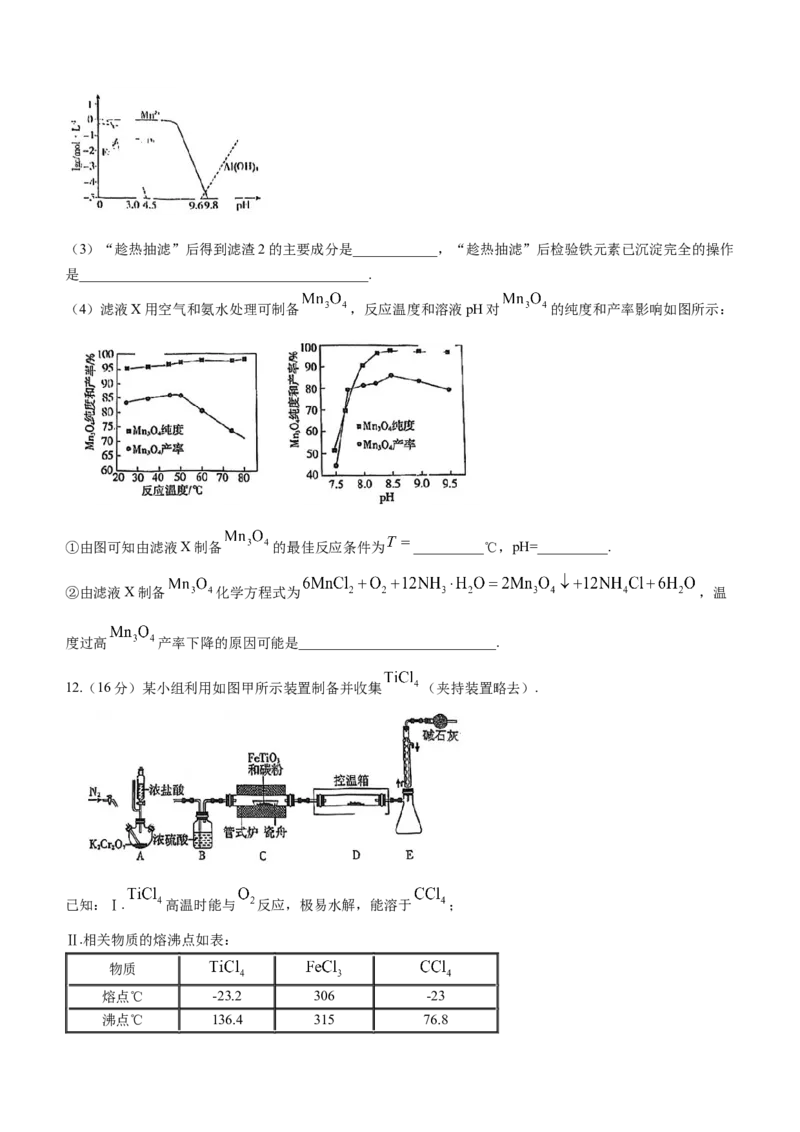
9. 可用于生产软磁铁氧体,以硫铁矿(主要成分是 ,含少量 、 和 )为原
料制备 的工艺流程如下,相关数据见下表.下列说法错误的是( )
金属离子
开始沉淀pH(25℃) 1.9 7.6 4.0
沉淀完全pH(25℃) 3.2 9.7 5.2
A.“焙烧”时硫铁矿发生的化学反应为
B.“试剂a”可选用铁粉,主要目的是将 转化为
C.“试剂b”可选用氨水,应调节溶液的pH范围:
D.“滤液D”的主要成分为 ,可用作氮肥
10. 为二元弱酸,常温下将 的 溶液滴入 的 溶液中,溶液中
(或 )的分布系数 、 溶液体积 与pH的关系如图所示.[已知:
学科网(北京)股份有限公司].下列叙述错误的是( )
A.曲线b表示的是 的分布系数变化曲线
B. 的第二步电离平衡常数
C. 溶液中
D. 点时,
二、非选择题:本题共4小题,共60分.
11.(16分)用方铅矿(主要含 及少量 )和软锰矿(主要含 及少量 、 )制备
和 的工艺流程如图所示:
已知: 难溶于冷水,易溶于热水; .
回答下列问题:
(1)“浸取”时,为加快反应速率可以采取的措施有____________(任写一种); 参与反应的离子
方程式为____________; 与 发生氧化还原反应,滤渣1的主要成分为__________(填化学式).
(2)“调pH”时,相关元素可溶性组分的 与pH的关系如下图所示,试计算
___________.已知:常温下 ,试计算 时,溶液中 ___________.
学科网(北京)股份有限公司(3)“趁热抽滤”后得到滤渣2的主要成分是____________,“趁热抽滤”后检验铁元素已沉淀完全的操作
是_________________________________________.
(4)滤液X用空气和氨水处理可制备 ,反应温度和溶液pH对 的纯度和产率影响如图所示:
①由图可知由滤液X制备 的最佳反应条件为 __________℃,pH=__________.
②由滤液X制备 化学方程式为 ,温
度过高 产率下降的原因可能是____________________________.
12.(16分)某小组利用如图甲所示装置制备并收集 (夹持装置略去).
已知:Ⅰ. 高温时能与 反应,极易水解,能溶于 ;
Ⅱ.相关物质的熔沸点如表:
物质
熔点℃ -23.2 306 -23
沸点℃ 136.4 315 76.8
学科网(北京)股份有限公司(1)加热管式炉前需先通入 的目的是_______________________,管式炉加热至900℃时,瓷舟中会生成
、 和一种有毒的气态氧化物,并发生副反应生成少量 ,写出主反应生成 的化学方程
式_________________________.
(2)为除去 中的 应调节控温箱的温度范围为_____________℃.
(3)碱石灰的作用是________________________,该装置的缺陷是__________________.
(4)已知 在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原 制取 :
.
①基态Ti原子的电子排布式为____________________.
②反应中涉及的元素第一电离能最大的是______________, 中化学键类型为___________.
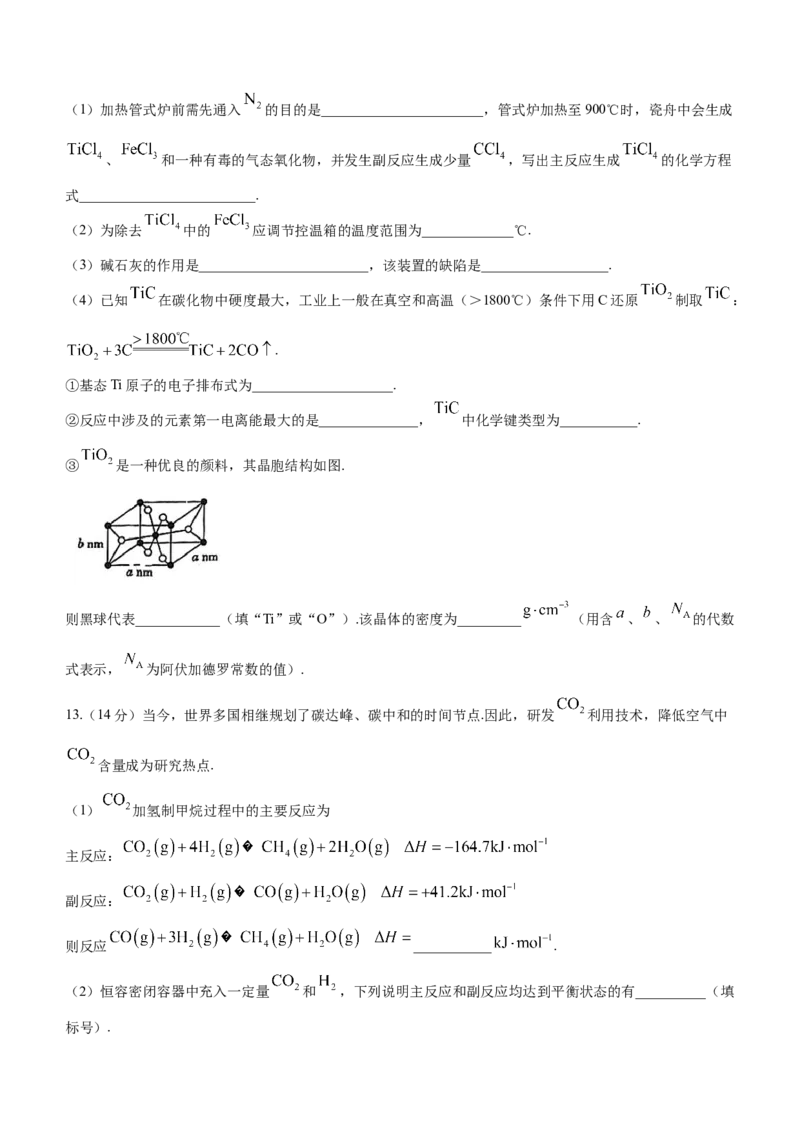
③ 是一种优良的颜料,其晶胞结构如图.
则黑球代表____________(填“Ti”或“O”).该晶体的密度为_________ (用含 、 、 的代数
式表示, 为阿伏加德罗常数的值).
13.(14分)当今,世界多国相继规划了碳达峰、碳中和的时间节点.因此,研发 利用技术,降低空气中
含量成为研究热点.
(1) 加氢制甲烷过程中的主要反应为
主反应:
副反应:
则反应 ___________ .
(2)恒容密闭容器中充入一定量 和 ,下列说明主反应和副反应均达到平衡状态的有__________(填
标号).
学科网(北京)股份有限公司A.混合气体密度不随时间变化 B.气体总压强不随时间变化
C.气体平均摩尔质量不随时间变化 D. 的消耗速率等于水蒸气生成速率
(3)500℃时,向1L恒容密闭容器中充入 和 及催化剂,经10min反应达到平衡后.①测
得转化率 ,生成CO的物质的量为1mol,0~10 min用 表示的平均反应速率
=___________ ,主反应的平衡常数 _________.
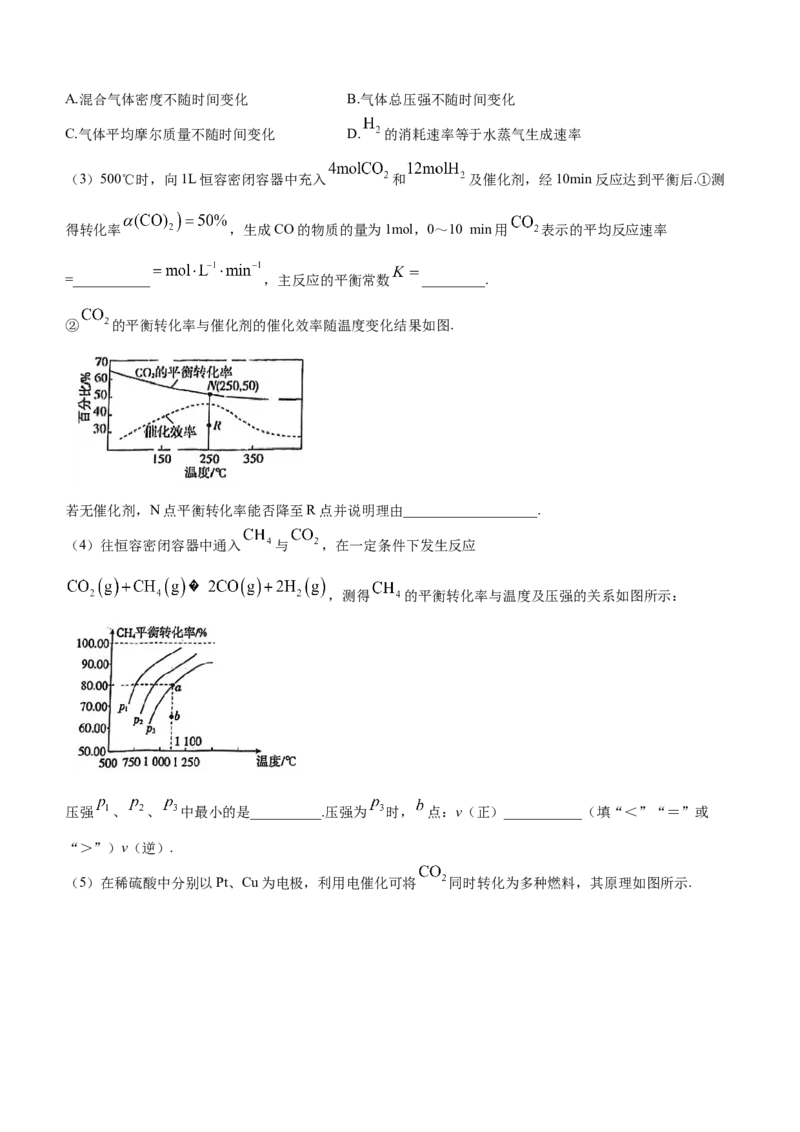
② 的平衡转化率与催化剂的催化效率随温度变化结果如图.
若无催化剂,N点平衡转化率能否降至R点并说明理由___________________.
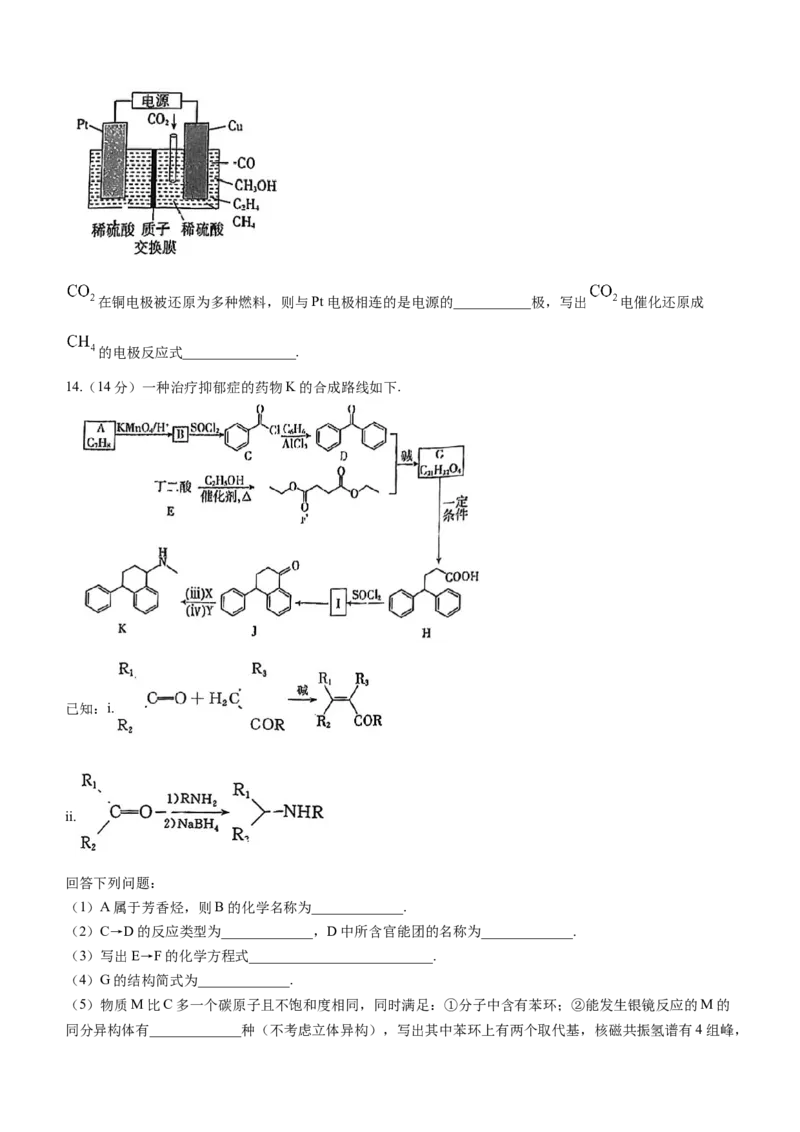
(4)往恒容密闭容器中通入 与 ,在一定条件下发生反应
,测得 的平衡转化率与温度及压强的关系如图所示:
压强 、 、 中最小的是__________.压强为 时, 点:v(正)___________(填“<”“=”或
“>”)v(逆).
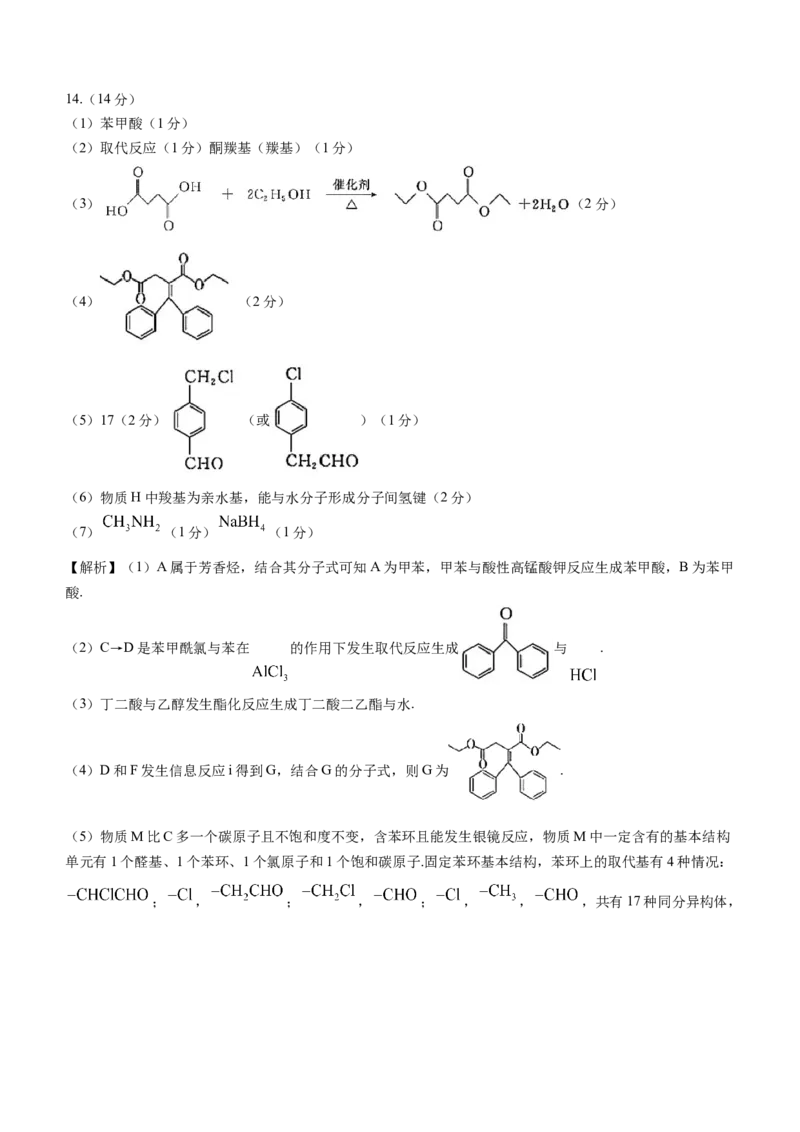
(5)在稀硫酸中分别以Pt、Cu为电极,利用电催化可将 同时转化为多种燃料,其原理如图所示.
学科网(北京)股份有限公司在铜电极被还原为多种燃料,则与Pt电极相连的是电源的___________极,写出 电催化还原成
的电极反应式________________.
14.(14分)一种治疗抑郁症的药物K的合成路线如下.
已知:i.
ii.
回答下列问题:
(1)A属于芳香烃,则B的化学名称为_____________.
(2)C→D的反应类型为_____________,D中所含官能团的名称为_____________.
(3)写出E→F的化学方程式__________________________.
(4)G的结构简式为_____________.
(5)物质M比C多一个碳原子且不饱和度相同,同时满足:①分子中含有苯环;②能发生银镜反应的M的
同分异构体有_____________种(不考虑立体异构),写出其中苯环上有两个取代基,核磁共振氢谱有4组峰,
学科网(北京)股份有限公司且峰面积比为1:2:2:2的同分异构体的结构简式为__________________________(只写一种).
(6)从物质结构的角度思考,物质H在水中的溶解度大于I的原因是_____________.
(7)J→K转化中需加入的物质X、Y分别是__________________________.
学科网(北京)股份有限公司漳州市 2024 届高三毕业班第二次质量检测
化学答案详解
1 2 3 4 5 6 7 8 9 10
A C C A B D C A A C
1.A【解析】碳纳米管与石墨烯是碳元素组成的不同单质,互为同素异形体;钢属于合金,熔点比纯铁低,硬
度比纯铁大;电催化醇氧化可得醛,体现了醇的还原性;玻璃属于无机非金属材料.
2.C【解析】该有机物含有醚键、酯基和酚羟基三种含氧官能团;该有机物中的饱和碳原子皆不符合手性碳的
条件;该有机物中含有的酯基和酚羟基均能与 反应,1 mol酯基消耗 ,1 mol酚羟基消耗
,所以1mol该有机物最多可消耗 ;该有机物中的碳碳双键、苯环均能发生加成反
应,酯基可以发生取代反应,酚羟基、碳碳双键能发生氧化反应.
3.C【解析】X、Y、Z、W为原子序数依次增大的短周期主族元素,W原子的最外层电子数等于其电子总数
的 ,为P元素;结合结构分析,X形成四个共价键,为C元素,Y形成两个共价键,为O元素,Z形成一
个共价键,为F元素.原子半径:P>C>O>F;简单氢化物的稳定性: ;电负性:F>O>
C;在阴离子中C、O、F原子最外层均为 稳定结构,P原子最外层未形成 稳定结构.
4.A【解析】12g金刚石的物质的量为1mol,依据金刚石的结构可知,每个碳原子形成C-C键的个数为
,故12g金刚石中含有C-C键的数目是 ;标准状况下 不是气体,故无法计算 键的数目;
溶液的体积未知,无法计算离子的数目;46g钠单质的物质的量为2mol,由关系式 可知转移电子数
为 .
5.B【解析】 只能溶于强碱不能溶于弱碱,所以明矾和过量的氨水反应生成 沉淀;向
溶液中滴加 至 完全沉淀,参加反应的 和 物质的量比为1:1,离子方程式
为 ;铁为活性电极,阳极的电极反应是铁单质放电生成 ,
不会生成 .
学科网(北京)股份有限公司6.D【解析】 与 不反应, 可与 反应生成 气体,该装置会将 气体除去;
易升华, 受热易分解,且其分解生成的 与 遇冷又会化合生成氯化铵固体,加热无法分离
两固体;苯的密度小于水,苯与水分层,有机层在上层;模拟侯氏制碱法制备 ,可在 与
的饱和溶液中通入 实现.
7.C【解析】 中碳原子为sp杂化, 中碳原子为 杂化,杂化方式不同;由图中信息可知,电极
N上,碱性溶液中的氧元素被氧化为氧气,电极反应为 ;反应器的总反应为
,反应后溶液的碱性增强,pH变大;未给出气体是否处于标准状况,无法
计算转移电子的数目.
8.A【解析】反应过程中,+4价、+2价氮元素与-3价的氮元素发生氧化还原反应,根据质量守恒定律,由
转化③可知X为 和 ,故X为混合物; 和 中心原子的价电子对数均为4,均为 杂化,但
含有1对孤电子对,故 的空间结构为正四面体形而 的空间结构为三角锥形;根据反应历程图
可知,进入体系的物质 、NO、 为反应物,从体系出来的物质 、 为生成物,总反应:
,故 脱除燃煤烟气中的NO和 时,
;根据质量守恒定律,由转化④可知Y是 .
9.A 【解析】硫铁矿焙烧被氧化的元素有铁和硫,主要发生的化学反应为
;“试剂a”可选用还原性铁粉,主要目的是将 转化为 ,以便
后续步骤中除去 ;根据信息中各金属离子开始沉淀和完全沉淀时溶液的pH可知,调节溶液pH为5.2~
7.6,能将 完全沉淀,而 不沉淀;“沉淀”时,向滤液(主要含有 )中加入过氧化氢和氨水,
产生沉淀 ,过滤得到“滤液D”,其主要成分为 ,属于铵态氮肥.
10.C 【解析】用 溶液滴定 发生反应 , 不断减少,
不断增多,故曲线b表示的是 的分布系数变化曲线; 点时 和 的分布系数相同,
学科网(北京)股份有限公司,则 的第二步电离平衡常数 ;由起点未加 溶液
时,常温下 溶液呈酸性可知, 的电离程度大于水解程度,所以 ; 点时滴入
了 溶液,溶液中 和 的浓度比为1:1,根据物料守恒和电荷守恒可得:
, ,消去
可得 .
11.(16分)
(1)适当升高温度(其他合理答案也给分)(1分)
(2分)S(1分)
(2) (2分) (2分)
(3) 、 (2分)
取少量抽滤液于试管中,向试管中滴加 溶液,若溶液未变成血红色,说明铁元素已沉淀完全(2分)
(4)①50 (1分)8.5(1分)
②温度过高,氨水不稳定,受热分解(2分)
【解析】(1)“浸取”时为加快反应速率可采取的措施有将矿石粉碎、适当升高温度或适当增大盐酸的浓度
等.
(2)由图可知, 时 , , ,
. 时, ,
, ,带入数值可得
.
(3)根据流程中的物质转化分析可知,滤渣2的成分是 和 .铁元素在溶液中以 形式存
在,调节 后,检验铁元素是否已沉淀完全只需检验滤液中是否有 即可.
(4)①依据图可知,温度越高, 纯度越高,但温度高于50℃纯度缓慢增大,产率下降,故最佳温度
为50℃;pH小于8.5时,产率、纯度随pH的增大而增大,pH大于8.5时产率下降,故最佳pH为8.5.②由滤
学科网(北京)股份有限公司液X制备 的化学方程式可知反应物中有氨水,氨水不稳定,受热易分解.
12.(16分)
(1)排出装置中的空气,防止 与空气中的 反应(2分)
(2分)
(2)136.4~306(1分)
(3) 极易水解,防止空气中的水蒸气进入E装置(2分)缺少处理尾气的装置(1分)
(4)① (或 )(1分)②O(2分)共价键(2分)③Ti(1分)
(2分)
【解析】(1)由信息Ⅰ可知, 高温时能与 反应,故加热管式炉前通入 的目的是排出装置中的空
气,防止 与空气中的 反应.
(2)根据信息Ⅱ可知,除去 中的 应调节控温箱温度高于 的沸点,低于 的熔点.
(3) 极易水解,需在收集 的装置后增加防水装置,故碱石灰的作用是防止空气中的水蒸气进入
E装置.管式炉中发生的主反应的生成物中含有 气体,故该装置的缺陷是缺少处理尾气的装置.
(4)①钛的原子序数为22,基态钛原子的电子排布式是 .②金属元素第一电离能一
般小于非金属元素,钛属于金属元素,第一电离能最小,C、O元素为同周期主族元素,一般情况下,第一
电离能从左至右依次增大,第一电离能:O>C.
为共价晶体,其中含有的化学键为共价键.③据图知,1个品胞中黑球个数为 ,白球个数为
,因此黑球代表Ti,白球代表O.1个晶胞的质量为 ,1个晶胞的体积为
,则晶体密度为 .
13.(14分)
学科网(北京)股份有限公司(1)-205.9(2分)
(2)BC (2分)
(3)①0.2(1分) (2分)②不能,因为催化剂不能改变反应物的平衡转化率(2分)
(4) (1分)>(1分)
(5)正(1分) (2分)
【解析】(1)根据盖斯定律,主反应-副反应即得目标反应,故
.
(2)恒容,反应前后物质状态全为气体,气体总质量不变,故气体密度始终不变;主反应变化前后气体分子
数减小,副反应变化前后气体分子数不变,反应到达平衡前气体总压强逐渐减小,总压强不变时达到平衡;
气体摩尔质量等于混合气体的总质量除以总物质的量,反应前后气体总质量不变,总物质的量减少,气体摩
尔质量是个变量,其不变时达到平衡; 的消耗和水蒸气的生成是同一方向,不能判断反应是否达到平衡.
(3)①根据 的转化率可知反应达到平衡后 的物质的量2mol,转化的 的浓度是
, ;再根据生成CO的物质的量为1mol,
利用碳元素守恒可知生成 的物质的量为1mol,由反应前后氧元素守恒可知生成 的物质的量为
3mol,由反应前后氢元素守恒可知 的物质的量为7mol,根据容器的体积为1L可知达到平衡时,
、 、 、 ,列出主反应K的
表达式带入计算可得 .②催化剂只能改变反应速率,不能改变平衡转化率,则无催化剂,N点的平
衡转化率也不会改变.
(4)该反应的正反应气体分子数增大,温度不变时,减小压强,平衡向正反应方向移动, 的平衡转化
率增大,故 .压强为 时, 点未达到平衡,反应正向进行,故v(正)>v(逆).
(5)由 在铜电极被还原为多种燃料,可知铜电极作阴极与电源负极相连,故Pt电极作阳极与电源正极
相连.
学科网(北京)股份有限公司14.(14分)
(1)苯甲酸(1分)
(2)取代反应(1分)酮羰基(羰基)(1分)
(3) (2分)
(4) (2分)
(5)17(2分) (或 )(1分)
(6)物质H中羧基为亲水基,能与水分子形成分子间氢键(2分)
(7) (1分) (1分)
【解析】(1)A属于芳香烃,结合其分子式可知A为甲苯,甲苯与酸性高锰酸钾反应生成苯甲酸,B为苯甲
酸.
(2)C→D是苯甲酰氯与苯在 的作用下发生取代反应生成 与 .
(3)丁二酸与乙醇发生酯化反应生成丁二酸二乙酯与水.
(4)D和F发生信息反应i得到G,结合G的分子式,则G为 .
(5)物质M比C多一个碳原子且不饱和度不变,含苯环且能发生银镜反应,物质M中一定含有的基本结构
单元有1个醛基、1个苯环、1个氯原子和1个饱和碳原子.固定苯环基本结构,苯环上的取代基有4种情况:
; , ; , ; , , ,共有17种同分异构体,
学科网(北京)股份有限公司分别是 .其
中满足苯环上有两个取代基,核磁共振氢谱有4组峰,且峰面积比为1:2:2:2的同分异构体的结构简式为
或 .
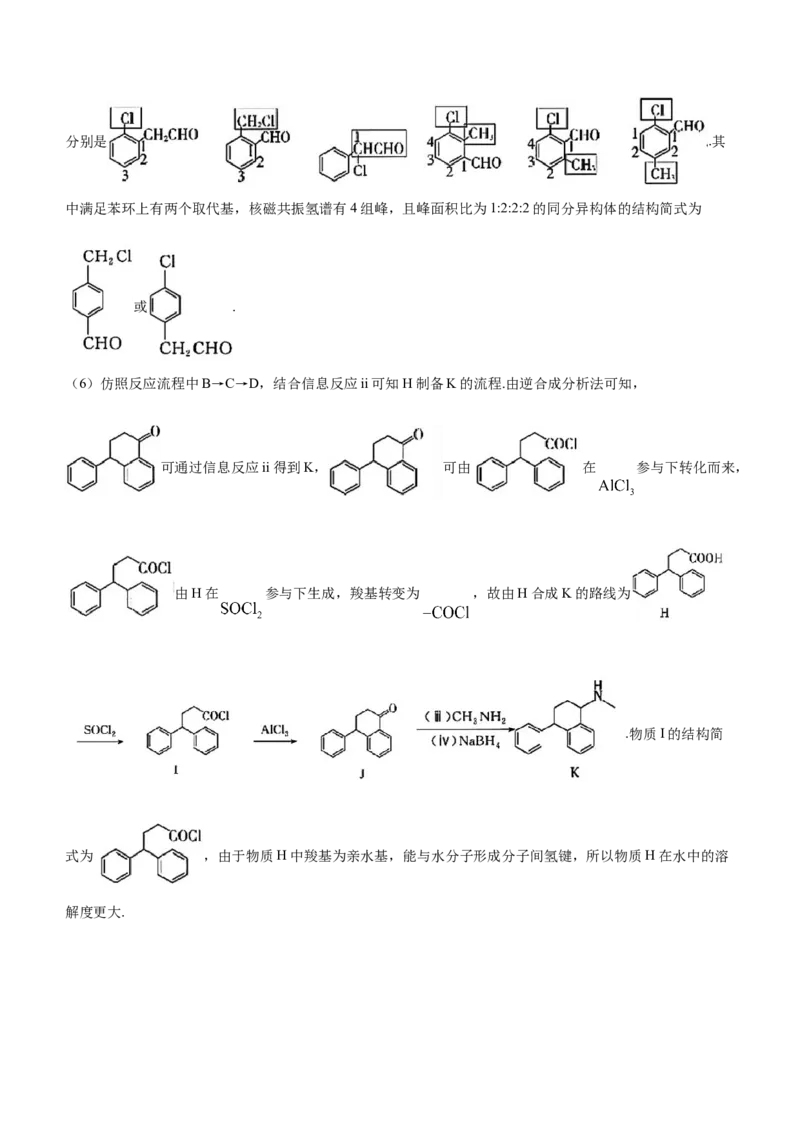
(6)仿照反应流程中B→C→D,结合信息反应ii可知H制备K的流程.由逆合成分析法可知,
可通过信息反应ii得到K, 可由 在 参与下转化而来,
由H在 参与下生成,羧基转变为 ,故由H合成K的路线为
.物质I的结构简
式为 ,由于物质H中羧基为亲水基,能与水分子形成分子间氢键,所以物质H在水中的溶
解度更大.
学科网(北京)股份有限公司