文档内容
点燃
“龙东联盟”2022 级高三学年上学期 11 月月考试题 C.制HCl:H 2 +Cl 2 =====2HCl
电解
D.冶炼铝:2AlCl(熔融)=====4Al+3Cl↑
3 2
(化学学科)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试结束后,将答题卡交回。
注意事项:
4. 摩尔盐的化学式为(NH)Fe(SO)·6HO,在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液
4 2 4 2 2
1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信息条形
的标准物质,用作化学试剂、医药,还用于冶金、电镀等。有关摩尔盐说法不正确的是( )
码粘贴区。 A.NH+的空间结构为正四面体形 B.可用KSCN溶液检验摩尔盐是否氧化变质
4
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字体工 C.NH
4
+的检验:NH
4
++OH-= NH
3
.H
2
O D.(NH
4
)
2
Fe(SO
4
)
2
·6H
2
O为纯净物
5.下列实验装置能达到相应目的的是( )
整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域作答,超出答题区域书写的答案无效;在草稿纸、试
题卷上答题无效。
4.保持卡面清洁,不得折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Na23 Fe56 Cl 35.5
第 I 卷(选择题,共 45 分)
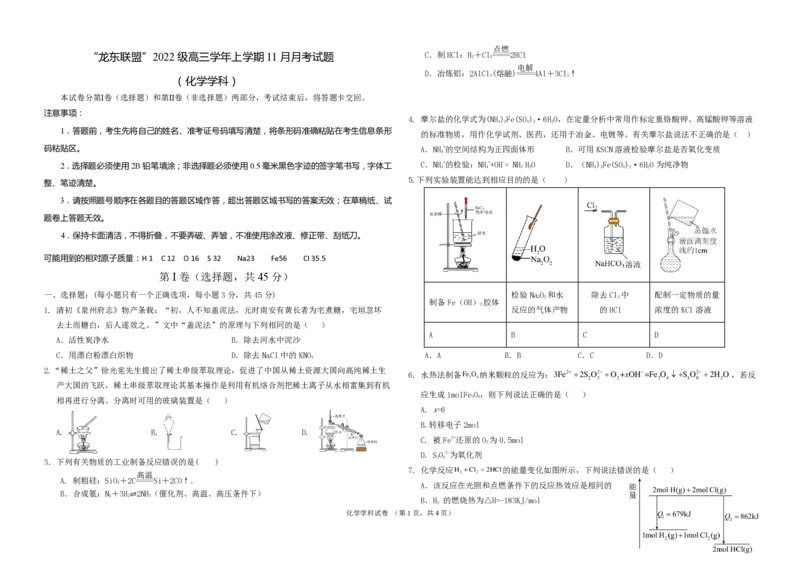
一、选择题:(每小题只有一个正确选项,每小题3分,共45分) 检验NaO 和水 除去Cl 中 配制一定物质的量
2 2 2
制备Fe(OH) 胶体
3
1. 清初《泉州府志》物产条载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏 反应的气体产物 的HCl 浓度的KCl溶液
去土而糖白,后人遂效之。”文中“盖泥法”的原理与下列相同的是( )
A B C D
A.活性炭净水 B.除去河水中泥沙
C.用漂白粉漂白织物 D.除去NaCl中的KNO A.A B.B C.C D.D
3
2.“稀土之父”徐光宪先生提出了稀土串级萃取理论,促进了中国从稀土资源大国向高纯稀土生
6. 水热法制备
产大国的飞跃,稀土串级萃取理论其基本操作是利用有机络合剂把稀土离子从水相富集到有机
相再进行分离。分离时可用的玻璃装置是( )
A. B. C. D.
3.下列有关物质的工业制备反应错误的是( )
高温
A. 制粗硅:SiO+2C=====Si+2CO↑.
2
B.合成氨:N+3H⇌2NH(催化剂、高温、高压条件下)
2 2 3
化学学科试卷 (第1页,共4页)
学科网(北京)股份有限公司
F e O3
4
纳米颗粒的反应为: 3 F e 2 2 S
2
O 23 O
2
+ x O H = F e
3
O
4
S
4
O 26 2 H
2
O ,若反
应生成1molFeO,则下列说法正确的是( )
3 4
A. x=6
B.转移电子2mol
C. 被Fe2+还原的O 为0.5mol
2
D. SO2-为氧化剂
2 3
7. 化学反应H Cl 2HCl的能量变化如图所示,下列说法错误的是( )
2 2
A.该反应在光照和点燃条件下的反应热效应是相同的
B.H 的燃烧热为△H=-183KJ/mol
2C.1mol H(g)变成2mol气态氢原子是吸热过程
2
D.2mol H(g)与2mol Cl (g)形成2mol HCl(g)时
释放862KJ能量
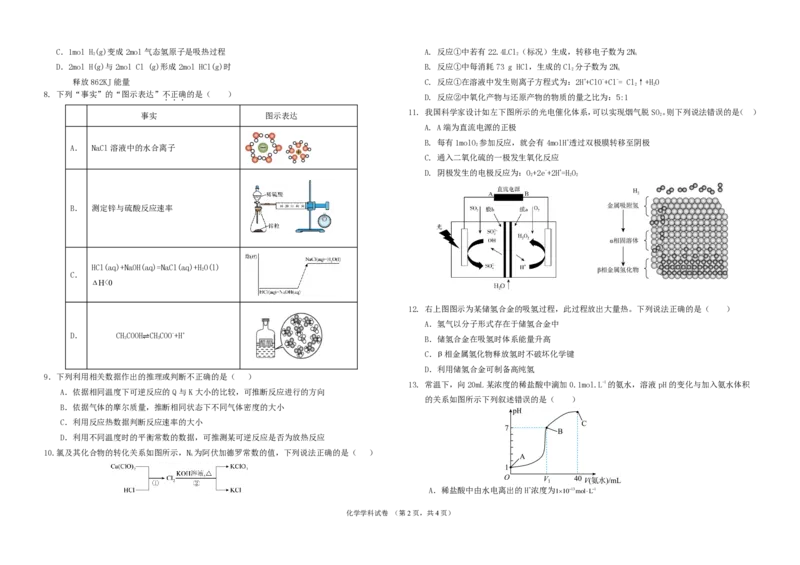
8. 下列“事实”的“图示表达”不正确的是( )
...
事实 图示表达
A. NaCl溶液中的水合离子
B. 测定锌与硫酸反应速率
HCl(aq)+NaOH(aq)=NaCl(aq)+HO(l)
2
C.
化学学科试卷 (第2页,共4页)
学科网(北京)股份有限公司
A. 反应①中若有22.4LCl(标况)生成,转移电子数为2N
2 A
B. 反应①中每消耗73 g HCl,生成的Cl 分子数为2N
2 A
C. 反应①在溶液中发生则离子方程式为:2H++ClO-+Cl-= Cl↑+HO
2 2
D. 反应②中氧化产物与还原产物的物质的量之比为:5:1
11. 我国科学家设计如左下图所示的光电催化体系,可以实现烟气脱SO。则下列说法错误的是( )
2
A. A端为直流电源的正极
B. 每有1molO 参加反应,就会有4molH+透过双极膜转移至阴极
2
C. 通入二氧化硫的一极发生氧化反应
D. 阴极发生的电极反应为:O+2e-+2H+=HO
2 2 2
<
12. 右上图图示为某储氢合金的吸氢过程,此过程放出大量热。下列说法正确的是( )
A.氢气以分子形式存在于储氢合金中
D. CHCOOH⇌CHCOO-+H+
3 3 B.储氢合金在吸氢时体系能量升高
C.
9.下列利用相关数据作出的推理或判断不正确的是( )
A.依据相同温度下可逆反应的Q与K大小的比较,可推断反应进行的方向
B.依据气体的摩尔质量,推断相同状态下不同气体密度的大小
C.利用反应热数据判断反应速率的大小
D.利用不同温度时的平衡常数的数据,可推测某可逆反应是否为放热反应
10.氯及其化合物的转化关系如图所示,N 为阿伏加德罗常数的值,下列说法正确的是( )
A
β 相金属氢化物释放氢时不破坏化学键
D.利用储氢合金可制备高纯氢
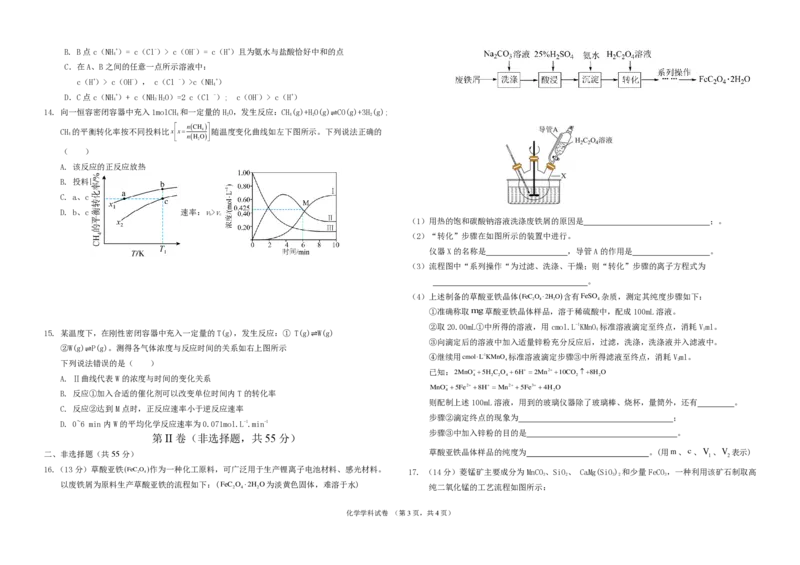
13. 常温下,向20mL某浓度的稀盐酸中滴加0.1mol.L-1的氨水,溶液pH的变化与加入氨水体积
的关系如图所示下列叙述错误的是( )
A.稀盐酸中由水电离出的H+浓度为11013molL1B. B点c(NH+)= c(Cl-)> c(OH-)= c(H+)且为氨水与盐酸恰好中和的点
4
C.在A、B之间的任意一点所示溶液中:
c(H+)> c(OH-), c(Cl -)>c(NH+)
4
D.C点c(NH+)+ c(NH.HO)=2 c(Cl -); c(OH-)> c(H+)
4 3 2
14. 向一恒容密闭容器中充入1molCH
4
和一定量的H
2
O,发生反应:CH
4
(g)+H
2
O(g)⇌CO(g)+3H
2
(g);
nCH
CH 4 的平衡转化率按不同投料比x x nH 2 O 4 随温度变化曲线如左下图所示。下列说法正确的
( )
A. 该反应的正反应放热
B. 投料比x:x>x
1 2
C. a、c两点的平衡常数:K= K
a c
D. b、c两点反应开始时的正反应速率:v>v
b c
(1)用热的饱和碳酸钠溶液洗涤废铁屑的原因是 ;。
(2)“转化”步骤在如图所示的装置中进行。
仪器X的名称是 ,导管A的作用是 。
(3)流程图中“系列操作“为过滤、洗涤、干燥;则“转化”步骤的离子方程式为
。
(4)上述制备的草酸亚铁晶体
15. 某温度下,在刚性密闭容器中充入一定量的T(g),发生反应:① T(g)⇌W(g)
②W(g)⇌P(g)。测得各气体浓度与反应时间的关系如右上图所示
下列说法错误的是( )
A. Ⅱ曲线代表W的浓度与时间的变化关系
B. 反应①加入合适的催化剂可以改变单位时间内T的转化率
C. 反应②达到M点时,正反应速率小于逆反应速率
D. 0~6 min内W的平均化学反应速率为0.071mol.L-1.min-1
第 II 卷(非选择题,共 55 分)
二、非选择题(共55分)
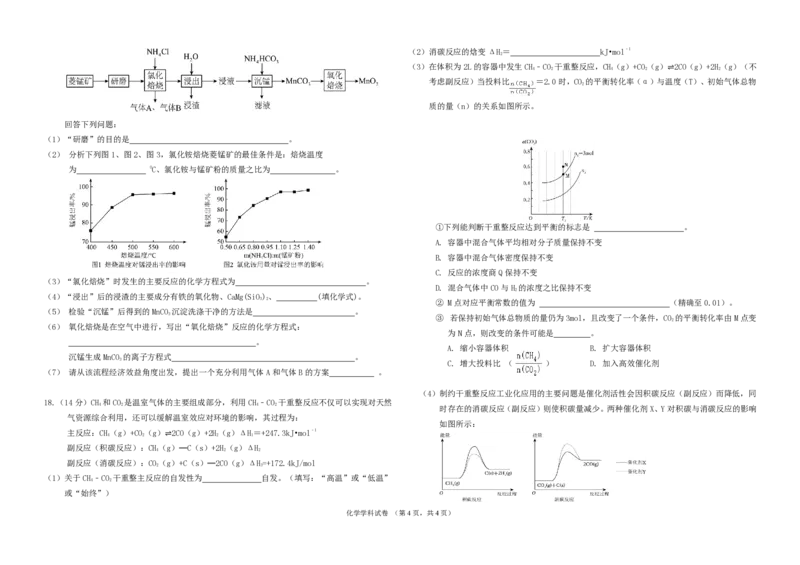
16.(13分)草酸亚铁FeCO 作为一种化工原料,可广泛用于生产锂离子电池材料、感光材料。
2 4
以废铁屑为原料生产草酸亚铁的流程如下:(FeC O 2H O为淡黄色固体,难溶于水)
2 4 2
化学学科试卷 (第3页,共4页)
学科网(北京)股份有限公司
F e C O2
4
2 H O2 含有 F e S O
4
杂质,测定其纯度步骤如下:
①准确称取 m g 草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
②取20.00mL①中所得的溶液,用cmol.L-1KMnO 标准溶液滴定至终点,消耗Vml。
4 1
③向滴定后的溶液中加入适量锌粉充分反应后,过滤,洗涤,洗涤液并入滤液中。
④继续用 c m o l L -1K M n O
4
标准溶液滴定步骤③中所得滤液至终点,消耗Vml。
2
已知: 2 M n O 4 5 H C2 O2
4
6 H 2 M n 2 1 0 C O
2
8 H O2
M n O 4 5 F e 2 8 H M n 2 5 F e 3 4 H
2
O
则配制上述100mL溶液,用到的玻璃仪器除了玻璃棒、烧杯,量筒外,还有 。
步骤②滴定终点的现象为 ;
步骤③中加入锌粉的目的是 。
草酸亚铁晶体样品的纯度为 。(用m、c、V 、V 表示)
1 2
17. (14分)菱锰矿主要成分为MnCO、SiO、 CaMg(SiO) 和少量FeCO,一种利用该矿石制取高 3 2 3 2 3
纯二氧化锰的工艺流程如图所示:(2)消碳反应的焓变ΔH= kJ•mol﹣1
2
(3)在体积为2L的容器中发生CH﹣CO 干重整反应,CH(g)+CO(g)⇌2CO(g)+2H(g)(不
4 2 4 2 2
考虑副反应)当投料比 =2.0时,CO 的平衡转化率(α)与温度(T)、初始气体总物
2
质的量(n)的关系如图所示。
回答下列问题:
(1)“研磨”的目的是 。
(2) 分析下列图1、图2、图3,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度
为 0C、氯化铵与锰矿粉的质量之比为 。
①下列能判断干重整反应达到平衡的标志是 。
A. 容器中混合气体平均相对分子质量保持不变
B. 容器中混合气体密度保持不变
C. 反应的浓度商Q保持不变
(3)“氯化焙烧”时发生的主要反应的化学方程式为 。
D. 混合气体中CO与H 的浓度之比保持不变
2
(4)“浸出”后的浸渣的主要成分有铁的氧化物、CaMg(SiO)、 (填化学式)。
3 2 ② M点对应平衡常数的值为 (精确至0.01)。
(5) 检验“沉锰”后得到的MnCO 沉淀洗涤干净的方法是 。
3 ③ 若保持初始气体总物质的量仍为3mol,且改变了一个条件,CO 的平衡转化率由M点变
2
(6) 氧化焙烧是在空气中进行,写出“氧化焙烧”反应的化学方程式:
为N点,则改变的条件可能是 。
。
A. 缩小容器体积 B. 扩大容器体积
沉锰生成MnCO 的离子方程式 。
3 C. 增大投料比 ( ) D. 加入高效催化剂
(7) 请从该流程经济效益角度出发,提出一个充分利用气体A和气体B的方案 。
(4)制约干重整反应工业化应用的主要问题是催化剂活性会因积碳反应(副反应)而降低,同
18.(14分)CH 和CO 是温室气体的主要组成部分,利用CH﹣CO 干重整反应不仅可以实现对天然
4 2 4 2
时存在的消碳反应(副反应)则使积碳量减少。两种催化剂X、Y对积碳与消碳反应的影响
气资源综合利用,还可以缓解温室效应对环境的影响,其过程为:
如图所示:
主反应:CH(g)+CO(g)⇌2CO(g)+2H(g)ΔH=+247.3kJ•mol﹣1
4 2 2 1
副反应(积碳反应):CH(g)═C(s)+2H(g)ΔH
4 2 2
副反应(消碳反应):CO(g)+C(s)═2CO(g)ΔH=+172.4kJ/mol
2 3
(1)关于CH﹣CO 干重整主反应的自发性为 自发。(填写:“高温”或“低温”
4 2
或“始终”)
化学学科试卷 (第4页,共4页)
学科网(北京)股份有限公司从消除催化剂表面积碳角度考虑,哪种催化剂更适合用于生产? (填催化剂X或
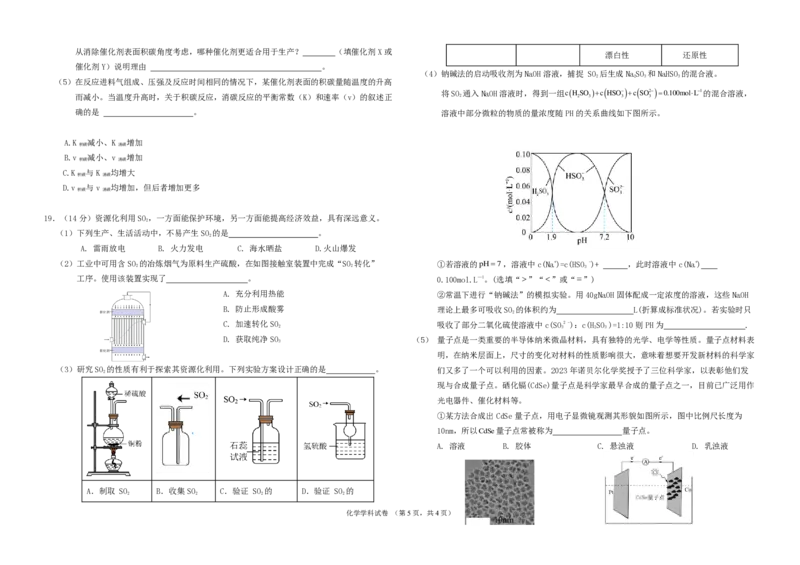
漂白性 还原性
催化剂Y)说明理由 。
(4)钠碱法的启动吸收剂为NaOH溶液,捕捉 SO 后生成NaSO 和NaHSO 的混合液。
2 2 3 3
(5)在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的升高
将SO 通入NaOH溶液时,得到一组cHSO c HSO c SO2 0.100molL1的混合溶液,
而减小。当温度升高时,关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正 2 2 3 3 3
确的是 。 溶液中部分微粒的物质的量浓度随PH的关系曲线如下图所示。
A.K 减小、K 增加
积碳 消碳
B.v 减小、v 增加
积碳 消碳
C.K 与K 均增大
积碳 消碳
D.v 与v 均增加,但后者增加更多
积碳 消碳
19.(14分)资源化利用SO,一方面能保护环境,另一方面能提高经济效益,具有深远意义。
2
(1)下列生产、生活活动中,不易产生SO 的是 。
2
A. 雷雨放电 B. 火力发电 C. 海水晒盐 D.火山爆发
(2)工业中可用含SO 的冶炼烟气为原料生产硫酸,在如图接触室装置中完成“SO 转化” ①若溶液的
2 2
工序。使用该装置实现了 。
A. 充分利用热能
B. 防止形成酸雾
C. 加速转化SO
2
D. 获取纯净SO
3
(3)研究SO 的性质有利于探索其资源化利用。下列实验方案设计正确的是 。
2
A.制取 SO B.收集SO C.验证 SO 的 D.验证 SO 的
2 2 2 2
化学学科试卷 (第5页,共4页)
学科网(北京)股份有限公司
p H 7 ,溶液中c(Na+)=c(HSO -)+ ,此时溶液中c(Na+)
3
0.100mol.L—1。(选填“ ”“ ”或“ ”)
②常温下进行“钠碱法”的模拟实验。用40gNaOH固体配成一定浓度的溶液,这些NaOH
理论上最多可吸收SO 的体积约为 L(折算成标准状况)。若实验时只
2
吸收了部分二氧化硫使溶液中c(SO2 -):c(HSO )=1:10则PH为 .
3 2 3
(5) 量子点是一类重要的半导体纳米微晶材料,具有独特的光学、电学等性质。量子点材料表
明,在纳米层面上,尺寸的变化对材料的性质影响很大,意味着想要开发新材料的科学家
们又多了一个可以利用的因素。2023年诺贝尔化学奖授予了三位科学家,以表彰他们发
现与合成量子点。硒化镉(CdSe)量子点是科学家最早合成的量子点之一,目前已广泛用作
光电器件、催化材料等。
①某方法合成出CdSe量子点,用电子显微镜观测其形貌如图所示,图中比例尺长度为
10nm,所以CdSe量子点常被称为 量子点。
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液②以Pt、Cu为电极材料并在Cu表面负载导电材料和CdSe量子点,高效催化光分解水,
如图所示:装置中P t作为 。
A.正极 B.负极 C.阳极 D.阴极
写出负极的电极反应式 。
化学学科试卷 (第6页,共4页)
学科网(北京)股份有限公司