文档内容
通州区 2024—2025 学年第一学期高三年级期中质量检测
化学试卷
2024年11月
本试卷共8页,共100分。考试时长90分钟。考生务必将答案答在答题卡上,在试卷上作答无效。考
试结束后,请将答题卡交回。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Fe 56
第一部分
本部分共14题,每题3分,共42分。在每题列出的四个选项中,选出最符合题目要求的一
项。
1.下列关于 与 说法正确的是
A.是同种核素 B.是同素异形体
C. 比 多一个电子 D. 比 多一个中子
2.下列化学用语或图示表达不正确的是
A. 的空间结构模型: B.基态 原子的价层电子排布式:
C. 的电子式: D. 的结构示意图:
3.下列说法不正确的是
A. 可用于治疗胃酸过多 B. 可用于杀菌消毒
C. 用于制作红色染料 D. 用于呼吸面具中氧气来源
4.设 为阿伏加德罗常数的值。下列说法正确的是
A. 中含有 键的数目为
B. 溶液中含 的数目为
C. 和 的混合气体含有的分子数目为
D. 水中含有的电子数为
5.下列方程式对事实的表述不正确的是A.电解饱和食盐水的反应:
B.利用覆铜板制作印刷电路板:
C.浓硝酸与铜反应产生红棕色气体:
D.硫酸铝溶液中滴加氨水产生白色胶状沉淀:
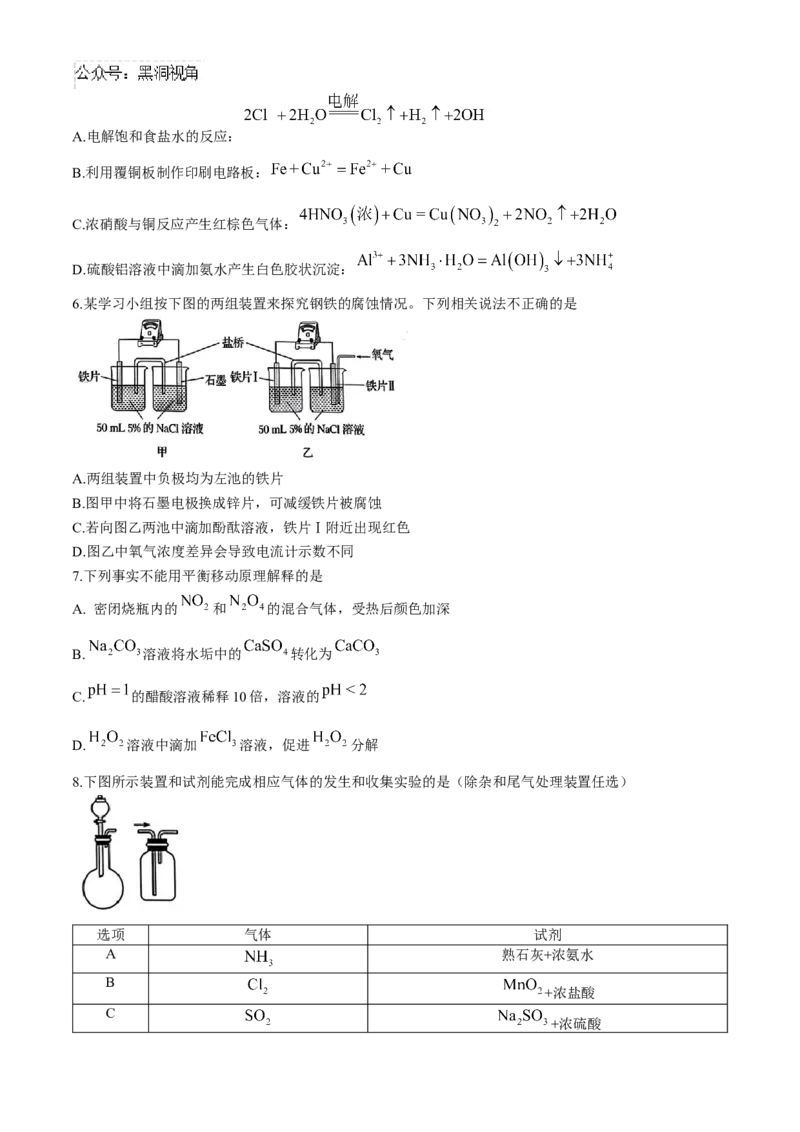
6.某学习小组按下图的两组装置来探究钢铁的腐蚀情况。下列相关说法不正确的是
A.两组装置中负极均为左池的铁片
B.图甲中将石墨电极换成锌片,可减缓铁片被腐蚀
C.若向图乙两池中滴加酚酞溶液,铁片Ⅰ附近出现红色
D.图乙中氧气浓度差异会导致电流计示数不同
7.下列事实不能用平衡移动原理解释的是
A. 密闭烧瓶内的 和 的混合气体,受热后颜色加深
B. 溶液将水垢中的 转化为
C. 的醋酸溶液稀释10倍,溶液的
D. 溶液中滴加 溶液,促进 分解
8.下图所示装置和试剂能完成相应气体的发生和收集实验的是(除杂和尾气处理装置任选)
选项 气体 试剂
A 熟石灰+浓氨水
B
+浓盐酸
C
+浓硫酸D 碳酸钙+稀硫酸
9.关于 和 的下列说法中,不正确的是
A.两种物质的溶液中,所含微粒的种类相同
B.向饱和 溶液中通入 ,会产生
C.分别向二者的溶液中加入 固体,水解平衡均受到抑制,溶液的pH均减小
D.测定二者混合物中 质量分数的方法是:取a g混合物充分加热,质量减少b g
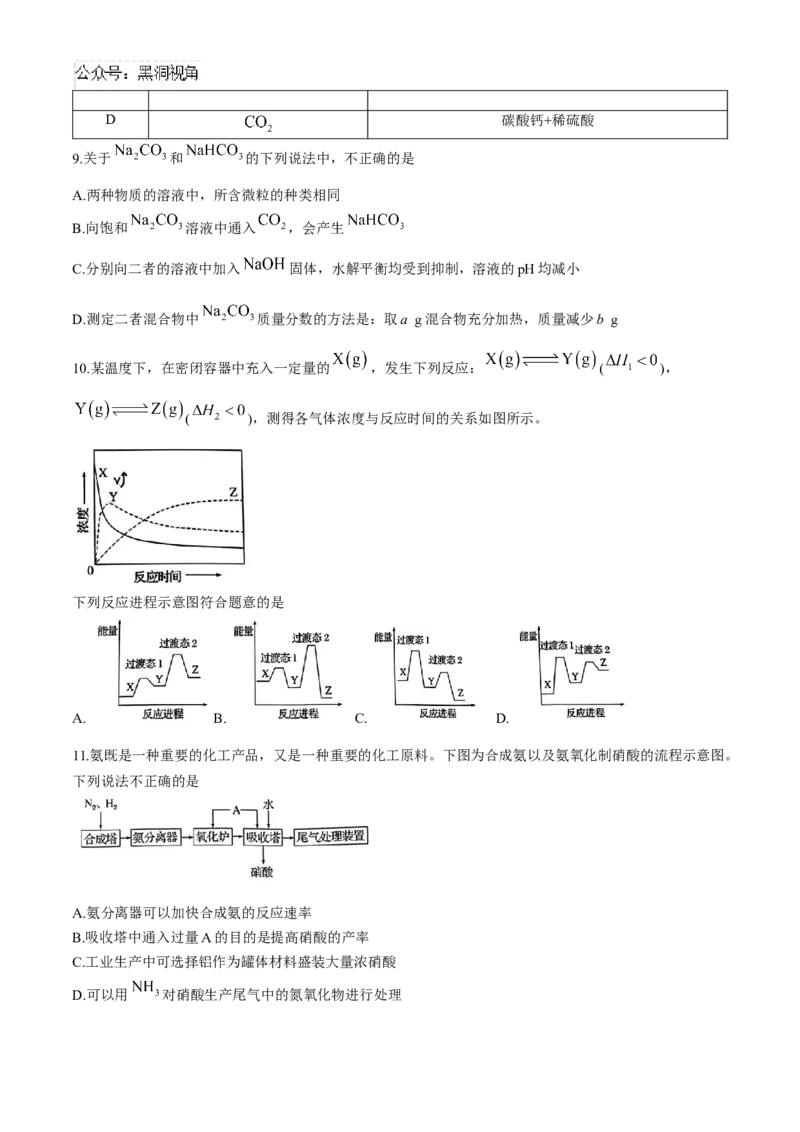
10.某温度下,在密闭容器中充入一定量的 ,发生下列反应: ( ),
( ),测得各气体浓度与反应时间的关系如图所示。
下列反应进程示意图符合题意的是
A. B. C. D.
11.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
下列说法不正确的是
A.氨分离器可以加快合成氨的反应速率
B.吸收塔中通入过量A的目的是提高硝酸的产率
C.工业生产中可选择铝作为罐体材料盛装大量浓硝酸
D.可以用 对硝酸生产尾气中的氮氧化物进行处理12. 还原 是实现“双碳”经济的有效途径之一。恒压、750℃时, 和 按物质的量之比为
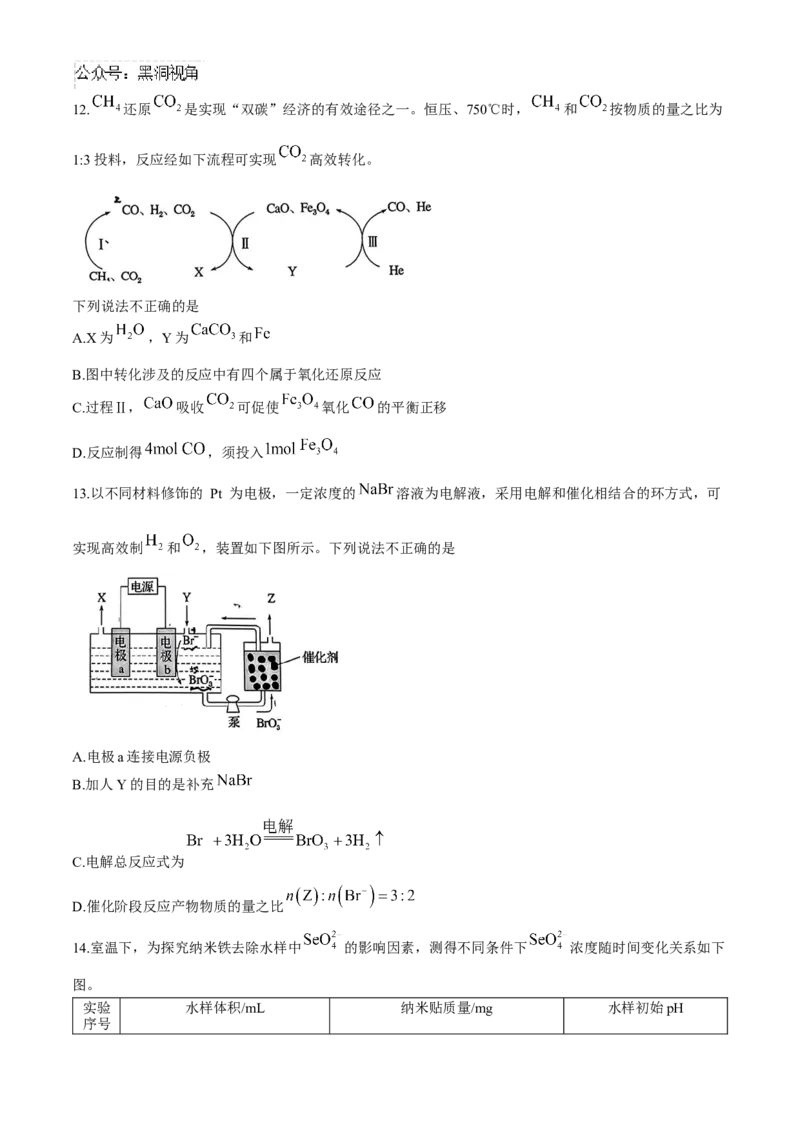
1:3投料,反应经如下流程可实现 高效转化。
下列说法不正确的是
A.X为 ,Y为 和
B.图中转化涉及的反应中有四个属于氧化还原反应
C.过程Ⅱ, 吸收 可促使 氧化 的平衡正移
D.反应制得 ,须投入
13.以不同材料修饰的 Pt 为电极,一定浓度的 溶液为电解液,采用电解和催化相结合的环方式,可
实现高效制 和 ,装置如下图所示。下列说法不正确的是
A.电极a连接电源负极
B.加人Y的目的是补充
C.电解总反应式为
D.催化阶段反应产物物质的量之比
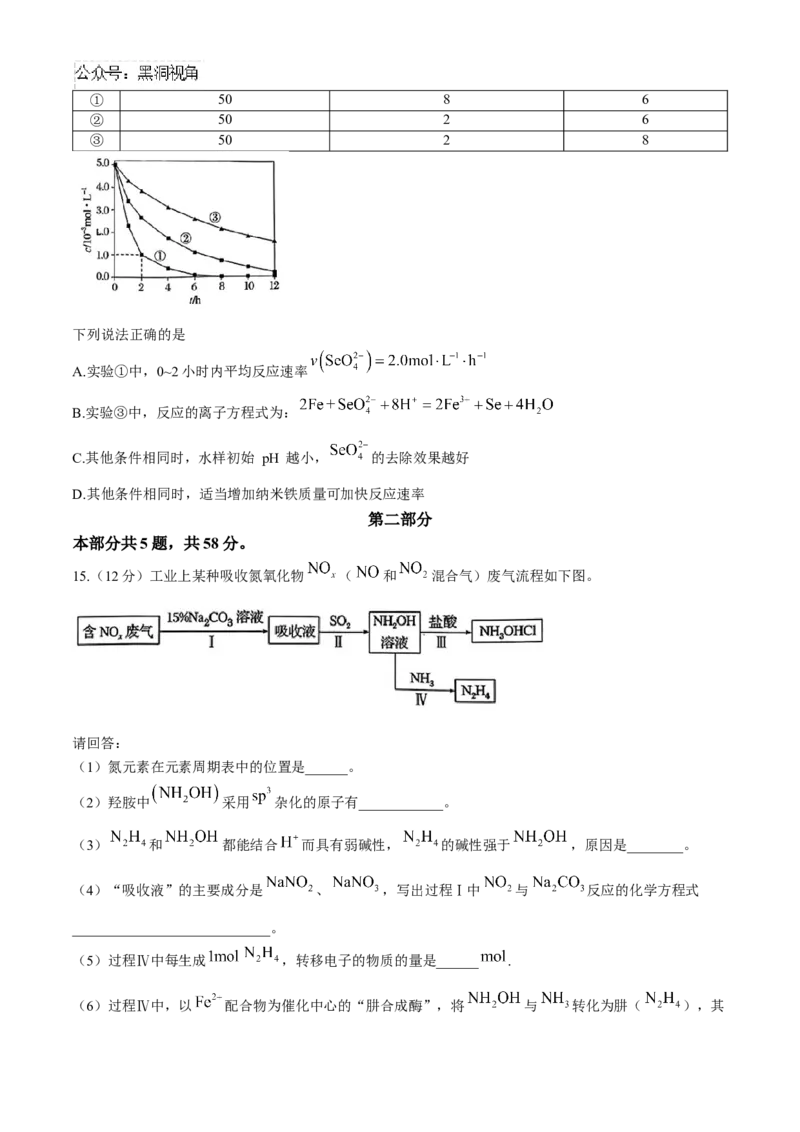
14.室温下,为探究纳米铁去除水样中 的影响因素,测得不同条件下 浓度随时间变化关系如下
图。
实验 水样体积/mL 纳米贴质量/mg 水样初始pH
序号① 50 8 6
② 50 2 6
③ 50 2 8
下列说法正确的是
A.实验①中,0~2小时内平均反应速率
B.实验③中,反应的离子方程式为:
C.其他条件相同时,水样初始 pH 越小, 的去除效果越好
D.其他条件相同时,适当增加纳米铁质量可加快反应速率
第二部分
本部分共5题,共58分。
15.(12分)工业上某种吸收氮氧化物 ( 和 混合气)废气流程如下图。
请回答:
(1)氮元素在元素周期表中的位置是______。
(2)羟胺中 采用 杂化的原子有____________。
(3) 和 都能结合 而具有弱碱性, 的碱性强于 ,原因是________。
(4)“吸收液”的主要成分是 、 ,写出过程Ⅰ中 与 反应的化学方程式
____________________________。
(5)过程Ⅳ中每生成 ,转移电子的物质的量是______ .
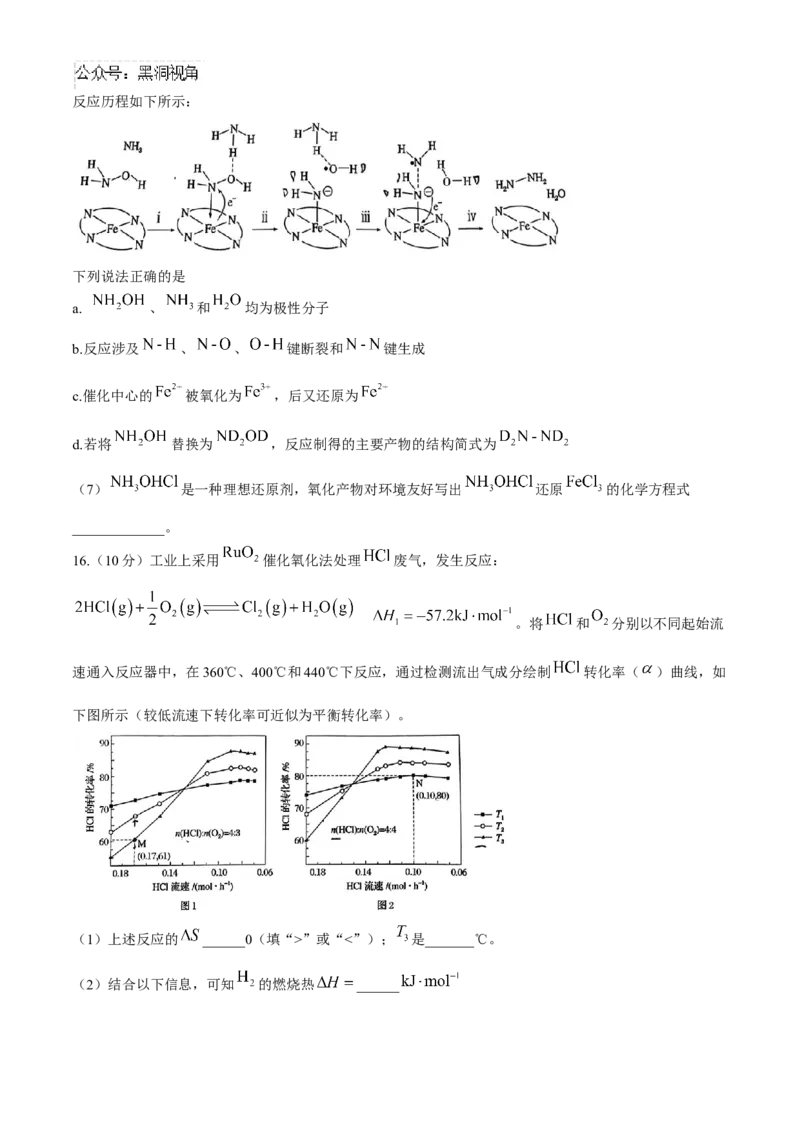
(6)过程Ⅳ中,以 配合物为催化中心的“肼合成酶”,将 与 转化为肼( ),其反应历程如下所示:
下列说法正确的是
a. 、 和 均为极性分子
b.反应涉及 、 、 键断裂和 键生成
c.催化中心的 被氧化为 ,后又还原为
d.若将 替换为 ,反应制得的主要产物的结构简式为
(7) 是一种理想还原剂,氧化产物对环境友好写出 还原 的化学方程式
_____________。
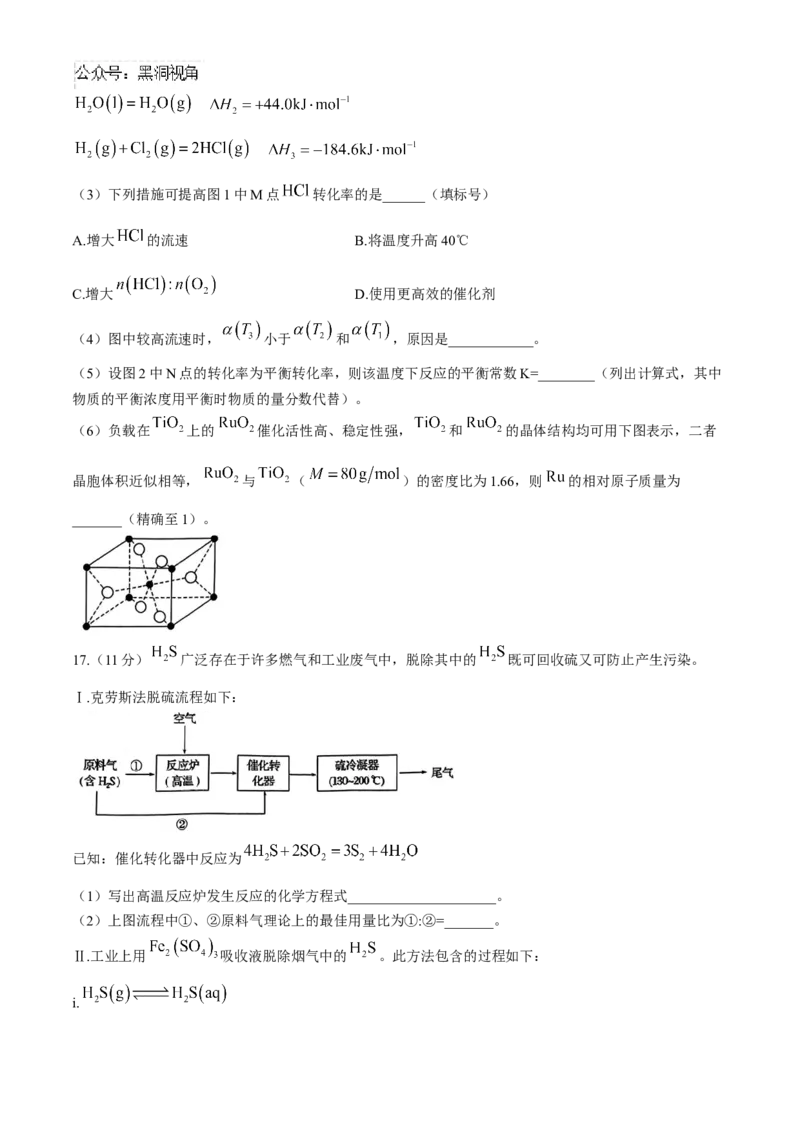
16.(10分)工业上采用 催化氧化法处理 废气,发生反应:
。将 和 分别以不同起始流
速通入反应器中,在360℃、400℃和440℃下反应,通过检测流出气成分绘制 转化率( )曲线,如
下图所示(较低流速下转化率可近似为平衡转化率)。
(1)上述反应的 ______0(填“>”或“<”); 是_______℃。
(2)结合以下信息,可知 的燃烧热 ______(3)下列措施可提高图1中M点 转化率的是______(填标号)
A.增大 的流速 B.将温度升高40℃
C.增大 D.使用更高效的催化剂
(4)图中较高流速时, 小于 和 ,原因是____________。
(5)设图2中N点的转化率为平衡转化率,则该温度下反应的平衡常数K=________(列出计算式,其中
物质的平衡浓度用平衡时物质的量分数代替)。
(6)负载在 上的 催化活性高、稳定性强, 和 的晶体结构均可用下图表示,二者
晶胞体积近似相等, 与 ( )的密度比为1.66,则 的相对原子质量为
_______(精确至1)。
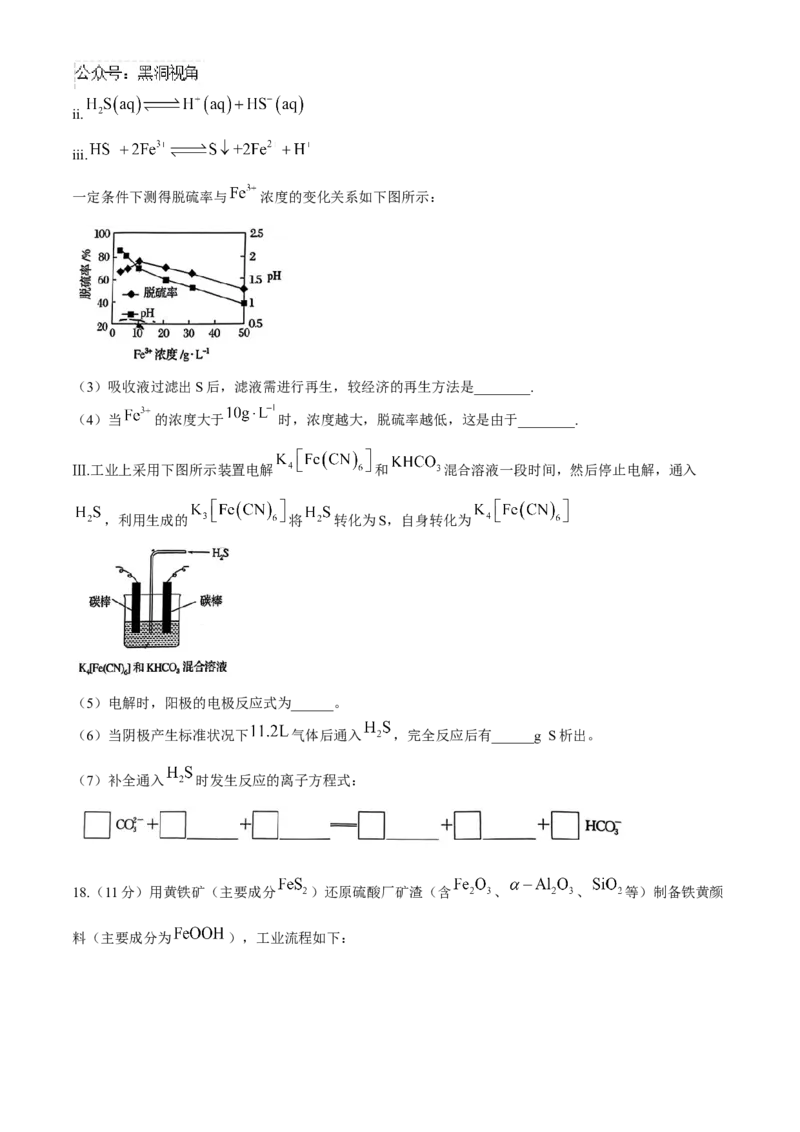
17.(11分) 广泛存在于许多燃气和工业废气中,脱除其中的 既可回收硫又可防止产生污染。
Ⅰ.克劳斯法脱硫流程如下:
已知:催化转化器中反应为
(1)写出高温反应炉发生反应的化学方程式_____________________。
(2)上图流程中①、②原料气理论上的最佳用量比为①:②=_______。
Ⅱ.工业上用 吸收液脱除烟气中的 。此方法包含的过程如下:
i.ii.
iii.
一定条件下测得脱硫率与 浓度的变化关系如下图所示:
(3)吸收液过滤出S后,滤液需进行再生,较经济的再生方法是________.
(4)当 的浓度大于 时,浓度越大,脱硫率越低,这是由于________.
Ⅲ.工业上采用下图所示装置电解 和 混合溶液一段时间,然后停止电解,通入
,利用生成的 将 转化为S,自身转化为
(5)电解时,阳极的电极反应式为______。
(6)当阴极产生标准状况下 气体后通入 ,完全反应后有______g S析出。
(7)补全通入 时发生反应的离子方程式:
18.(11分)用黄铁矿(主要成分 )还原硫酸厂矿渣(含 、 、 等)制备铁黄颜
料(主要成分为 ),工业流程如下:资料: 化学性质极不活泼,不溶于水也不溶于酸或碱。
I.制备铁黄产品
(1)提高“酸浸”的速率可以采用的措施有______。(任写一条措施)
(2)“还原”过程中生成硫磺的离子方程式是______
(3)制备 晶种。向 溶液中加入一定量的 ,鼓入空气,在一定的温度和pH条件下
可以制得 晶种, 与稀 反应生成的气体在反应中起催化剂作用。催化过程主要反应:
i.
ii.......
iii.
反应ii、iii均有 生成,请写出ii发生反应的离子方程式:________________。
(4)“二次氧化”时,将所得的晶种液按一定比例加入一定浓度的 溶液中,然后通入 氧化,温
度控制在80~85℃,再滴加氨水。溶液pH对铁黄质量分数影响如下表所示:
序号 pH 颜色
w( )/%
1 1~2 黄、红 67.3
2 3 亮黄 86.5
3 3~4 亮黄 88.6
4 4 亮黄 87.1
5 5 黄中有红黑相 78.9
①溶液的pH应控制到_________。
②pH过低或过高会造成铁黄质量分数降低,原因可能是______。
Ⅱ.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
资料: , 不与稀碱液反应。
(5)“溶解”时发生反应的化学方程式为_______。(6) 标准液和 标准液浓度均为 ,消耗两溶液的体积依次为 、 ,
计算铁黄的纯度为_______(列出计算式,不需化简)。
19.(14分)为探究 与 溶液的反应机理,查阅资料并进行实验。
资料:i.饱和 溶液的pH 约为11。
ii.部分微粒在水溶液中的颜色: (黄绿色)、 (无色)。
(1)甲同学研究 与 溶液的反应,他将 通入 溶液中制备pH≈11.7的84消毒液代替
溶液进行如下实验。
实验 滴管 烧杯 现象
Ⅰ 5滴84消毒液 溶液变棕黄色,再滴入淀粉溶液,溶液
变蓝
溶液
( )
Ⅱ 溶液变黄绿色,再滴入淀粉溶液,溶液
5滴 84消毒液(
颜色不变蓝,久置后,溶液黄绿色消失
溶液 )
①制备84消毒液时发生反应的化学方程式为_______________。
②实验Ⅰ中发生主要反应的离子方程式为_______________
③根据实验Ⅱ中溶液变为黄绿色,推测此时的主要氧化产物为_______________。
(2)乙同学认为实验Ⅱ过程中也有可能生成 ,设计实验进行探究。
实验 滴管 烧杯 现象
Ⅲ 逐滴加入
84消毒液( 随着 溶液的滴入,溶液变为黄绿
溶 色,且颜色不断加深,同时观察到溶液
)含少量
液 中出现局部变蓝但很快褪去的现象。继
淀粉溶液
续滴加 溶液,蓝色褪去速度变慢,
最终溶液变为蓝色,且不再褪色。
①实验Ⅲ中蓝色褪去的可能原因为__________(用离子方程式表示)。
②由以上实验可以得出: 浓度_________(填“较低”或“较高”)有利于 的生成。
(3)丙同学进一步探究溶液酸碱性对反应的影响,用硫酸调节84消毒液的pH约为1,进行实验。
实验 滴管 烧杯 现象
Ⅳ 逐滴加入 得到黑色固体和棕褐色溶液
84消毒液(
溶
)
液至过量
( )
①经过实验确定,黑色固体不是碘单质,实验方案是________(填实验操作和现象)。
②查阅资料, 是黑色固体或红棕色液体,化学性质类似卤素单质。为进一步探究实验Ⅳ中黑色固体成分,进行如下实验:取多次洗涤后的黑色固体,加入过量铁粉后加水振荡,黑色固体消失。为验证所得溶
液中的离子,需要的试剂有________________。
③结合上述实验,可以得出实验结论:在 溶液体系中,强碱性条件下,氧化产物最终为______;
强酸性条件下,氧化产物为______。
结论:改变溶液浓度或pH,可以影响 与 溶液反应的产物。
答案
DACAB CDCCB ADBD
15.第二周期第VA族:N、O;O原子电负性大,使得 分子中N原子周围电子云密度低,结合氢
离子能力减弱,碱性减弱
;1;ac
16.<;360; ;BD;较高流速下反应未达到平衡, 的转化率与反应速率相关, 温度低,反
应速率较慢, 小于 和
;101
17. ; 1:2;通入足量的空气; 浓度增大,pH减小,使过程i、ii向逆
反应方向进行且pH减小的影响超过过程中 浓度增大的影响
;16;
18.地增大硫酸的浓度、加热、将矿渣粉碎、搅拌等;3~4;pH过低会导致产生游离的 ,pH过高会导致产生 ,铁黄产品质量分数都降低;
19.
①
②
③ (或 或 )
① (或 或
)
较低:取少量黑色固体溶于水,取上层清液,滴加淀粉溶液,不变蓝;
铁氰化钾、 和稀 ; (或 或 );