文档内容
64 级高二上学期第一次阶段测试化学试题
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.答题前,考生务必将姓名、班级等个人信息填写在答题卡指定位置。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答。超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
可能用到的相对原子量:H-1 C-12 O-16 Cu-64 Pb-127 Ni-59
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1. 化学与生活、生产密切相关,下列说法错误的是
A. 雪碧打开时产生气泡,是因为压强减小促使 逸出
B. 工业合成氨,常采用铁触媒、氨气液化分离来提高反应速率
C. 废旧电池属于有害垃圾,因含有重金属,不能采用深挖填埋的方式进行处理
D. 北京冬奥会“同心”金属奖牌属于合金材料
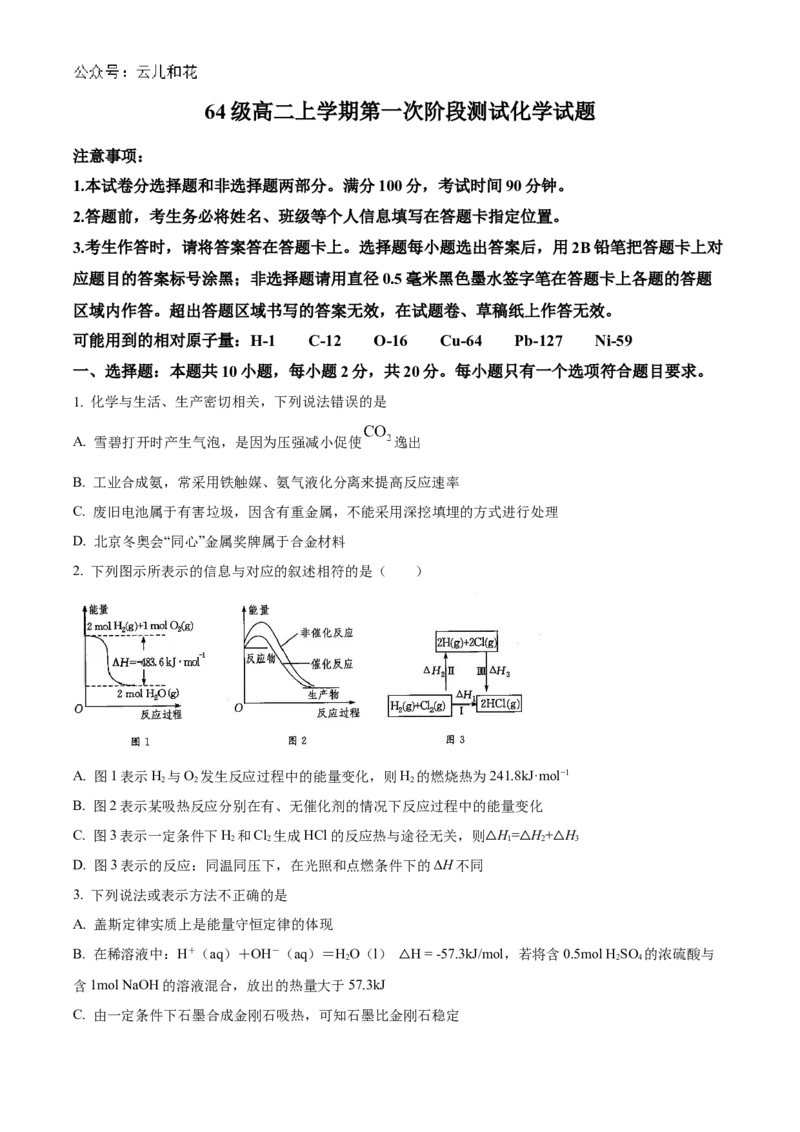
2. 下列图示所表示的信息与对应的叙述相符的是( )
A. 图1表示H 与O 发生反应过程中的能量变化,则H 的燃烧热为241.8kJ·mol−1
2 2 2
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H 和Cl 生成HCl的反应热与途径无关,则 H= H+ H
2 2 1 2 3
D. 图3表示的反应:同温同压下,在光照和点燃条件下的ΔH不同△ △ △
3. 下列说法或表示方法不正确的是
A. 盖斯定律实质上是能量守恒定律的体现
B. 在稀溶液中:H+(aq)+OH-(aq)=HO(l) H = -57.3kJ/mol,若将含0.5mol H SO 的浓硫酸与
2 2 4
含1mol NaOH的溶液混合,放出的热量大于57.3kJ △
C. 由一定条件下石墨合成金刚石吸热,可知石墨比金刚石稳定D. 在101kPa时,2g H 完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H
2 2
(g)+O(g)=2HO(l) H = –285.8kJ/mol
2 2
4. 氧化亚氮(N
2
O)是一种强温室△气体,且易转换成颗粒污染物。碘蒸气存在能大幅度提高N
2
O的分解速率,
反应历程为:
第一步I(g)→2I(g)(快反应)
2
第二步I(g)+NO(g)→N (g)+IO(g)(慢反应)
2 2
第三步IO(g)+N O(g)→N (g)+O(g)+I (g)(快反应)
2 2 2 2
实验表明,含碘时NO分解速率方程v=k•c(NO)•[c(I )]0.5(k为速率常数)。下列表述正确的是
2 2 2
A. NO分解反应中,k(含碘)>k(无碘) B. 第一步对总反应速率起决定作用
2
C. 第二步活化能比第三步小 D. I 浓度与NO分解速率无关
2 2
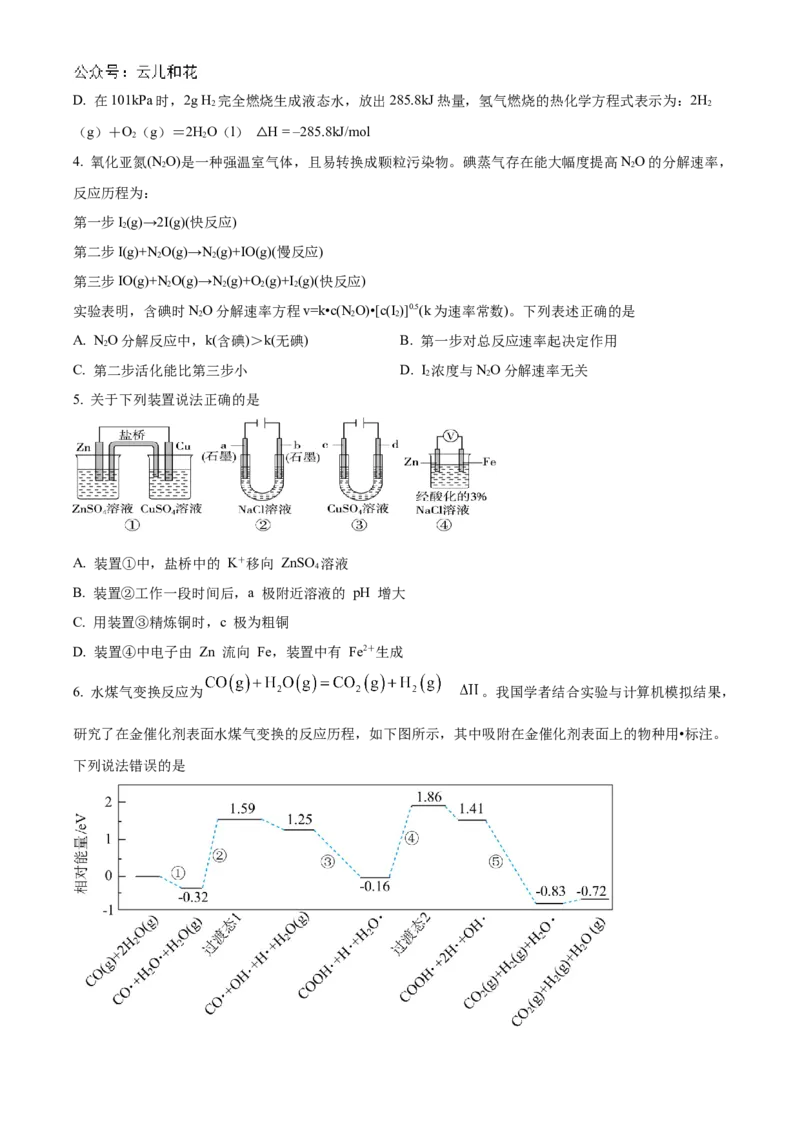
5. 关于下列装置说法正确的是
A. 装置①中,盐桥中的 K+移向 ZnSO 溶液
4
B. 装置②工作一段时间后,a 极附近溶液的 pH 增大
C. 用装置③精炼铜时,c 极为粗铜
D. 装置④中电子由 Zn 流向 Fe,装置中有 Fe2+生成
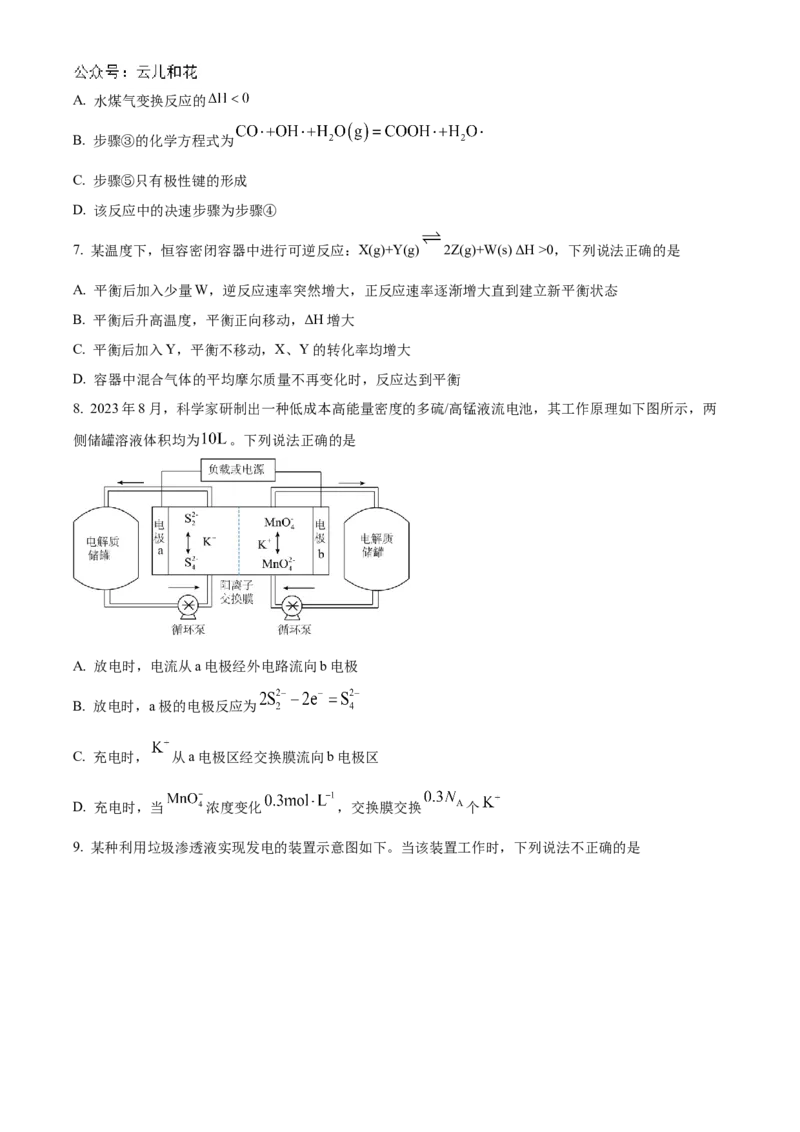
6. 水煤气变换反应为 。我国学者结合实验与计算机模拟结果,
研究了在金催化剂表面水煤气变换的反应历程,如下图所示,其中吸附在金催化剂表面上的物种用•标注。
下列说法错误的是A. 水煤气变换反应的
B. 步骤③的化学方程式为
C. 步骤⑤只有极性键的形成
D. 该反应中的决速步骤为步骤④
7. 某温度下,恒容密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) ΔH >0,下列说法正确的是
A. 平衡后加入少量W,逆反应速率突然增大,正反应速率逐渐增大直到建立新平衡状态
B. 平衡后升高温度,平衡正向移动,ΔH增大
C. 平衡后加入Y,平衡不移动,X、Y的转化率均增大
D. 容器中混合气体的平均摩尔质量不再变化时,反应达到平衡
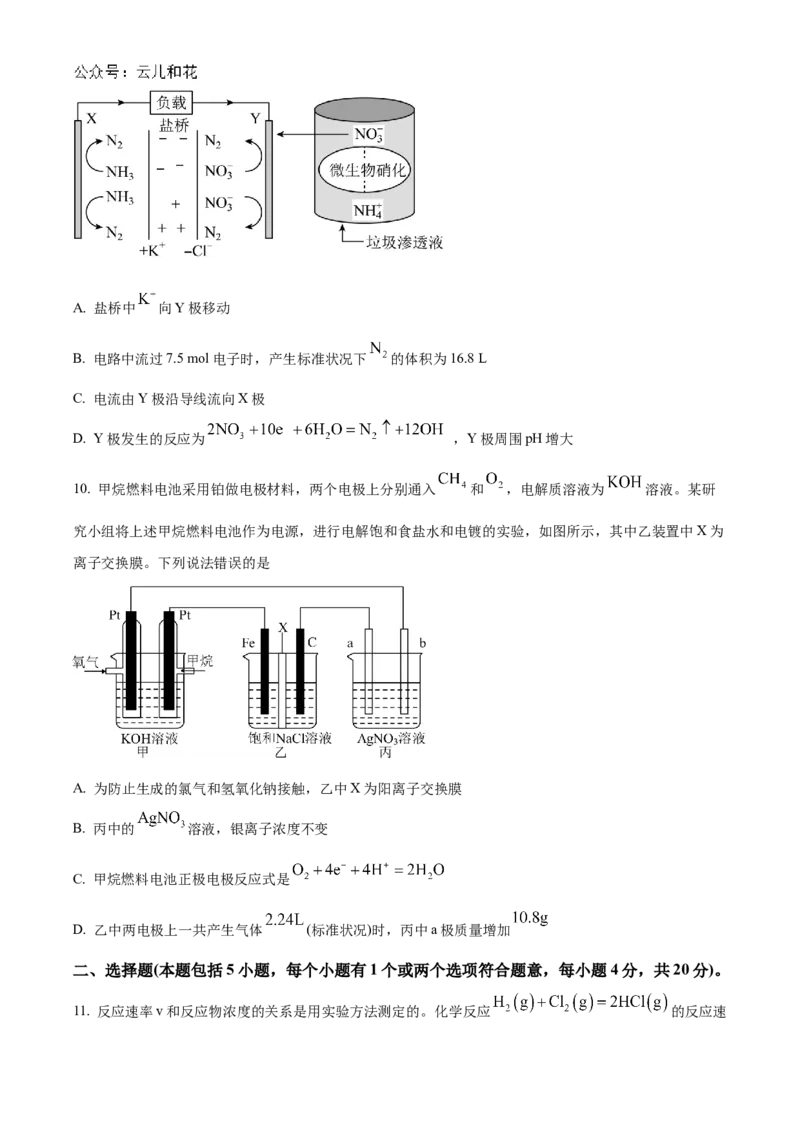
8. 2023年8月,科学家研制出一种低成本高能量密度的多硫/高锰液流电池,其工作原理如下图所示,两
侧储罐溶液体积均为 。下列说法正确的是
A. 放电时,电流从a电极经外电路流向b电极
B. 放电时,a极的电极反应为
C. 充电时, 从a电极区经交换膜流向b电极区
D. 充电时,当 浓度变化 ,交换膜交换 个
9. 某种利用垃圾渗透液实现发电的装置示意图如下。当该装置工作时,下列说法不正确的是A. 盐桥中 向Y极移动
B. 电路中流过7.5 mol电子时,产生标准状况下 的体积为16.8 L
C. 电流由Y极沿导线流向X极
D. Y极发生的反应为 ,Y极周围pH增大
10. 甲烷燃料电池采用铂做电极材料,两个电极上分别通入 和 ,电解质溶液为 溶液。某研
究小组将上述甲烷燃料电池作为电源,进行电解饱和食盐水和电镀的实验,如图所示,其中乙装置中X为
离子交换膜。下列说法错误的是
A. 为防止生成的氯气和氢氧化钠接触,乙中X为阳离子交换膜
B. 丙中的 溶液,银离子浓度不变
C. 甲烷燃料电池正极电极反应式是
D. 乙中两电极上一共产生气体 (标准状况)时,丙中a极质量增加
二、选择题(本题包括5小题,每个小题有1个或两个选项符合题意,每小题4分,共20分)。
11. 反应速率v和反应物浓度的关系是用实验方法测定的。化学反应 的反应速率v可表示为 ,式中k为常数,m、n值可用下表中数据确定。下列说法正确的是
实验序号
① 1.0 1.0 1.0k
.
② 2.0 1.0 20k
③ 2.0 4.0 4.0k
A. 在上述反应中, 、HCl、 的反应速率之比为1∶2∶1
B. 加入催化剂,正反应速率增大,逆反应速率减小
C. 上述化学反应速率表达式中 、
D. 相同条件下, 的浓度对反应速率的影响小于
12. 在密闭容器中发生反应: ,向密闭容器中以 通入两种反应
物,15min时A在四种不同温度下的转化率如下表所示,且 。下列说法正确的是
温度
转化率 10% 70% 70% 60%
A. 该反应是吸热反应
B. 温度时( ),A的转化率是70%
C. 温度反应15min时,若 ,则 温度时的平衡常数是5.625
D. 温度下,若反应在15min后继续进行,则A的转化率变大
13. 为实现实验目的,选用的装置、实验操作均正确的是
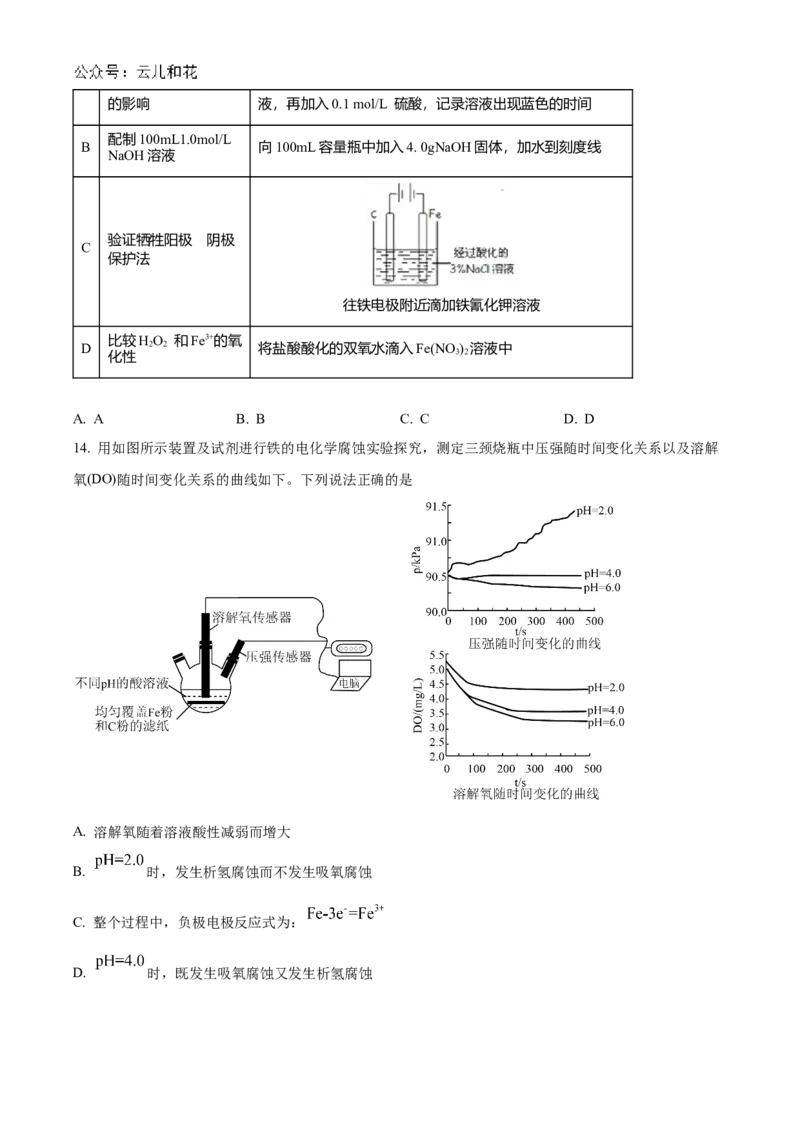
实验目的 实验步骤和装置
A 探究温度对反应速率 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶的影响 液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间
配制100mL1.0mol/L
B 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线
NaOH溶液
验证牺牲阳极 阴的极
C
保护法
往铁电极附近滴加铁氰化钾溶液
比较HO 和Fe3+的氧
D 2 2 将盐酸酸化的双氧水滴入Fe(NO ) 溶液中
化性 3 2
A. A B. B C. C D. D
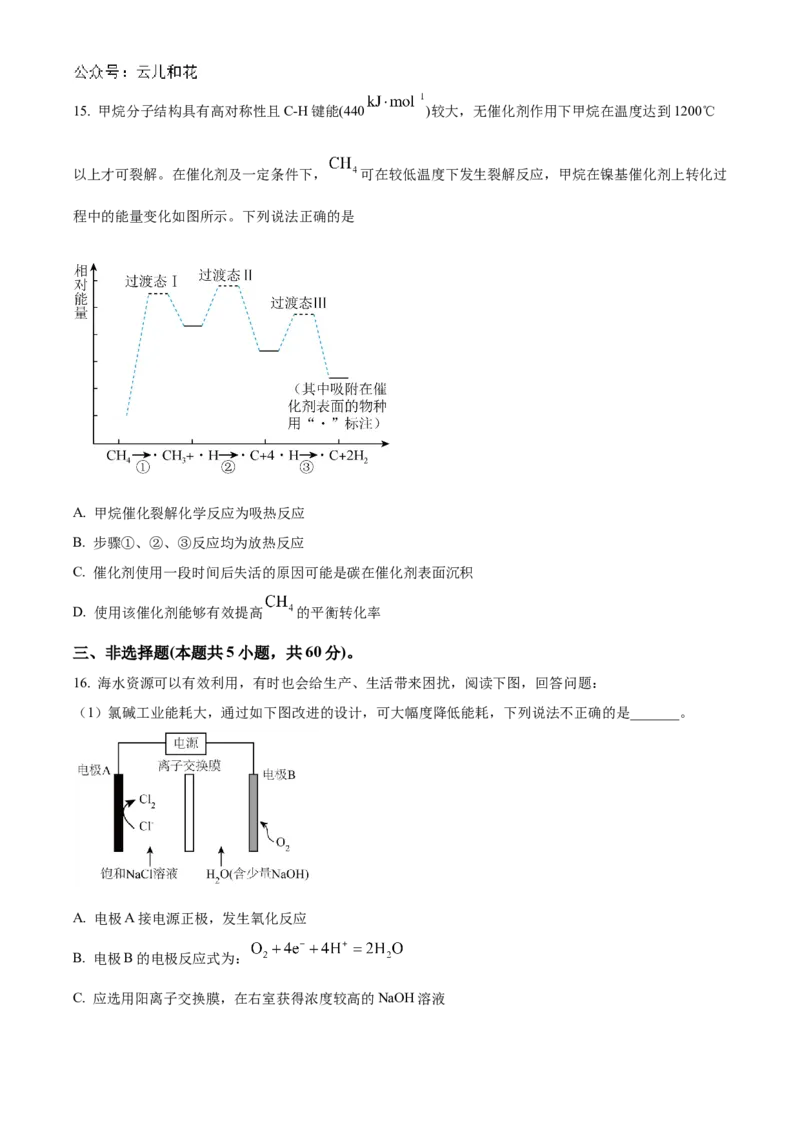
14. 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定三颈烧瓶中压强随时间变化关系以及溶解
氧(DO)随时间变化关系的曲线如下。下列说法正确的是
A. 溶解氧随着溶液酸性减弱而增大
B. 时,发生析氢腐蚀而不发生吸氧腐蚀
C. 整个过程中,负极电极反应式为:
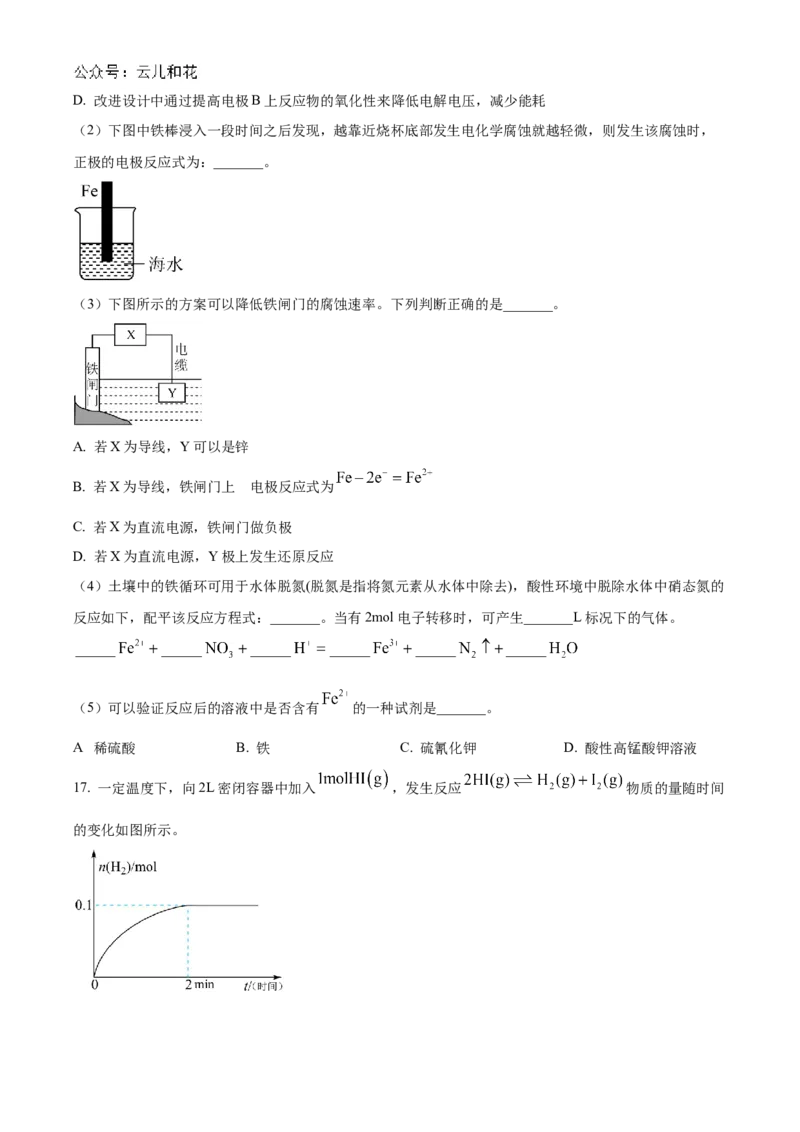
D. 时,既发生吸氧腐蚀又发生析氢腐蚀15. 甲烷分子结构具有高对称性且C-H键能(440 )较大,无催化剂作用下甲烷在温度达到1200℃
以上才可裂解。在催化剂及一定条件下, 可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过
程中的能量变化如图所示。下列说法正确的是
A. 甲烷催化裂解化学反应为吸热反应
B. 步骤①、②、③反应均为放热反应
C. 催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D. 使用该催化剂能够有效提高 的平衡转化率
三、非选择题(本题共5小题,共60分)。
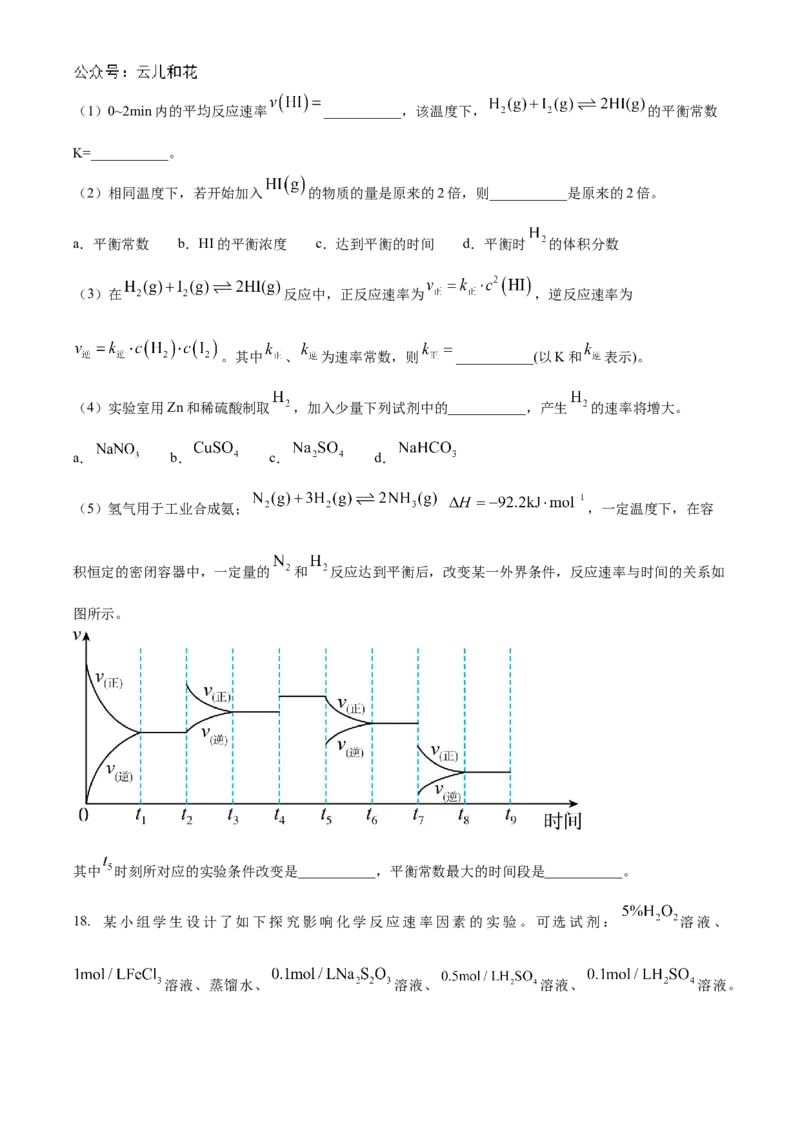
16. 海水资源可以有效利用,有时也会给生产、生活带来困扰,阅读下图,回答问题:
(1)氯碱工业能耗大,通过如下图改进的设计,可大幅度降低能耗,下列说法不正确的是_______。
A. 电极A接电源正极,发生氧化反应
B. 电极B的电极反应式为:
C. 应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液D. 改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
(2)下图中铁棒浸入一段时间之后发现,越靠近烧杯底部发生电化学腐蚀就越轻微,则发生该腐蚀时,
正极的电极反应式为:_______。
(3)下图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是_______。
A. 若X为导线,Y可以是锌
的
B. 若X为导线,铁闸门上 电极反应式为
C. 若X为直流电源,铁闸门做负极
D. 若X为直流电源,Y极上发生还原反应
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中脱除水体中硝态氮的
反应如下,配平该反应方程式:_______。当有2mol电子转移时,可产生_______L标况下的气体。
(5)可以验证反应后的溶液中是否含有 的一种试剂是_______。
.
A 稀硫酸 B. 铁 C. 硫氰化钾 D. 酸性高锰酸钾溶液
17. 一定温度下,向2L密闭容器中加入 ,发生反应 物质的量随时间
的变化如图所示。(1)0~2min内的平均反应速率 ___________,该温度下, 的平衡常数
K=___________。
(2)相同温度下,若开始加入 的物质的量是原来的2倍,则___________是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时 的体积分数
(3)在 反应中,正反应速率为 ,逆反应速率为
。其中 、 为速率常数,则 ___________(以K和 表示)。
(4)实验室用Zn和稀硫酸制取 ,加入少量下列试剂中的___________,产生 的速率将增大。
a. b. c. d.
(5)氢气用于工业合成氨; ,一定温度下,在容
积恒定的密闭容器中,一定量的 和 反应达到平衡后,改变某一外界条件,反应速率与时间的关系如
图所示。
其中 时刻所对应的实验条件改变是___________,平衡常数最大的时间段是___________。
18. 某小组学生设计了如下探究影响化学反应速率因素的实验。可选试剂: 溶液、
溶液、蒸馏水、 溶液、 溶液、 溶液。请按要求回答下列问题:
(1)小组确定实验探究的反应原理及比较反应速率大小的依据(填充空白)。
实验原理 化学方程式 判断依据
原理i ___________ 产生气泡快慢
原理ii ___________
的
(2)学生甲选择原理 ,探究催化剂对该反应速率 影响,必选试剂除 溶液外,还应选
___________。
(3)学生乙选择原理ii,设计如图所示对照实验,探究 浓度对该反应速率的影响。
试剂X及其用量:___________。
(4)学生丙选择原理ii设计实验,探究影响该反应速率的因素,数据如表所示:
溶液 溶液 蒸馏水
实验编 温
号 度/℃
浓度/ 体积/ 浓度/ 体积/ 体积/
(mol/L) mL (mol/L) mL mL
I 0.1 1 0.5 1 V 30
Ⅱ 0.1 2 0.5 1 7 30
Ⅲ 0.1 2 0.5 1 7 40
①对比实验I、Ⅱ,为探究___________对该反应速率的影响。
②V=___________,加入 水的目的是___________
③对比上述实验数据,推测反应速率最快的是___________(填实验编号)。
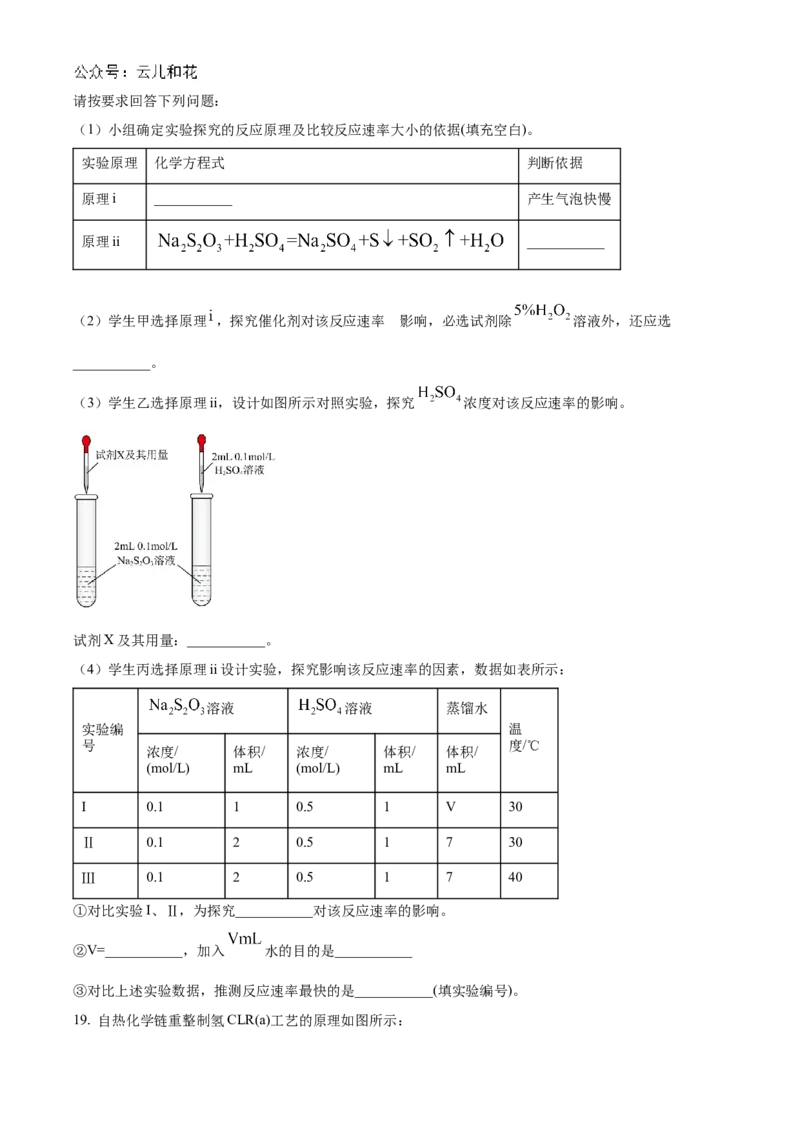
19. 自热化学链重整制氢CLR(a)工艺的原理如图所示:回答下列问题:
(1)25℃、101kPa时,1.0g Ni与足量 反应生成NiO放出8.0kJ的热量,则在“空气反应器”中发生反
应的热化学方程式为_______。
(2)“燃料反应器”中发生的部分反应有:
(Ⅰ) ;
(Ⅱ) ;
(Ⅲ) 。
则反应 的 _______ 。
(3)“水汽转换反应器”中发生的反应为 (平衡常数K=0.75),将
天然气看作是纯净的 (假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在t℃
时进行转换,水汽转换反应器中某时刻CO、 、 、 浓度之比为1∶x∶2∶1,此时
v(正)_______v(逆)(填“>”“=”或“<”),理由是_______。
(4)甲烷制氢传统工艺有水蒸气重整、部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,
涉及反应的热化学方程式如下:
水蒸气重整反应: 。
部分氧化重整反应: 。
采用水蒸气重整的优点是_______;若上述两个反应在保持自热条件下(假设无热量损失),理论上1mol
至多可获得 的物质的量为_______(结果保留1位小数)。
(5)一种以葡萄糖为燃料的微生物电池,其工作原理如图所示:①写出负极电极反应式:_______。
②随着电池不断放电,电解质溶液的酸性_______(填“增大”、“减小”或“不变”)。
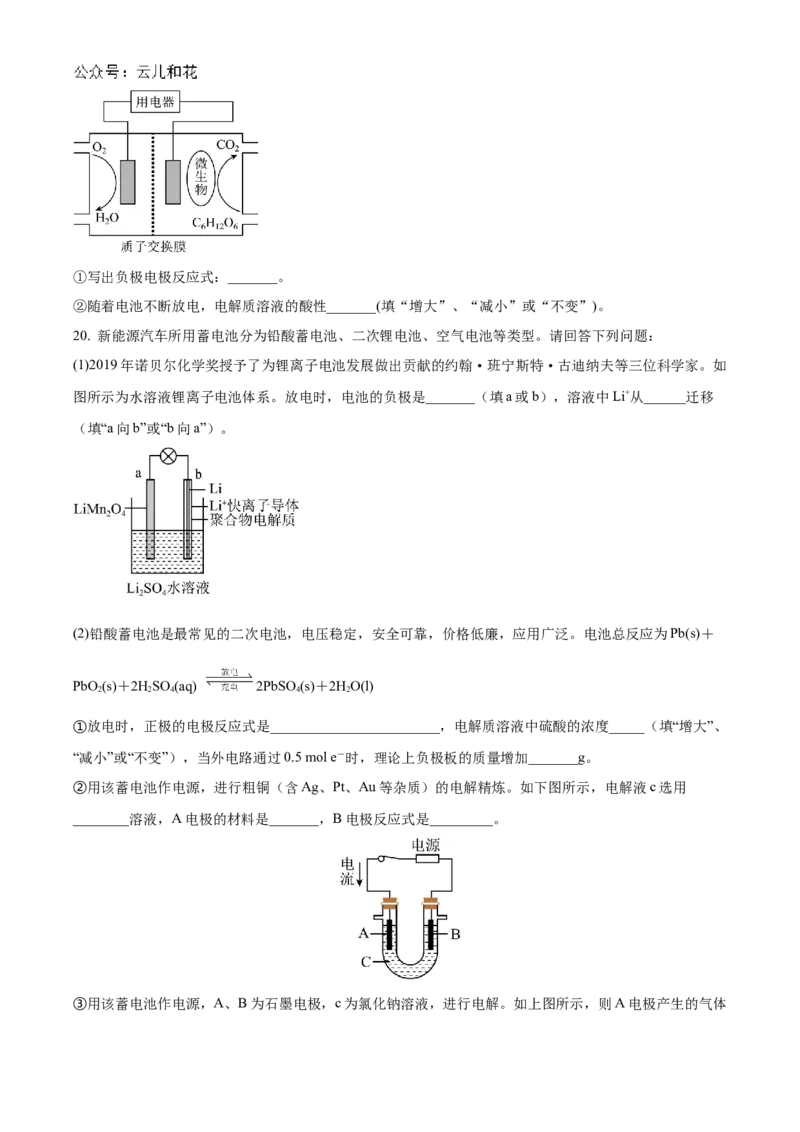
20. 新能源汽车所用蓄电池分为铅酸蓄电池、二次锂电池、空气电池等类型。请回答下列问题:
(1)2019年诺贝尔化学奖授予了为锂离子电池发展做出贡献的约翰·班宁斯特·古迪纳夫等三位科学家。如
图所示为水溶液锂离子电池体系。放电时,电池的负极是_______(填a或b),溶液中Li+从______迁移
(填“a向b”或“b向a”)。
(2)铅酸蓄电池是最常见的二次电池,电压稳定,安全可靠,价格低廉,应用广泛。电池总反应为Pb(s)+
PbO (s)+2HSO (aq) 2PbSO (s)+2HO(l)
2 2 4 4 2
①放电时,正极的电极反应式是________________________,电解质溶液中硫酸的浓度_____(填“增大”、
“减小”或“不变”),当外电路通过0.5 mol e-时,理论上负极板的质量增加_______g。
②用该蓄电池作电源,进行粗铜(含Ag、Pt、Au等杂质)的电解精炼。如下图所示,电解液c选用
________溶液,A电极的材料是_______,B电极反应式是_________。
③用该蓄电池作电源,A、B为石墨电极,c为氯化钠溶液,进行电解。如上图所示,则A电极产生的气体是________,B电极附近溶液的pH_____(填“增大”、“减小”或“不变”)。64 级高二上学期第一次阶段测试化学试题
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.答题前,考生务必将姓名、班级等个人信息填写在答题卡指定位置。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答。超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
可能用到的相对原子量:H-1 C-12 O-16 Cu-64 Pb-127 Ni-59
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】B
【2题答案】
【答案】C
【3题答案】
【答案】D
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】C
【7题答案】
【答案】D
【8题答案】
【答案】B
【9题答案】
【答案】B
【10题答案】
【答案】C
二、选择题(本题包括5小题,每个小题有1个或两个选项符合题意,每小题4分,共20分)。
【11题答案】【答案】AC
【12题答案】
【答案】C
【13题答案】
【答案】A
【14题答案】
【答案】D
【15题答案】
【答案】AC
三、非选择题(本题共5小题,共60分)。
【16题答案】
【答案】(1)B (2) (3)A
(4) ①. ②. 4.48 (5)D
【17题答案】
【答案】(1) ①. 0.05mol/(L·min) ②. 64
(2)b (3)
(4)b (5) ①. 减少生成物 的浓度(移走 ) ②.
【18题答案】
【答案】(1) ①. ②. 溶液变浑浊快慢
(2) 溶液
(3) 溶液
(4) ①. 溶液的浓度 ②. 8 ③. 控制硫酸的起始浓度相同 ④. Ⅲ
【19题答案】【答案】(1)
(2)+211.9 (3) ①. > ②. 根据碳、氢守恒得到 ,解得 ,浓度商
(4) ①. 消耗相同量的甲烷产生的氢气多 ②. 3.6mol
(5) ①. ②. 减小
【20题答案】
【答案】 ①. b ②. b向a ③. PbO+2e-+4H++2SO2-═PbSO+2HO ④. 减小 ⑤. 24 ⑥.
2 4 4 2
CuSO(CuCl 等) ⑦. 粗铜 ⑧. Cu2++2e-=Cu ⑨. 氯气 ⑩. 增大
4 2