文档内容
淄博实验中学高二年级第二学期第二次诊断考试 2024.6
化 学
可能用到的相对原子质量:H1 C12 O16 S32 Al27 N14 Cu64 Fe56 Mg24
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.淄博市文化底蕴丰厚,产业门类齐全。下列叙述正确的是
A.周村是鲁中地区著名的“旱码头”,其经营的棉布和丝绸化学成分相同
B.齐鲁石化生产的丙烯腈是重要化工产品,在类别上属于烃的含氧衍生物
C.桓台是江北第一个吨粮县,粮食酿酒的过程就是淀粉水解成乙醇的过程
D.“天下第一店”花生油中含有不饱和高级脂肪酸甘油酯,能使溴水褪色
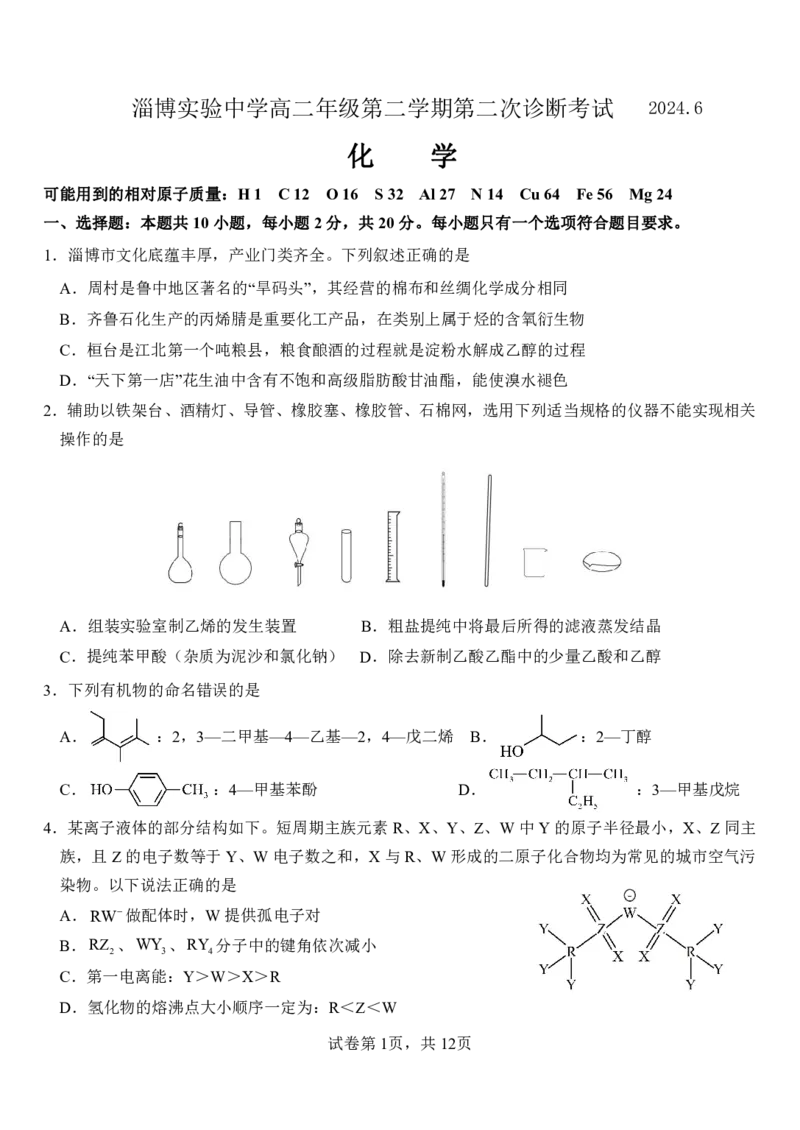
2.辅助以铁架台、酒精灯、导管、橡胶塞、橡胶管、石棉网,选用下列适当规格的仪器不能实现相关
操作的是
A.组装实验室制乙烯的发生装置 B.粗盐提纯中将最后所得的滤液蒸发结晶
C.提纯苯甲酸(杂质为泥沙和氯化钠) D.除去新制乙酸乙酯中的少量乙酸和乙醇
3.下列有机物的命名错误的是
A. :2,3—二甲基—4—乙基—2,4—戊二烯 B. :2—丁醇
C. :4—甲基苯酚 D. :3—甲基戊烷
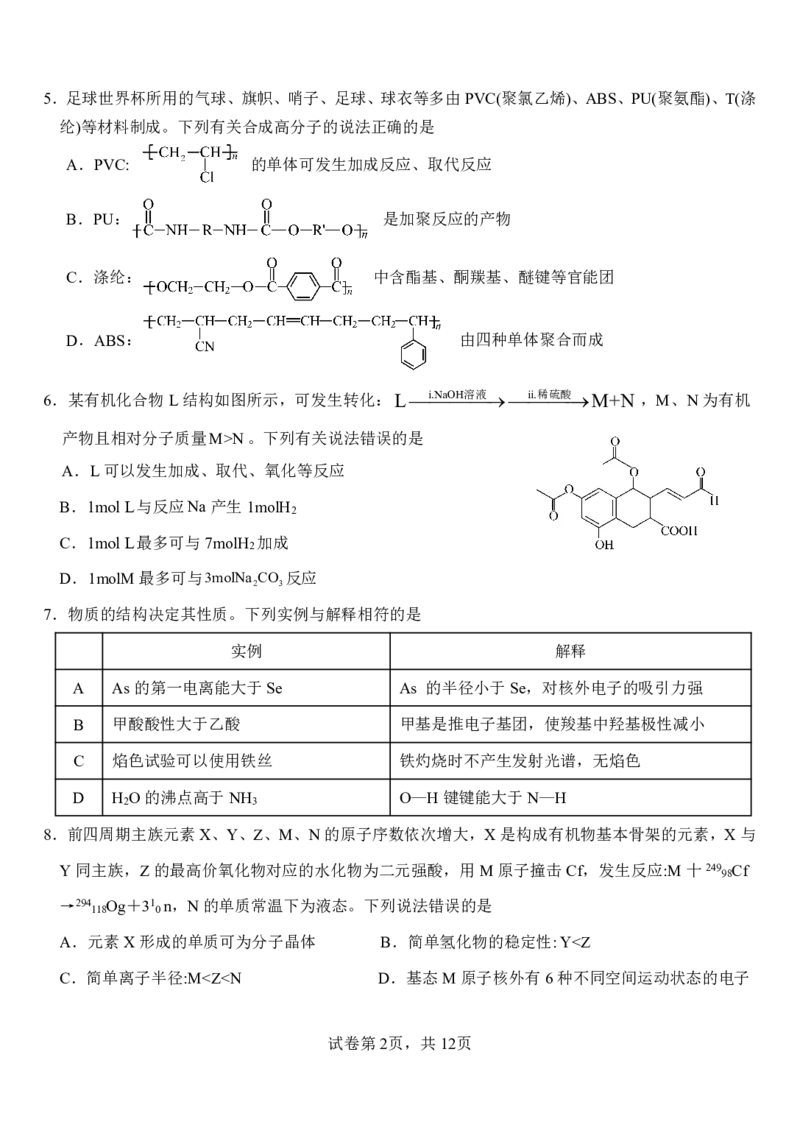
4.某离子液体的部分结构如下。短周期主族元素R、X、Y、Z、W中Y的原子半径最小,X、Z同主
族,且Z的电子数等于Y、W电子数之和,X与R、W形成的二原子化合物均为常见的城市空气污
染物。以下说法正确的是
A.RW做配体时,W提供孤电子对
B.RZ 、WY 、RY 分子中的键角依次减小
2 3 4
C.第一电离能:Y>W>X>R
D.氢化物的熔沸点大小顺序一定为:R<Z<W
试卷第1页,共12页
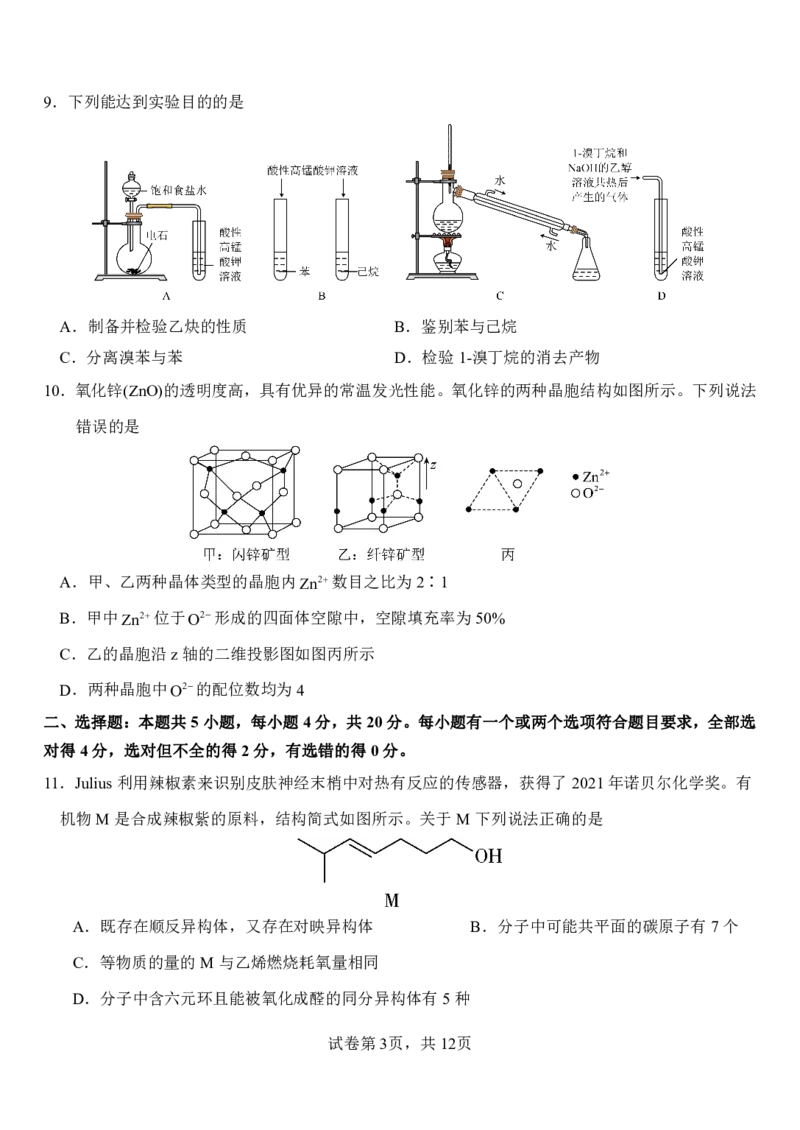
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}5.足球世界杯所用的气球、旗帜、哨子、足球、球衣等多由PVC(聚氯乙烯)、ABS、PU(聚氨酯)、T(涤
纶)等材料制成。下列有关合成高分子的说法正确的是
A.PVC: 的单体可发生加成反应、取代反应
B.PU: 是加聚反应的产物
C.涤纶: 中含酯基、酮羰基、醚键等官能团
D.ABS: 由四种单体聚合而成
6.某有机化合物L结构如图所示,可发生转化:Li.NaOH溶液ii.稀硫酸M+N ,M、N为有机
产物且相对分子质量M>N。下列有关说法错误的是
A.L可以发生加成、取代、氧化等反应
B.1mol L与反应Na产生1molH
2
C.1mol L最多可与7molH 加成
2
D.1molM最多可与3molNa CO 反应
2 3
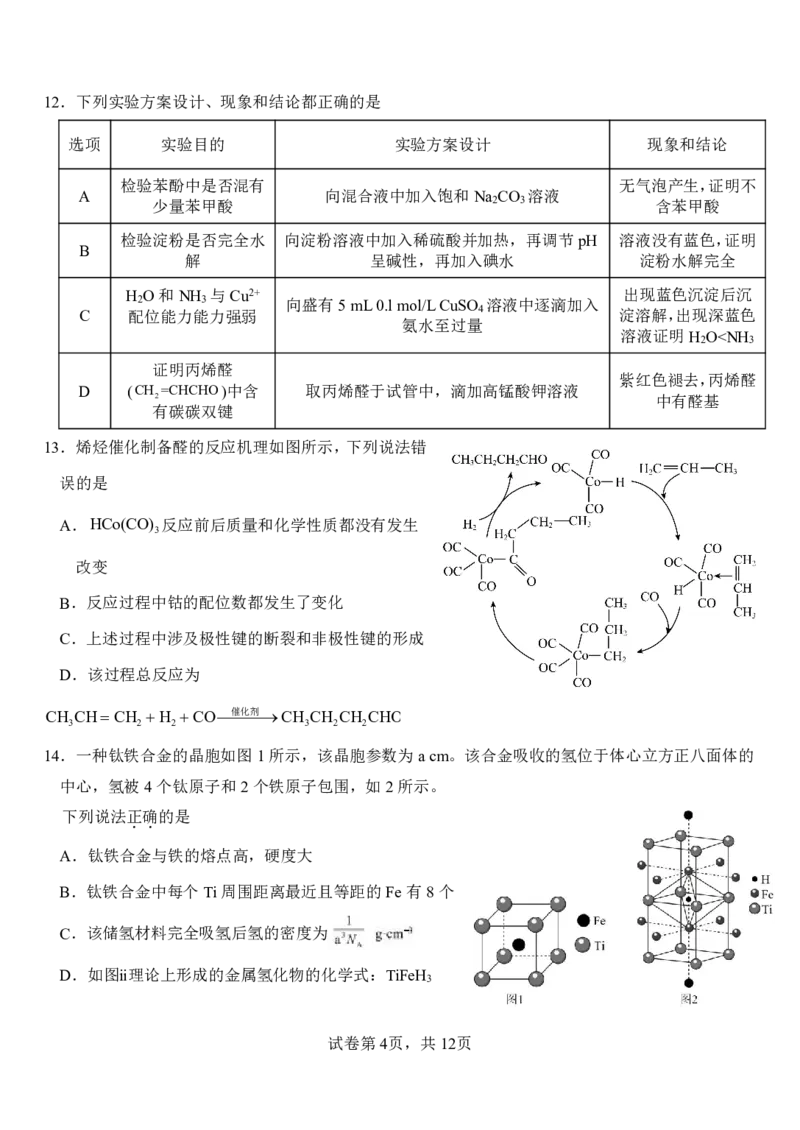
7.物质的结构决定其性质。下列实例与解释相符的是
实例 解释
A As的第一电离能大于Se As 的半径小于Se,对核外电子的吸引力强
B 甲酸酸性大于乙酸 甲基是推电子基团,使羧基中羟基极性减小
C 焰色试验可以使用铁丝 铁灼烧时不产生发射光谱,无焰色
D H O的沸点高于NH O—H键键能大于N—H
2 3
8.前四周期主族元素X、Y、Z、M、N的原子序数依次增大,X是构成有机物基本骨架的元素,X与
Y同主族,Z的最高价氧化物对应的水化物为二元强酸,用M原子撞击Cf,发生反应:M十249 Cf
98
→294 Og+31 n,N的单质常温下为液态。下列说法错误的是
118 0
A.元素X形成的单质可为分子晶体 B.简单氢化物的稳定性:Y①>② B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③ D.得电子能力:①>②
(2)立方氮化硼(BN)硬度大、熔点为3000℃,其晶体类型为 。 制备氮化硼(BN) 的一种方法为
BCl (g)+NH (g)=BN(s)+3HCl(g),则BCl 和NH 的键角较大的是 (填化学式)。
3 3 3 3
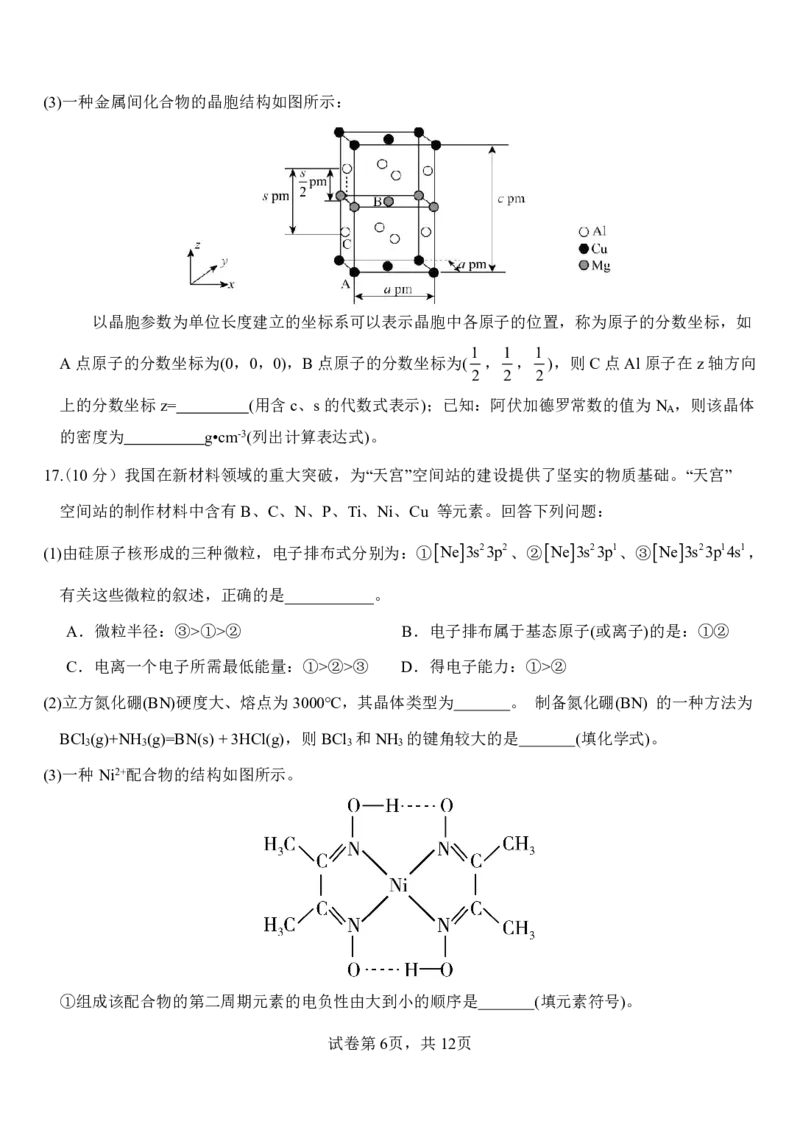
(3)一种Ni2+配合物的结构如图所示。
①组成该配合物的第二周期元素的电负性由大到小的顺序是 (填元素符号)。
试卷第6页,共12页
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}②该配合物中存在的化学键类型有 (填标号)。
A.离子键 B.σ键 C.π键 D.氢键 E..配位键
(4)铁蓝钾盐是一种常见染料。一定条件下,可用FeCl 、FeCl 与KCN反
2 3
应制得,其配离子的结构如图所示。(小白球代表Fe2+或Fe3+且两者比例
1:1,小黑球代表CN-)
①Fe元素在周期表中的位置为_
②反应的化学方程式为_
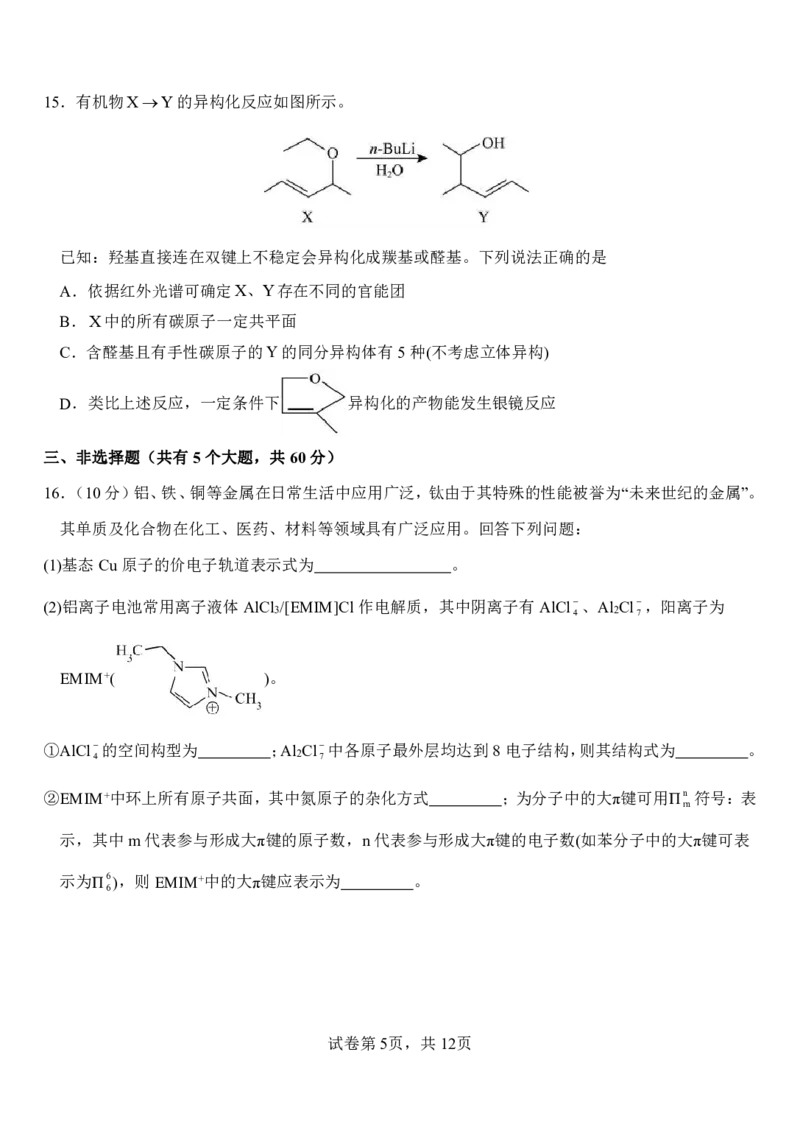
18.(14分)三苯甲醇 [ C H COH]是一种重要的有机合成中间体,制备流程如下:
6 5 3
已知:Ⅰ.RMgBr(R-表示烃基)能与水、二氧化碳、氧气、卤代烃、酮反应。如:RMgBr+R′Br→R-R′+MgBr
2
Ⅱ.ROMgBrH OROHMg(OH)Br
2
Ⅲ.几种物质的物理性质如下表:(*表示溴苯与水形成的共沸物沸点)
物质 熔点(℃) 沸点(℃) 溶解性
三苯甲醇 164.2 380 不溶于水,易溶于乙醇
乙醚 -116.3 34.6 微溶于水
溴苯 -30.7 156.2(92.8*) 不溶于水,易溶于乙醚
实验装置如下(加热及夹持装置略)。
试卷第7页,共12页
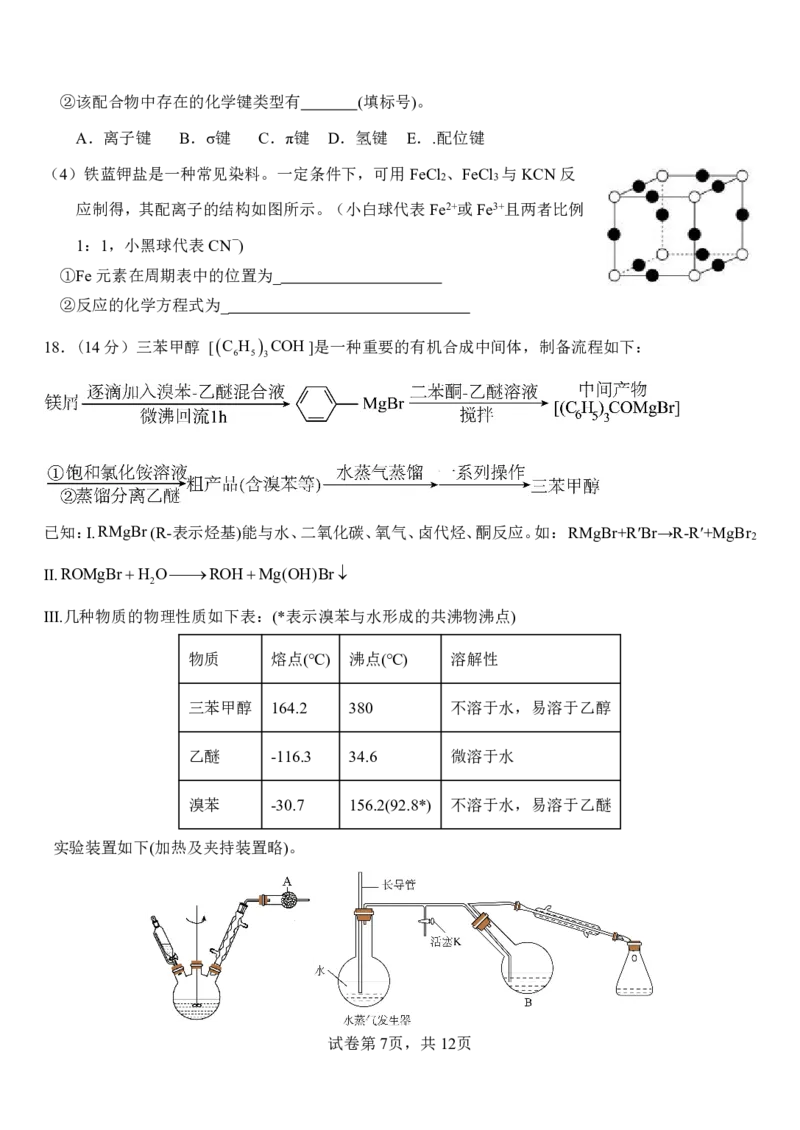
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}回答下列问题:
(1)装置A中的试剂为 。
(2)制备 时,乙醚除作溶剂外,另一个作用是 ;若溴苯-乙醚
混合液滴加过快,生成的主要副产物为 (写结构简式)。
(3)用饱和NH Cl溶液代替水与中间产物反应,能避免产生难溶的Mg(OH)Br,加入饱和NH Cl溶液反
4 4
应的离子方程式为 。
(4)装置B中的物质经 (填操作名称)分离出产品,再向产品中加入 进行重结晶
进一步提纯(填标号)。
A.NaOH溶液 B.水 C.稀盐酸 D.乙醇
(5)计算产率:反应中投加0.10mol溴苯、0.08mol二苯酮,经纯化、干燥后得13.0g产品[M(三苯甲
醇)260gmol1],则三苯甲醇的产率为 。
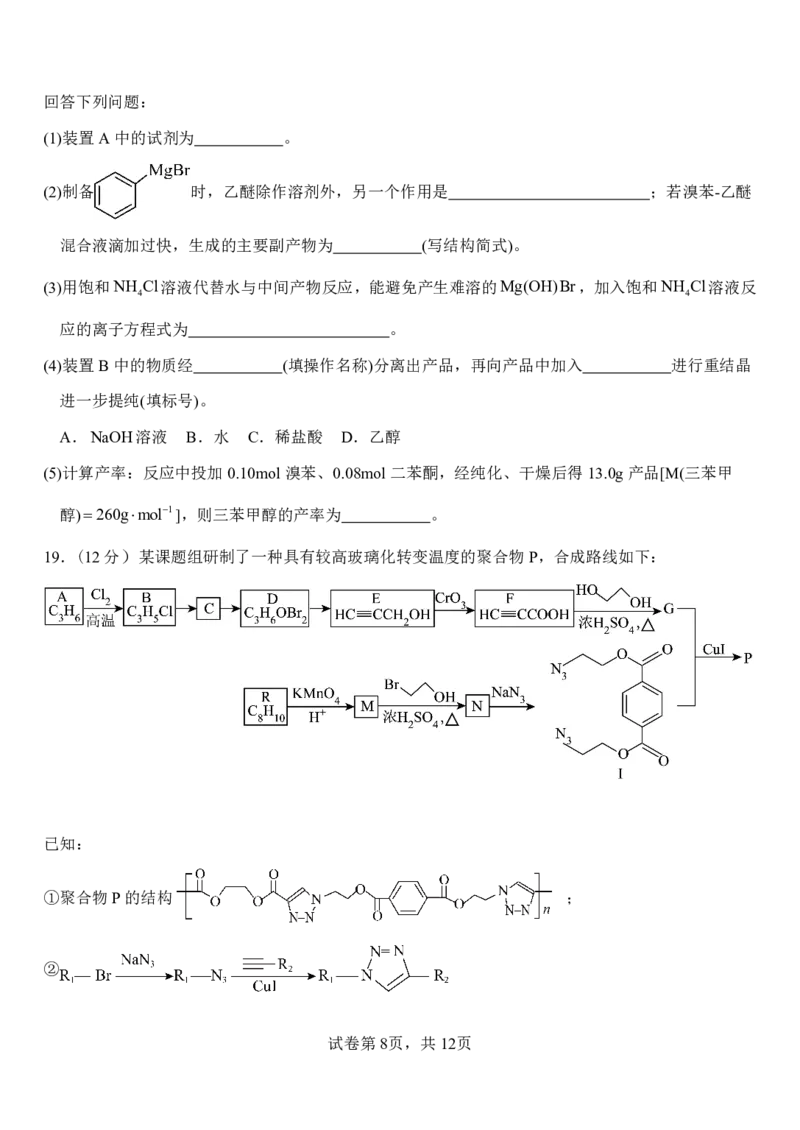
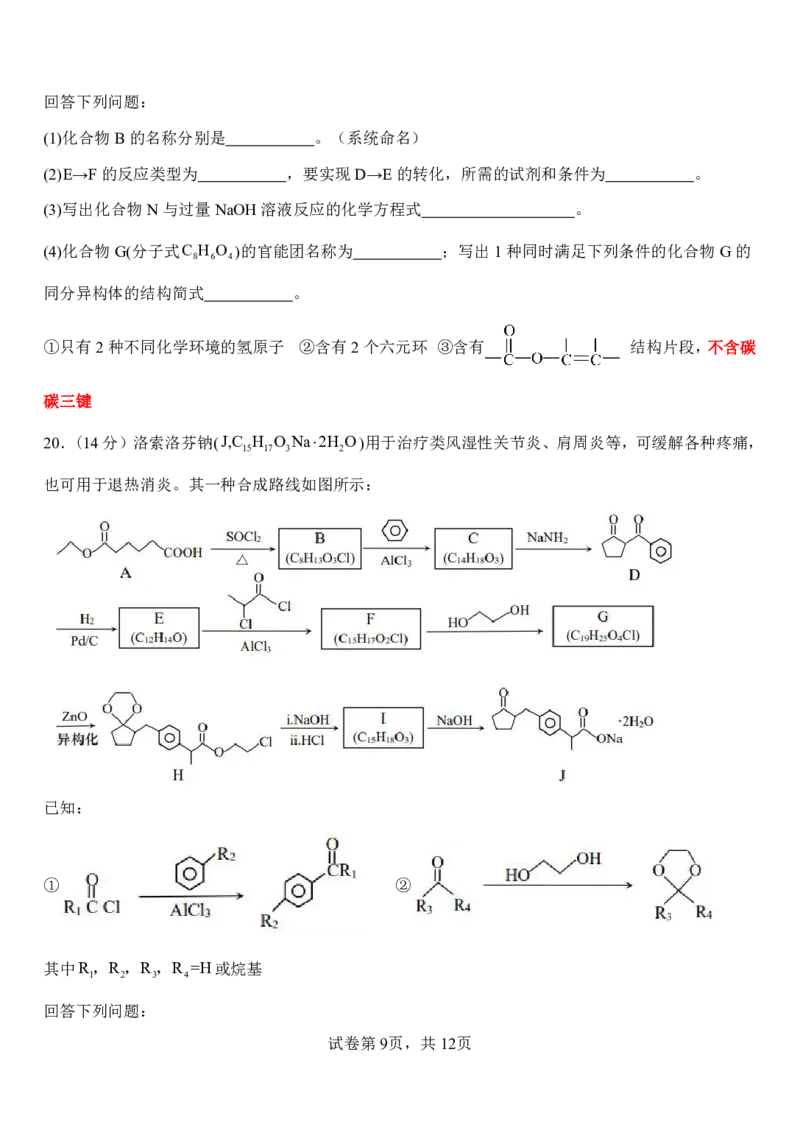
19.(12分)某课题组研制了一种具有较高玻璃化转变温度的聚合物P,合成路线如下:
已知:
①聚合物P的结构 ;
②
试卷第8页,共12页
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}回答下列问题:
(1)化合物B的名称分别是 。(系统命名)
(2)E→F的反应类型为 ,要实现D→E的转化,所需的试剂和条件为 。
(3)写出化合物N与过量NaOH溶液反应的化学方程式 。
(4)化合物G(分子式C H O )的官能团名称为 ;写出1种同时满足下列条件的化合物G的
8 6 4
同分异构体的结构简式 。
①只有2种不同化学环境的氢原子 ②含有2个六元环 ③含有 结构片段,不含碳
碳三键
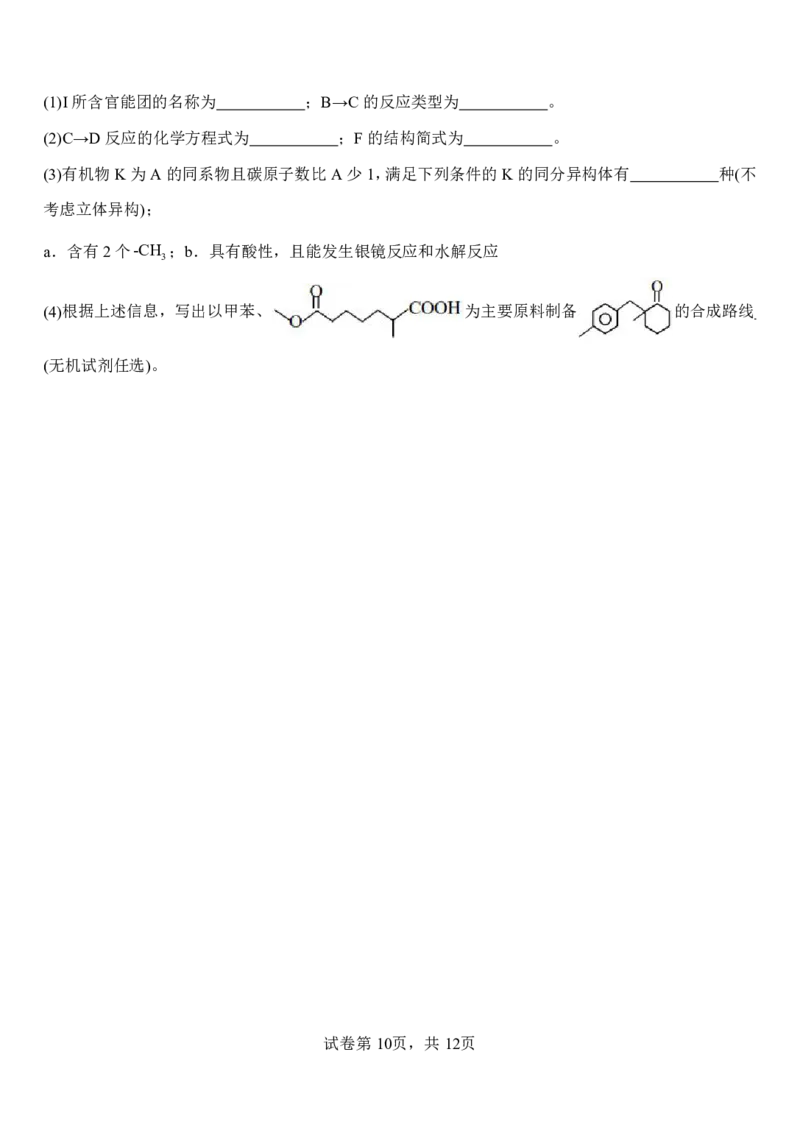
20.(14分)洛索洛芬钠(J,C H O Na2H O)用于治疗类风湿性关节炎、肩周炎等,可缓解各种疼痛,
15 17 3 2
也可用于退热消炎。其一种合成路线如图所示:
已知:
① ②
其中R,R ,R,R =H或烷基
1 2 3 4
回答下列问题:
试卷第9页,共12页
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}(1)I所含官能团的名称为 ;B→C的反应类型为 。
(2)C→D反应的化学方程式为 ;F的结构简式为 。
(3)有机物K为A的同系物且碳原子数比A少1,满足下列条件的K的同分异构体有 种(不
考虑立体异构);
a.含有2个-CH ;b.具有酸性,且能发生银镜反应和水解反应
3
(4)根据上述信息,写出以甲苯、 为主要原料制备 的合成路线
(无机试剂任选)。
试卷第10页,共12页
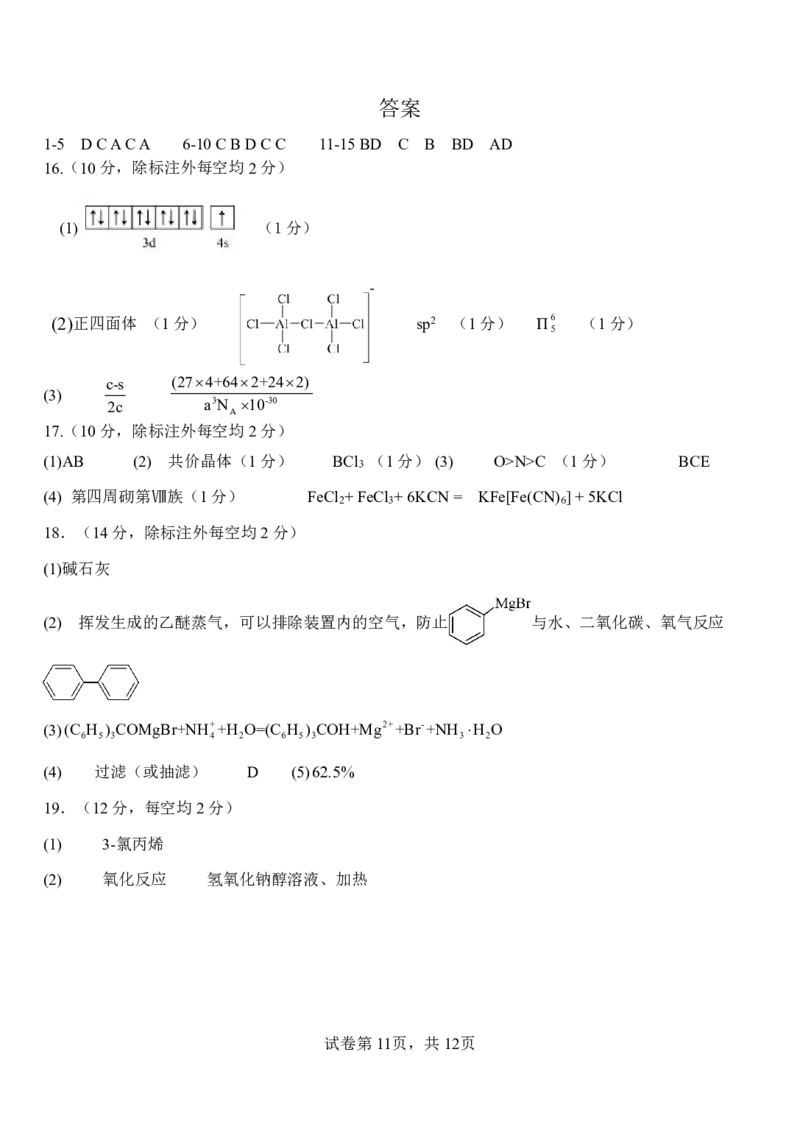
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}答案
1-5 DCACA 6-10CBDCC 11-15BD C B BD AD
16.(10分,除标注外每空均2分)
(1) (1分)
(2)正四面体 (1分) sp2 (1分) Π6 (1分)
5
c-s (274+642+242)
(3)
2c a3N 10-30
A
17.(10分,除标注外每空均2分)
(1)AB (2) 共价晶体(1分) BCl (1分) (3) O>N>C (1分) BCE
3
(4) 第四周砌第Ⅷ族(1分) FeCl +FeCl +6KCN= KFe[Fe(CN) ]+5KCl
2 3 6
18.(14分,除标注外每空均2分)
(1)碱石灰
(2) 挥发生成的乙醚蒸气,可以排除装置内的空气,防止 与水、二氧化碳、氧气反应
(3)(C H ) COMgBr+NH++H O=(C H ) COH+Mg2++Br-+NH H O
6 5 3 4 2 6 5 3 3 2
(4) 过滤(或抽滤) D (5)62.5%
19.(12分,每空均2分)
(1) 3-氯丙烯
(2) 氧化反应 氢氧化钠醇溶液、加热
试卷第11页,共12页
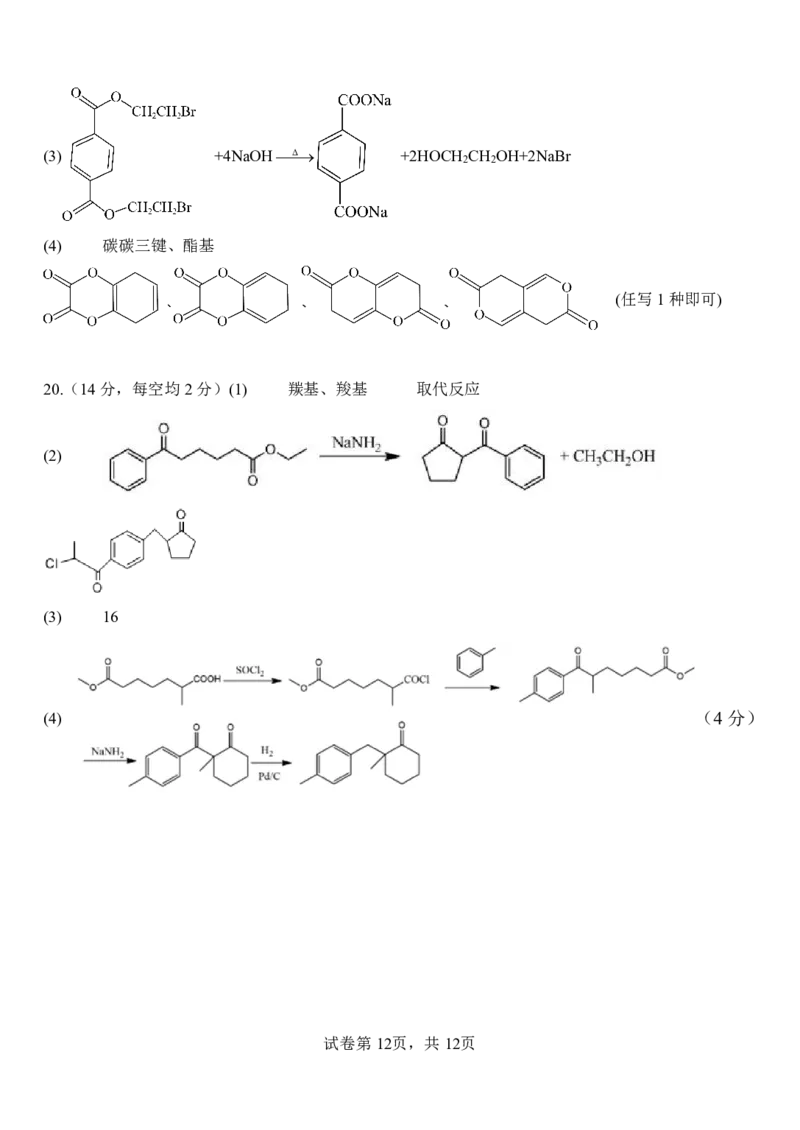
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}(3) +4NaOHΔ +2HOCH CH OH+2NaBr
2 2
(4) 碳碳三键、酯基
(任写1种即可)
20.(14分,每空均2分)(1) 羰基、羧基 取代反应
(2)
(3) 16
(4) (4分)
试卷第12页,共12页
{#{QQABbQyEggAIAIAAAAgCQwkSCgCQkBGCCQgGhAAIoAAAgRFABCA=}#}