文档内容
2024~2025 学年高二 10 月质量检测卷
化 学
考生注意:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间75分钟。
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上
对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答
题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本卷命题范围:人教版选择性必修1第一章~第二章第二节。
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 24
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的)
1.“挖掘文物价值,讲好中国故事”。下列有关文物的叙述正确的是( )
A.“良渚古城遗址”出土的良渚陶器制作原料是石灰石、纯碱和二氧化硅
B.“贾湖骨笛”制作材料是鹤类直骨,它的成分羟基磷酸钙属于有机高分子材料
C.“马家窑”出土的铜刀表面的绿色物质,其主要成分是CuSO ·5HO
4 2
D.台北故宫的“东坡肉”主要成分是 ,它属于硅酸盐矿物
2.下列应用涉及的反应属于吸热反应的是( )
A.NH 和NO 反应作为火箭推进剂 B.Al和Fe O 反应焊接钢轨
2 4 2 2 3
C.煅烧石灰石制取生石灰 D.乙炔与氧气反应用于切割金属
3.汽车尾气处理中涉及化学反应: 。下列措施能使
平衡正向移动的是( )
A.加压 B.升温
C.使用催化剂 D.恒容条件下充入He
4.常温下足量锌粒与稀硫酸发生反应: ,下列操作或加入的试剂能够加快
反应速率但不影响生成H 的总量的是( )
2
A.升高温度 B.增大压强 C.加入盐酸 D.加入NaSO 溶液
2 4
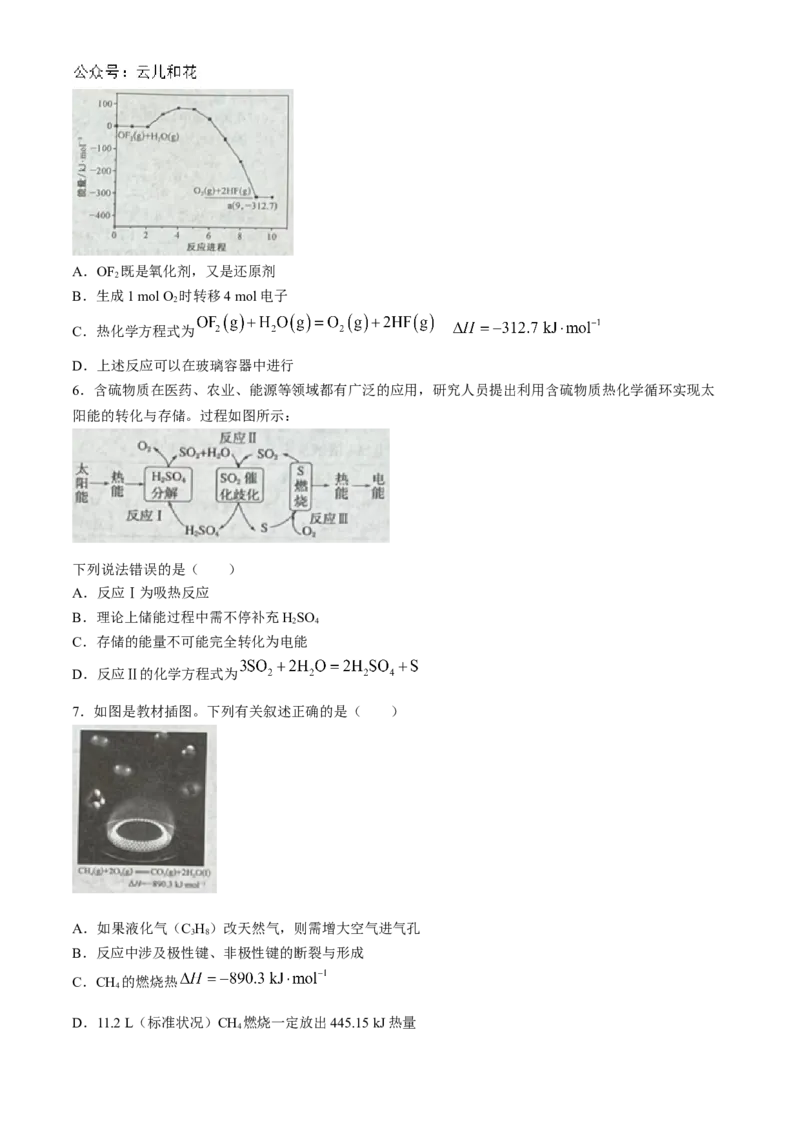
5.OF (g)和HO(g)反应生成O 和HF的能量变化如图所示。下列叙述正确的是( )
2 2 2A.OF 既是氧化剂,又是还原剂
2
B.生成1 mol O 时转移4 mol电子
2
C.热化学方程式为
D.上述反应可以在玻璃容器中进行
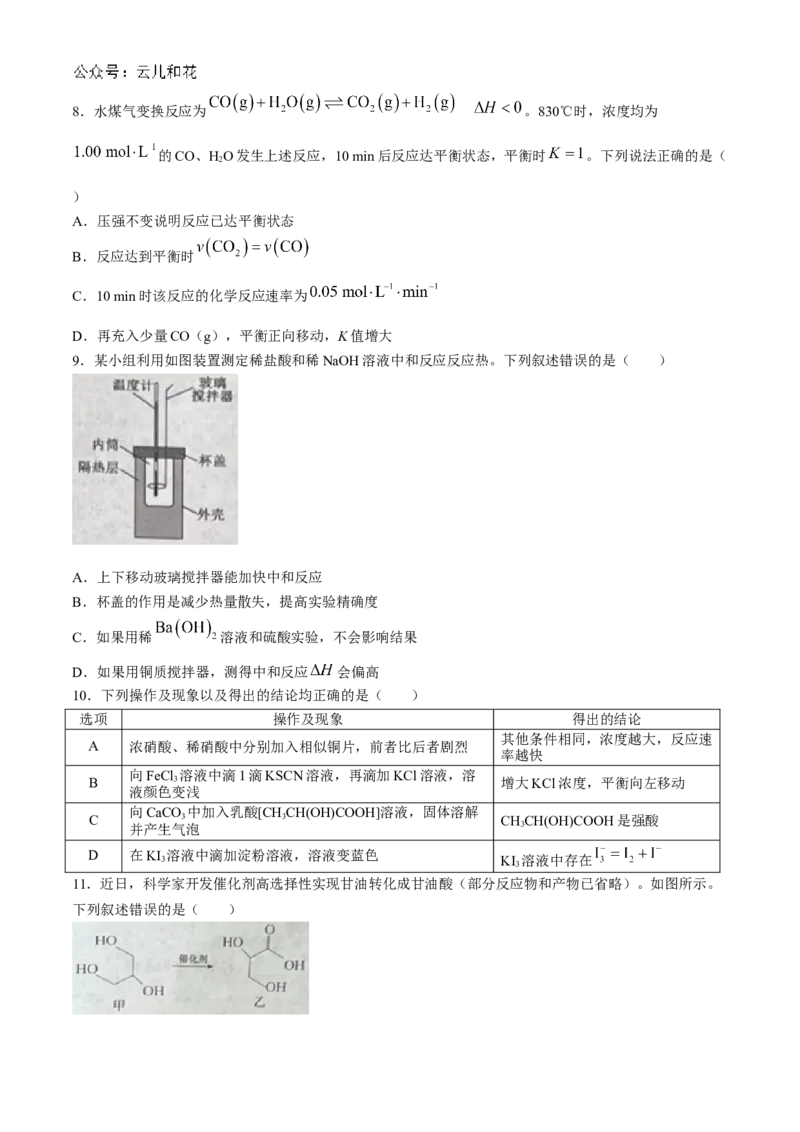
6.含硫物质在医药、农业、能源等领域都有广泛的应用,研究人员提出利用含硫物质热化学循环实现太
阳能的转化与存储。过程如图所示:
下列说法错误的是( )
A.反应Ⅰ为吸热反应
B.理论上储能过程中需不停补充HSO
2 4
C.存储的能量不可能完全转化为电能
D.反应Ⅱ的化学方程式为
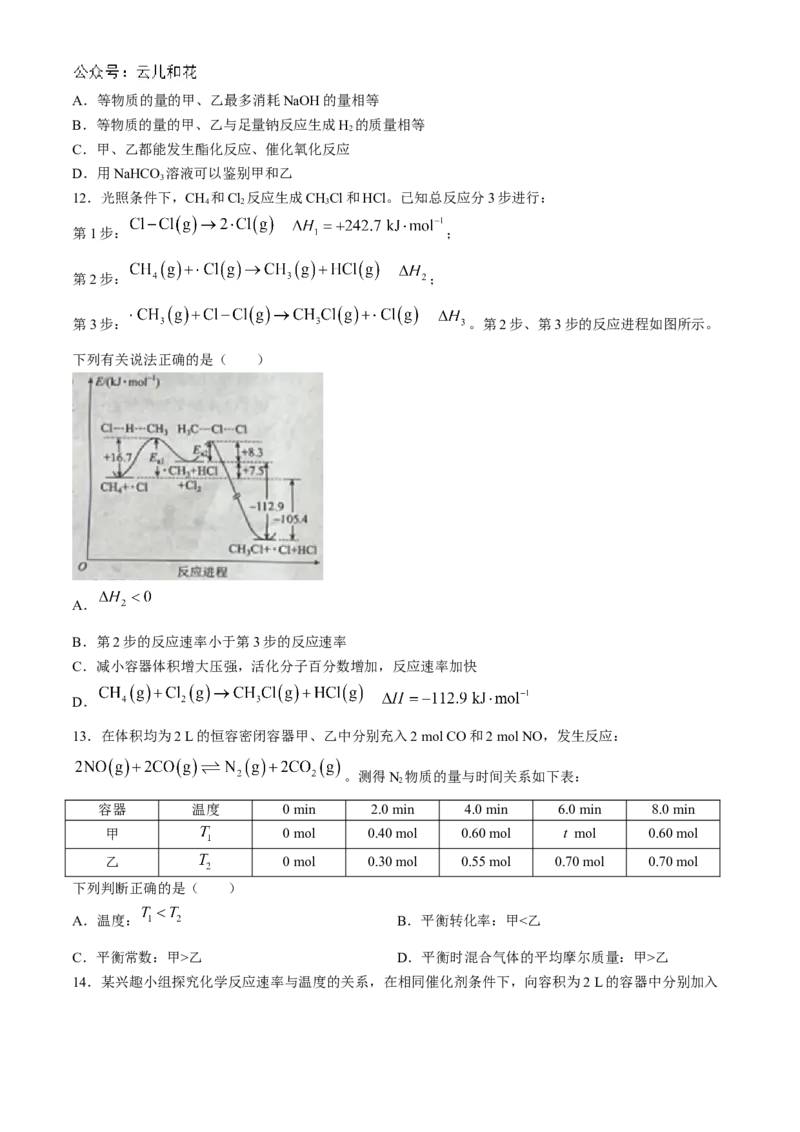
7.如图是教材插图。下列有关叙述正确的是( )
A.如果液化气(C H)改天然气,则需增大空气进气孔
3 8
B.反应中涉及极性键、非极性键的断裂与形成
C.CH 的燃烧热
4
D.11.2 L(标准状况)CH 燃烧一定放出445.15 kJ热量
48.水煤气变换反应为 。830℃时,浓度均为
的CO、HO发生上述反应,10 min后反应达平衡状态,平衡时 。下列说法正确的是(
2
)
A.压强不变说明反应已达平衡状态
B.反应达到平衡时
C.10 min时该反应的化学反应速率为
D.再充入少量CO(g),平衡正向移动,K值增大
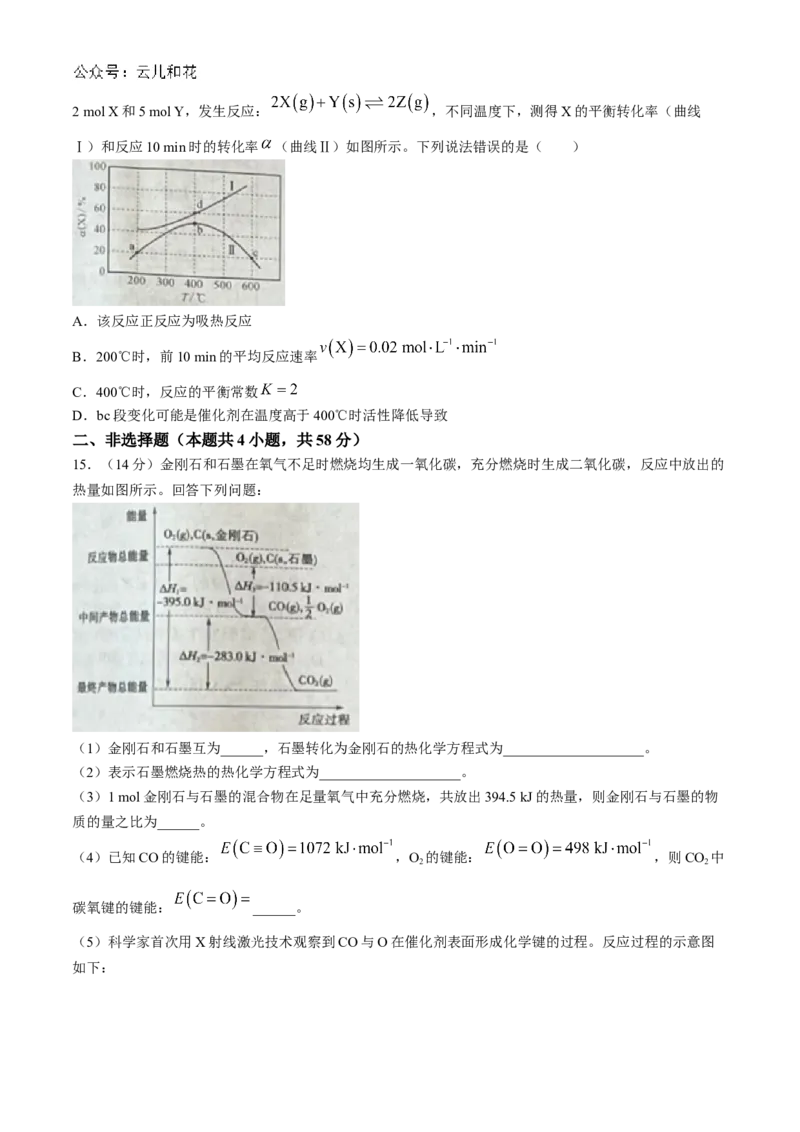
9.某小组利用如图装置测定稀盐酸和稀NaOH溶液中和反应反应热。下列叙述错误的是( )
A.上下移动玻璃搅拌器能加快中和反应
B.杯盖的作用是减少热量散失,提高实验精确度
C.如果用稀 溶液和硫酸实验,不会影响结果
D.如果用铜质搅拌器,测得中和反应 会偏高
10.下列操作及现象以及得出的结论均正确的是( )
选项 操作及现象 得出的结论
其他条件相同,浓度越大,反应速
A 浓硝酸、稀硝酸中分别加入相似铜片,前者比后者剧烈
率越快
向FeCl 溶液中滴1滴KSCN溶液,再滴加KCl溶液,溶
B 3 增大KCl浓度,平衡向左移动
液颜色变浅
向CaCO 中加入乳酸[CHCH(OH)COOH]溶液,固体溶解
C 3 3 CHCH(OH)COOH是强酸
并产生气泡 3
D 在KI 溶液中滴加淀粉溶液,溶液变蓝色
3 KI 溶液中存在
3
11.近日,科学家开发催化剂高选择性实现甘油转化成甘油酸(部分反应物和产物已省略)。如图所示。
下列叙述错误的是( )A.等物质的量的甲、乙最多消耗NaOH的量相等
B.等物质的量的甲、乙与足量钠反应生成H 的质量相等
2
C.甲、乙都能发生酯化反应、催化氧化反应
D.用NaHCO 溶液可以鉴别甲和乙
3
12.光照条件下,CH 和Cl 反应生成CHCl和HCl。已知总反应分3步进行:
4 2 3
第1步: ;
第2步: ;
第3步: 。第2步、第3步的反应进程如图所示。
下列有关说法正确的是( )
Α.
B.第2步的反应速率小于第3步的反应速率
C.减小容器体积增大压强,活化分子百分数增加,反应速率加快
D.
13.在体积均为2 L的恒容密闭容器甲、乙中分别充入2 mol CO和2 mol NO,发生反应:
。测得N 物质的量与时间关系如下表:
2
容器 温度 0 min 2.0 min 4.0 min 6.0 min 8.0 min
甲 0 mol 0.40 mol 0.60 mol t mol 0.60 mol
乙 0 mol 0.30 mol 0.55 mol 0.70 mol 0.70 mol
下列判断正确的是( )
A.温度: B.平衡转化率:甲<乙
C.平衡常数:甲>乙 D.平衡时混合气体的平均摩尔质量:甲>乙
14.某兴趣小组探究化学反应速率与温度的关系,在相同催化剂条件下,向容积为2 L的容器中分别加入2 mol X和5 mol Y,发生反应: ,不同温度下,测得X的平衡转化率(曲线
Ⅰ)和反应10 min时的转化率 (曲线Ⅱ)如图所示。下列说法错误的是( )
A.该反应正反应为吸热反应
B.200℃时,前10 min的平均反应速率
C.400℃时,反应的平衡常数
D.bc段变化可能是催化剂在温度高于400℃时活性降低导致
二、非选择题(本题共4小题,共58分)
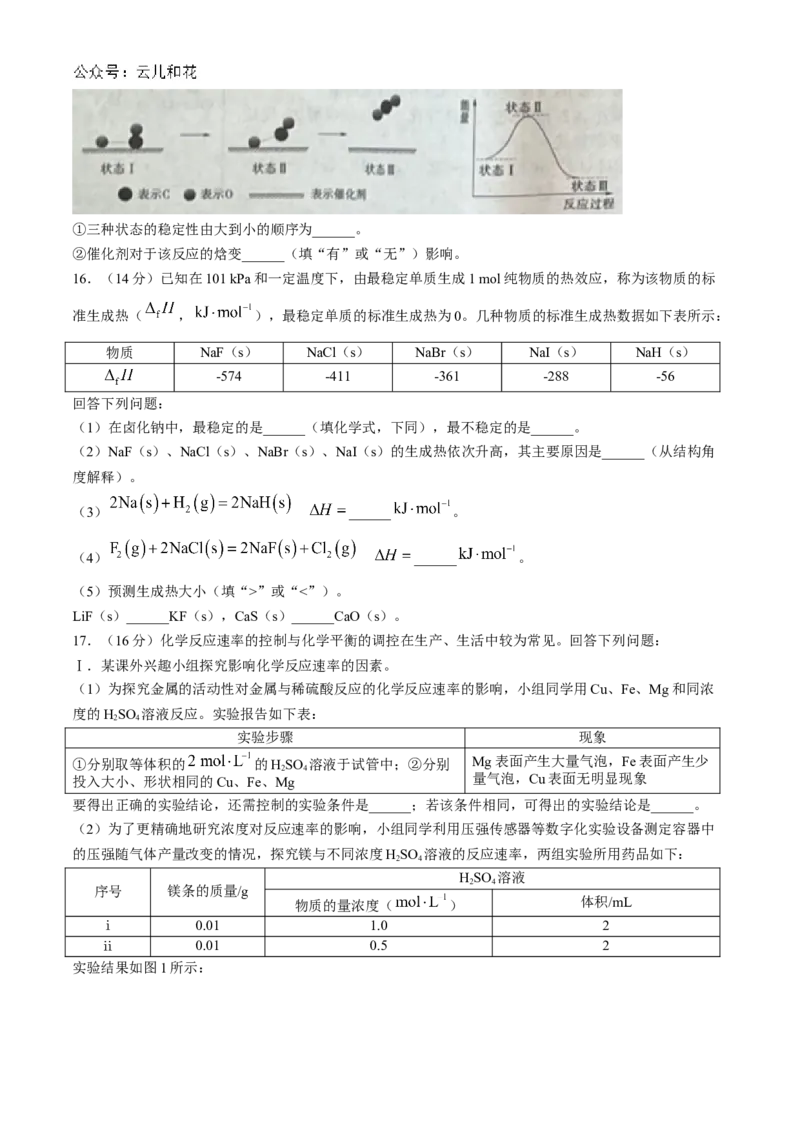
15.(14分)金刚石和石墨在氧气不足时燃烧均生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的
热量如图所示。回答下列问题:
(1)金刚石和石墨互为______,石墨转化为金刚石的热化学方程式为____________________。
(2)表示石墨燃烧热的热化学方程式为____________________。
(3)1 mol金刚石与石墨的混合物在足量氧气中充分燃烧,共放出394.5 kJ的热量,则金刚石与石墨的物
质的量之比为______。
(4)已知CO的键能: ,O 的键能: ,则CO 中
2 2
碳氧键的键能: ______。
(5)科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图
如下:①三种状态的稳定性由大到小的顺序为______。
②催化剂对于该反应的焓变______(填“有”或“无”)影响。
16.(14分)已知在101 kPa和一定温度下,由最稳定单质生成1 mol纯物质的热效应,称为该物质的标
准生成热( , ),最稳定单质的标准生成热为0。几种物质的标准生成热数据如下表所示:
物质 NaF(s) NaCl(s) NaBr(s) NaI(s) NaH(s)
-574 -411 -361 -288 -56
回答下列问题:
(1)在卤化钠中,最稳定的是______(填化学式,下同),最不稳定的是______。
(2)NaF(s)、NaCl(s)、NaBr(s)、NaI(s)的生成热依次升高,其主要原因是______(从结构角
度解释)。
(3) ______ 。
(4) ______ 。
(5)预测生成热大小(填“>”或“<”)。
LiF(s)______KF(s),CaS(s)______CaO(s)。
17.(16分)化学反应速率的控制与化学平衡的调控在生产、生活中较为常见。回答下列问题:
Ⅰ.某课外兴趣小组探究影响化学反应速率的因素。
(1)为探究金属的活动性对金属与稀硫酸反应的化学反应速率的影响,小组同学用Cu、Fe、Mg和同浓
度的HSO 溶液反应。实验报告如下表:
2 4
实验步骤 现象
①分别取等体积的 的HSO 溶液于试管中;②分别 Mg表面产生大量气泡,Fe表面产生少
2 4
投入大小、形状相同的Cu、Fe、Mg 量气泡,Cu表面无明显现象
要得出正确的实验结论,还需控制的实验条件是______;若该条件相同,可得出的实验结论是______。
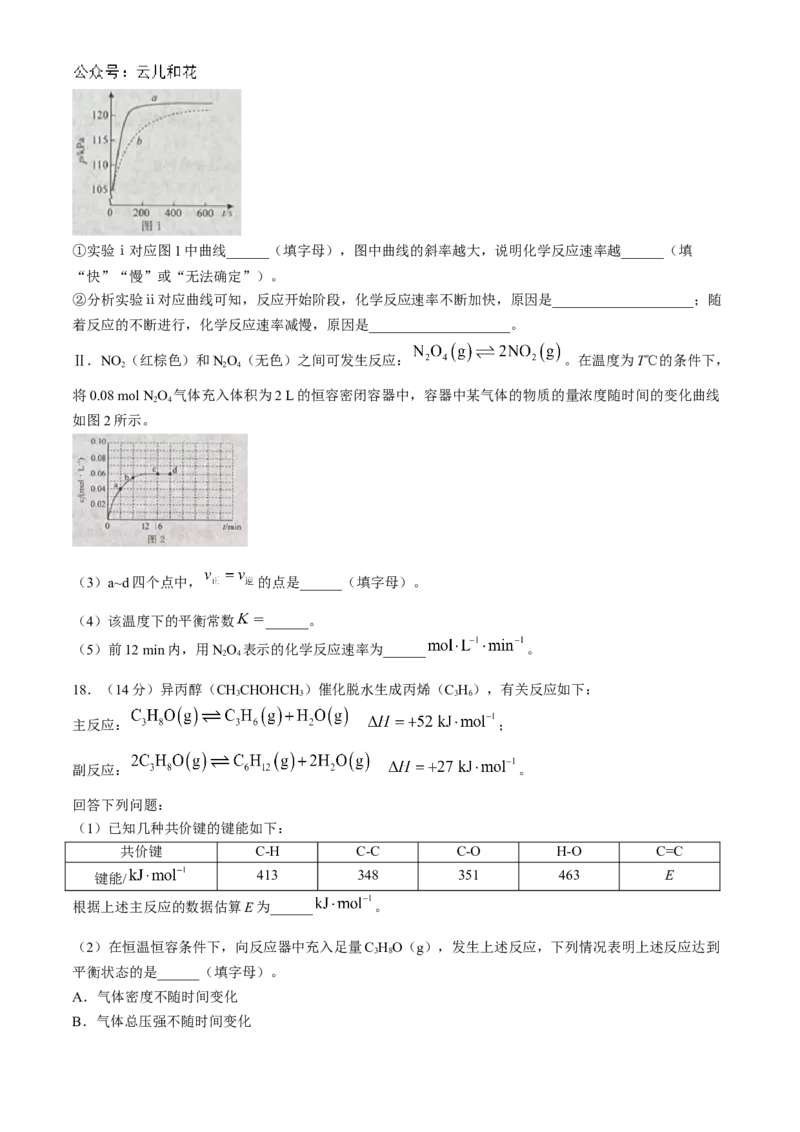
(2)为了更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备测定容器中
的压强随气体产量改变的情况,探究镁与不同浓度HSO 溶液的反应速率,两组实验所用药品如下:
2 4
HSO 溶液
2 4
序号 镁条的质量/g
物质的量浓度( )
体积/mL
ⅰ 0.01 1.0 2
ⅱ 0.01 0.5 2
实验结果如图1所示:①实验ⅰ对应图1中曲线______(填字母),图中曲线的斜率越大,说明化学反应速率越______(填
“快”“慢”或“无法确定”)。
②分析实验ⅱ对应曲线可知,反应开始阶段,化学反应速率不断加快,原因是____________________;随
着反应的不断进行,化学反应速率减慢,原因是____________________。
Ⅱ.NO (红棕色)和NO(无色)之间可发生反应: 。在温度为T℃的条件下,
2 2 4
将0.08 mol NO 气体充入体积为2 L的恒容密闭容器中,容器中某气体的物质的量浓度随时间的变化曲线
2 4
如图2所示。
(3)a~d四个点中, 的点是______(填字母)。
(4)该温度下的平衡常数 ______。
(5)前12 min内,用NO 表示的化学反应速率为______ 。
2 4
18.(14分)异丙醇(CHCHOHCH )催化脱水生成丙烯(C H),有关反应如下:
3 3 3 6
主反应: ;
副反应: 。
回答下列问题:
(1)已知几种共价键的键能如下:
共价键 C-H C-C C-O H-O C=C
键能/ 413 348 351 463 E
根据上述主反应的数据估算E为______ 。
(2)在恒温恒容条件下,向反应器中充入足量C HO(g),发生上述反应,下列情况表明上述反应达到
3 8
平衡状态的是______(填字母)。
A.气体密度不随时间变化
B.气体总压强不随时间变化C.C H 的体积分数不随时间变化
3 6
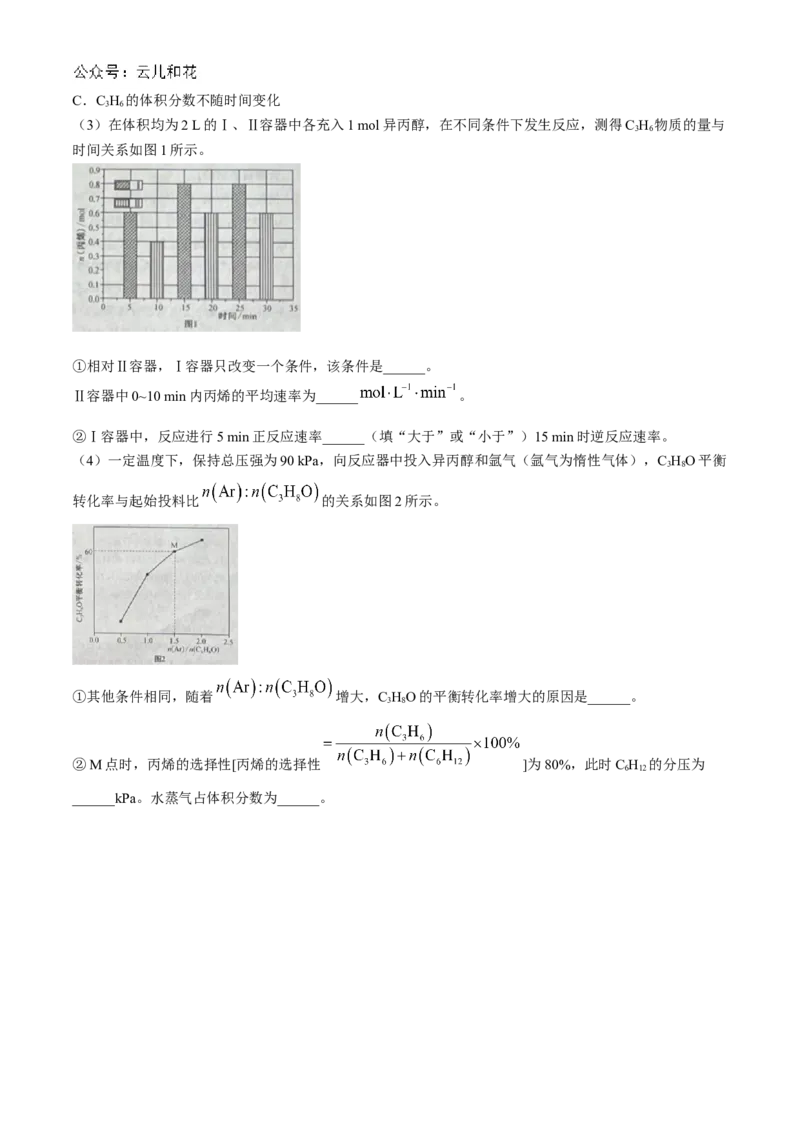
(3)在体积均为2 L的Ⅰ、Ⅱ容器中各充入1 mol异丙醇,在不同条件下发生反应,测得C H 物质的量与
3 6
时间关系如图1所示。
①相对Ⅱ容器,Ⅰ容器只改变一个条件,该条件是______。
Ⅱ容器中0~10 min内丙烯的平均速率为______ 。
②Ⅰ容器中,反应进行5 min正反应速率______(填“大于”或“小于”)15 min时逆反应速率。
(4)一定温度下,保持总压强为90 kPa,向反应器中投入异丙醇和氩气(氩气为惰性气体),C HO平衡
3 8
转化率与起始投料比 的关系如图2所示。
①其他条件相同,随着 增大,C HO的平衡转化率增大的原因是______。
3 8
②M点时,丙烯的选择性[丙烯的选择性 ]为80%,此时C H 的分压为
6 12
______kPa。水蒸气占体积分数为______。