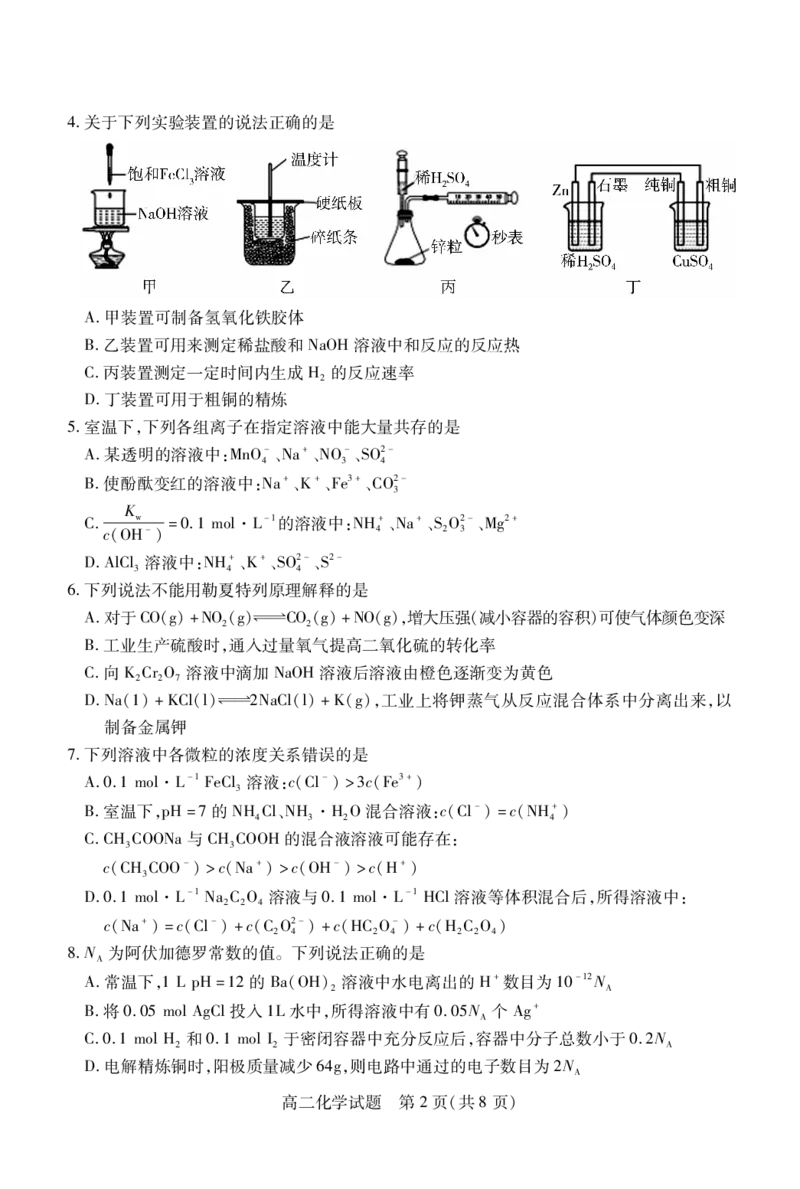
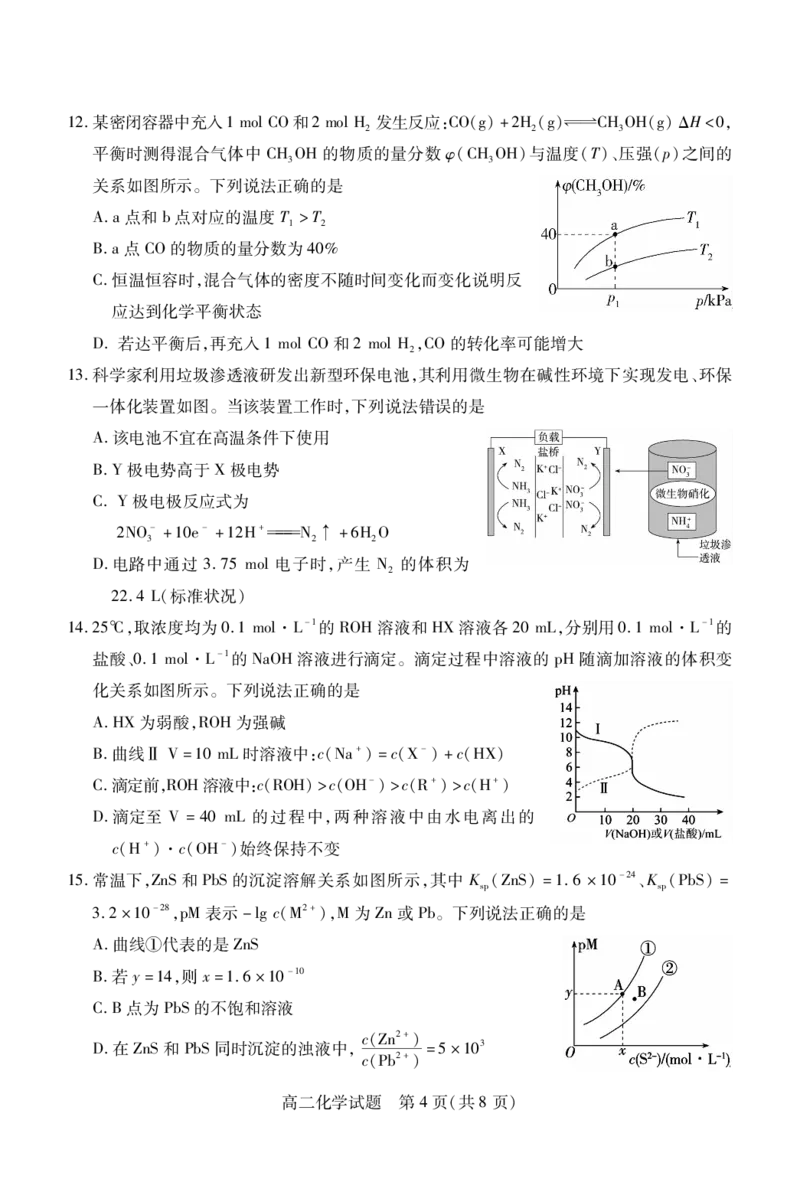
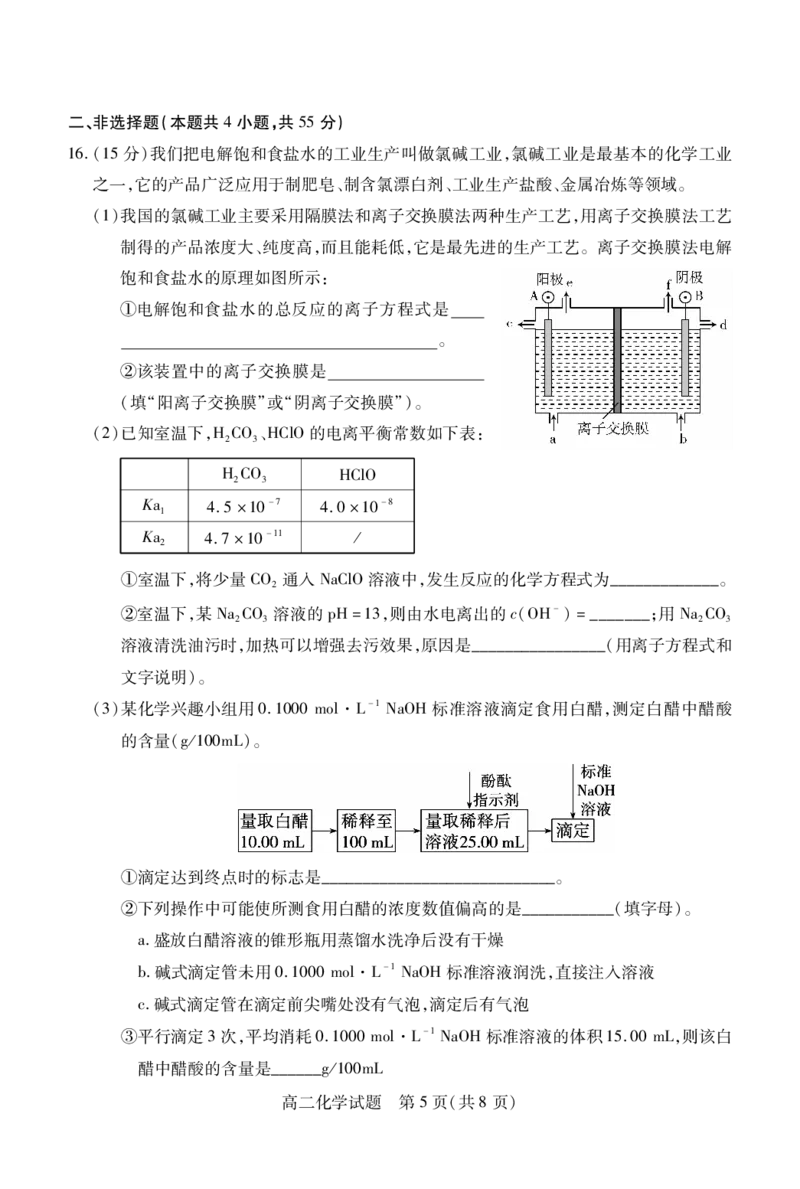
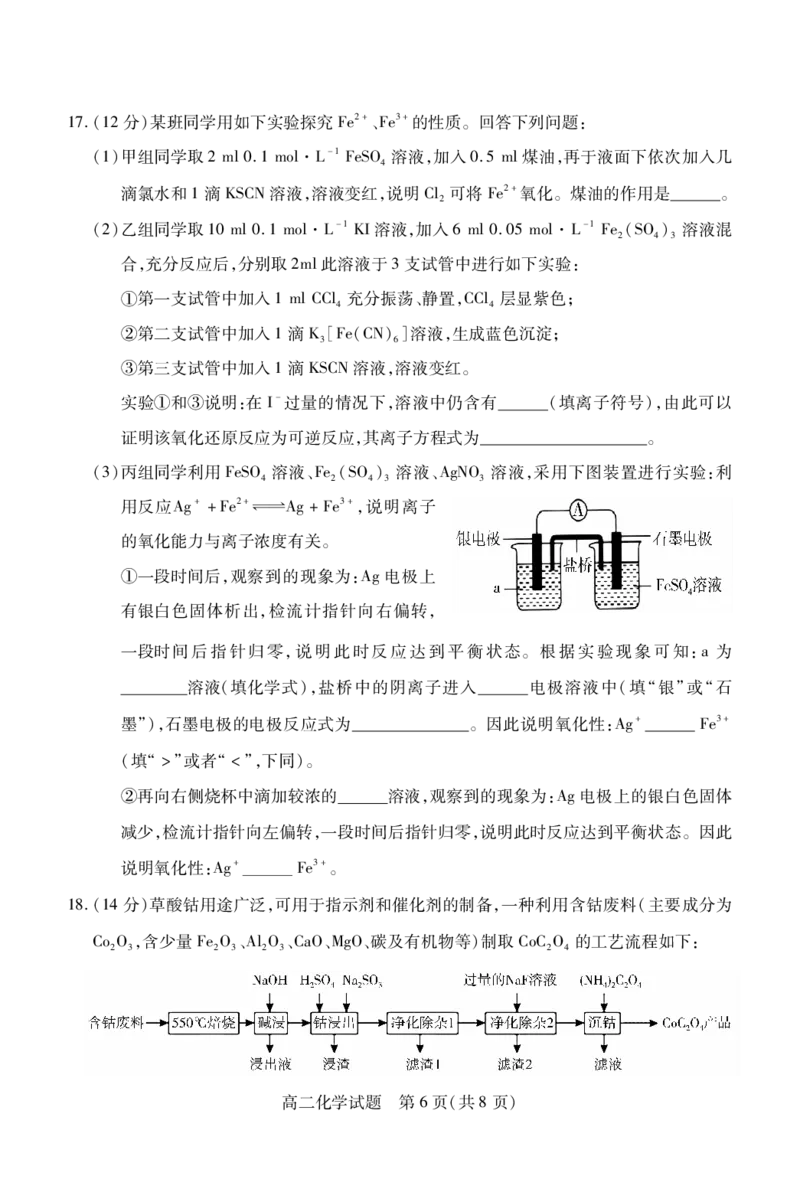
文档内容
运城市 $%$& ’$%$( 学年第一学期期末调研测试
高二化学试题
$%$()"
本试题满分"%% 分!考试时间*( 分钟" 答案一律写在答题卡上"
注意事项!
"+答题前!考生务必先将自己的姓名#准考证号填写在答题卡上!认真核对条形码上的姓
名#准考证号!并将条形码粘贴在答题卡的指定位置上"
$+答题时使用%+( 毫米的黑色中性$签字%笔或碳素笔书写!字体工整#笔迹清楚"
,+请按照题号在各题的答题区域$黑色线框%内作答!超出答题区域书写的答案无效"
&+保持卡面清洁!不折叠!不破损"
可能用到的相对原子质量#-$"!.$"$!/$"0!12$$,!.3$,()(!.4$0&!56$"%#
一"选择题#本题共!" 小题$每小题# 分$共$" 分% 在每小题列出的四个选项中$只有一项是
符合题目要求的&
")齐国的工艺官书%考工记&中载有’涑帛(的方法)即利用’灰(!草木灰"和’蜃(!贝壳高温
分解形成的灰"混合加水所得液体来洗涤丝帛* 下列说法错误的是
5)草木灰与铵态氮肥不可混合施用!!7)’蜃(的主要成分属于电解质
.)’灰(和’蜃(的水溶液都显碱性!! 8)’灰(和’蜃(混合加水发生化合反应
$)生产生活中处处有化学)下列有关说法正确的是
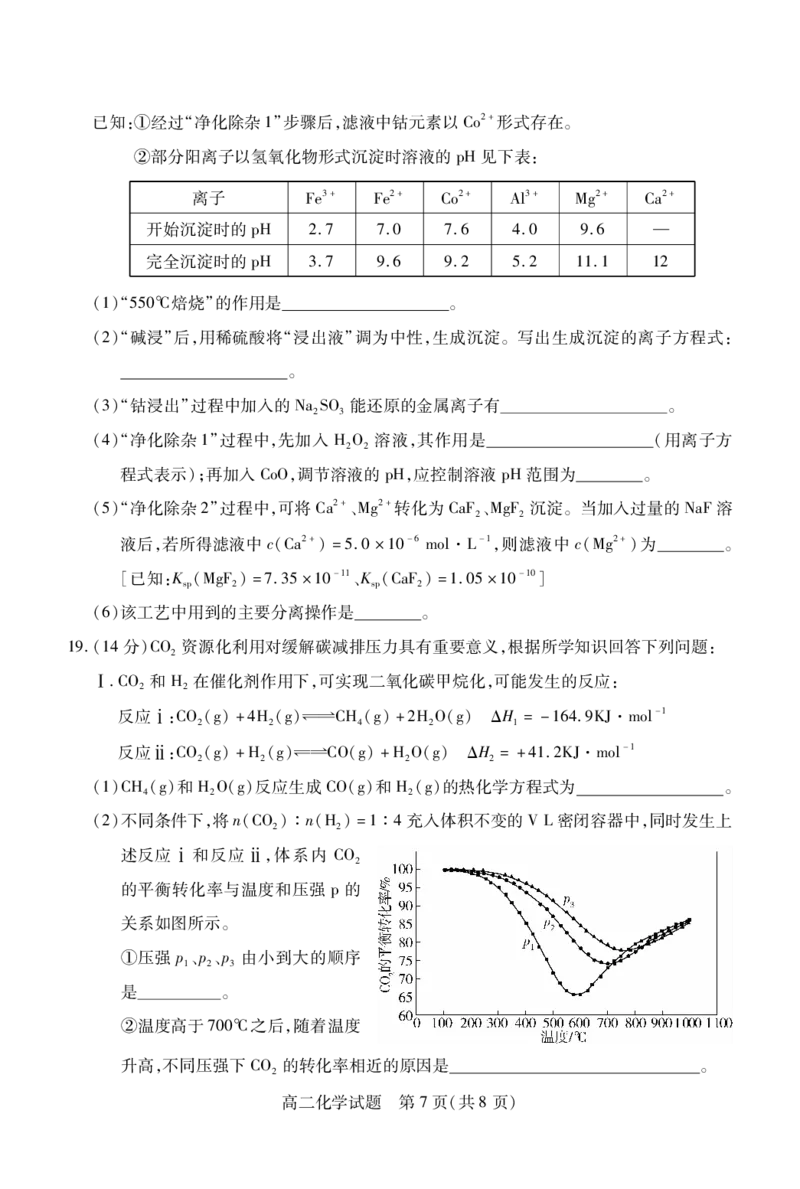
5)天然硬水呈碱性的原因是其中含有较多的96$:+.2$:等离子
7)./+/ 与人体血液中的血红蛋白!-;"建立平衡#./:-;/ !"-;./:/)当 ./中毒
$ $ $
时)应将中毒患者转移至高压氧仓吸氧
.)明矾中的铝离子可在水中形成胶体)用于水体净化与消毒
8)铁表面镀锌可以增强其抗腐蚀性)镀层局部破损后不再具有防护作用
,)下列方程式书写正确的是
5)硫化氢的水溶液显酸性#-"!".2./!=" :"
& , , &
.)泡沫灭火器工作原理#$53,::,./$’:,-/?$53!/-" #:,./$
, $ , $
8)铅酸蓄电池充电时阴极的反应#@;/ :