文档内容
东莞市 2025-2026 学年第一学期七校联考试题
高二化学
注意事项:
1. 本试卷分选择题和非选择题两部分
2. 试卷满分 100 分,考试时间 75 分钟
一、选择题(本题包括 16 小题,共 44 分。其中 1-10 小题,每小题 2 分;11-16 小题,每
小题 4 分。每小题只有一个选项符合题意)
1.人类的一切活动都离不开能量变化。下列说法正确的是
A.稀释浓硫酸属于放热反应
B.用燃料电池驱动汽车时,电能转变成化学能
C.乙炔燃烧,化学能全部转变为热能
D.葡萄糖在人体内的氧化过程属于放热反应
2.劳动有利于“知行合一 ”。下列劳动项目与所述的化学知识没有关联的是
选项 劳动项目 化学知识
A 家务劳动:热纯碱液浸泡油烟机滤网 升温促进碳酸钠水解
B 社区服务:使用氯化铵溶液清洗铁锈 氯化铵可分解产生HCl
C 医药管理:用冰箱保存疫苗 温度越低,反应速率越慢
D 制作美食:面包师傅用小苏打作糕点膨松剂 碳酸氢钠受热分解出二氧化碳
3.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是
选项 A B C D
强电解质 Fe NaCl CaCO HNO
3 3
弱电解质 CH COOH NH H PO Fe(OH)
3 3 3 4 3
非电解质 蔗糖 BaSO 酒精 H O
4 2
4.变化观念与平衡思想是化学学科核心素养之一,下列事实不能用勒夏特列原理解释的是
A.Fe(SCN) 溶液中加入固体 KSCN 后颜色变深
3
B.实验室中常用排饱和食盐水的方法收集Cl
2
C.工业生产硫酸的过程中使用过量氧气以提高 SO 的利用率
2
D.对于反应 2HI(g)≈ H
2
(g)+I
2
(g)达平衡后,缩小容器体积可使体系颜色变深
5.下列各组离子能大量共存的是
A.Fe3+ 、Na + 、SCN - 、SO4 2- B.K + 、H + 、ClO - 、I -
C.Al3+ 、Ca2+ 、HCO - 、NO D.NH 、Na+ 、CH COO- 、NO
3 36.历史上曾用“地康法 ”制氯气,相关反应为4HCl(g) + O (g) = 2Cl (g) + 2H O(g)
2 2 2
ΔH ,已知相关化学键的键能(E)如表所示。则该反应的 ΔH 为
化学键 Cl — Cl O = O O — H H — Cl
E/(kJ·mol -1) 247 497 463 431
A.+125kJ·mol
-1
B.-125kJ·mol
-1
C.-801kJ·mol
-1
D.+801kJ·mol
-1
7.下列关于热化学反应的描述中正确的是
A.表示甲烷的燃烧热:CH (g)+ 2O (g) = CO (g)+ 2HO (g) ΔH = —890.3 kJ·mol-1
4 2 2 2
B.已知稀盐酸和稀 NaOH 溶液反应的中和热 ΔH= —57.3kJ·mol-1 ,则H SO 溶液和
2 4
Ba (OH) 溶液反应生成 1molH O 时放出 57.3kJ 的热量
2
2
C.已知:N (g) + 3H (g) ≈ 2NH (g) ΔH = —92.4 kJ . mol—1 ;则 0.5molN 与
2 2 3 2
1.5molH 在一定条件下充分反应,放出热量为 46.2kJ
2
D.2C( s )+2O (g) = 2CO (g) ΔH ; 2C( s )+O (g)= 2CO(g) ΔH ,则 ΔH
2 2 1 2 2 1
< ΔH
2
8.化学用语是化学的独特语言,下列表示正确的是
A. NaHCO 在水中的电离方程式:NaHCO ==Na++H++CO -
3 3
-
B.HS 的水解离子方程式:HS-+H O ⇌ S +H O+
2 2- 3
C.泡沫灭火器中药品的主要成分为NaHCO 与Al (SO ) ,其工作原理为:
3 2 4 3
Al3++3HCO ===Al(OH) ↓+3CO ↑
3 3 2
D.CaCO 的饱和- 水溶液中存在沉淀溶解平衡:CaCO == Ca2++CO 2-
3 3 3
9.下列事实不能说明 NH ·H O 是弱碱的是
3 2
A.25℃时,0. 1 mol·L-1 的氨水的 pH 约为 11
B.10mL1mol·L-1 的氨水恰好与 10 mL1 mol·L-1 盐酸完全反应
C.25℃时,0. 1mol·L-1 的 NH Cl 溶液的 pH 约为 5
4
D.25℃时,pH=12 的氨水和 NaOH 溶液,分别加水稀释 10 倍,氨水的 pH 变化小
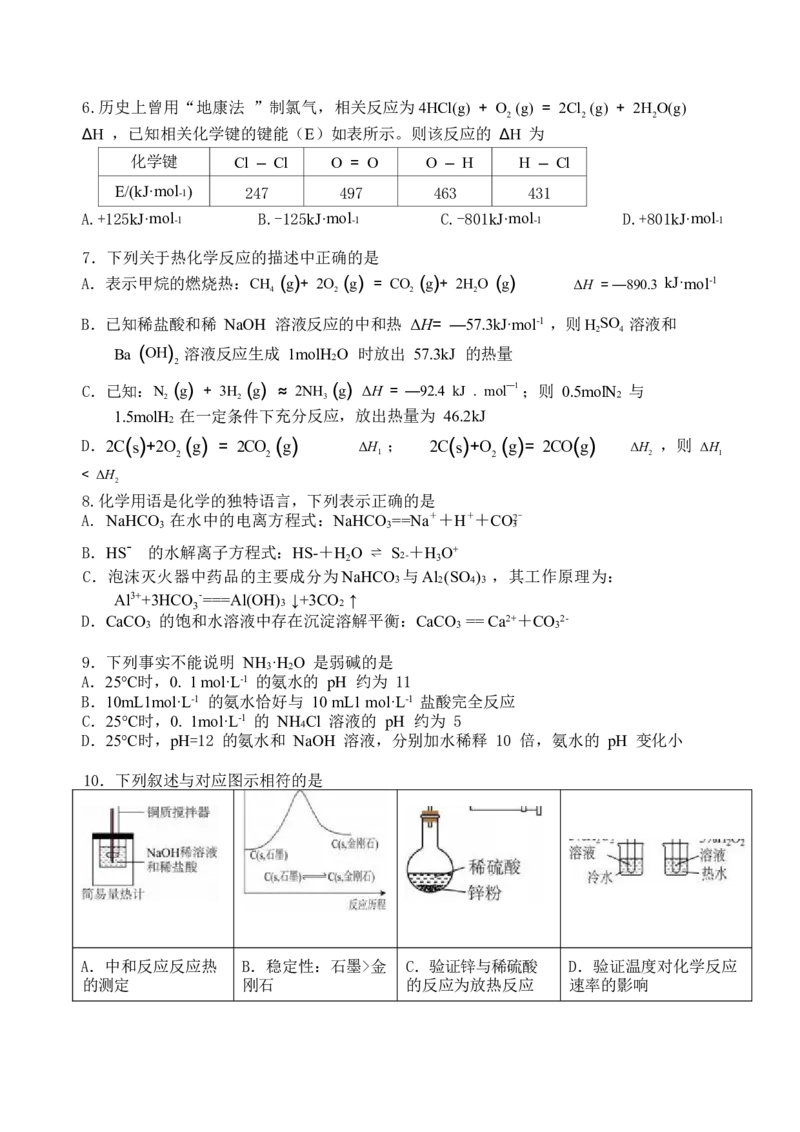
10.下列叙述与对应图示相符的是
A.中和反应反应热 B.稳定性:石墨>金 C.验证锌与稀硫酸 D.验证温度对化学反应
的测定 刚石 的反应为放热反应 速率的影响11.下列陈述 Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述 Ⅰ 陈述Ⅱ
A FeCl 水解可生成 Fe(OH) 胶体 FeCl 可用作净水剂
3 3 3
B 装有 NO 的密闭烧瓶冷却后颜色变浅 NO 转化为 N O 的反应吸热
2 2 2 4
C 工业合成氨采用高温条件 合成氨反应为放热反应
向含有 Mg(OH) 和 NaOH 的悬浊液
D 2 K [Cu(OH) ]<K [Mg(OH) ]
中滴加 CuSO 溶液,有蓝色沉淀产 sp 2 sp 2
4
生
12.下列说法错误的是
A.在常温下,由水电离出的c ( H+ ) = 1× 10—13mol.L—1 时,此溶液的pH= 1 或 13
—
B. 反应 2Mg(s)+CO (g) C(s)+2MgO(s)能正向自发进行,则该反应的ΔH<0
2
C.增大压强,可提高单位体积内活化分子数和活化分子百分数,从而提高反应速率
D.常温下,pH=4 的醋酸和 pH=4 氯化铵溶液,后者水的电离程度更大
13.设阿伏加德罗常数的值为 N ,下列说法正确的是
A
A.1L 0.01mol/LKAl(SO ) 溶液中含有的铝离子数为 0.01N
4 2 A
B.1 L0.1 mol·L-1 的 HClO 溶液中含有 HClO 的数目小于 0. 1N
A
C.常温下,pH=12 的 Ba(OH) 溶液中含有 OH的数目为
2 -
0.01N D.0.3 mol H 和 0.1 mol N 充分反应生成 NH 的分子
A 2 2 3
数为 0.2N
A
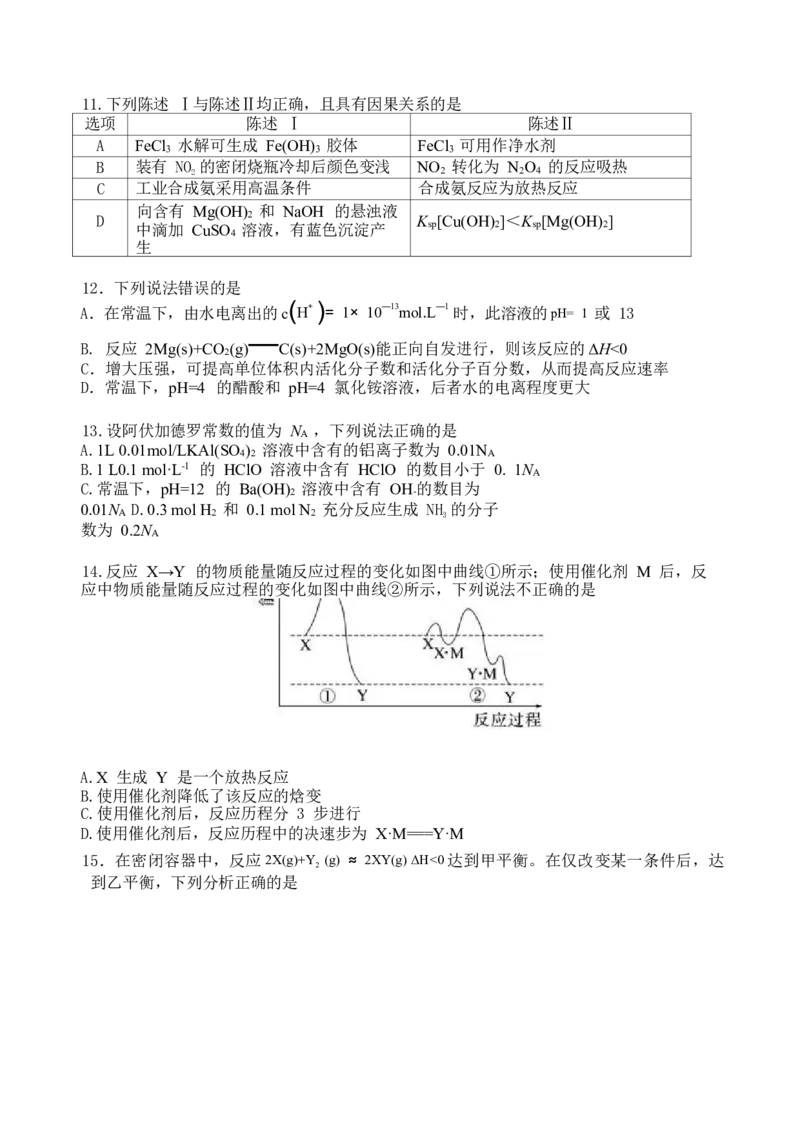
14.反应 X→Y 的物质能量随反应过程的变化如图中曲线①所示;使用催化剂 M 后,反
应中物质能量随反应过程的变化如图中曲线②所示,下列说法不正确的是
A.X 生成 Y 是一个放热反应
B.使用催化剂降低了该反应的焓变
C.使用催化剂后,反应历程分 3 步进行
D.使用催化剂后,反应历程中的决速步为 X·M===Y·M
15.在密闭容器中,反应2X(g)+Y (g) ≈ 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达
2
到乙平衡,下列分析正确的是A.图 Ⅰ 中,t 时刻可能是往恒容容器中通入了X 气体
B.图Ⅱ中,平衡状态甲与乙的反应物转化率乙>甲
C.图Ⅱ中,t 时刻可能是增大了压强
D.图Ⅲ表示反应分别在甲、乙条件下达到平衡,说明乙温度高于甲温度
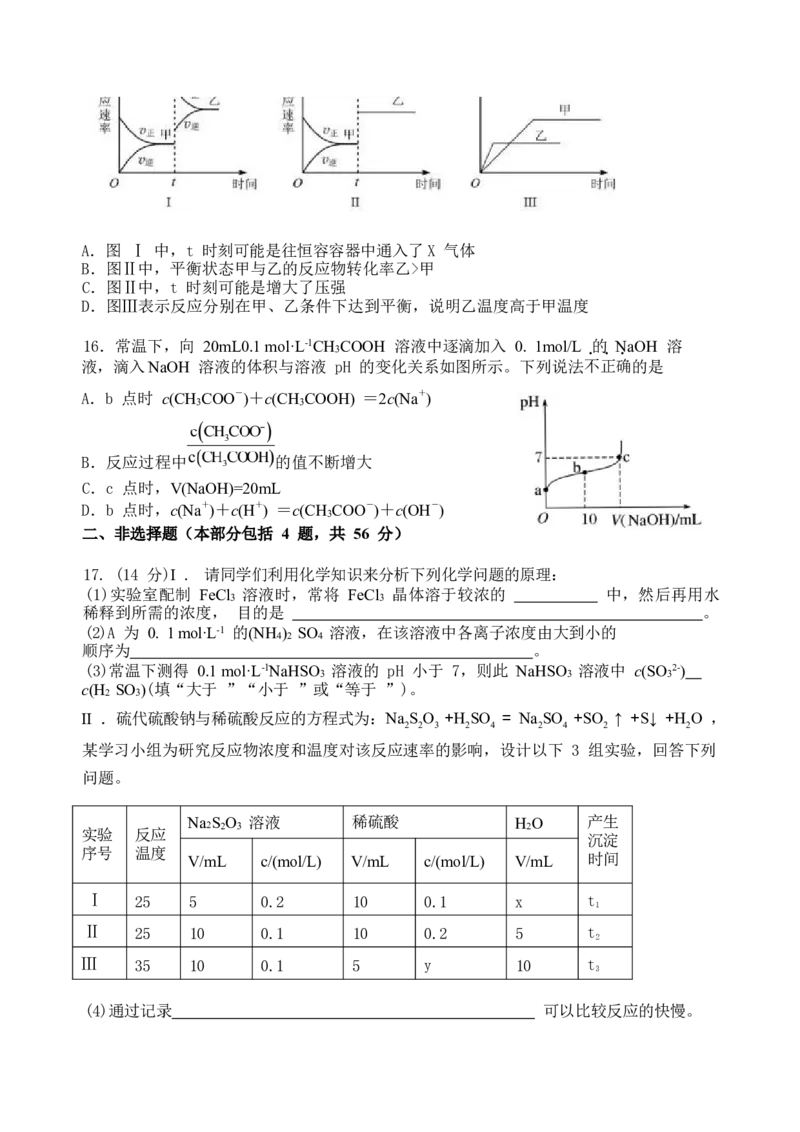
16.常温下,向 20mL0.1 mol·L-1CH COOH 溶液中逐滴加入 0. 1mol/L 的 NaOH 溶
3
液,滴入NaOH 溶液的体积与溶液 pH 的变化关系如图所示。下列说法不正确的是
A.b 点时 c(CH COO-)+c(CH COOH) =2c(Na+)
3 3
B.反应过程中 的值不断增大
C.c 点时,V(NaOH)=20mL
D.b 点时,c(Na+)+c(H+) =c(CH COO-)+c(OH-)
3
二、非选择题(本部分包括 4 题,共 56 分)
17. (14 分)Ⅰ . 请同学们利用化学知识来分析下列化学问题的原理:
(1)实验室配制 FeCl 溶液时,常将 FeCl 晶体溶于较浓的 中,然后再用水
3 3
稀释到所需的浓度, 目的是 。
(2)A 为 0. 1 mol·L-1 的(NH ) SO 溶液,在该溶液中各离子浓度由大到小的
4 2 4
顺序为 。
(3)常温下测得 0.1 mol·L-1NaHSO 溶液的 pH 小于 7,则此 NaHSO 溶液中 c(SO 2-)
3 3 3
c(H SO )(填“大于 ”“小于 ”或“等于 ”)。
2 3
II .硫代硫酸钠与稀硫酸反应的方程式为:Na S O +H SO = Na SO +SO ↑ +S↓ +H O ,
2 2 3 2 4 2 4 2 2
某学习小组为研究反应物浓度和温度对该反应速率的影响,设计以下 3 组实验,回答下列
问题。
Na S O 溶液 稀硫酸 H O 产生
2 2 3 2
实验 反应
沉淀
序号 温度
V/mL c/(mol/L) V/mL c/(mol/L) V/mL 时间
Ⅰ 25 5 0.2 10 0.1 x t
1
Ⅱ 25 10 0.1 10 0.2 5 t
2
Ⅲ 35 10 0.1 5 y 10 t
3
(4)通过记录 可以比较反应的快慢。(5)对比实验Ⅱ、Ⅲ研究温度对该反应速率的影响,则 y= 。
(6)对比实验 (填实验序号) 研究c(H+ ) 对该反应速率的影响。
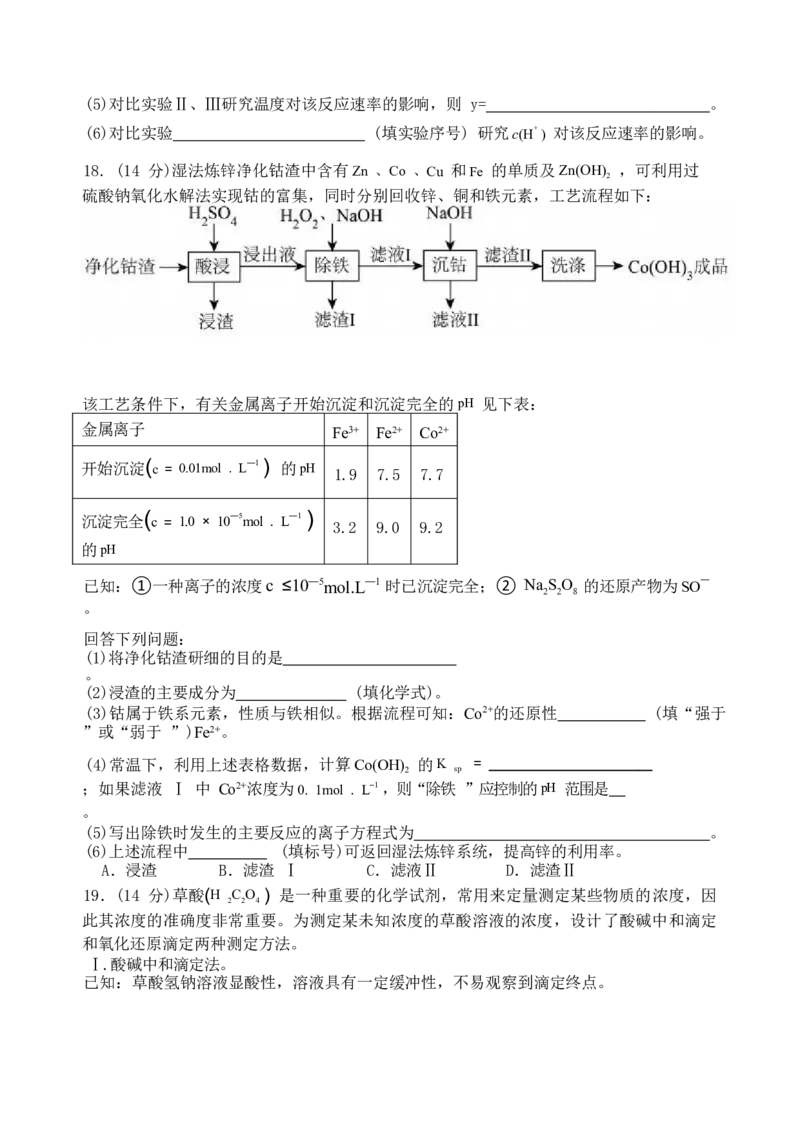
18. (14 分)湿法炼锌净化钴渣中含有Zn 、Co 、Cu 和Fe 的单质及Zn(OH) ,可利用过
2
硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH 见下表:
金属离子 Fe3+ Fe2+ Co2+
开始沉淀( c = 0.01mol . L—1 ) 的pH 1.9 7.5 7.7
沉淀完全 ( c = 1.0 × 10—5mol . L—1 ) 3.2 9.0 9.2
的pH
已知:①一种离子的浓度c ≤10—5mol.L—1 时已沉淀完全;② Na S O 的还原产物为SO —
2 2 8
。
回答下列问题:
(1)将净化钴渣研细的目的是
。
(2)浸渣的主要成分为 (填化学式)。
(3)钴属于铁系元素,性质与铁相似。根据流程可知:Co2+的还原性 (填“强于
”或“弱于 ”)Fe2+。
(4)常温下,利用上述表格数据,计算Co(OH) 的K =
2 sp
;如果滤液 Ⅰ 中 Co2+浓度为0. 1mol . L—1 ,则“除铁 ”应控制的pH 范围是
。
(5)写出除铁时发生的主要反应的离子方程式为 。
(6)上述流程中 (填标号)可返回湿法炼锌系统,提高锌的利用率。
A.浸渣 B.滤渣 Ⅰ C.滤液Ⅱ D.滤渣Ⅱ
19.(14 分)草酸(H C O ) 是一种重要的化学试剂,常用来定量测定某些物质的浓度,因
2 2 4
此其浓度的准确度非常重要。为测定某未知浓度的草酸溶液的浓度,设计了酸碱中和滴定
和氧化还原滴定两种测定方法。
Ⅰ.酸碱中和滴定法。
已知:草酸氢钠溶液显酸性,溶液具有一定缓冲性,不易观察到滴定终点。操作步骤:量取待测草酸溶液 10.00mL于锥形瓶中,滴加 2 滴指示剂;将 0. 1000mol . L—
1NaOH 溶液盛装于滴定管中,到达滴定终点时停止滴定,并记录NaOH 溶液的体积,再重复
滴定 3 次。记录数据如下:
滴定次数 1 2 3 4
V(草酸)/mL 10.00 10.00 10.00 10.00
V NaOH(aq)
(消耗)/mL 15.95 15.00 15.02 14.98
(1)该滴定过程中应选用的指示剂为 (填“酚酞 ”或“ 甲基橙 ”)。
(2)将NaOH 溶液盛装于滴定管后,需要排尽滴定管尖嘴部分的气泡,并将液面调至“0
”刻度或“0 ”刻度 (填“ 以上 ”或“ 以下 ”);其中排气泡的正确操作
为 (填字母)。
a. b. c. d.
(3)由上述滴定结果可计算得到 c(草酸)= mol . L—1 。
(4)若出现下列情况,测定结果偏高的是 (填字母)。
A.滴定前用蒸馏水冲洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.滴定至终点时,俯视读数
D.用蒸馏水清洗滴定管后,未用NaOH 标准液润洗
Ⅱ.氧化还原滴定法。用已知浓度的KMnO 溶液滴定该草酸溶液。
4
滴定过程中涉及反应的离子方程式为:5H C O +2MnO — +6H+ = 10CO ↑ +2Mn2+
2 2 4 4 2
+8H O
2
(5)滴定时盛装KMnO 溶液的滴定管为 (填“酸式滴定管 ”或“碱式滴定管
4
”)。
(6)滴定至终点的现象为 。
20. (14 分)二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。
(1)已知:
①CO (g) + H (g) ≈ CO(g) + H O (g) ΔH = +41kJ/mol
2 2 2
②2CO(g) + 4H (g) ≈ CH = CH (g) + 2HO (g) ΔH = —210 kJ/mol
2 2 2 2
则CO 与H 反应生成乙烯和水蒸气的热化学方程式为 。
2 2
(2)研究表明CO 和H 在一定条件下可以合成甲醇,反应的化学方程式为:
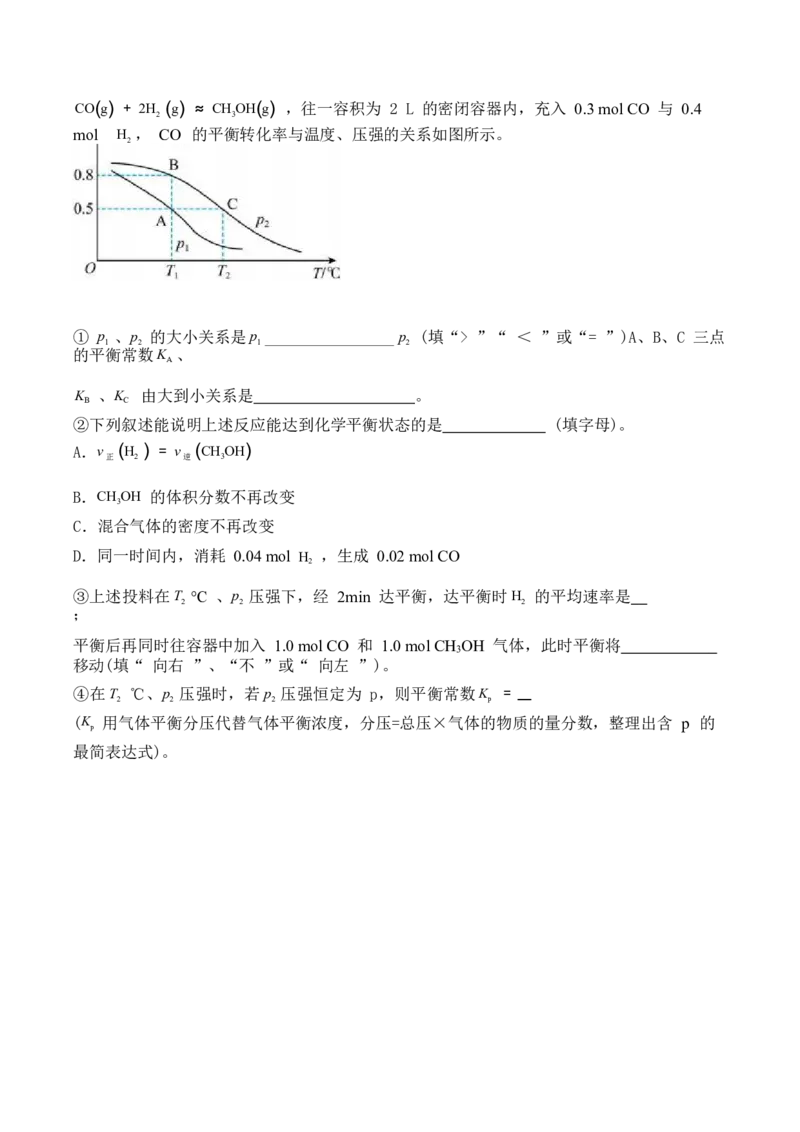
2CO(g) + 2H (g) ≈ CHOH(g) ,往一容积为 2 L 的密闭容器内,充入 0.3 mol CO 与 0.4
2 3
mol H , CO 的平衡转化率与温度、压强的关系如图所示。
2
① p 、p 的大小关系是p p (填“> ”“ < ”或“= ”)A、B、C 三点
1 2 1 2
的平衡常数K 、
A
K 、K 由大到小关系是 。
B C
②下列叙述能说明上述反应能达到化学平衡状态的是 (填字母)。
A.v (H ) = v (CHOH)
正 2 逆 3
B.CHOH 的体积分数不再改变
3
C.混合气体的密度不再改变
D.同一时间内,消耗 0.04 mol H ,生成 0.02 mol CO
2
③上述投料在T ℃ 、p 压强下,经 2min 达平衡,达平衡时H 的平均速率是
2 2 2
;
平衡后再同时往容器中加入 1.0 mol CO 和 1.0 mol CH OH 气体,此时平衡将
3
移动(填“ 向右 ”、“不 ”或“ 向左 ”)。
④在T ℃、p 压强时,若p 压强恒定为 p,则平衡常数K =
2 2 2 p
(K 用气体平衡分压代替气体平衡浓度,分压=总压×气体的物质的量分数,整理出含 p 的
p
最简表达式)。1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
D B C D D B D C B B A C B B D C
二、非选择题(本部分包括 4 题,共 56 分)(每空 2 分)
17(14 分)I.(1) 盐酸 通过增大溶液中的 H+浓度(1 分),从而抑制 Fe3+的水解(1
分)
(2)c(N )>c(S )>c(H+)>c(OH-) (顺序全对才可以得分) (3) 大于
−
II. (H4)达到O相 同沉淀程度所需的时间(或出现浑浊所用时间)
(5)0.4 (6) Ⅰ 、 Ⅱ(只写对一个不给分)
18(14 分)(1)增大钴渣与酸的接触面积(1 分),从而加快酸浸速率,使酸浸更充分(1
分)
(2) Cu (3)弱于
(4) 1.0 × 10-14 .6 3.2 ≤ pH < 7.2 ( [3.2,7.2)或者 3.2~7.2 均给 2 分 )
(5)2Fe2++H O +4OH =2Fe(OH) ↓ (2 分)或 2Fe2++H O +2H+=2Fe3+ +H O(1 分)、Fe3+
2 2 - 3 2 2 2
+3OH- =Fe(OH) ↓(1 分),写对 1 个给 1 分,没配平、漏沉淀符号合扣 1 分
3
(6)C
19.(14 分)
(1)酚酞 (2)以下 c
(3)0.07500(有效数字不作为扣分点,0.075 也得 2 分) (4)D
(5) 酸式滴定管 (6)当滴入最后半滴KMnO 溶液后,锥形瓶内溶液颜色由无色变为浅
4
红
色(或浅紫色)且半分钟内不变色(颜色变化错误得 0 分,漏写半滴操作、半分钟等待酌
情合扣 1 分)
20(14 分) (1)2CO (g)+6H (g) ≈ CH =CH (g)+4H O(g) ΔH=-128kJ/mol (写对
2 2 2 2 2
, 后面反应热计算错误得 1 分 )其他符合比例关系
的正确热化学方程式也得分
(2)
①< K =K >K
A B C
②BD (选 B 或选 D 得 1 分,有错选 0 分)