文档内容
宜宾市普通高中 2022 级第一次诊断性测试
化 学
(考试时间:75分钟;全卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的考号、姓名、班级填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦擦干净后,再选涂其它答案标号。回答非选择题时,将答案写在
答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:N14 O16 Si28
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有
一项是符合题目要求的。
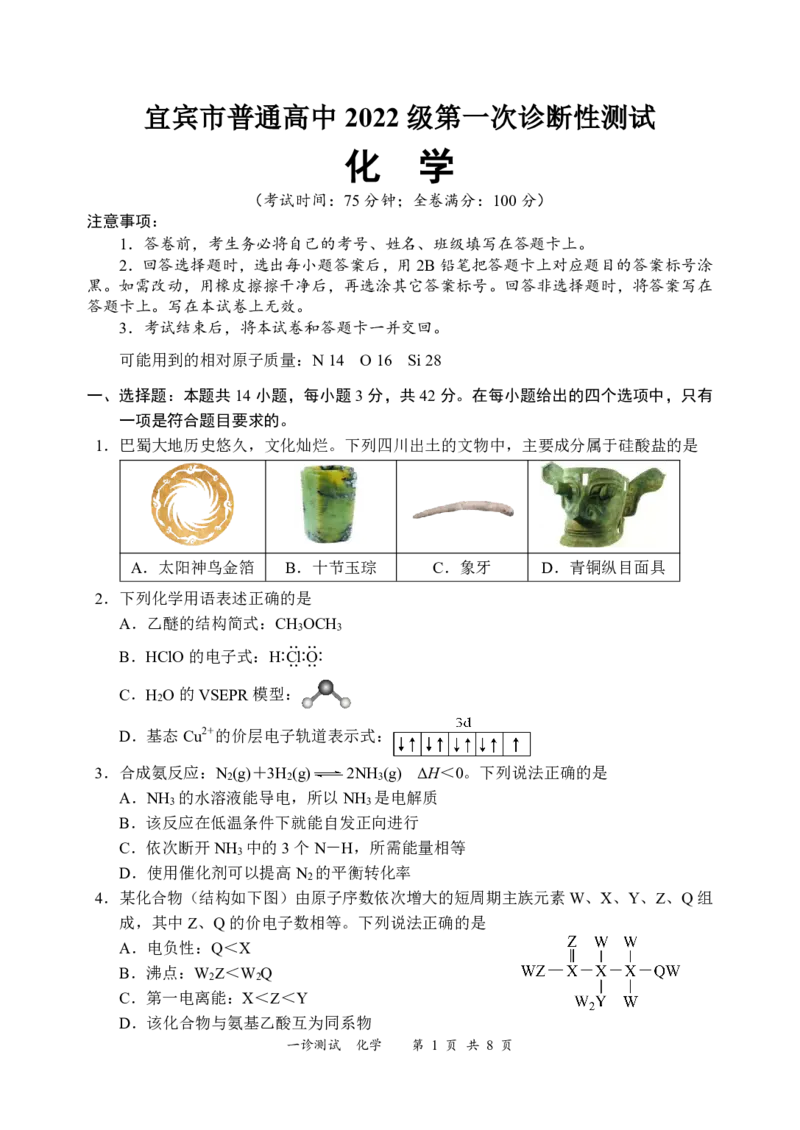
1.巴蜀大地历史悠久,文化灿烂。下列四川出土的文物中,主要成分属于硅酸盐的是
A.太阳神鸟金箔 B.十节玉琮 C.象牙 D.青铜纵目面具
2.下列化学用语表述正确的是
A.乙醚的结构简式:CH OCH
3 3
·· ··
B.HClO的电子式:H· ·Cl· ·O·
·
·· ··
C.H O的VSEPR模型:
2
D.基态Cu2+的价层电子轨道表示式:
3.合成氨反应:N (g)+3H (g) 2NH (g) ΔH<0。下列说法正确的是
2 2 3
A.NH 的水溶液能导电,所以NH 是电解质
3 3
B.该反应在低温条件下就能自发正向进行
C.依次断开NH 中的3个N-H,所需能量相等
3
D.使用催化剂可以提高N 的平衡转化率
2
4.某化合物(结构如下图)由原子序数依次增大的短周期主族元素W、X、Y、Z、Q组
成,其中Z、Q的价电子数相等。下列说法正确的是
A.电负性:Q<X
B.沸点:W Z<W Q
2 2
C.第一电离能:X<Z<Y
D.该化合物与氨基乙酸互为同系物
一诊测试 化学 第 1 页 共 8 页5.氮化硅(Si N )可由石英与焦炭在高温的氮气流中通过以下反应制备:
3 4
3SiO +6C+2N 高温 Si N +6CO
2 2 3 4
下列说法正确的是
A.28gN 中π键的数目为N
2 A
B.60gSiO 晶体中含Si-O数目为2N
2 A
C.每生成1molSi N ,转移电子数目为12N
3 4 A
D.每消耗22.4LN ,生成CO分子数目为3N
2 A
6.下列方程式与所列实验事实不相符的是
A.足量铁粉与稀硝酸反应,产生无色气体:Fe+4H++NO-=Fe3++NO↑+2H O
3 2
B.加热氯化铵和氢氧化钙固体混合物,产生无色气体:
2NH Cl+Ca(OH) CaCl +2NH ↑+2H O
4 2 2 3 2
C.苯酚钠溶液中通入二氧化碳,出现白色浑浊:
CO +H O+C H O-→HCO-+C H OH
2 2 6 5 3 6 5
D.氢氧化铝溶于烧碱溶液:Al(OH) +OH-=[Al(OH) ]-
3 4
7.某有机物是合成叶酸的中间体,其结构简式如图。下列有关该有机物的说法正确的是
A.可与盐酸发生反应
B.分子中含有酰胺基
C.分子中含有1个手性碳原子
D.分子中碳原子均采用sp2杂化
8.单质M、N、Q的相关转化关系如下图:
下列说法错误的是
A.若单质M为金属,其具有一定的非金属性
B.N中的基态原子价电子排布式为3d64s2
C.单质N和氧化物III常温下不反应
D.常用Q还原氧化物II冶炼单质M
一诊测试 化学 第 2 页 共 8 页9.下列实验装置和操作均正确,且可以实现相应实验目的的是
甲 乙 丙 丁
A.甲:加热NH HCO 固体制取纯净的氨
4 3
B.乙:用pH试纸测定烧杯中溶液的pH
C.丙:收集钠与水反应产生的气体
D.丁:打开止水夹并挤压胶头滴管后形成红色喷泉
10.连二亚硫酸钠(Na S O )俗称保险粉,其在碱性溶液中稳定,在中性和酸性溶液中
2 2 4
极不稳定。用含锌(粉)悬浊液制备Na S O 的流程如下:
2 2 4
下列说法正确的是
A.通入的SO 作还原剂
2
B.“滤液1”中的溶质只有ZnS O
2 4
C.“系列操作”过程中可直接用水洗涤Na S O
2 2 4
D.向“滤液2”中加NaCl固体是为了降低Na S O 的溶解度
2 2 4
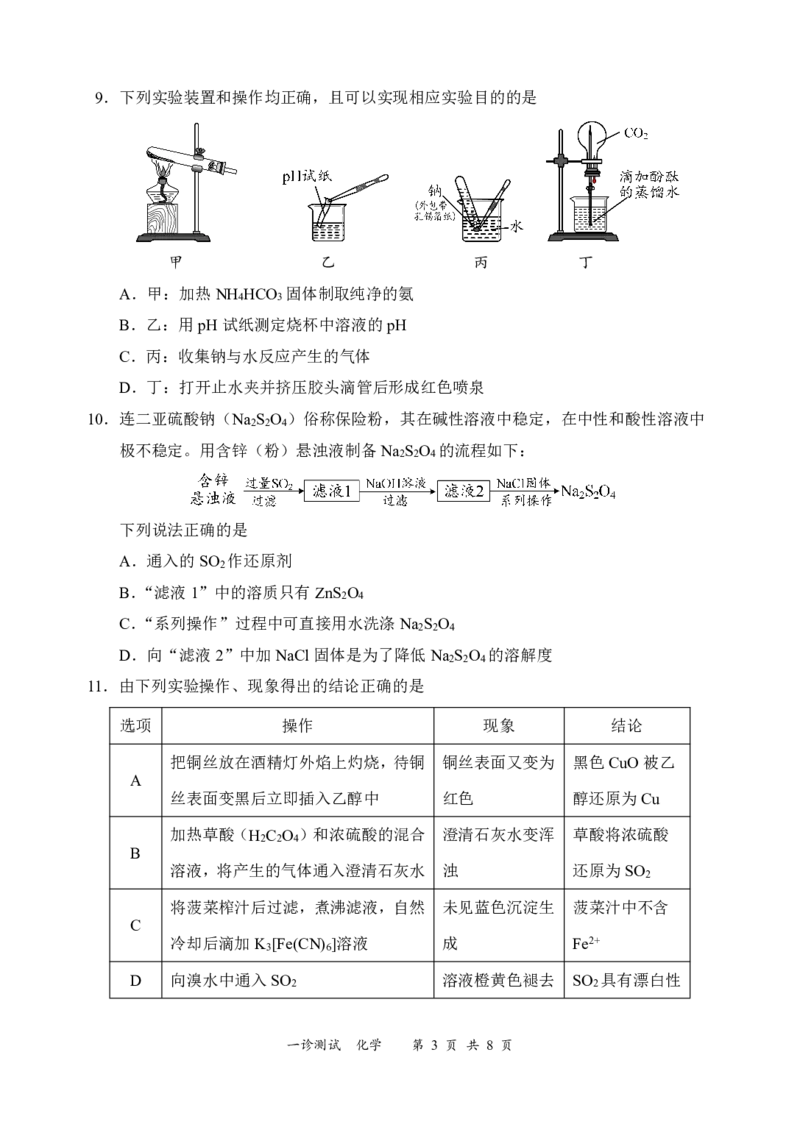
11.由下列实验操作、现象得出的结论正确的是
选项 操作 现象 结论
把铜丝放在酒精灯外焰上灼烧,待铜 铜丝表面又变为 黑色CuO被乙
A
丝表面变黑后立即插入乙醇中 红色 醇还原为Cu
加热草酸(H C O )和浓硫酸的混合 澄清石灰水变浑 草酸将浓硫酸
2 2 4
B
溶液,将产生的气体通入澄清石灰水 浊 还原为SO
2
将菠菜榨汁后过滤,煮沸滤液,自然 未见蓝色沉淀生 菠菜汁中不含
C
冷却后滴加K [Fe(CN) ]溶液 成 Fe2+
3 6
D 向溴水中通入SO 溶液橙黄色褪去 SO 具有漂白性
2 2
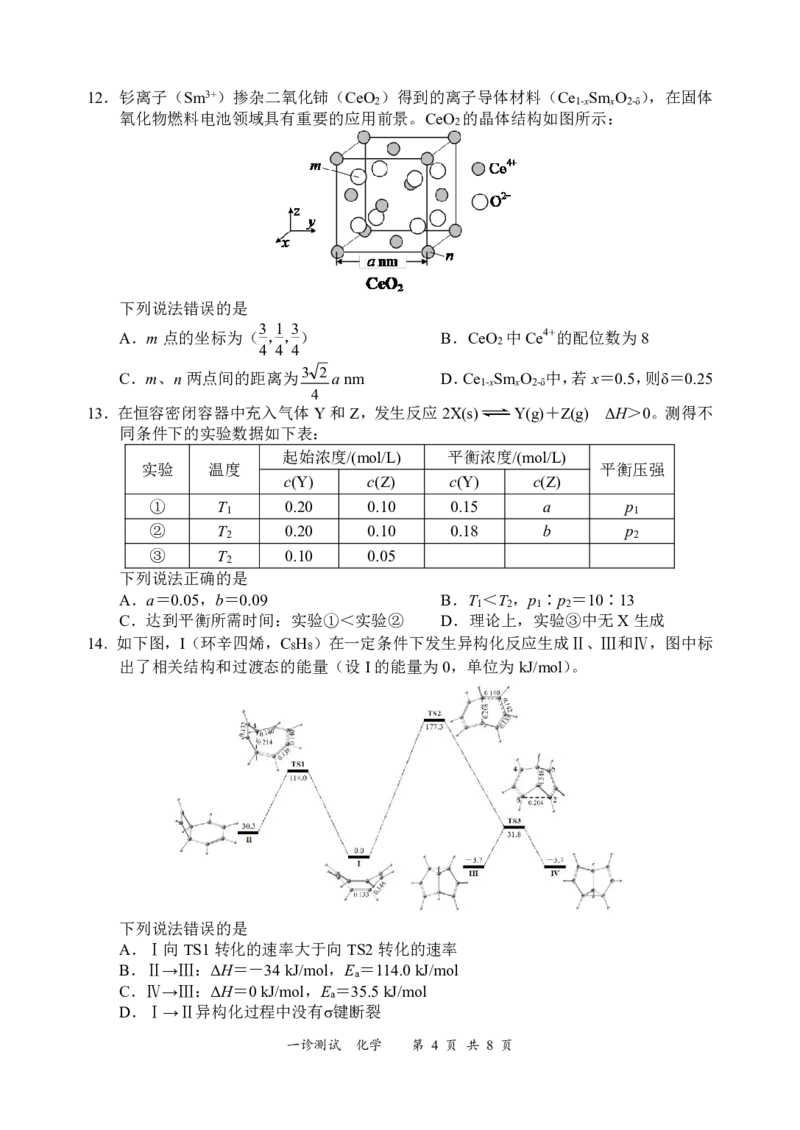
一诊测试 化学 第 3 页 共 8 页12.钐离子(Sm3+)掺杂二氧化铈(CeO )得到的离子导体材料(Ce Sm O ),在固体
2 1-x x 2-δ
氧化物燃料电池领域具有重要的应用前景。CeO 的晶体结构如图所示:
2
下列说法错误的是
3 1 3
A.m点的坐标为( ,,) B.CeO 中Ce4+的配位数为8
2
4 4 4
C.m、n两点间的距离为3 2 anm D.Ce Sm O 中,若x=0.5,则δ=0.25
1-x x 2-δ
4
13.在恒容密闭容器中充入气体Y和Z,发生反应2X(s) Y(g)+Z(g) ΔH>0。测得不
同条件下的实验数据如下表:
起始浓度/(mol/L) 平衡浓度/(mol/L)
实验 温度 平衡压强
c(Y) c(Z) c(Y) c(Z)
① T 0.20 0.10 0.15 a p
1 1
② T 0.20 0.10 0.18 b p
2 2
③ T 0.10 0.05
2
下列说法正确的是
A.a=0.05,b=0.09 B.T <T ,p ∶p =10∶13
1 2 1 2
C.达到平衡所需时间:实验①<实验② D.理论上,实验③中无X生成
14.如下图,I(环辛四烯,C H )在一定条件下发生异构化反应生成Ⅱ、Ⅲ和Ⅳ,图中标
8 8
出了相关结构和过渡态的能量(设I的能量为0,单位为kJ/mol)。
下列说法错误的是
A.Ⅰ向TS1转化的速率大于向TS2转化的速率
B.Ⅱ→Ⅲ:ΔH=-34kJ/mol,E=114.0kJ/mol
a
C.Ⅳ→Ⅲ:ΔH=0kJ/mol,E=35.5kJ/mol
a
D.Ⅰ→Ⅱ异构化过程中没有σ键断裂
一诊测试 化学 第 4 页 共 8 页二、非选择题:共4题,共58分。
15.(14分)
重铬酸钠(Na Cr O )在工业生产中有着广泛的用途。一种以不锈钢废渣为原料(主
2 2 7
要成分为Cr O ·Fe O ,还含有少量MgO、Al O 和SiO 等杂质)生产重铬酸钠晶体的工
2 3 2 3 2 3 2
艺流程如下图。
已知:①MgO难溶于水;
②Na CO +Al O 高温 2NaAlO +CO ↑,Na CO +Fe O 高温 2NaFeO +CO ↑;
2 3 2 3 2 2 2 3 2 3 2 2
③含Cr O2-的溶液呈橙色,含Cr3+的溶液呈墨绿色;
2 7
④温度高于32.4℃后,Na SO 的溶解度随温度升高而降低。
2 4
回答下列问题:
(1)Cr元素位于元素周期表的______区,基态铬原子的未成对电子数为______。
(2)“焙烧”时,Cr O •Fe O 反应生成Na CrO 的化学方程式为______。
2 3 2 3 2 4
(3)“滤渣1”的主要成分为______(填化学式)。
(4)“酸化”时,若加入硫酸过多,观察到溶液由橙色变成墨绿色,同时有气泡产生。
该过程的离子方程式为______。
(5)“分离”时,得到副产品Na SO 的操作依次为______、______、洗涤干燥。
2 4
(6)物料的粒度对铬浸出率的影响如下图所示。“粉碎”时,物料的粒度以______目
为宜,粒度太大或太小都不利于后续铬元素的浸出,原因是______。
16.(15分)
某化学兴趣小组探究CuSO 溶液和Na CO 溶液的反应产物,进行如下实验:分别配
4 2 3
制浓度均为0.50mol/L 的 CuSO 溶液和 Na CO 溶液,按不同的体积比将CuSO 溶液和
4 2 3 4
Na CO 溶液混合均匀后,在水浴锅中搅拌反应15min,观察沉淀的生成速度及颜色,静
2 3
置,待产物完全沉淀后,抽滤、洗涤、烘干。
记录实验信息如下表:
一诊测试 化学 第 5 页 共 8 页n(Na CO )∶n(CuSO ) 0.8∶1.0 1.0∶1.0 1.1∶1.0 1.2∶1.0 1.4∶1.0
2 3 4
产物生成速度 很慢 较慢 慢 快 很快
沉淀颜色 蓝色 蓝色 蓝绿色 绿色 绿色
回答下列问题:
(1)配制500mL0.50mol/LCuSO 溶液,需要用到的玻璃仪器包括胶头滴管、玻璃
4
棒、烧杯和______。
(2)抽滤后,洗涤的具体操作为______。
(3)取蓝色沉淀进行实验。
①取蓝色沉淀,用______(填试剂名称)溶解,生成蓝色溶液而无气体产生。证
明蓝色沉淀中的阴离子有SO2-、OH-而无______(填离子符号)。
4
②取2份25.00mL上述蓝色溶液进行滴定(部分实验细节省略):向第一份溶液
中加入过量KI溶液,发生反应2Cu2++4I- 2CuI↓+I ,然后用0.0100mol/LNa S O
2 2 2 3
溶液滴定生成的I ,发生反应I +2S O2- 2I-+S O2-,消耗20.00mLNa S O 溶液;
2 2 2 3 4 6 2 2 3
向第二份溶液中加入10.00mL0.0200mol/LBaCl 标准溶液,再用0.0100mol/LEDTA溶液
2
滴定剩余Ba2+(EDTA与Ba2+按照1∶1反应),消耗15.00mLEDTA溶液。经计算,蓝
色沉淀的化学式为_______(不考虑结晶水)。
(4)取绿色沉淀,经检验其组成主要为碱式碳酸铜[Cu (OH) CO ]而不是CuCO ,原
2 2 3 3
因是______。
(5)水浴加热相较于酒精灯加热的优点有______;当温度超过90℃时,产物中有少
量黑色固体,其化学式为______。
(6)若向Na CO 溶液中滴加CuSO 溶液,反应初期生成含铜配离子而无沉淀。下列
2 3 4
说法错误的是______。
A.含铜配离子的化学式可能是[Cu(CO ) ]2-
3 2
B.含铜配离子不与稀硫酸反应
C.含铜配离子能与Cu2+反应生成CuCO 沉淀
3
D.含铜配离子中配位原子为O和C
17.(14分)
CO 和CH 的大量排放是造成气候变化的主要原因。干重整甲烷可将CH 和CO 转化
2 4 4 2
为H 和CO,进一步转化为各类燃料和高附加值化学品。
2
回答下列问题:
(1)已知:CH (g) C(s)+2H (g) ∆H =+75kJ/mol
4 2 1
C(s)+CO (g) 2CO(g) ∆H =+171kJ/mol
2 2
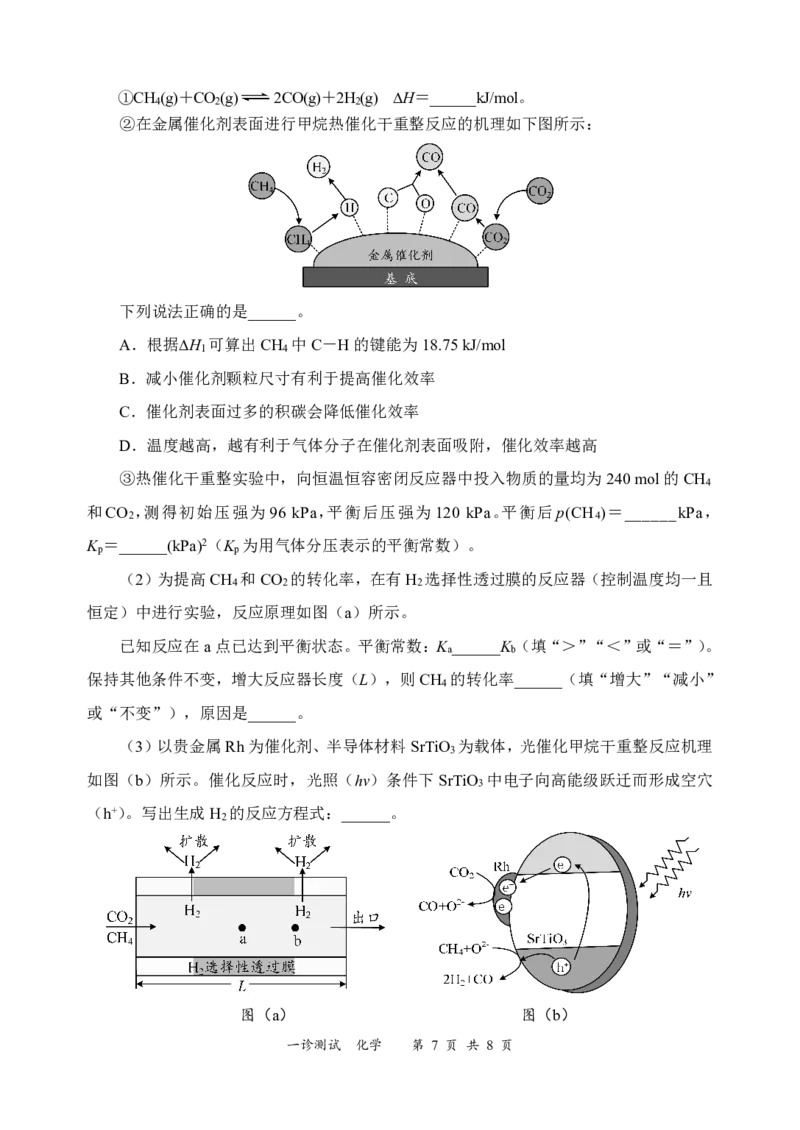
一诊测试 化学 第 6 页 共 8 页①CH (g)+CO (g) 2CO(g)+2H(g) ∆H=______kJ/mol。
4 2 2
②在金属催化剂表面进行甲烷热催化干重整反应的机理如下图所示:
下列说法正确的是______。
A.根据∆H 可算出CH 中C-H的键能为18.75kJ/mol
1 4
B.减小催化剂颗粒尺寸有利于提高催化效率
C.催化剂表面过多的积碳会降低催化效率
D.温度越高,越有利于气体分子在催化剂表面吸附,催化效率越高
③热催化干重整实验中,向恒温恒容密闭反应器中投入物质的量均为240mol的CH
4
和CO ,测得初始压强为96 kPa,平衡后压强为120 kPa。平衡后p(CH )=______kPa,
2 4
K =______(kPa)2(K 为用气体分压表示的平衡常数)。
p p
(2)为提高CH 和CO 的转化率,在有H 选择性透过膜的反应器(控制温度均一且
4 2 2
恒定)中进行实验,反应原理如图(a)所示。
已知反应在a点已达到平衡状态。平衡常数:K ______K(填“>”“<”或“=”)。
a b
保持其他条件不变,增大反应器长度(L),则CH 的转化率______(填“增大”“减小”
4
或“不变”),原因是______。
(3)以贵金属Rh为催化剂、半导体材料SrTiO 为载体,光催化甲烷干重整反应机理
3
如图(b)所示。催化反应时,光照(hv)条件下SrTiO 中电子向高能级跃迁而形成空穴
3
(h+)。写出生成H 的反应方程式:______。
2
图(a) 图(b)
一诊测试 化学 第 7 页 共 8 页18.(15分)
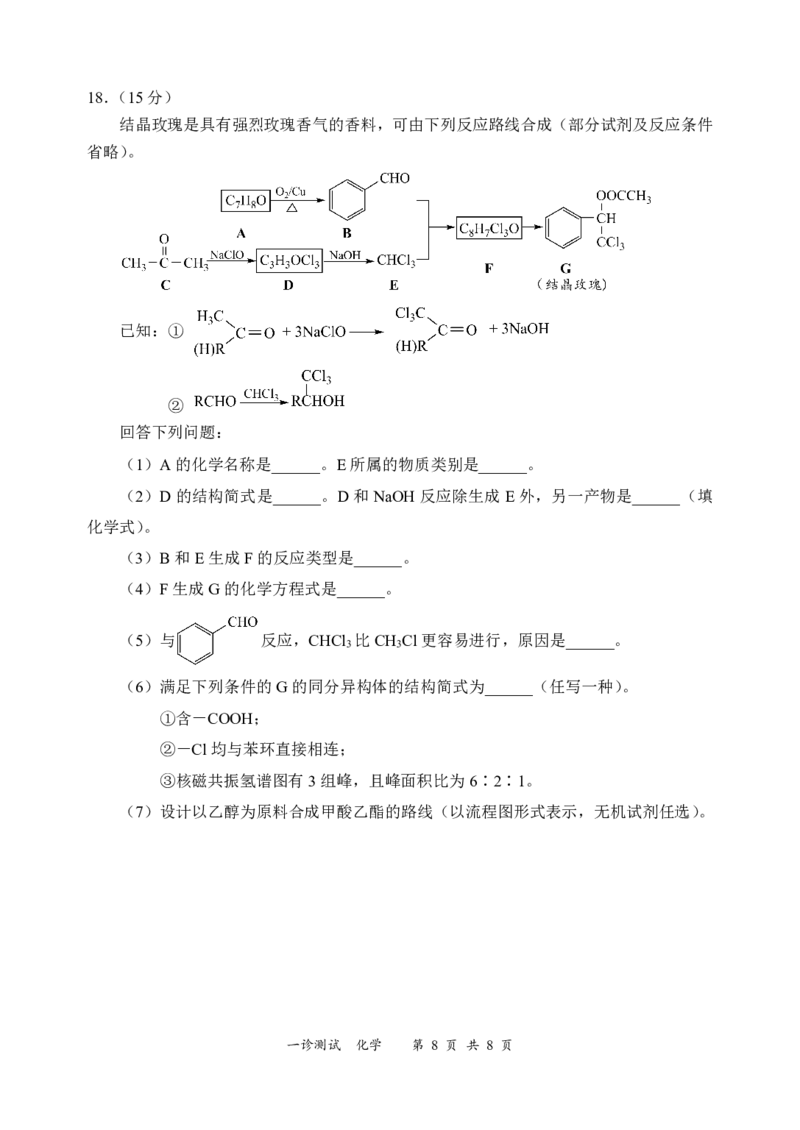
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分试剂及反应条件
省略)。
已知:①
②
回答下列问题:
(1)A的化学名称是______。E所属的物质类别是______。
(2)D的结构简式是______。D和NaOH反应除生成E外,另一产物是______(填
化学式)。
(3)B和E生成F的反应类型是______。
(4)F生成G的化学方程式是______。
(5)与 反应,CHCl 比CH Cl更容易进行,原因是______。
3 3
(6)满足下列条件的G的同分异构体的结构简式为______(任写一种)。
①含-COOH;
②-Cl均与苯环直接相连;
③核磁共振氢谱图有3组峰,且峰面积比为6∶2∶1。
(7)设计以乙醇为原料合成甲酸乙酯的路线(以流程图形式表示,无机试剂任选)。
一诊测试 化学 第 8 页 共 8 页