文档内容
华附、省实、广雅、深中 2022 级高二下学期四校联考
化学
命题学校:广东实验中学
本试卷分选择题和非选择题两部分,共 10页,满分 100分,考试用时 75分钟.
注意事项,
1.答卷的,考生务必用黑色字迹的钢笔或签字笔将自己的校名、姓名、考号、座位号等相关信
息填写在答题卡指定区域内,并用 2B铅笔填涂相关信息.
2.选择题每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用
橡皮擦干净后,再选涂其它答案:不能答在试卷上.
3.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内的相
应位置上:如需改动,先划掉原来的答案,然后再写上新的答案:不准使用铅笔和涂改液.不按
以上要求作答的答案无效.
4.考生必须保持答题卡的整洁.
可能用到的相对原子质量:H-1 C-12 O-16 Ni-59
第一部分(选择题共 44分)
一、选择题:本题共 16小题,共 44分.第 1~10小题每小题 2分,第 11~16题每小题 4分.在
每小题给出的四个选项中,只有一项符合题目要求.
1.化学与生活密切相关.下列说法不正确的是( )
A.乙二醇可用于生产汽车防冻剂
B.疫苗一般应冷藏存放,目的是避免蛋白质变性
C.糖类、油脂、蛋白质在一定条件下一定都能发生水解反应
D.衣服面料中的聚酯纤维、棉、麻均属于有机高分子材料
2.下列有关化学用语表示正确的是( )
A.聚丙烯的链节:—CH —CH —CH —
2 2 2
B.基态氧原子的轨道表示式:
电解
C.用石墨电极电解CuCl 溶液:2Cl−+2H+ H ↑+Cl ↑
2 2 2
( )
D.CH CH CH CH COOH用系统命名法命名为3-甲基丁酸
2 3 2
3.化学处处呈现美,下列说法不正确的是( )
A.舞台上干冰升华时,共价键断裂
B.K+与18-冠-6的空腔大小相近,形成稳定的超分子结构( ),这体现出超分子的分子识别特征
学科网(北京)股份有限公司C.缺角的NaCl晶体在饱和NaCl溶液中变为完美立方体块,体现晶体的自范性
D.雪花是天空中的水汽经凝华而来的一种晶体,其六角形形状与氢键的方向性有关
4、化学创造美好生活.下列选项中生产活动和化学原理关联正确的是( )
A.向工业废水中添加FeS以除去废水中的Cu2+,是由于FeS具有还原性
B.利用废弃的秸秆生产生物质燃料乙醇,是由于纤维素能发生水解反应生成乙醇
C.飞船返回舱使用耐高温的结构材料氮化硅,因为Si N 是由共价键构成的分子晶体
3 4
D.用醋酸能除去水垢中的CaCO ,因为醋酸的酸性强于碳酸
3
5.在生产生活中,金属腐蚀会带来严重的经济损失.下列说法正确的是( )
A.生铁浸泡在食盐水中易发生析氢腐蚀
B.在船舶外壳安装锌块,利用了牺牲阳极法
C.钢铁发生吸氧腐蚀时,负极反应是Fe−3e− =Fe3+
D.将钢铁闸门与电源正极相连的防腐措施属于外加电流法
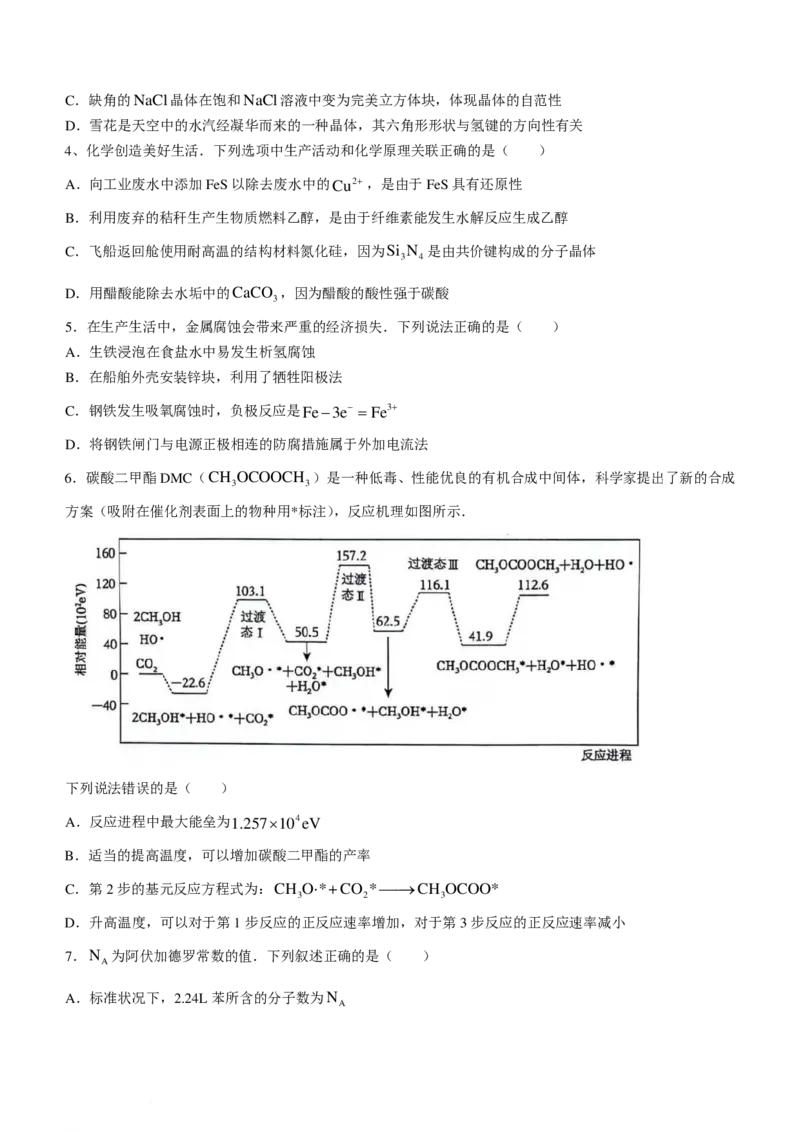
6.碳酸二甲酯DMC(CH OCOOCH )是一种低毒、性能优良的有机合成中间体,科学家提出了新的合成
3 3
方案(吸附在催化剂表面上的物种用*标注),反应机理如图所示.
下列说法错误的是( )
A.反应进程中最大能垒为1.257×104eV
B.适当的提高温度,可以增加碳酸二甲酯的产率
C.第2步的基元反应方程式为:CH O⋅*+CO *→CH OCOO*
3 2 3
D.升高温度,可以对于第1步反应的正反应速率增加,对于第3步反应的正反应速率减小
7.N 为阿伏加德罗常数的值.下列叙述正确的是( )
A
A.标准状况下,2.24L苯所含的分子数为N
A
学科网(北京)股份有限公司B.1.0L pH=2的H SO 溶液中H+的数目为0.02N
2 4 A
C.常温下,12g石墨中含有σ键的数目为1.5N
A
D.标准状况下, 22.4L NO和11.2L O 混合,生成物中含有的分子数为N
2 A
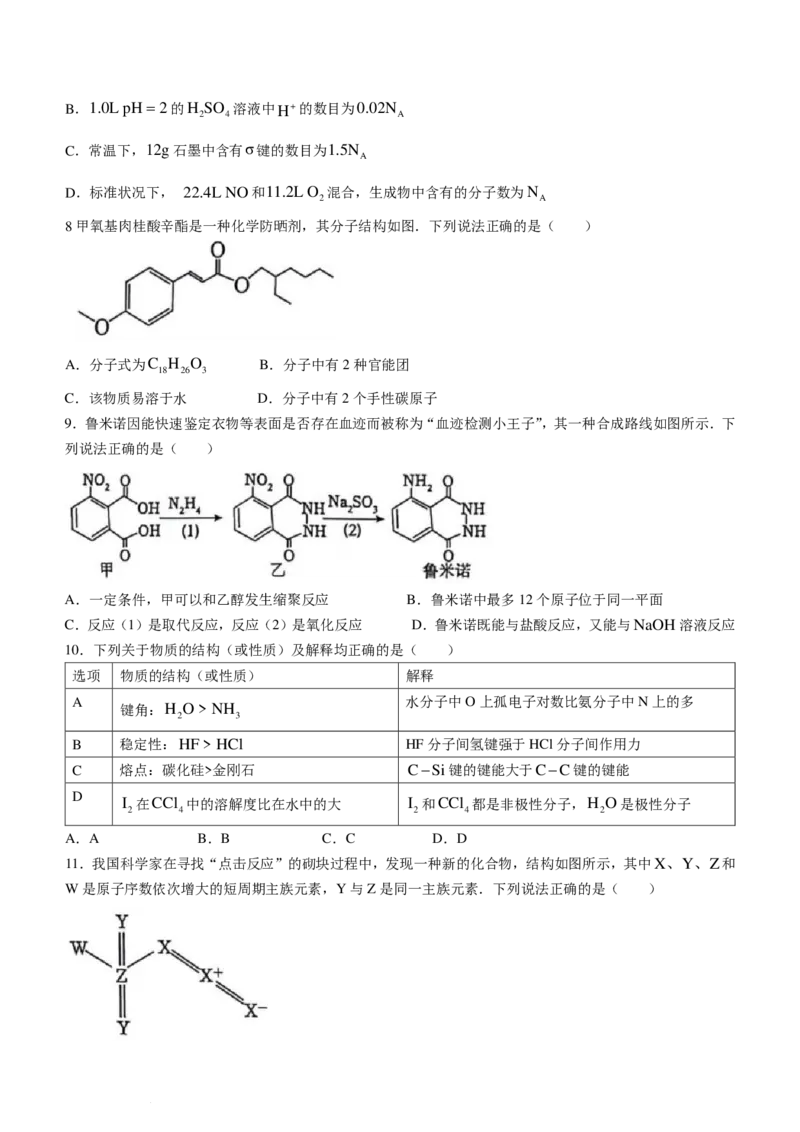
8甲氧基肉桂酸辛酯是一种化学防晒剂,其分子结构如图.下列说法正确的是( )
A.分子式为C H O B.分子中有2种官能团
18 26 3
C.该物质易溶于水 D.分子中有2个手性碳原子
9.鲁米诺因能快速鉴定衣物等表面是否存在血迹而被称为“血迹检测小王子”,其一种合成路线如图所示.下
列说法正确的是( )
A.一定条件,甲可以和乙醇发生缩聚反应 B.鲁米诺中最多12个原子位于同一平面
C.反应(1)是取代反应,反应(2)是氧化反应 D.鲁米诺既能与盐酸反应,又能与NaOH溶液反应
10.下列关于物质的结构(或性质)及解释均正确的是( )
选项 物质的结构(或性质) 解释
A 水分子中O上孤电子对数比氨分子中N上的多
键角:H O> NH
2 3
B 稳定性:HF>HCl HF分子间氢键强于HCl分子间作用力
C 熔点:碳化硅>金刚石 C−Si键的键能大于C−C键的键能
D
I 在CCl 中的溶解度比在水中的大 I 和CCl 都是非极性分子,H O是极性分子
2 4 2 4 2
A.A B.B C.C D.D
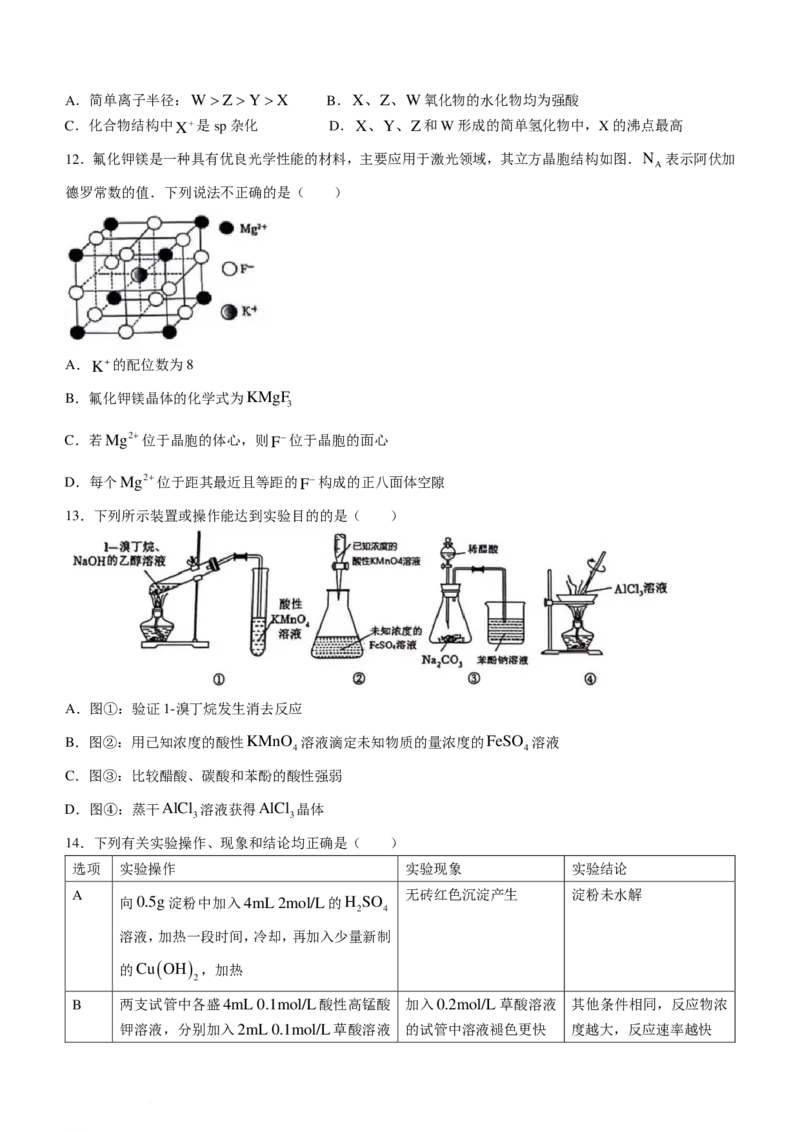
11.我国科学家在寻找“点击反应”的砌块过程中,发现一种新的化合物,结构如图所示,其中X、Y、Z和
W是原子序数依次增大的短周期主族元素,Y与Z是同一主族元素.下列说法正确的是( )
学科网(北京)股份有限公司A.简单离子半径:W >Z>Y>X B.X、Z、W氧化物的水化物均为强酸
C.化合物结构中X+是sp杂化 D.X、Y、Z和W形成的简单氢化物中,X的沸点最高
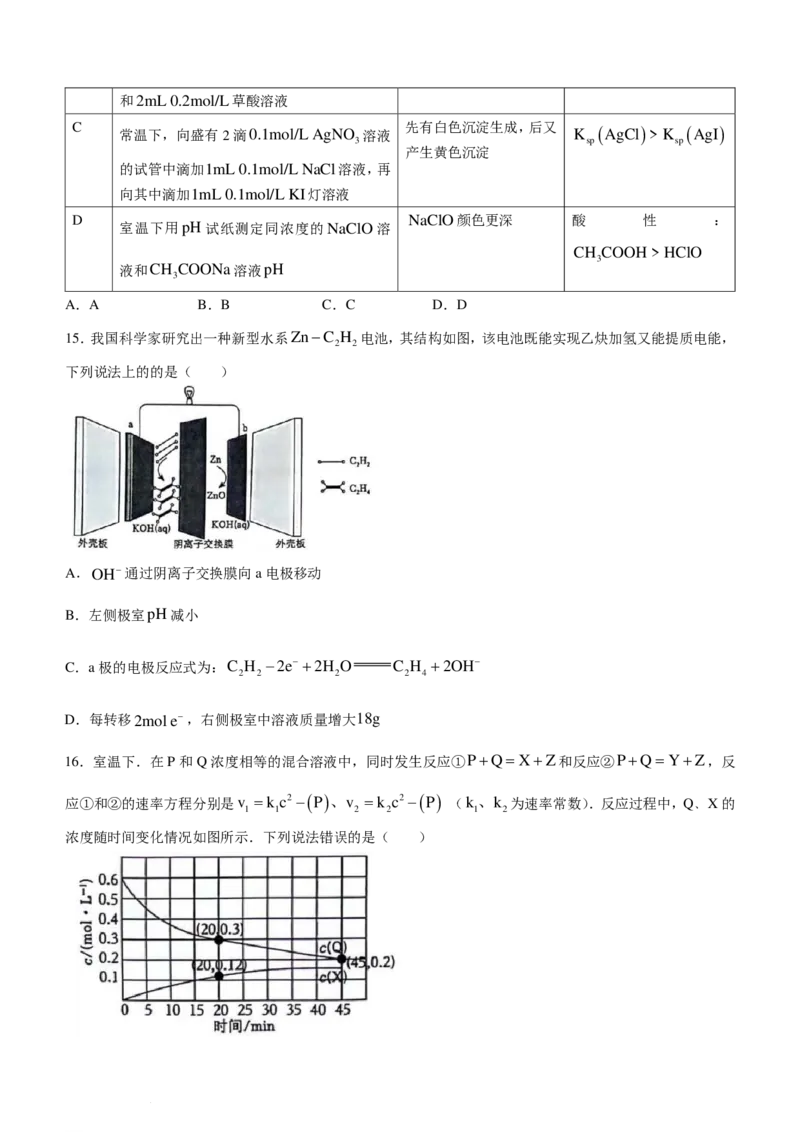
12.氟化钾镁是一种具有优良光学性能的材料,主要应用于激光领域,其立方晶胞结构如图.N 表示阿伏加
A
德罗常数的值.下列说法不正确的是( )
A.K+的配位数为8
B.氟化钾镁晶体的化学式为KMgF
3
C.若Mg2+位于晶胞的体心,则F−位于晶胞的面心
D.每个Mg2+位于距其最近且等距的F−构成的正八面体空隙
13.下列所示装置或操作能达到实验目的的是( )
A.图①:验证1-溴丁烷发生消去反应
B.图②:用已知浓度的酸性KMnO 溶液滴定未知物质的量浓度的FeSO 溶液
4 4
C.图③:比较醋酸、碳酸和苯酚的酸性强弱
D.图④:蒸干AlCl 溶液获得AlCl 晶体
3 3
14.下列有关实验操作、现象和结论均正确是( )
选项 实验操作 实验现象 实验结论
A 无砖红色沉淀产生 淀粉未水解
向0.5g淀粉中加入4mL 2mol/L的H SO
2 4
溶液,加热一段时间,冷却,再加入少量新制
( )
的Cu OH ,加热
2
B 两支试管中各盛4mL 0.1mol/L酸性高锰酸 加入0.2mol/L草酸溶液 其他条件相同,反应物浓
钾溶液,分别加入2mL 0.1mol/L草酸溶液 的试管中溶液褪色更快 度越大,反应速率越快
学科网(北京)股份有限公司和2mL 0.2mol/L草酸溶液
C 先有白色沉淀生成,后又 ( ) ( )
常温下,向盛有2滴0.1mol/L AgNO 溶液 K AgCl >K AgI
3 sp sp
产生黄色沉淀
的试管中滴加1mL 0.1mol/L NaCl溶液,再
向其中滴加1mL 0.1mol/L KI灯溶液
D NaClO颜色更深 酸 性 :
室温下用pH 试纸测定同浓度的NaClO溶
CH COOH>HClO
3
液和CH COONa溶液pH
3
A.A B.B C.C D.D
15.我国科学家研究出一种新型水系Zn−C H 电池,其结构如图,该电池既能实现乙炔加氢又能提质电能,
2 2
下列说法上的的是( )
A.OH−通过阴离子交换膜向a电极移动
B.左侧极室pH减小
C.a极的电极反应式为:C H −2e− +2H O C H +2OH−
2 2 2 2 4
D.每转移2mol e−,右侧极室中溶液质量增大18g
16.室温下.在P和Q浓度相等的混合溶液中,同时发生反应①P+Q=X+Z和反应②P+Q=Y+Z,反
应①和②的速率方程分别是v =k c2 −( P )、v =k c2 −( P ) (k、k 为速率常数).反应过程中,Q﹑X的
1 1 2 2 1 2
浓度随时间变化情况如图所示.下列说法错误的是( )
学科网(北京)股份有限公司A.45min时Z的浓度为0.4mol⋅L−1
B.反应①的活化能比反应②的活化能大
C.反应开始后,体系中X和Y的浓度之比保持不变
D.如果反应能进行到底,反应结束时,有40%的P转化为Y
第二部分(非选择题共 56分)
17.(14分)铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回
答下列问题:
(1)基态格原子的价层电子排布式为___________.
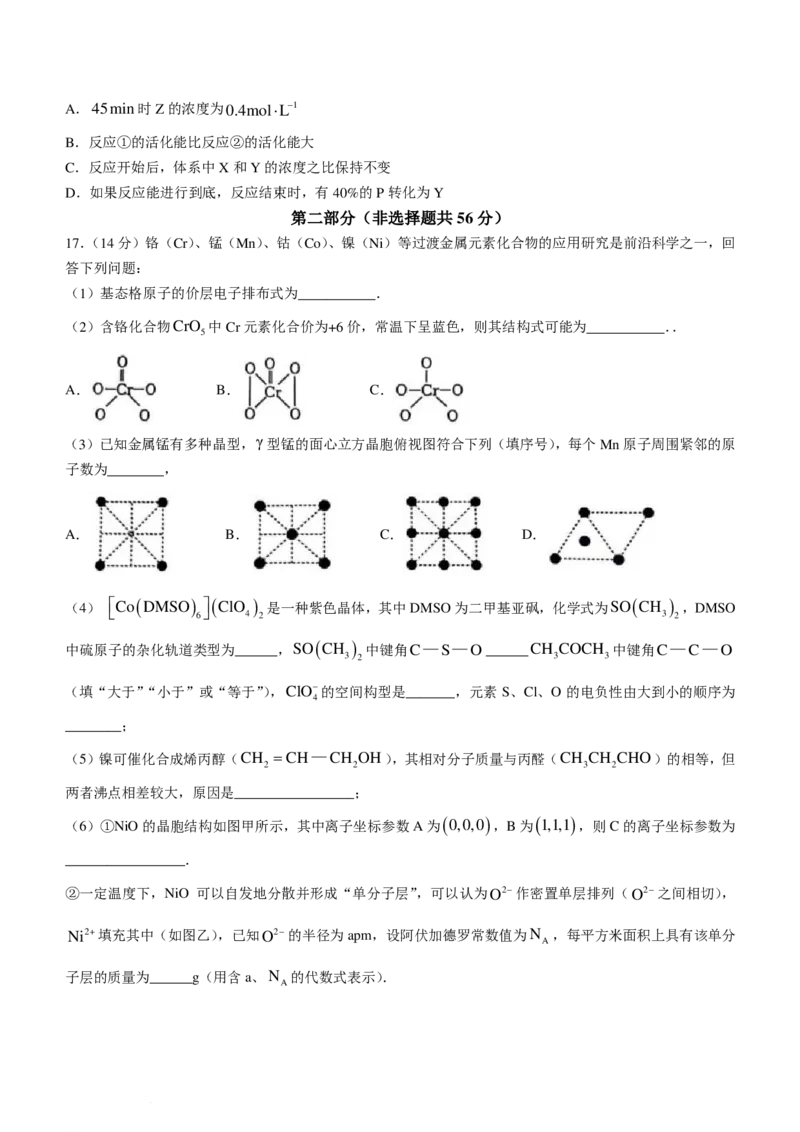
(2)含铬化合物CrO 中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为___________..
5
A. B. C.
(3)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列(填序号),每个Mn原子周围紧邻的原
子数为________,
A. B. C. D.
(4)
Co ( DMSO )
6
( ClO
4
)
2
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO ( CH
3
)
2
,DMSO
中硫原子的杂化轨道类型为______,SO ( CH ) 中键角C—S—O______CH COCH 中键角C—C—O
3 2 3 3
(填“大于”“小于”或“等于”),ClO−的空间构型是_______,元素 S、Cl、O 的电负性由大到小的顺序为
4
________;
(5)镍可催化合成烯丙醇(CH =CH—CH OH),其相对分子质量与丙醛(CH CH CHO)的相等,但
2 2 3 2
两者沸点相差较大,原因是_________________;
( ) ( )
(6)①NiO的晶胞结构如图甲所示,其中离子坐标参数A为 0,0,0 ,B为 1,1,1 ,则C的离子坐标参数为
_________________.
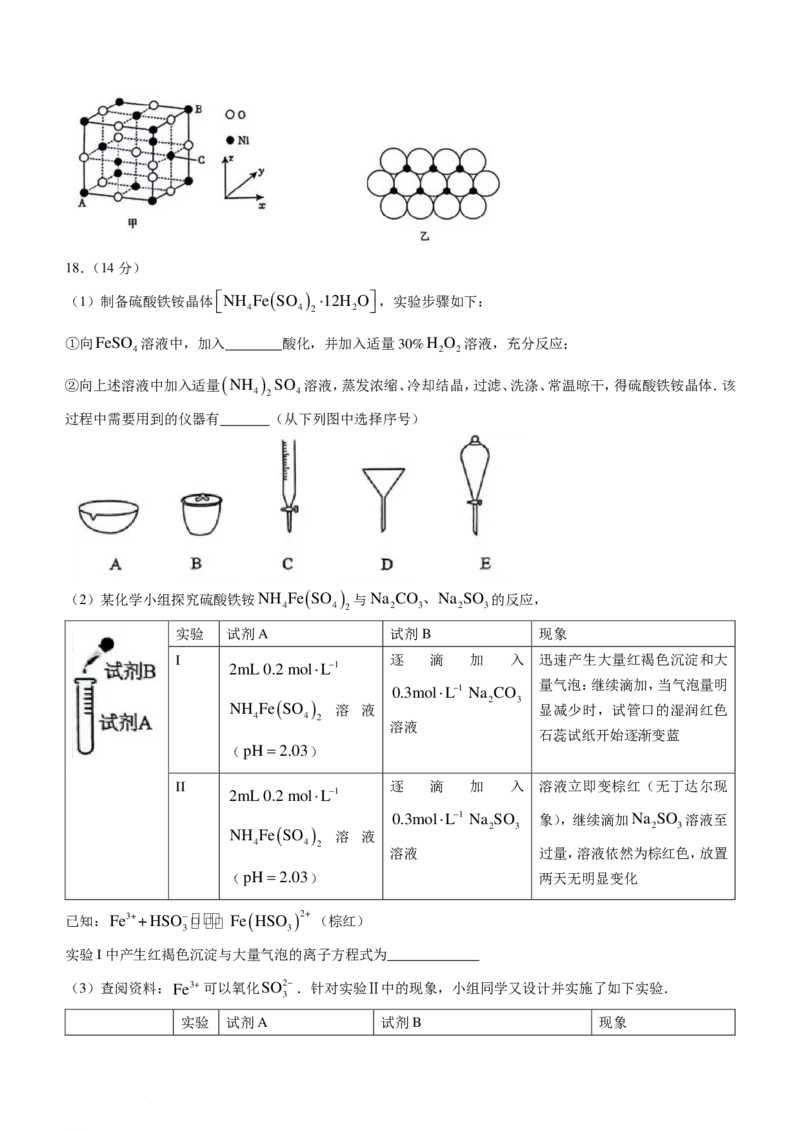
②一定温度下,NiO 可以自发地分散并形成“单分子层”,可以认为O2−作密置单层排列(O2−之间相切),
Ni2+填充其中(如图乙),已知O2−的半径为apm,设阿伏加德罗常数值为N ,每平方米面积上具有该单分
A
子层的质量为______g(用含a、N 的代数式表示).
A
学科网(北京)股份有限公司18.(14分)
(1)制备硫酸铁铵晶体
NH Fe ( SO ) ⋅12H O
,实验步骤如下:
4 4 2 2
①向FeSO 溶液中,加入________酸化,并加入适量30%H O 溶液,充分反应;
4 2 2
( )
②向上述溶液中加入适量 NH SO 溶液,蒸发浓缩、冷却结晶,过滤、洗涤、常温晾干,得硫酸铁铵晶体.该
4 2 4
过程中需要用到的仪器有_______(从下列图中选择序号)
(2)某化学小组探究硫酸铁铵NH Fe ( SO ) 与Na CO、Na SO 的反应,
4 4 2 2 3 2 3
实验 试剂A 试剂B 现象
I 逐 滴 加 入 迅速产生大量红褐色沉淀和大
2mL 0.2 mol⋅L−1
量气泡:继续滴加,当气泡量明
0.3mol⋅L−1 Na CO
( ) 2 3
NH Fe SO 溶 液 显减少时,试管口的湿润红色
4 4 2
溶液
石蕊试纸开始逐渐变蓝
(pH=2.03)
II 逐 滴 加 入 溶液立即变棕红(无丁达尔现
2mL 0.2 mol⋅L−1
0.3mol⋅L−1 Na SO 象),继续滴加Na SO 溶液至
( ) 2 3 2 3
NH Fe SO 溶 液
4 4 2
溶液 过量,溶液依然为棕红色,放置
(pH=2.03) 两天无明显变化
已知:Fe3++HSO− Fe ( HSO )2+(棕红)
3 3
实验I中产生红褐色沉淀与大量气泡的离子方程式为_____________
(3)查阅资料:Fe3+可以氧化SO2−.针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验.
3
实验 试剂A 试剂B 现象
学科网(北京)股份有限公司III 逐 滴 加 入 溶液立即变棕红色,
2mL 0.2 mol⋅L−1
0.5mL 0.3mol⋅L−1 Na SO 溶 约 2 小时后,棕红色
( ) 2 3
Fe SO 溶 液
2 4 3 消失,检测到Fe2+
液
(pH=1.78)
IV 逐 滴 加 入 溶液立即变棕红色,
2mL 0.2 mol⋅L−1
0.5mL 0.3mol⋅L−1 Na SO 溶 约 5 小时后,棕红色
( ) 2 3
NH Fe SO 溶 液
4 4 2 消失,检测到Fe2+
液
(pH=2.03)
实验Ⅲ中Fe3+与SO2−反应生成Fe2+的离子方程式为______________
3
(4)针对实验Ⅲ、Ⅳ的现象差异、小组同学猜想,pH影响了Fe3+的氧化性成SO2−的还原性,并实施实验,
3
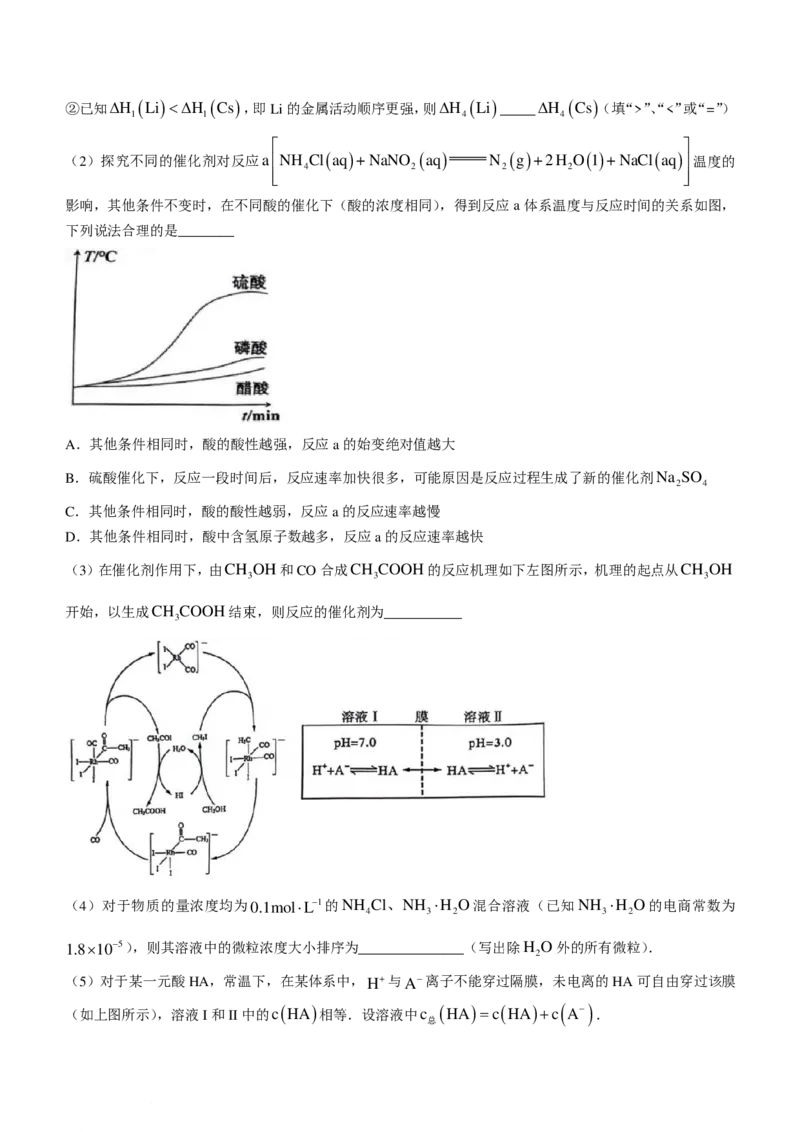
实验 实验装置 实验步骤及现象
V 一、按如图搭好装置,接通电路,电压表读数为0.6V
二、向a电极附近滴加3滴10%稀疏酸,电压表读数不变
三、向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。
查阅资料:其他条件不变时,氧化剂氧化性越强,电压越大;还原剂还原性越强,电压越大.
①a电极材料为_____________;b溶液为______________.
②结合上述查阅的资料和实验V的现象,小组同学推测,还原性:SO2− ____HSO−(填“>”、“<”或“=”).
3 3
③补充实验Ⅵ:向实验I得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速消失,检测到Fe2+.
结合实验I~V,请用化学平衡移动原理解释实验Ⅵ中氧化还原反应明显加快的可能原因____________
(5)综合以上实验,盐溶液间反应的多样性与微观粒子种类、试剂的相对用量、pH等有关.
19.(13分)(1)金属活动顺序的强弱可参照下式表示:M ( s ) M+( aq ) +e− ∆H
1
已知:M ( s ) M ( g ) ∆H (与沸点相关)
2
M ( g ) M+( g )+e− ∆H (第一电离能)
3
M+( g ) M+( aq ) ∆H (水合能)
4
①∆H =_______(用含ΔH 、ΔH 、ΔH 的式子表示)
1 2 3 4
学科网(北京)股份有限公司②已知∆H ( Li )<∆H ( Cs ) ,即Li的金属活动顺序更强,则∆H ( Li ) _____∆H ( Cs ) (填“>”、“<”或“=”)
1 1 4 4
( ) ( ) ( ) ( ) ( )
(2)探究不同的催化剂对反应aNH Cl aq +NaNO aq N g +2H O 1 +NaCl aq 温度的
4 2 2 2
影响,其他条件不变时,在不同酸的催化下(酸的浓度相同),得到反应 a体系温度与反应时间的关系如图,
下列说法合理的是________
A.其他条件相同时,酸的酸性越强,反应a的始变绝对值越大
B.硫酸催化下,反应一段时间后,反应速率加快很多,可能原因是反应过程生成了新的催化剂Na SO
2 4
C.其他条件相同时,酸的酸性越弱,反应a的反应速率越慢
D.其他条件相同时,酸中含氢原子数越多,反应a的反应速率越快
(3)在催化剂作用下,由CH OH和CO合成CH COOH的反应机理如下左图所示,机理的起点从CH OH
3 3 3
开始,以生成CH COOH结束,则反应的催化剂为___________
3
(4)对于物质的量浓度均为0.1mol⋅L−1的NH Cl、NH ⋅H O混合溶液(已知NH ⋅H O的电商常数为
4 3 2 3 2
1.8×10−5),则其溶液中的微粒浓度大小排序为_______________(写出除H O外的所有微粒).
2
(5)对于某一元酸HA,常温下,在某体系中,H+与A−离子不能穿过隔膜,未电离的HA可自由穿过该膜
(如上图所示),溶液I和II中的c
(
HA
)
相等.设溶液中c
(
HA
)=c (
HA
)+c ( A−)
.
总
学科网(北京)股份有限公司 c ( A−)
1
①溶液II中的HA的电离度 II 为 ,求K ( HA )=__________
c ( HA ) 101 a
II总
②将上图中的 HA 换为一元酸 HB(图中其他条件不变,HB 的电离常数为 K),则溶液 I 和 II 中的比值
c ( HB )
I总 为__________(用含K的式子表示)
( )
c HB
II总
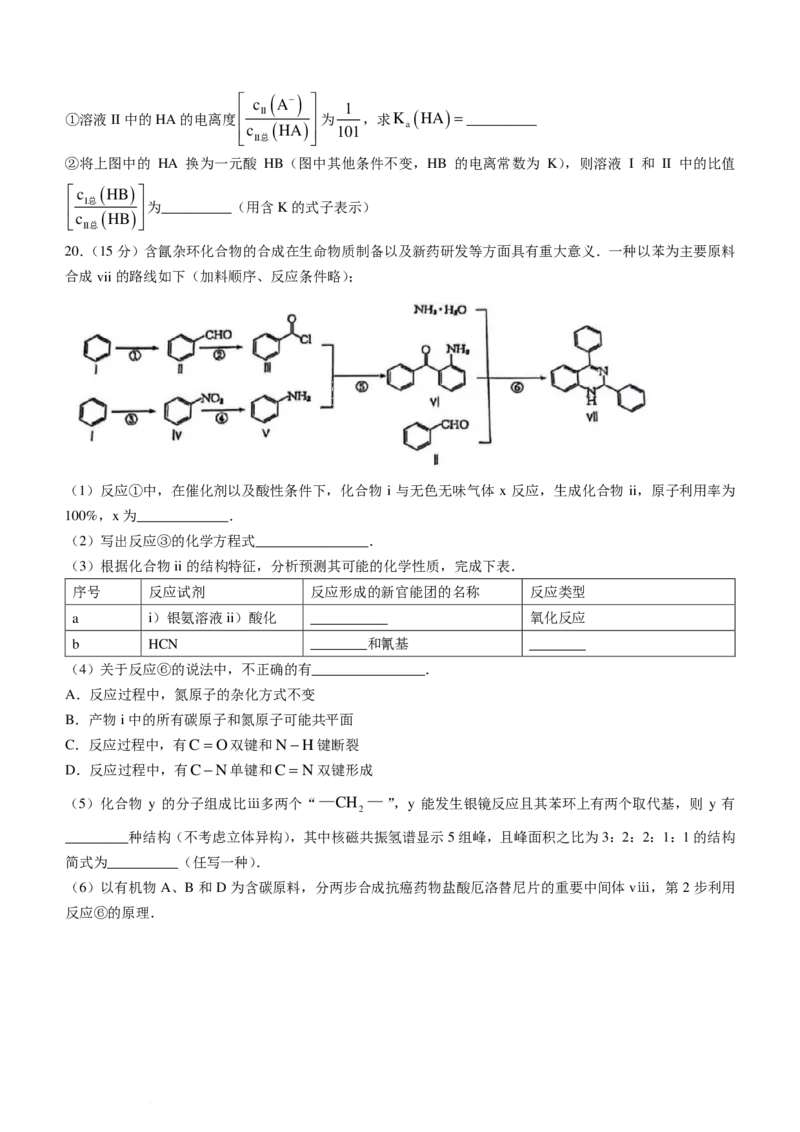
20.(15分)含氤杂环化合物的合成在生命物质制备以及新药研发等方面具有重大意义.一种以苯为主要原料
合成vii的路线如下(加料顺序、反应条件略);
(1)反应①中,在催化剂以及酸性条件下,化合物 i 与无色无味气体 x 反应,生成化合物 ii,原子利用率为
100%,x为_____________.
(2)写出反应③的化学方程式________________.
(3)根据化合物ii的结构特征,分析预测其可能的化学性质,完成下表.
序号 反应试剂 反应形成的新官能团的名称 反应类型
a i)银氨溶液ii)酸化 ___________ 氧化反应
b HCN ________和氰基 ________
(4)关于反应⑥的说法中,不正确的有________________.
A.反应过程中,氮原子的杂化方式不变
B.产物i中的所有碳原子和氮原子可能共平面
C.反应过程中,有C=O双键和N−H键断裂
D.反应过程中,有C−N单键和C= N双键形成
(5)化合物 y 的分子组成比ⅲ多两个“—CH —”,y 能发生银镜反应且其苯环上有两个取代基,则 y 有
2
_________种结构(不考虑立体异构),其中核磁共振氢谱显示5组峰,且峰面积之比为3:2:2:1:1的结构
简式为__________(任写一种).
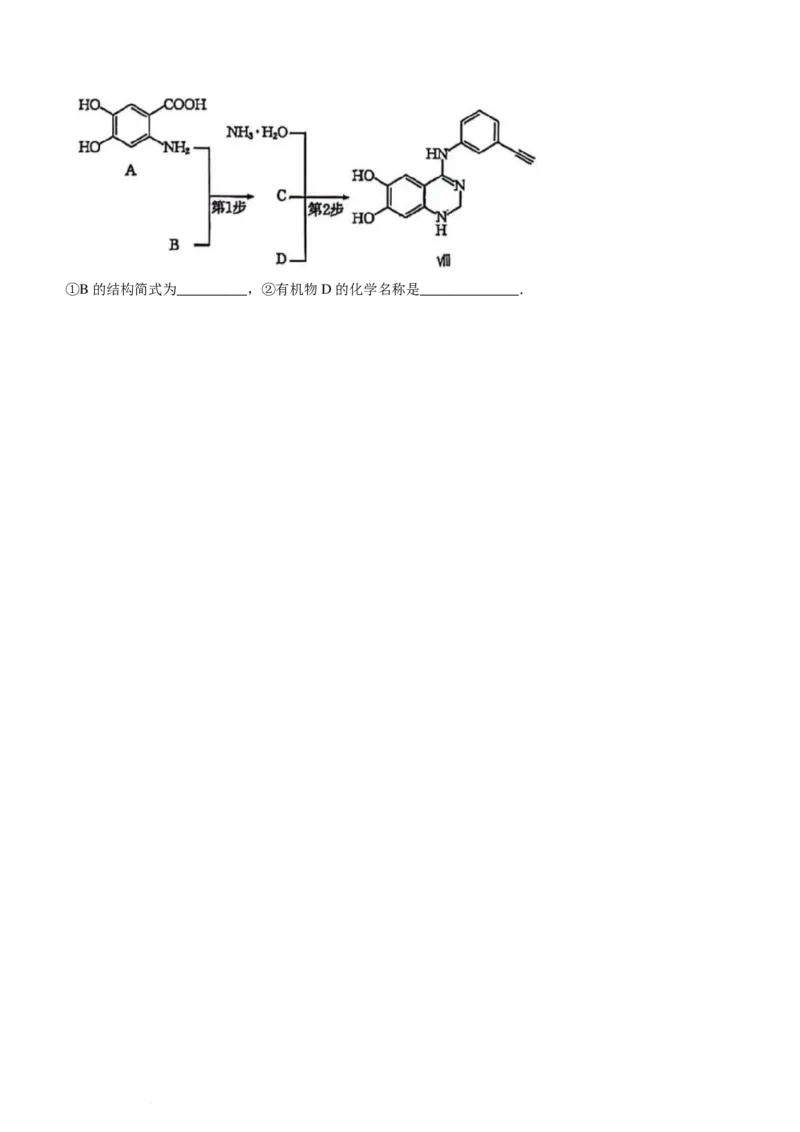
(6)以有机物A、B和D为含碳原料,分两步合成抗癌药物盐酸厄洛替尼片的重要中间体vⅲ,第2步利用
反应⑥的原理.
学科网(北京)股份有限公司①B的结构简式为__________,②有机物D的化学名称是______________.
学科网(北京)股份有限公司华附、省实、广雅、深中 2022 级高二下学期四校联考
化学参考答案及评分标准
一、单项选择题(本题共 16小题,第 1~10 小题每小题 2分,第 11~16题每小题 4分,共 44分。)
1 2 3 4 5 6 7 8
C D A D B D C A
9 10 11 12 13 14 15 16
D D C A B C D D
二、非选择题(本部分包括 4小题,共 56分。)
17 (14分)
(1)3 d54s1 (1分) (2)B(1分) (3)C(1分);12(1分)
(4)sp3(1分);小于(1分);正四面体形(1分);O>Cl>S(2分)
(5)烯丙醇分子之间能形成分子间氢键(2分)
1 1 25 3×1024
(6)1, , (1分); (2分)
2 2 2a2×N
A
18. (14分)
(1)硫酸(1分),AD(2分)
(2)2Fe3+ + 3CO
3
2-+ 3H
2
O=2Fe(OH)
3
↓+ 3CO
2
↑(2分)
(3)2Fe3+ + H
2
O+ SO
3
2-== 2Fe2+ + SO
4
2-+ 2H+(2分)
(4)① 石墨(1分);0.3 mol∙L-1 Na
2
SO
3
溶液(1分) ②>(2分)
③加入 滴 稀硫酸,H+与 反应使 降低(1分),从而使平衡 逆移
− − 3+ − 2+
3 10% HSO3 c(HSO3) Fe +HSO3 ⇌[Fe(HSO3)]
(1分), 增大(1分), 与 价硫化合物的氧化还原反应速率加快。(3分)
3+ 3+
19.
(13分c)(F e ) Fe +4
(1)①∆H 2 +∆H 3 +∆H 4(1分) ②<(2分)
(2)C(2分)
(3)HI(1分)、 (1分)
学科网(北京)股份有限公司(4)c(NH
4
+)>c(Cl-)>c(NH
3
∙H
2
O)>c(OH-)>c(H+)(2分)
(5)①1×10-5 (2分) ② (2分)
7
10 K+1
3
20.(15分) 10 K+1
(1)CO(1分)
(2) (2分)
(3)
序号 反应试剂 反应形成的新官能团的名称 反应类型
a 羧基
b 羟基 加成反应
(3分,每空各1分)
(4)AB(2分)
(5)18(2分) (任写一个得2分)
(6)① (2分) ②甲醛(1分)
学科网(北京)股份有限公司