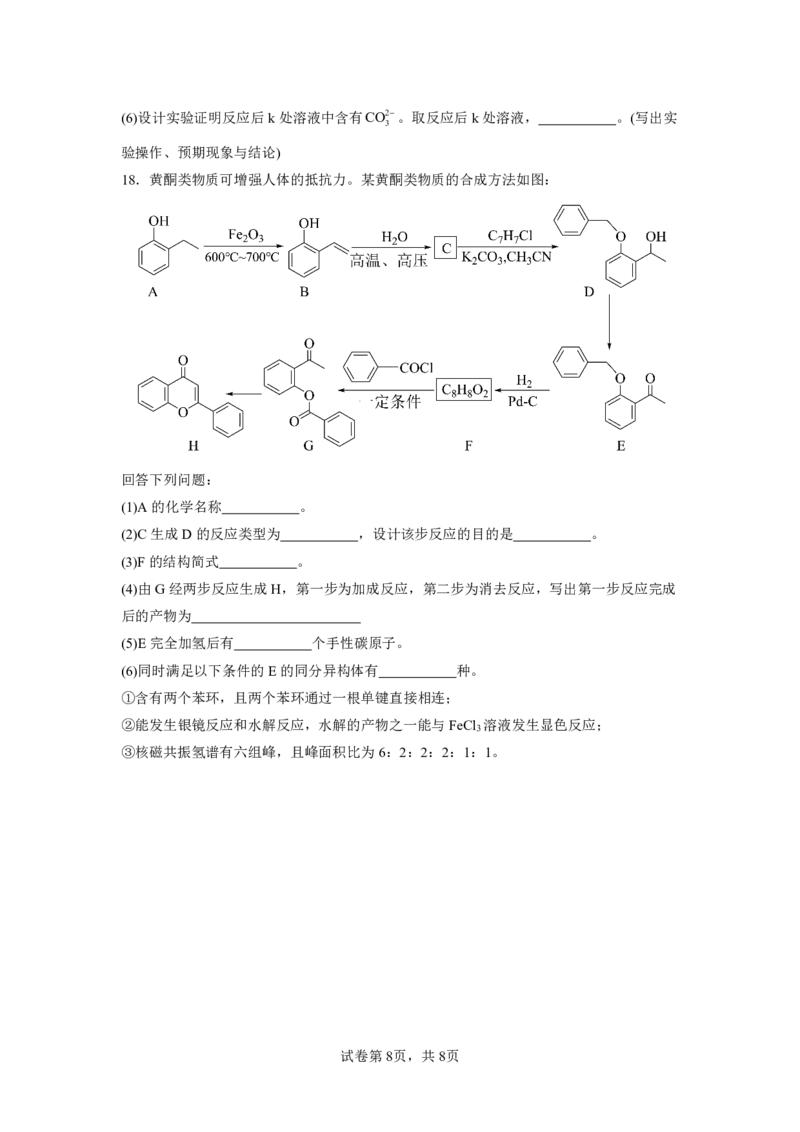文档内容
成都外国语学校 2024—2025 学年度(上)第一学月考试
化学试卷
注意事项:
1、本试卷分Ⅰ卷(选择题)和Ⅱ卷(非选择题)两部分。
2、本堂考试75分钟,满分100分。
3、答题前,考生务必先将自己的姓名、学号填写在答卷上,并使用2B铅笔填涂。
4、考试结束后,将答题卡交回。
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Mg-24 Ta-181
第Ⅰ卷(选择题,共 42 分)
1.三星堆历史文化广受大众关注和喜欢。近年来,一种由纯金、铜、银组成的合金,由于
能呈现出玫瑰的颜色,因此被称作玫瑰金,与传统黄金相比,其含金量只有75%。下列关
于说法不正确的是
A.青铜是使用最早的合金,主要成分是铜锡合金
B.可用稀硝酸鉴别玫瑰金和纯金
C.玫瑰金的硬度比黄金大,熔、沸点比黄金高
D.将玫瑰金投入硝酸银溶液中,有银析出
2. 下列有关化学用语的叙述正确的是
A. NH 的结构式为 B. 肼的电子式:
3
C. 简单硫离子的结构示意图为 D. SO 的VSEPR模型:
2
3. 设N 为阿伏加德罗常数的值,下列叙述正确的是
A
A. 标准状况下,11.2LNH 与11.2LHF均含有5N 个质子
3 A
B.2.4gMg与足量稀硝酸完全反应可生成0.1molH
2
C.2.0g H 18O与D 16O混合物中所含中子数小于N
2 2 A
D. 常温常压下,71gCl 溶于水中,转移电子数目小于N
2 A
4. 下列叙述正确的是
A. 常温下浓硫酸分别与Fe、Cu反应,生成的气体相同
B. 取两份新制氯水,分别滴加AgNO 溶液和淀粉KI溶液,前者有白色沉淀,后者溶液变
3
蓝色,说明氯气与水的反应存在限度
试卷第1页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}C. 等质量的Na O 分别与足量CO 、SO 反应,转移的电子数不同
2 2 2 2
D. 冶炼金属Mg和Al,电解熔融物的类别都属于盐酸盐
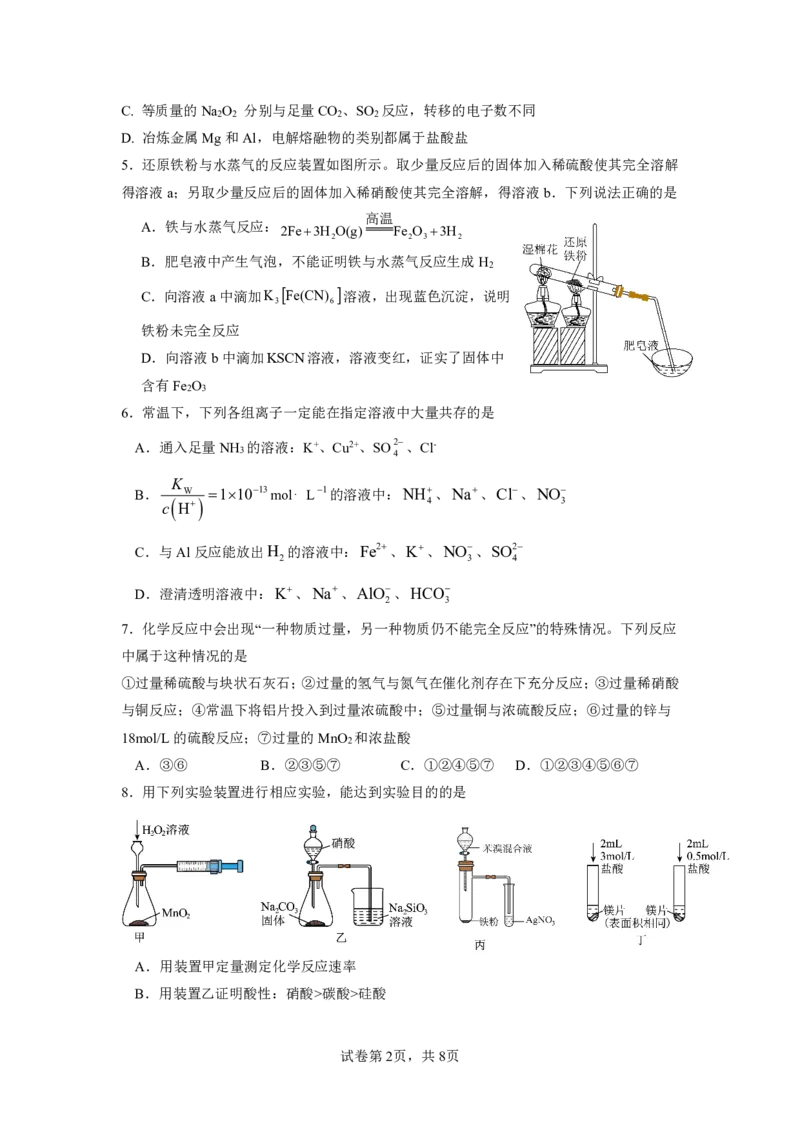
5.还原铁粉与水蒸气的反应装置如图所示。取少量反应后的固体加入稀硫酸使其完全溶解
得溶液a;另取少量反应后的固体加入稀硝酸使其完全溶解,得溶液b.下列说法正确的是
高温
A.铁与水蒸气反应:
2Fe3H O(g) Fe O 3H
2 2 3 2
B.肥皂液中产生气泡,不能证明铁与水蒸气反应生成H
2
C.向溶液a中滴加K Fe(CN) 溶液,出现蓝色沉淀,说明
3 6
铁粉未完全反应
D.向溶液b中滴加KSCN溶液,溶液变红,证实了固体中
含有Fe O
2 3
6.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.通入足量NH 的溶液:K+、Cu2+、SO 2、Cl-
3 4
K
B. W 11013mol⋅ L 1的溶液中:NH、Na、Cl、NO
c
H 4 3
C.与Al反应能放出H 的溶液中:Fe2、K、NO、SO2
2 3 4
D.澄清透明溶液中:K、Na、AlO、HCO
2 3
7.化学反应中会出现“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应
中属于这种情况的是
①过量稀硫酸与块状石灰石;②过量的氢气与氮气在催化剂存在下充分反应;③过量稀硝酸
与铜反应;④常温下将铝片投入到过量浓硫酸中;⑤过量铜与浓硫酸反应;⑥过量的锌与
18mol/L的硫酸反应;⑦过量的MnO 和浓盐酸
2
A.③⑥ B.②③⑤⑦ C.①②④⑤⑦ D.①②③④⑤⑥⑦
8.用下列实验装置进行相应实验,能达到实验目的的是
A.用装置甲定量测定化学反应速率
B.用装置乙证明酸性:硝酸>碳酸>硅酸
试卷第2页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}C.用装置丙验证苯与液溴反应为取代反应
D.用装置丁探究化学反应速率的影响因素
9.700℃时,向容积为2L的密闭容器中充入一定量的CO(g)和H O(g),发生反应
2
CO(g)+H O(g) ⇌ CO (g)+H (g),部分数据见表:
2 2 2
反应时间/min n(CO)/mol n(H O)/mol
2
0 1.20 0.60
t 0.80
1
t 0.20
2
下列说法正确的是
0.40
A.反应在t min内的平均速率为v(H )= mol•L-1•min-1
1 2 t
1
B.温度升至800℃,则正反应速率加快,逆反应速率减慢
C.反应在t min时未达到平衡
1
D.反应在t min时,H O的转化率约为66.7%
2 2
10.下列离子方程式书写正确的是
HCO Ba2 OH BaCO H O
A.足量碳酸氢钠与少量氢氧化钡溶液反应: 3 3 2
B.将SO 通入漂白粉溶液中:SO +H O+Ca2++2ClO-=CaSO ↓+2HClO
2 2 2 3
C.铝放入氢氧化钠溶液中:2Al2OH 6H O2 Al(OH) 3H
2 4 2
D.用稀硝酸溶解铜:Cu2NO 4H Cu2 2NO 2H O
3 2 2
11. 已知电对的标准电极电势(Eϴ)越高,其电对中氧化剂的氧化性越强。现有4组电对的标
准电极电势:①Eθ(PbO /PbSO )=+1.69V;②Eθ(MnO/Mn2+)=+1.51V;
2 4 4
③E(θ Fe3+/Fe2+)=+0.77V;④E(θ Cl /Cl-)=+1.36V。下列有关说法正确的是
2
A. 溶液中浓度均为1mol/L的Fe3+和Cl-可发生反应:2Fe3++2Cl-=2Fe2++Cl
2
B. 酸化高锰酸钾时既可以用硫酸也可以用盐酸
C.PbO 与酸性MnSO 反应的离子方程式:
2 4
5PbO +2Mn2++4H++5SO2=5PbSO +2MnO+2H O
2 4 4 4 2
D. 向含2molFeCl 的溶液中加1molPbO 可观察到黄绿色气体产生
2 2
试卷第3页,共8页
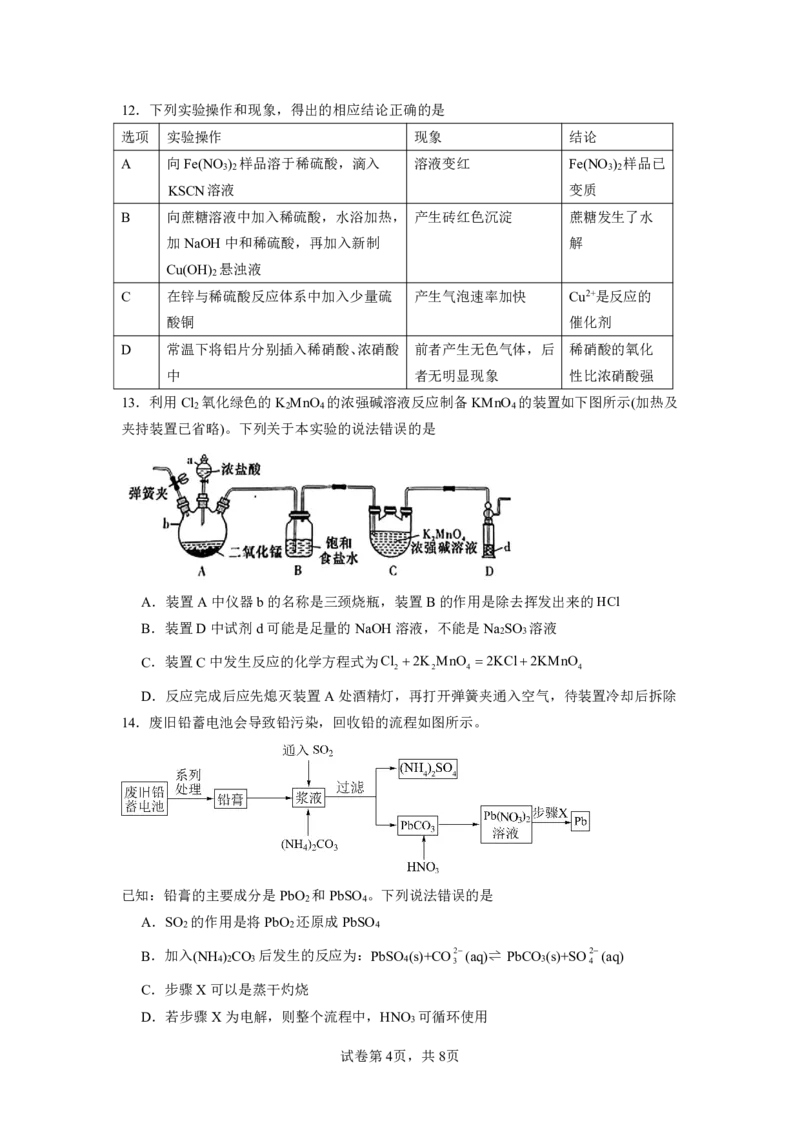
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}12.下列实验操作和现象,得出的相应结论正确的是
选项 实验操作 现象 结论
A 向Fe(NO ) 样品溶于稀硫酸,滴入 溶液变红 Fe(NO ) 样品已
3 2 3 2
KSCN溶液 变质
B 向蔗糖溶液中加入稀硫酸,水浴加热, 产生砖红色沉淀 蔗糖发生了水
加NaOH中和稀硫酸,再加入新制 解
Cu(OH) 悬浊液
2
C 在锌与稀硫酸反应体系中加入少量硫 产生气泡速率加快 Cu2+是反应的
酸铜 催化剂
D 常温下将铝片分别插入稀硝酸、浓硝酸 前者产生无色气体,后 稀硝酸的氧化
中 者无明显现象 性比浓硝酸强
13.利用Cl 氧化绿色的K MnO 的浓强碱溶液反应制备KMnO 的装置如下图所示(加热及
2 2 4 4
夹持装置已省略)。下列关于本实验的说法错误的是
A.装置A中仪器b的名称是三颈烧瓶,装置B的作用是除去挥发出来的HCl
B.装置D中试剂d可能是足量的NaOH溶液,不能是Na SO 溶液
2 3
C.装置C中发生反应的化学方程式为Cl 2K MnO 2KCl2KMnO
2 2 4 4
D.反应完成后应先熄灭装置A处酒精灯,再打开弹簧夹通入空气,待装置冷却后拆除
14.废旧铅蓄电池会导致铅污染,回收铅的流程如图所示。
已知:铅膏的主要成分是PbO 和PbSO 。下列说法错误的是
2 4
A.SO 的作用是将PbO 还原成PbSO
2 2 4
B.加入(NH ) CO 后发生的反应为:PbSO (s)+CO2(aq) ⇌ PbCO (s)+SO2 (aq)
4 2 3 4 3 3 4
C.步骤X可以是蒸干灼烧
D.若步骤X为电解,则整个流程中,HNO 可循环使用
3
试卷第4页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}第Ⅱ卷(非选择题,共 58 分)
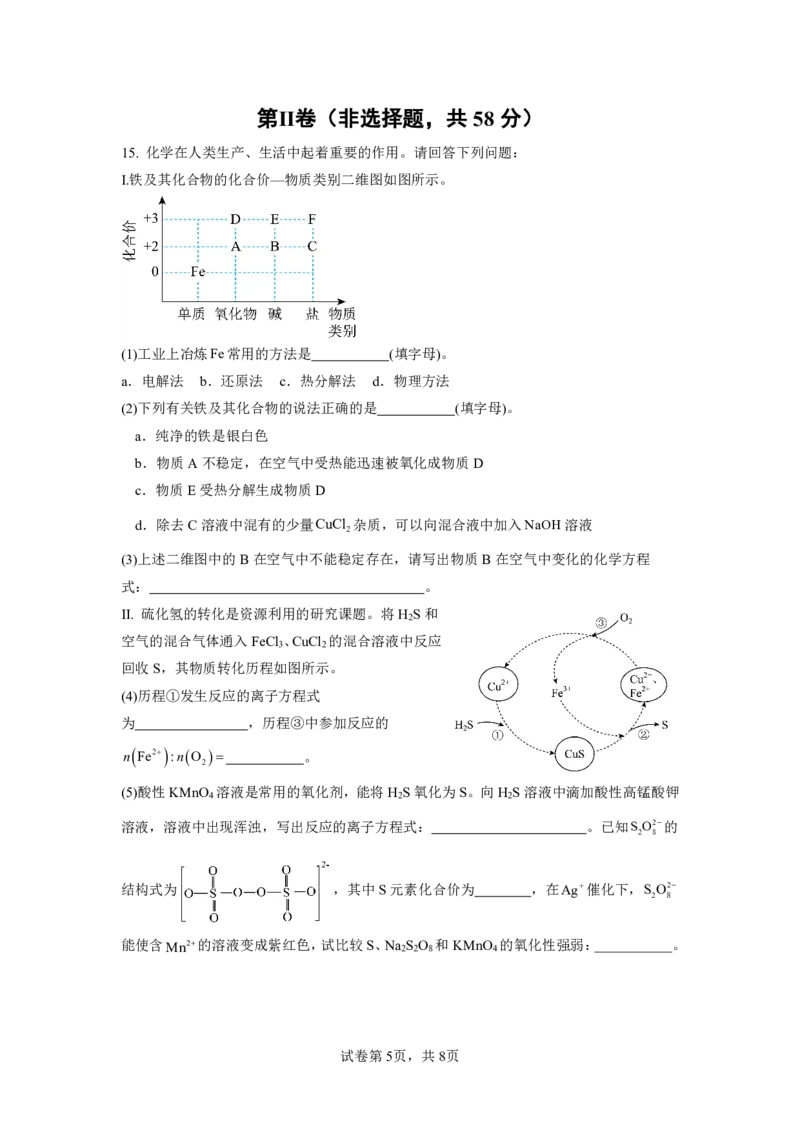
15. 化学在人类生产、生活中起着重要的作用。请回答下列问题:
Ⅰ.铁及其化合物的化合价—物质类别二维图如图所示。
(1)工业上冶炼Fe常用的方法是 (填字母)。
a.电解法 b.还原法 c.热分解法 d.物理方法
(2)下列有关铁及其化合物的说法正确的是 (填字母)。
a.纯净的铁是银白色
b.物质A不稳定,在空气中受热能迅速被氧化成物质D
c.物质E受热分解生成物质D
d.除去C溶液中混有的少量CuCl 杂质,可以向混合液中加入NaOH溶液
2
(3)上述二维图中的B在空气中不能稳定存在,请写出物质B在空气中变化的化学方程
式: 。
Ⅱ. 硫化氢的转化是资源利用的研究课题。将H S和
2
空气的混合气体通入FeCl 、CuCl 的混合溶液中反应
3 2
回收S,其物质转化历程如图所示。
(4)历程①发生反应的离子方程式
为 ,历程③中参加反应的
n Fe2 :nO 。
2
(5)酸性KMnO 溶液是常用的氧化剂,能将H S氧化为S。向H S溶液中滴加酸性高锰酸钾
4 2 2
溶液,溶液中出现浑浊,写出反应的离子方程式: 。已知S O2的
2 8
结构式为 ,其中S元素化合价为 ,在Ag催化下,S O2
2 8
能使含Mn2的溶液变成紫红色,试比较S、Na
2
S
2
O
8
和KMnO
4
的氧化性强弱: 。
试卷第5页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}Ⅲ.三星堆出土的金面具等金制品揭示了人类古文明对黄金
的使用。
金的化学性质很稳定,单独用浓盐酸或浓硝酸均不能将金
溶解,但将浓硝酸与浓盐酸按体积比1:3配制成王水,则可
以溶解金,发生的反应如下:
AuHNO 4HClH AuCl NO2H O。
3 4 2
(6)王水溶金过程中,硝酸的作用是 。
(7)H
AuCl
可用Zn粉还原,完成“沉金”。1mol
H
AuCl
被Zn完全还原时,消耗Zn的物
4 4
质的量是 mol。
16.钽酸锂(LiTaO )是一种功能材料。一种以钽渣(主要成分是Ta O FeO,含少量杂质油
3 2 3
脂和Al O 等)为原料制备钽酸锂的流程如下:
2 3
已知:+5价Ta具有氧化性;常温下,K
sp
AlOH
3
1.01033。
请回答下列问题:
(1)“焙烧”在沸腾炉中进行,常采用“逆流操作”,即在沸腾炉中上部填入固体原料,在下部通
入空气,这样操作的目的是 。
(2)列举固体1的一种用途: ;灼烧固体2得到新的固体,则新固体的化学式
为 。
(3)“焙烧”中发生的主要反应的化学方程式为 。
(4)“沉钽”中,如果用盐酸替代硫酸,会发生副反应,反应过程中1mol NaTaO 得到2mol
3
电子生成Ta3,写出该副反应的离子方程式: 。气体
Y可用于 阶段循环利用。
(5)“沉铝”中,c Al3 1.0105molL1表明已完全沉淀。为了使AlOH 完全沉淀,pH至
3
少为 (保留2位有效数字)。
(6)质量为mt的含Ta废渣中Ta的质量分数为,按上述流程制备得到akg LiTaO ,LiTaO
3 3
的产率为 %。
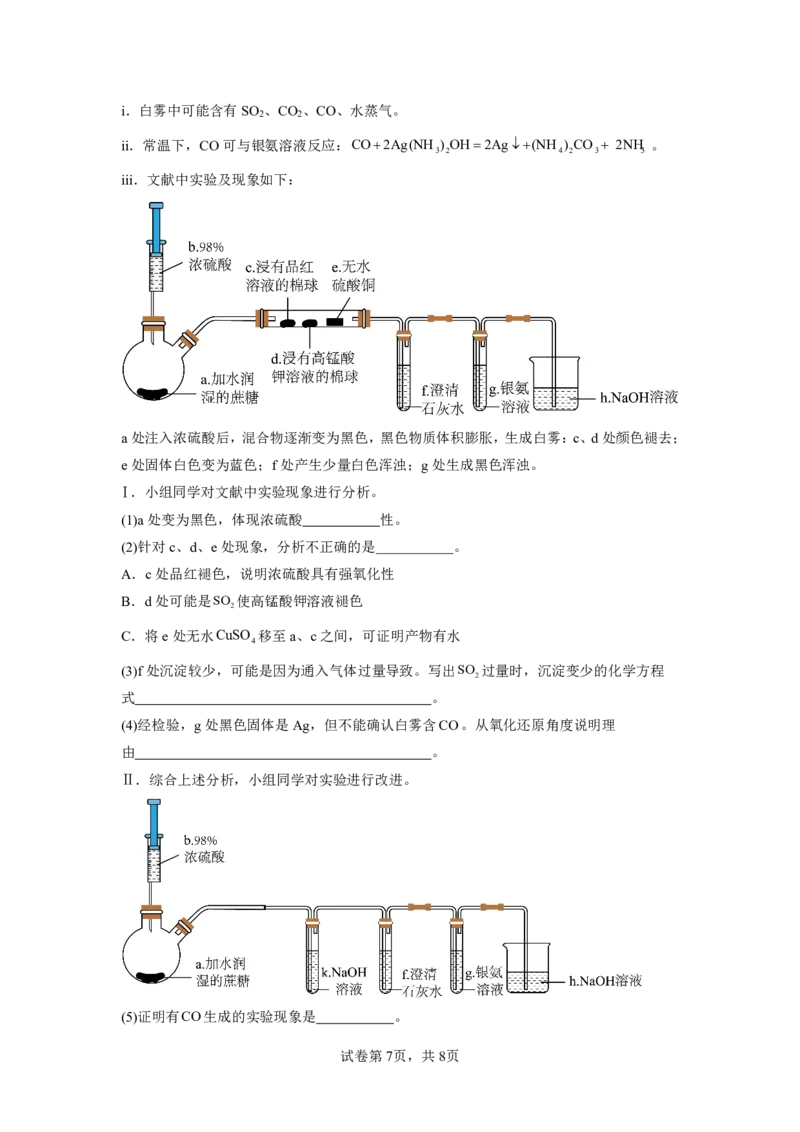
17.蔗糖与浓硫酸发生反应时有白雾产生。某化学小组对其成分进行探究。
查阅资料:
试卷第6页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}i.白雾中可能含有SO 、CO 、CO、水蒸气。
2 2
ii.常温下,CO可与银氨溶液反应:CO2Ag(NH ) OH2Ag(NH ) CO 2NH 。
3 2 4 2 3 3
iii.文献中实验及现象如下:
a处注入浓硫酸后,混合物逐渐变为黑色,黑色物质体积膨胀,生成白雾:c、d处颜色褪去;
e处固体白色变为蓝色;f处产生少量白色浑浊;g处生成黑色浑浊。
Ⅰ.小组同学对文献中实验现象进行分析。
(1)a处变为黑色,体现浓硫酸 性。
(2)针对c、d、e处现象,分析不正确的是 。
A.c处品红褪色,说明浓硫酸具有强氧化性
B.d处可能是SO 使高锰酸钾溶液褪色
2
C.将e处无水CuSO 移至a、c之间,可证明产物有水
4
(3)f处沉淀较少,可能是因为通入气体过量导致。写出SO 过量时,沉淀变少的化学方程
2
式 。
(4)经检验,g处黑色固体是Ag,但不能确认白雾含CO。从氧化还原角度说明理
由 。
Ⅱ.综合上述分析,小组同学对实验进行改进。
(5)证明有CO生成的实验现象是 。
试卷第7页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}(6)设计实验证明反应后k处溶液中含有CO2。取反应后k处溶液, 。(写出实
3
验操作、预期现象与结论)
18.黄酮类物质可增强人体的抵抗力。某黄酮类物质的合成方法如图:
回答下列问题:
(1)A的化学名称 。
(2)C生成D的反应类型为 ,设计该步反应的目的是 。
(3)F的结构简式 。
(4)由G经两步反应生成H,第一步为加成反应,第二步为消去反应,写出第一步反应完成
后的产物为
(5)E完全加氢后有 个手性碳原子。
(6)同时满足以下条件的E的同分异构体有 种。
①含有两个苯环,且两个苯环通过一根单键直接相连;
②能发生银镜反应和水解反应,水解的产物之一能与FeCl 溶液发生显色反应;
3
③核磁共振氢谱有六组峰,且峰面积比为6:2:2:2:1:1。
试卷第8页,共8页
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}成都外国语学校 2024—2025 学年度(上)第一学月考试
化学答案
一、选择题(共42分)
题号 1 2 3 4 5 6 7
选项 C A D C B B C
题号 8 9 10 11 12 13 14
选项 D D C C B B C
二、填空题(共58分)
15、(1)b (2)ac (3)4Fe(OH) +O +2H O=4Fe(OH)
2 2 2 3
(4)H S+Cu2+=CuS↓+2H+ 4:1
2
(5) 5H 2 S+2MnO- 4 +6H+=2Mn2++5S+8H 2 O +6 Na 2 S 2 O 8 >KMnO 4 >S
(6) 作氧化剂 (7)1.5
16、(1)增大固气接触面积,增大反应速率 (2)制造红色颜料、炼铁等 Al O
2 3
焙烧
4Ta O FeO4Na CO 5O 8NaTaO 2Fe O 4CO
2 3 2 3 2 3 2 3 2
(3)
181a
(4) TaO 3 6H 2Cl Ta3 Cl 2 3H 2 O 沉铝 (5)4.7 (6)2360m
CaSO +SO +H O=Ca(HSO )
17、(1)脱水 (2)C (3) 3 2 2 3 2
(4)g处黑色固体是Ag,说明银氨溶液发生还原反应,二氧化硫具有还原性,所以不能确认
白雾含CO
(5)f处澄清石灰水不变浑浊,g处产生黑色固体
(6)加入足量盐酸,反应生成的气体依次通过足量高锰酸钾溶液、澄清石灰水,高锰酸钾溶
液没有完全褪色、澄清石灰水变浑浊,证明k处溶液中含有CO 2-(或加入足量稀硝酸,将
3
生成的气体通入澄清石灰水,澄清石灰水变浑浊,证明k处溶液中含有CO 2-)
3
18、(1)2-乙基苯酚(或邻乙基苯酚) (2)取代反应 保护酚羟基,防止被氧化
(3) (4)
(5)3 (6)4
{#{QQABQQ6AggCgApBAAAhCUwUqCAGQkACACQgGQBAIsAAAyBFABCA=}#}