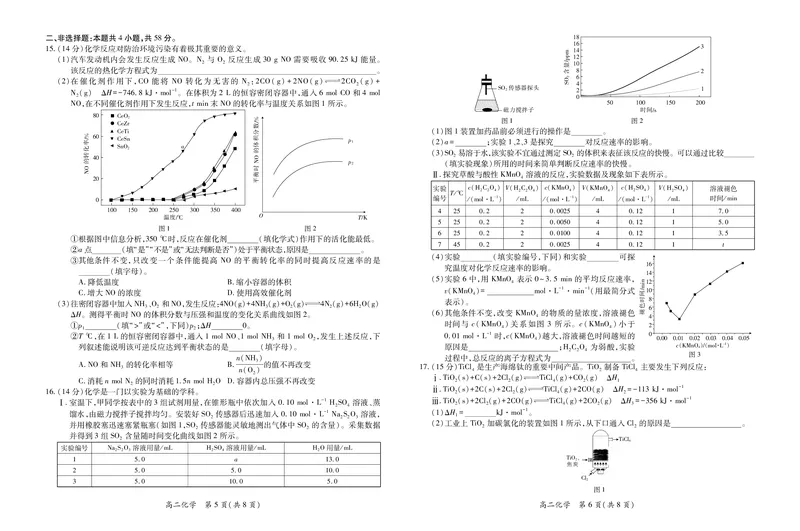
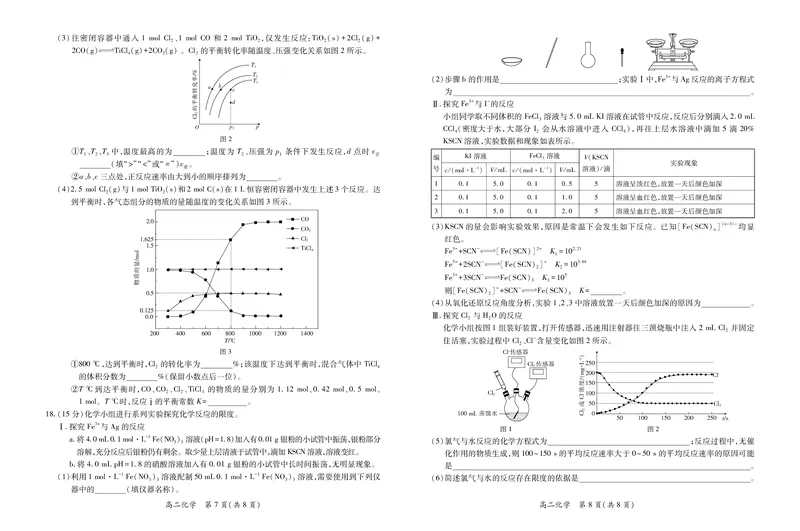
文档内容
绝密★启用前 4.利用下列装置进行实验,其中能到达实验目的的是
!"$%
#
江西 2025—2026学年高二年级 10月阶段检测
!"#
!"#
$%
化 学 试 卷
A.用浓硫酸代替稀硫酸加快生成H 的反应速率 B.实验室制备并收集NH
2 3
- ") $%& "’(!)*& - ") &3 "’(!)*&
!"#$% 1./ !" 4./ !"
试卷共8页,18小题,满分100分。考试用时75分钟。 ! 2 - 5
注意事项: &’(
)*
1.考查范围:选择性必修1第一章和第二章第一节、第二节。
! "# $%& "’(!)*&+,./ !"
2.答卷前,考生务必将自己的姓名、准考证号等填写在答题卡指定位置上。 - - 0
C.探究稀盐酸与锌粒反应的热效应 D.探究浓度对化学反应速率的影响
3.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改
5.往烧杯中加入10g碳酸氢钠固体、10g柠檬酸及少量蒸馏水,搅拌,体系温度随时间变化曲线如
动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
图所示。下列关于该反应的说法正确的是
上无效。
4.考生必须保持答题卡的整洁。考试结束后,请将答题卡交回。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Ag—108
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.月饼是中秋佳节必不可少的美食。下列月饼制作过程的主要目的是减小反应速率的是 !"!"
A.熟绿豆制作豆沙馅 B.月饼印花 C.分散烘烤 D.阴凉干燥处保存
2.CH(g)+4NO(g)幑幐2N(g)+CO(g)+2HO(g)在不同条件下的反应速率如下,其中表示反应速
4 2 2 2
率最快的是
A.v(CH)=10mol·L-1·min-1
4
B.v(NO)=2mol·L-1·s-1
C.v(N)=2mol·L-1·min-1
2
D.v(CO)=2mol·L-1·min-1
2
3.下列事实不能用勒夏特列原理解释的是
A.工业上用熔融的 Na和熔融的 KCl反应制备 K:Na(l)+KCl(l)幑幐NaCl(l)+K(g)
B.工业合成氨时一般采用的压强为10MPa~30MPa
C.天热时,打开冰镇可乐瓶盖产生大量泡沫
D.实验室不能用铁桶盛装 CuSO 溶液
4
高二化学 第1页(共8页) 高二化学 第2页(共8页)
书书书
!!$#
#$
%&
%$
&
$
&$ %$$ %&$
’&
A.为放热反应
B.正反应的活化能大于逆反应的活化能
C.反应物的总能量大于生成物的总能量
D.反应过程中能量变化趋势和生石灰与 HO反应的能量变化趋势相同
2
1
6.1000℃时,往密闭容器中通入 10molHS,发生反应:HS(g)幑幐H(g)+ S(g) ΔH=
2 2 2 2 2
+90.45kJ·mol-1。下列说法正确的是
A.充分反应后,混合气体的物质的量为15mol
B.到达平衡时,降低温度,混合气体总物质的量会增大
n(H)
2
C.反应体系中, 的值始终为2
n(S)
2
D.平衡时,v=v=0
正 逆
7.劳动是人类生存的基石。下列劳动过程对应的化学知识正确且有关联的是
选项 劳动过程 化学知识
A 野炊时,往柴火堆中鼓入空气 空气中的O 具有可燃性
2
B 酿酒时,在合适的温度下添加酒曲发酵 酒曲在合适的温度下具有催化作用
C 煤炭工对煤炭进行脱硫处理 脱硫后的煤炭燃烧效率更高
D 利用铝与氧化铁反应焊接铁轨 铝的熔点低8.软脂酸[CH(CH) COOH(s)]和蔗糖[C H O (s)]的燃烧热分别为 ΔH=-9977kJ·mol-1、
3 2 14 12 22 11 1
ΔH=-5641kJ·mol-1。下列说法错误的是
2
A.在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热
B.表示 CH(CH) COOH(s)燃烧热的热化学方程式为 CH(CH) COOH(s)+23O(g)
3 2 14 3 2 14 2
16CO(g)+16HO(l) ΔH=-9977kJ·mol-1
2 2 1
C.C H O (s)完全燃烧生成6molCO(g)和5.5molHO(l),放出的热量为2820.5kJ
12 22 11 2 2
D.相同物质的量的软脂酸和蔗糖完全燃烧,蔗糖释放的热量更多
9.利用如图装置测定 H+(aq)+OH-(aq)HO(l)的 ΔH。每次用
2 !
50mL0.5mol·L-1盐酸和50mL0.55mol·L-1NaOH溶液进行反应,重 *+,
复实验多次,测得反应前后温度差的平均值为3.2℃。已知反应后溶液的 !"
比热容 c=4.18J·g-1·℃-1,盐酸与 NaOH溶液的密度近似为 1g·cm-3, %&
且忽略由反应引起的体积变化。下列说法正确的是 ’() #$
A.仪器 a为金属搅拌器
B.实验过程中,若盐酸和NaOH溶液少量多次混合,则测得的ΔH会偏小
C.该实验测得的 ΔH≈-53.5kJ·mol-1
D.将 NaOH溶液与盐酸混合后,立即测混合液的温度,该温度为反应前的初始温度
10.下列陈述Ⅰ与陈述Ⅱ均正确,且两者间具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
压缩封装有NO 和NO 混合气体的注射器,增大压强,2NO(g)幑幐NO(g)平衡正向移动,最终平
A 2 2 4 2 2 4
混合气体的颜色先变深又逐渐变浅 衡时的c(NO)大于未压缩时的c(NO)
2 2
B Fe与稀硫酸反应,溶液变为棕黄色 2Fe+6H+2Fe3++3H↑
2
C 浓硝酸保存在棕色试剂瓶中 浓硝酸具有强氧化性
D 反应物的浓度增大,化学反应速率增大 浓度增大,活化分子百分数增多,有效碰撞次数增多
11.HCOOH脱氢制备 H 具有巨大的经济价值。在不同的催化剂作用下,HCOOH脱氢部分反应历
2
程如图所示,TS表示过渡态物质,表示物质吸附在催化剂表面。下列说法错误的是
$&’()*+,-*.,$
/01
$&’()*
102
101
’102
’/01
’/02
’301
!"#$%%# #$%%#!
反应历程
高二化学 第3页(共8页) 高二化学 第4页(共8页)
54+量能对相
#
$
%
&
’
(&
()
($
(*
!!"
!10=/"
!10>="
:
!’10/3"
!’103="
!’10/<"
!’10;<"
6 !’10