文档内容
静海一中2024-2025第一学期高三化学(10月)
学生学业能力调研试卷
命题人:杜文华 审题人:杜书梅
考生注意:
本试卷分第Ⅰ卷基础题(80分)和第Ⅱ卷提高题(17分)两部分,共97分。
3分卷面分,满分100分。
知 识 与 技 能 学习能力(学法)
内容 物质分类 化学计量 氧化还原 离子反应 易混易错 方法归纳 学习习惯
分数 9 18 24 23 10 8 8
可能用到的相对原子质量:H:1 O:16 C:12 Na:23 Cl:35.5 Fe:56 Cu:64 S:32
第Ⅰ卷 基础题(共80分)
一、选择题: (每小题只有一个选项符合题意,每小题3分,共36分)
1.(化学与生活)广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫
茶艺和香云纱染整技艺等。下列说法不正确的是
A.广东剪纸的裁剪过程不涉及化学变化
B.冲泡工夫茶时茶香四溢,体现了分子是运动的
C.制作粤绣所用的植物纤维布含有天然高分子化合物
D.染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
2.(物质分类)下列物质的分类组合正确的是
碱 酸 盐 碱性氧化物 电解质 3 .
A 石灰水 HSO NaOH Al O 食盐 ( 物
2 4 2 3
质 的
B NaOH HCl CaCO CaO HO
3 2
量 浓
Cu (OH) CO
2 2
C NaHSO HSO MnO FeSO ·7H O 度 计
4 2 4 2 7 4 2
3
算 )
D 纯碱 HNO CaF NaO 铁粉
3 2 2 2 下 列
叙述正确的是
A.将5.85 g NaCl晶体溶入100 mL水中,制得1 mol·L-1NaCl溶液
B.将25 g无水CuSO 溶于水配制成100 mL溶液,其浓度为1 mol·L-1
4
C.将1体积c mol·L-1硫酸用水稀释为5体积,得到0.2c mol·L-1硫酸
D.将w g a% NaCl溶液蒸发掉w/2 g水(无晶体析出),得到4a% NaCl溶液
4.LiAlH 与水发生反应:LiAlH +2HO===LiAlO +4H↑。下列说法正确的是
4 4 2 2 2
A.LiAlH 既是氧化剂又是还原剂 B.H 既是氧化产物又是还原产物
4 2
C.若生成4.48 L H ,转移0.2 mol电子 D.还原剂与氧化剂的物质的量之比为2:1
2
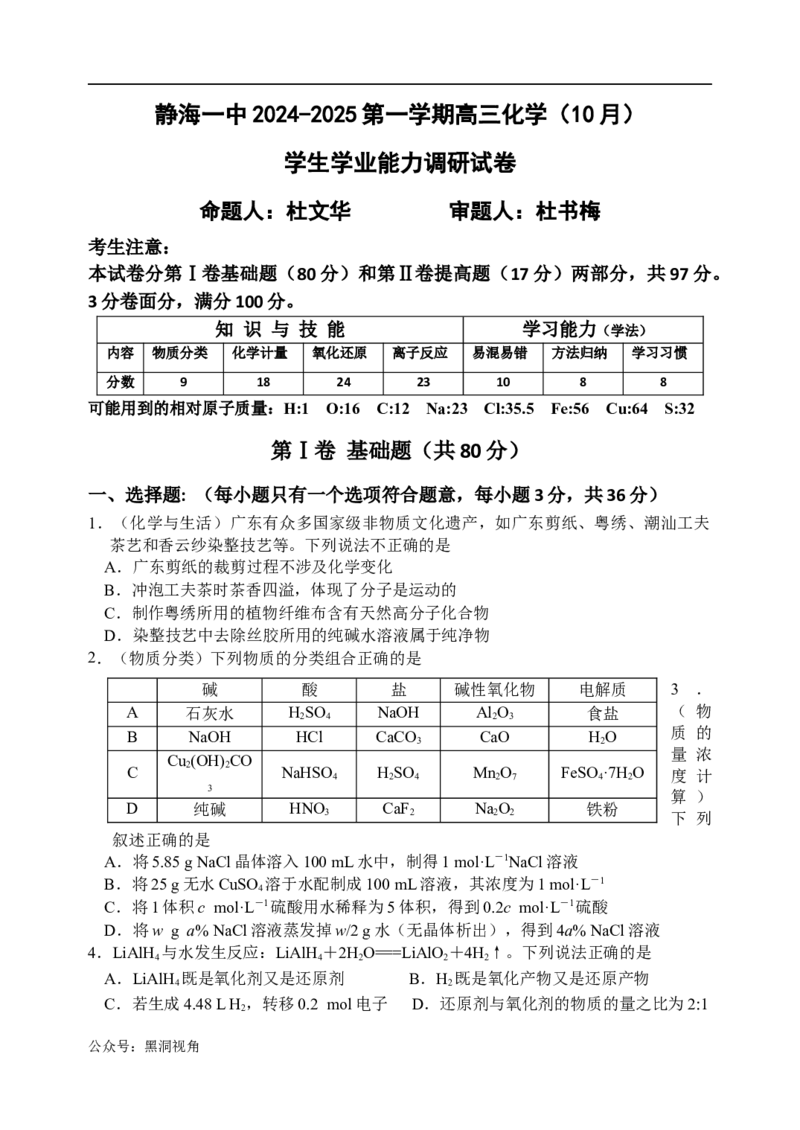
公众号:黑洞视角5.(基本实验操作)下列实验操作规范的是
A.用于制备氢氧 B.配制50.0 mL 0.1000 C.钾的焰色 D.溶液的
化铁胶体 mol·L-1 NaCO 溶液 试验 转移
2 3
6.(有关N 的计算)设N 为阿伏加德罗常数的值,下列说法正确的是
A A
A.标准状况下,2.24 L CHOH含有的分子数为0.1N
3 A
B.在反应KIO +6HI===KI+3I+3HO中,每生成3mol I 转移的电子数为6N
3 2 2 2 A
C.等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2N
A
D.质量为39g 的NaO 和NaS混合物中含有的离子数目均为1.5N
2 2 2 A
7.(离子共存和离子方程式)下列各组澄清溶液中离子能大量共存,且滴入X试剂后
发生反应的离子方程式书写正确的是
离子组 X试剂 离子方程式
A NH、Fe3+、SO、Br- 过量HS 2Fe3++HS==2Fe2++S↓+2H+
2 2
B Fe2+、K+、NO、Cl- 少量HI 4H++3Fe2++NO==3Fe3++NO↑+2HO
2
C NH、Fe3+、AlO、Na+ 过量铜粉 Fe3++Cu == Fe2++Cu2+
D AlO、Na+、K+、HCO 少量HCl H++AlO+HO == Al(OH) ↓
2 3
8.(基本概念辨析)下列说法中不正确的是个数为
①纯碱、火碱、苛性钾都是属于强碱
②CO、SiO、NO、 MnO 均为酸性氧化物
2 2 2 2 7
③用玻璃棒蘸取少量某溶液进行焰色试验,火焰呈黄色,该溶液中一定含Na+
④强酸溶液的导电能力一定比弱酸强
⑤氯化铁溶液与氢氧化铁胶体具有的共同性质是:能透过滤纸
⑥盐酸、醋酸按顺序分类依次为强电解质、弱电解质
⑦标准状况下,22.4 mL水中含有的分子数目约为1.24N
A
⑧有化学键断裂或有化学键形成的过程一定是化学变化
A.5个 B.6个 C.7个 D.8个
9.(物质性质对比)类推思维是化学解题中常用的一种方法,下列“类推”合理的是
A.将Fe加入CuSO 溶液中可制得Cu,则将Na加入CuSO 溶液中也可制得Cu
4 4
B.向Ca(ClO) 溶液通入少量CO 反应生成CaCO 和HClO,则向Ca(ClO) 溶液通入
2 2 3 2
少量SO 反应生成CaSO 和HClO
2 3
C.向AlCl 溶液中加入少量NaOH溶液可制得Al(OH),则向AlCl 溶液中加入少量
3 3 3
氨水也可制得Al(OH)
3
D.向NaOH溶液中滴加少量AgNO 溶液反应生成Ag O和NaNO ,则向氨水中滴加
3 2 3
少量AgNO 溶液反应生成Ag O和NH NO
3 2 4 3
10.(离子推断及检验)某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、
⑤SO、⑥SO、⑦Fe2+中的几种离子,依次进行下列实验,且每步所加试剂均过量,
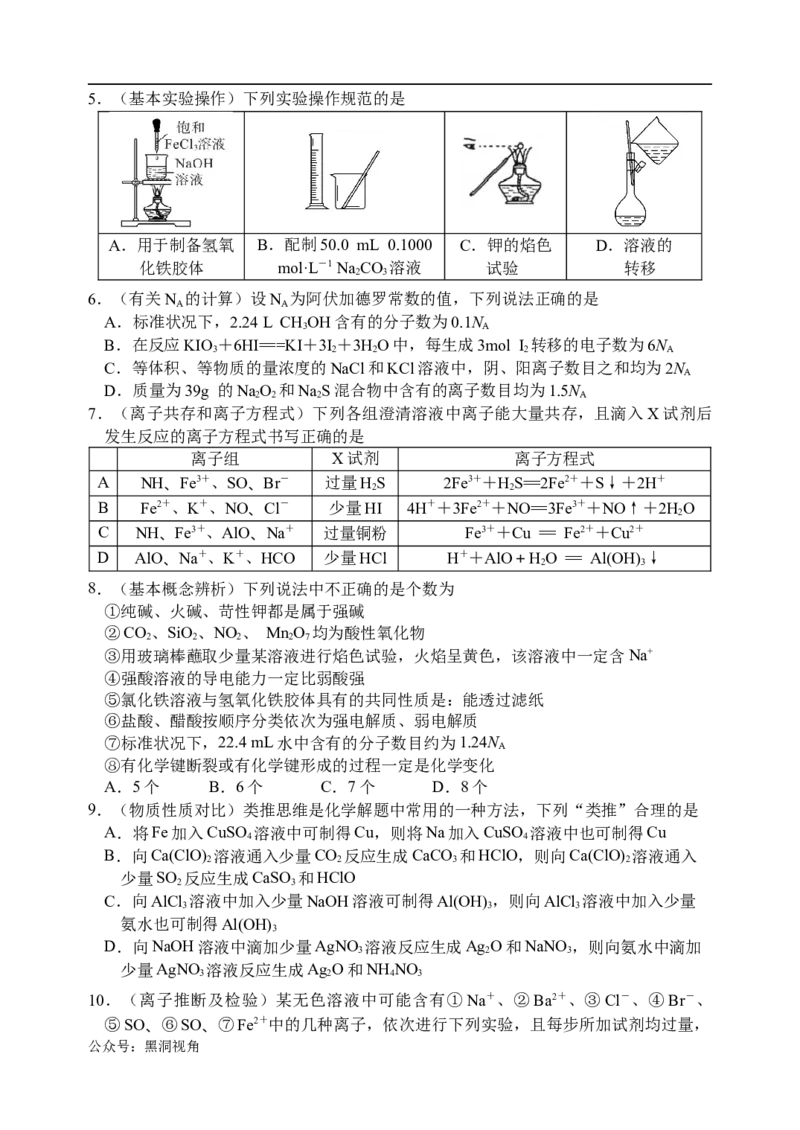
公众号:黑洞视角观察到的现象如下:
步骤 操作 现象
Ⅰ 用pH试纸检验 溶液的pH大于7
Ⅱ 向溶液中滴加氯水,再加入CCl ,振荡,静置 CCl 层呈橙红色
4 4
Ⅲ 取Ⅱ的上层溶液,加入Ba(NO ) 溶液和稀硝酸 有白色沉淀产生
3 2
Ⅳ 将Ⅲ过滤,向滤液中加入AgNO 溶液和稀硝酸 有白色沉淀产生
3
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑤⑦
C.可能含有的离子是①②⑥ D.不能确定的离子是①③⑥
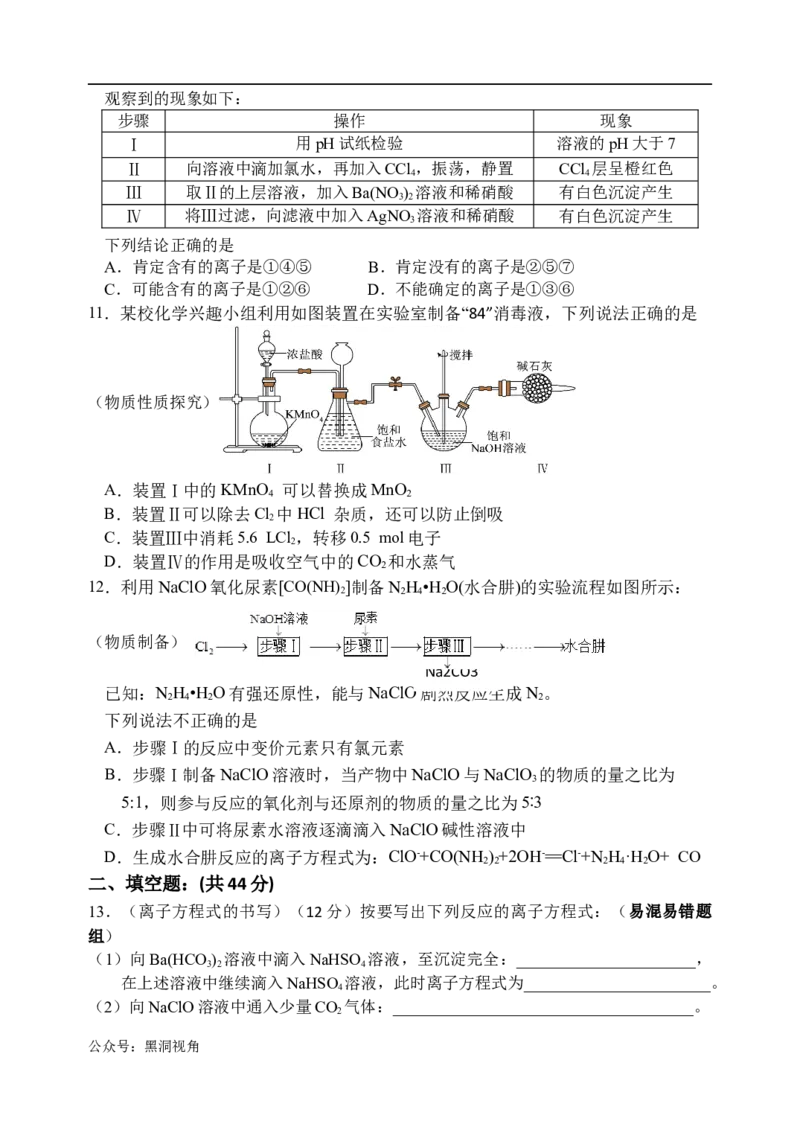
11.某校化学兴趣小组利用如图装置在实验室制备“84”消毒液,下列说法正确的是
(物质性质探究)
A.装置Ⅰ中的KMnO 可以替换成MnO
4 2
B.装置Ⅱ可以除去Cl 中HCl 杂质,还可以防止倒吸
2
C.装置Ⅲ中消耗5.6 LCl,转移0.5 mol电子
2
D.装置Ⅳ的作用是吸收空气中的CO 和水蒸气
2
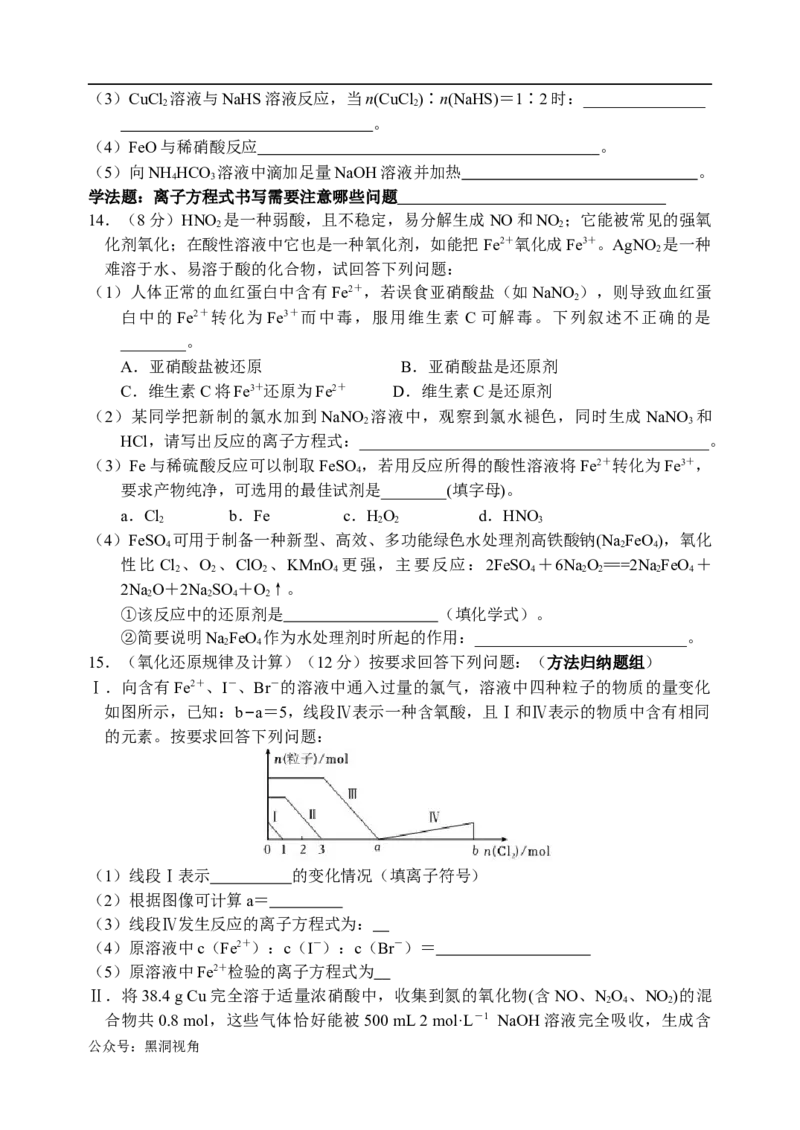
12.利用NaClO氧化尿素[CO(NH) ]制备N H •H O(水合肼)的实验流程如图所示:
2 2 4 2
(物质制备)
Na2CO3
已知:N H •H O有强还原性,能与NaClO剧烈反应生成N 。
2 4 2 2
下列说法不正确的是
A.步骤Ⅰ的反应中变价元素只有氯元素
B.步骤Ⅰ制备NaClO溶液时,当产物中NaClO与NaClO 的物质的量之比为
3
5:1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3
C.步骤Ⅱ中可将尿素水溶液逐滴滴入NaClO碱性溶液中
D.生成水合肼反应的离子方程式为:ClO-+CO(NH ) +2OH-==Cl-+N H ·H O+ CO
2 2 2 4 2
二、填空题:(共44分)
13.(离子方程式的书写)(12分)按要写出下列反应的离子方程式:(易混易错题
组)
(1)向Ba(HCO ) 溶液中滴入NaHSO 溶液,至沉淀完全:______________________,
3 2 4
在上述溶液中继续滴入NaHSO 溶液,此时离子方程式为_______________________。
4
(2)向NaClO溶液中通入少量CO 气体:_____________________________________。
2
公众号:黑洞视角(3)CuCl 溶液与NaHS溶液反应,当n(CuCl )∶n(NaHS)=1∶2时:_______________
2 2
。
(4)FeO与稀硝酸反应 。
(5)向NH HCO 溶液中滴加足量NaOH溶液并加热 。
4 3
学法题:离子方程式书写需要注意哪些问题
14.(8分)HNO 是一种弱酸,且不稳定,易分解生成NO和NO ;它能被常见的强氧
2 2
化剂氧化;在酸性溶液中它也是一种氧化剂,如能把 Fe2+氧化成Fe3+。AgNO 是一种
2
难溶于水、易溶于酸的化合物,试回答下列问题:
(1)人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐(如NaNO ),则导致血红蛋
2
白中的 Fe2+转化为 Fe3+而中毒,服用维生素 C 可解毒。下列叙述不正确的是
________。
A.亚硝酸盐被还原 B.亚硝酸盐是还原剂
C.维生素C将Fe3+还原为Fe2+ D.维生素C是还原剂
(2)某同学把新制的氯水加到NaNO 溶液中,观察到氯水褪色,同时生成NaNO 和
2 3
HCl,请写出反应的离子方程式:___________________________________________。
(3)Fe与稀硫酸反应可以制取FeSO ,若用反应所得的酸性溶液将Fe2+转化为Fe3+,
4
要求产物纯净,可选用的最佳试剂是________(填字母)。
a.Cl b.Fe c.HO d.HNO
2 2 2 3
(4)FeSO 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na FeO),氧化
4 2 4
性比 Cl 、O 、ClO 、KMnO 更强,主要反应:2FeSO +6NaO===2NaFeO +
2 2 2 4 4 2 2 2 4
2NaO+2NaSO +O↑。
2 2 4 2
①该反应中的还原剂是 (填化学式)。
②简要说明NaFeO 作为水处理剂时所起的作用:__________________________。
2 4
15.(氧化还原规律及计算)(12分)按要求回答下列问题:(方法归纳题组)
Ⅰ.向含有Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化
如图所示,已知:b−a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同
的元素。按要求回答下列问题:
(1)线段Ⅰ表示 的变化情况(填离子符号)
(2)根据图像可计算a=
(3)线段Ⅳ发生反应的离子方程式为:
(4)原溶液中c(Fe2+):c(I-):c(Br-)=
(5)原溶液中Fe2+检验的离子方程式为
Ⅱ.将38.4 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO 、NO )的混
2 4 2
合物共0.8 mol,这些气体恰好能被500 mL 2 mol·L-1 NaOH溶液完全吸收,生成含
公众号:黑洞视角NaNO 和NaNO 的盐溶液,其中NaNO 的物质的量为 mol
3 2 3
学法题:氧化还原反应计算的基本方法 。
16.(溶液配制及应用)(12分)“84 消毒液”能有效杀灭甲型 H1N1病毒,某同学
购买了一瓶“威露士”牌“84 消毒液”,该消毒液通常稀释 100 倍(体积比)使用。
查阅相关资料和消毒液包装说明得到如图1
(1)某同学取 100mL该“84消毒液”,按要求稀释后可用于消毒,则稀释后的溶液中
c(Na+)= 。
品名:84消毒液
有效成分:NaClO
相对分子质量:74.5
规格:1000 mL
密度:1.192 g·mL-1
质量分数:25%
图1
(2)如图2所示的仪器中使用前需要检查是否漏液的有 (填字母),仪器E的
名称为 。
(3)该同学参阅该“84 消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量
分数为25%的消毒液。下列说法中正确的是 (填字母)。
A.如图2所示的仪器中,有三种是不需要的,还另需要一种玻璃仪器
B.需要称量NaClO固体的质量为149.0g
C.将称量好的NaClO固体转入容量瓶中加水溶解
D.定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
(4)“84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 18.4
mol•L−1的浓硫酸配制500mL 2.3 mol•L−1的稀硫酸用于增强“84 消毒液”的消毒
能力,需取用浓硫酸的体积为 mL。
(5)在配制过程中,下列操作中能使所配溶液的浓度偏高的有 (填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的HSO 溶液冷却至室温就转移到容量瓶中
2 4
④转移前,容量瓶中含有少量蒸馏水
(6)现有密度为dg/mL 浓度为18 mol/L 的浓硫酸溶液100g,需要加入一定量的水将其
稀释为浓度是 9mol/L,则加入水的体积是 (填字母)
A.大于100 mL B.小于100mL C.等于100mL
第Ⅱ卷 提高题(共17分)
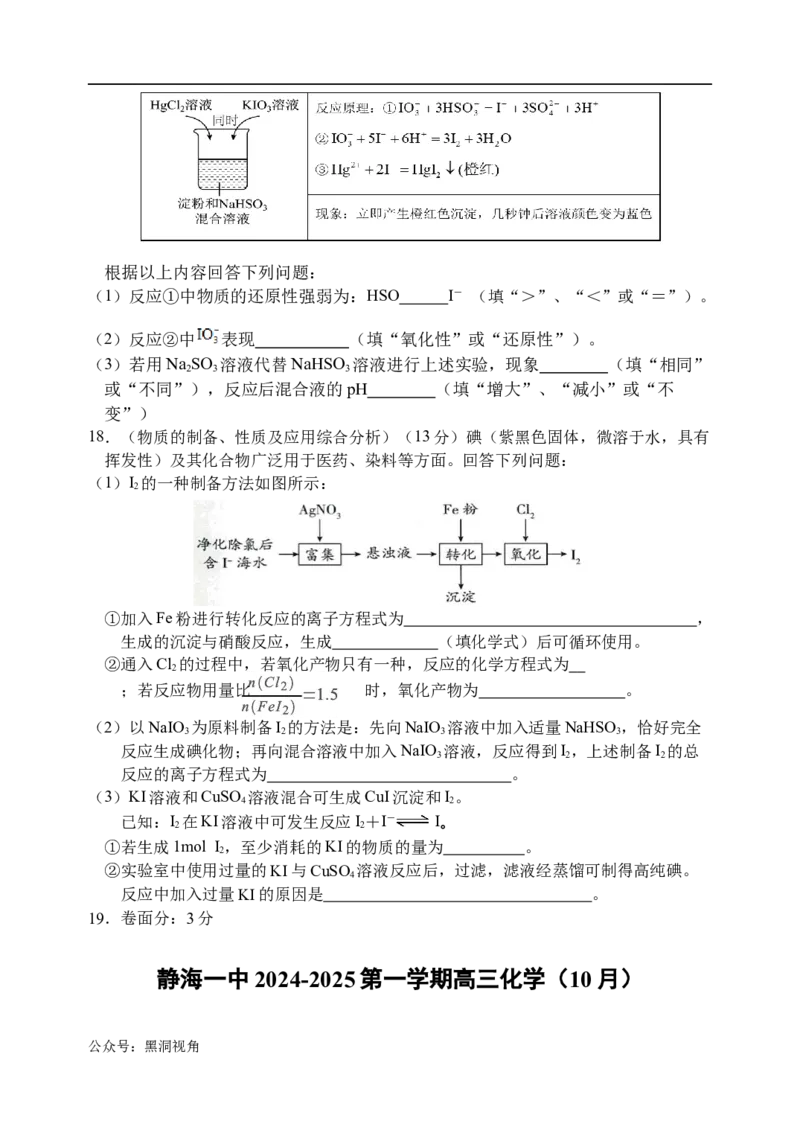
17.(氧化还原规律及应用)(4分)某同学进行如下兴趣实验:
公众号:黑洞视角根据以上内容回答下列问题:
(1)反应①中物质的还原性强弱为:HSO I- (填“>”、“<”或“=”)。
(2)反应②中 表现 (填“氧化性”或“还原性”)。
(3)若用Na SO 溶液代替NaHSO 溶液进行上述实验,现象 (填“相同”
2 3 3
或“不同”),反应后混合液的pH (填“增大”、“减小”或“不
变”)
18.(物质的制备、性质及应用综合分析)(13分)碘(紫黑色固体,微溶于水,具有
挥发性)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I 的一种制备方法如图所示:
2
①加入Fe粉进行转化反应的离子方程式为 ,
生成的沉淀与硝酸反应,生成 (填化学式)后可循环使用。
②通入Cl 的过程中,若氧化产物只有一种,反应的化学方程式为
2
;若反应物用量比 时,氧化产物为 。
(2)以NaIO 为原料制备I 的方法是:先向NaIO 溶液中加入适量NaHSO,恰好完全
3 2 3 3
反应生成碘化物;再向混合溶液中加入NaIO 溶液,反应得到I,上述制备I 的总
3 2 2
反应的离子方程式为 。
(3)KI溶液和CuSO 溶液混合可生成CuI沉淀和I。
4 2
已知:I 在KI溶液中可发生反应I+I- I。
2 2
①若生成1mol I,至少消耗的KI的物质的量为 。
2
②实验室中使用过量的KI与CuSO 溶液反应后,过滤,滤液经蒸馏可制得高纯碘。
4
反应中加入过量KI的原因是 。
19.卷面分:3分
静海一中2024-2025第一学期高三化学(10月)
公众号:黑洞视角学生学业能力调研试卷答题卡
第Ⅰ卷 基础题(共80分)
一、选择题: 每小题3分,共36分。
题号 1 2 3 4 5 6
答案
题号 7 8 9 10 11 12
答案
二、填空题:(共44分)
13.(12分)
(1) ,
(2)
(3)
(4)
(5)
【学法题】
14.(8分)
(1)________(2)___________________________________________
(3)________
(4)①
②
15.(12分)
Ⅰ.(1) (2)
(3)
公众号:黑洞视角(4)
(5)
Ⅱ.
【学法题】
16.(12分)
(1) (2) , (3)
(4) (5) (6)
第Ⅱ卷 提高题(共17分)
17.(4分)
(1) (2) (3) ,
18.(13分)
(1)① ,
② ;
(2)
(3)①
②
19.卷面分:3
静海一中2024-2025第一学期高三化学(10月)
学生学业能力调研试卷答案
第Ⅰ卷 基础题(共80分)
公众号:黑洞视角一、选择题: 每小题3分,共36分。
题号 1 2 3 4 5 6
答案 D B C A D D
题号 7 8 9 10 11 12
答案 A B C A B C
二、填空题:(共44分)
13.(12分)略。 学法题:略。
14.(8分)除标注1分外,其余各2分
(1)B (1分)
(2)Cl+NO -+HO ==NO -+2Cl-+2H+。
2 2 2 3
(3)C(1分)
(4)①FeSO 、NaO。
4 2 2
②高铁酸钠有强氧化性能杀菌消毒,产物Fe3+水解生成氢氧化铁胶体能吸附水中
悬浮杂质而沉降。
15.(12分)除标注1分外,其余各2分
Ⅰ.(1)I- (1分)
(2)6
(3)I+5Cl +6HO ==10 IO -+10Cl-+12H+。
2 2 2 3
(4)2:1:3
(5)Fe2++K++[Fe(CN) ]3-==KFe[Fe(CN) ]↓。
6 6
Ⅱ.0.4
学法题:略(1分)。
16.(12分)除标注1分外,其余各2分
(1)0.04 mol•L−1 (2)B E(1分)、容量瓶(1分) (3)B D (4)62.5
(5)②③ (6)B
第Ⅱ卷 提高题(共17分)
18.(4分)各1分
(1)> (2)氧化性 (3)不同 减小
18.(13分)各2分
(1)①Fe+2AgI==2Ag+Fe2++2I-, AgNO (1分)。
3
②Cl +FeI ==FeCl+I ; FeCl 和I 。
2 2 2 2 3 2
(2)2IO -+5HSO -== I +5SO+3H++HO。
3 3 2 2
(3)①4mol
②使Cu2+充分还原为CuI,防止I 结晶析出易于和CuI分离。
2
19.卷面分:3分
公众号:黑洞视角