文档内容
湖南师大附中 2025—2026 学年度高二第一学期第一次大练习
化 学
时量:75 分钟 满分:100 分
得分:________
可能用到的相对原子质量:H~1 Li~7 C~12 O~16
一、选择题(本题包括 14 小题,每小题 3 分,共 42 分。在每小题给出的四个
选项中,只有一项是符合题目要求的)
1.下列有关电解质、非电解质、强电解质、弱电解质的分类正确的是
选项 A B C D
电解质 Cu CO NaCl NaOH
2
非电解质 SO 乙醇 葡萄糖 NH
2 3
强电解质 HCl Ba(OH) HClO BaSO
2 4 4
弱电解质 CHCOOH HO Cu(OH) 氨水
3 2 2
2.下列说法正确的是
通电
A.一定温度下,反应 MgCl (l) Mg(l)+Cl(g)的ΔH>0,ΔS<0
2 2
B.凡是放热反应都是自发的,凡是吸热反应都是非自发的
C.凡是熵增的反应都是自发的,凡是熵减的反应都是非自发的
D.对于ΔH<0,ΔS>0 的反应,其在任何温度下都能自发进行
3.下列说法或表示正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
B.C(金刚石,s)===C(石墨,s) ΔH=-1.19 kJ/mol,所以石墨比金刚石更
稳定
C.已知:2H(g)+O(g)===2HO(g) ΔH=-483.6 kJ/mol,则 H 的燃烧热为
2 2 2 2
241.8 kJ/mol
D.HCl 和 NaOH 反应的中和热ΔH=-57.3 kJ/mol,则 HSO 和 Ca(OH) 反
2 4 2
应的反应热ΔH=2×(-57.3) kJ/mol
4.下列离子方程式或电离方程式书写正确的是
A.醋酸溶液与水垢中的碳酸钙发生反应:
CaCO +2H+===Ca2++HO+CO↑
3 2 2
B.将金属钠加入硫酸铜溶液中:2Na+Cu2+===Cu+2Na+
C.向澄清石灰水中滴入过量 NaHCO 溶液:
3
2HCO-3+Ca2++2OH-===CaCO ↓+2HO+CO2-3
3 2
D.NaHCO 在熔融状态下的电离方程式:
3
NaHCO ===Na++H++CO2-3
3
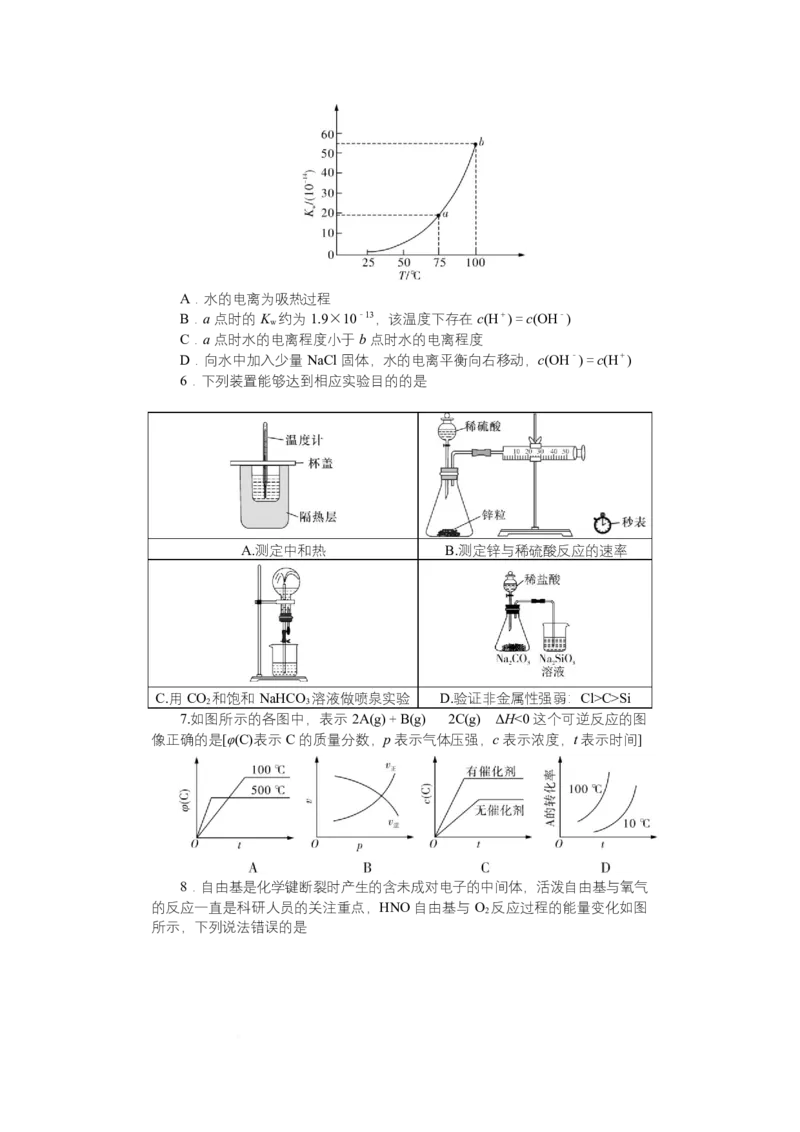
5.水的离子积常数 K 与温度的变化曲线如图所示。下列有关纯水的电离说
w
法错误的是A.水的电离为吸热过程
B.a 点时的 K 约为 1.9×10-13,该温度下存在 c(H+)=c(OH-)
w
C.a 点时水的电离程度小于 b 点时水的电离程度
D.向水中加入少量 NaCl 固体,水的电离平衡向右移动,c(OH-)=c(H+)
6.下列装置能够达到相应实验目的的是
A.测定中和热 B.测定锌与稀硫酸反应的速率
C.用 CO 和饱和 NaHCO 溶液做喷泉实验 D.验证非金属性强弱:Cl>C>Si
2 3
7.如图所示的各图中,表示 2A(g)+B(g)2C(g) ΔH<0 这个可逆反应的图
像正确的是[φ(C)表示 C 的质量分数,p 表示气体压强,c 表示浓度,t 表示时间]
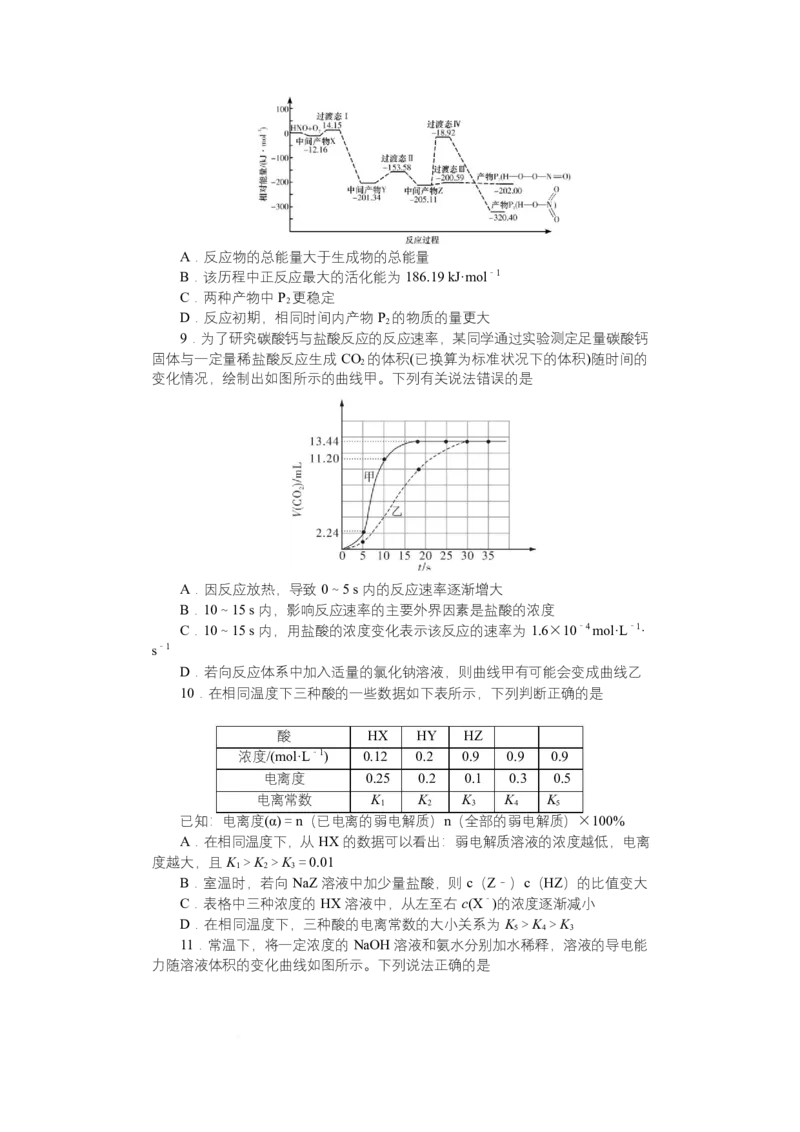
8.自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气
的反应一直是科研人员的关注重点,HNO 自由基与 O 反应过程的能量变化如图
2
所示,下列说法错误的是A.反应物的总能量大于生成物的总能量
B.该历程中正反应最大的活化能为 186.19 kJ·mol-1
C.两种产物中 P 更稳定
2
D.反应初期,相同时间内产物 P 的物质的量更大
2
9.为了研究碳酸钙与盐酸反应的反应速率,某同学通过实验测定足量碳酸钙
固体与一定量稀盐酸反应生成 CO 的体积(已换算为标准状况下的体积)随时间的
2
变化情况,绘制出如图所示的曲线甲。下列有关说法错误的是
A.因反应放热,导致 0~5 s 内的反应速率逐渐增大
B.10~15 s 内,影响反应速率的主要外界因素是盐酸的浓度
C.10~15 s 内,用盐酸的浓度变化表示该反应的速率为 1.6×10-4 mol·L-1·
s-1
D.若向反应体系中加入适量的氯化钠溶液,则曲线甲有可能会变成曲线乙
10.在相同温度下三种酸的一些数据如下表所示,下列判断正确的是
酸 HX HY HZ
浓度/(mol·L-1) 0.12 0.2 0.9 0.9 0.9
电离度 0.25 0.2 0.1 0.3 0.5
电离常数 K K K K K
1 2 3 4 5
已知:电离度(α)=n(已电离的弱电解质)n(全部的弱电解质)×100%
A.在相同温度下,从 HX 的数据可以看出:弱电解质溶液的浓度越低,电离
度越大,且 K >K >K =0.01
1 2 3
B.室温时,若向 NaZ 溶液中加少量盐酸,则 c(Z-)c(HZ)的比值变大
C.表格中三种浓度的 HX 溶液中,从左至右 c(X-)的浓度逐渐减小
D.在相同温度下,三种酸的电离常数的大小关系为 K >K >K
5 4 3
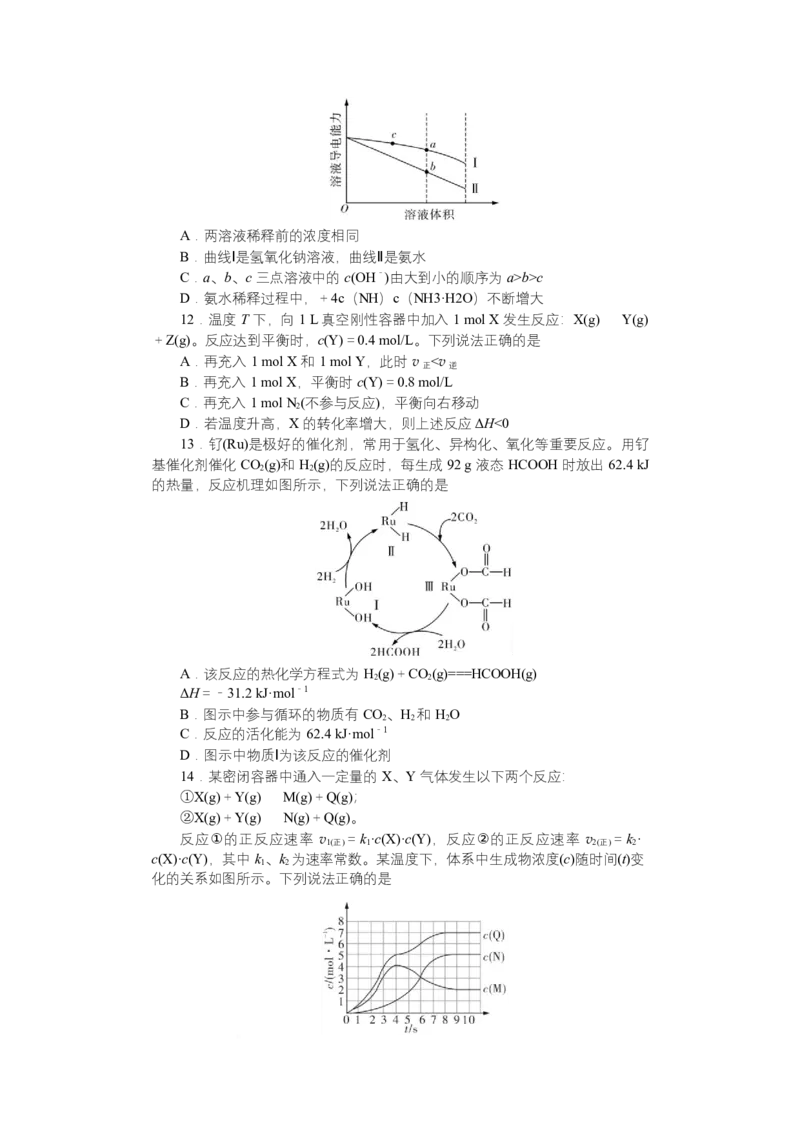
11.常温下,将一定浓度的 NaOH 溶液和氨水分别加水稀释,溶液的导电能
力随溶液体积的变化曲线如图所示。下列说法正确的是A.两溶液稀释前的浓度相同
B.曲线Ⅰ是氢氧化钠溶液,曲线Ⅱ是氨水
C.a、b、c 三点溶液中的 c(OH-)由大到小的顺序为 a>b>c
D.氨水稀释过程中,+4c(NH)c(NH3·H2O)不断增大
12.温度 T 下,向 1 L 真空刚性容器中加入 1 mol X 发生反应:X(g)Y(g)
+Z(g)。反应达到平衡时,c(Y)=0.4 mol/L。下列说法正确的是
A.再充入 1 mol X 和 1 mol Y,此时 v v
1(正) 2(逆)
C.当容器压强不变时,反应①、②均达到平衡状态
D.0~6 s 内,X 的平均反应速率 v(X)=0.5 mol·L-1·s-1
选择题答题卡
题 得
1 2 3 4 5 6 7 8 9 10 11 12 13 14
号 分
答
案
二、非选择题(本题共 4 个小题,共 58 分)
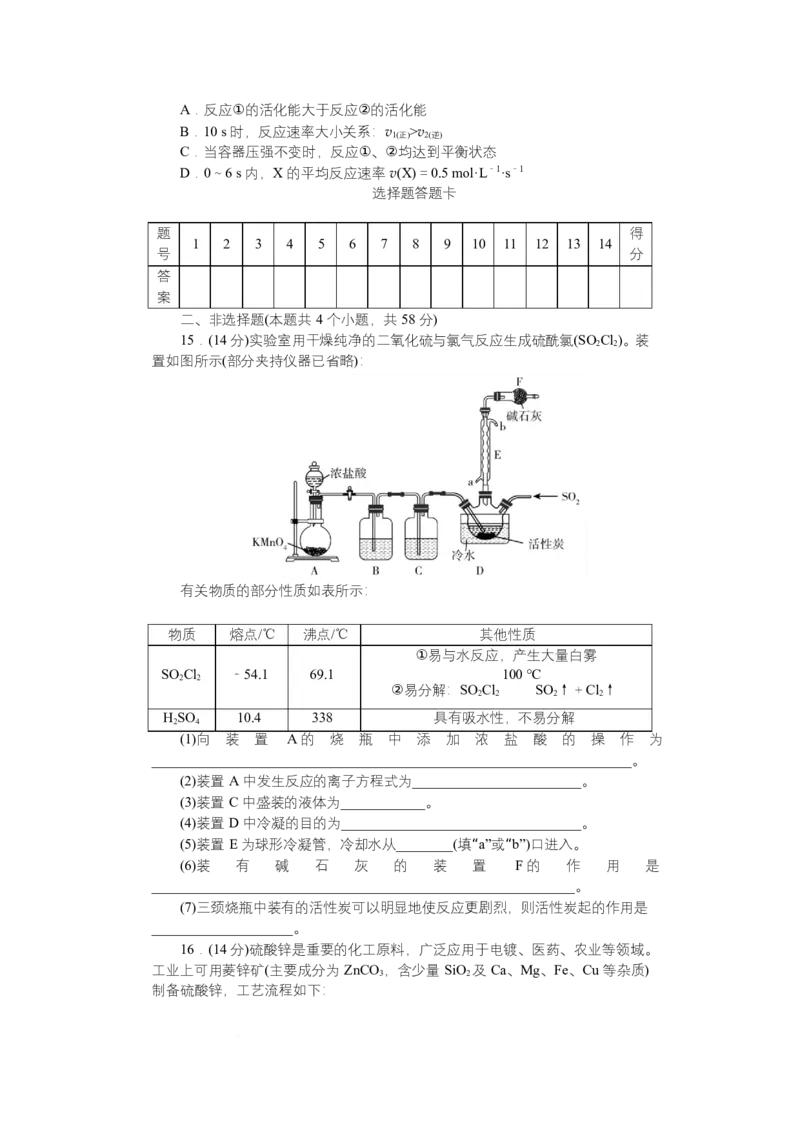
15.(14 分)实验室用干燥纯净的二氧化硫与氯气反应生成硫酰氯(SO Cl)。装
2 2
置如图所示(部分夹持仪器已省略):
有关物质的部分性质如表所示:
物质 熔点/℃ 沸点/℃ 其他性质
①易与水反应,产生大量白雾
SO Cl -54.1 69.1 100 ℃
2 2
②易分解:SO Cl SO ↑+Cl↑
2 2 2 2
HSO 10.4 338 具有吸水性,不易分解
2 4
(1)向 装 置 A 的 烧 瓶 中 添 加 浓 盐 酸 的 操 作 为
____________________________________________________________________。
(2)装置 A 中发生反应的离子方程式为________________________。
(3)装置 C 中盛装的液体为____________。
(4)装置 D 中冷凝的目的为__________________________________。
(5)装置 E 为球形冷凝管,冷却水从________(填“a”或“b”)口进入。
(6)装 有 碱 石 灰 的 装 置 F 的 作 用 是
____________________________________________________________。
(7)三颈烧瓶中装有的活性炭可以明显地使反应更剧烈,则活性炭起的作用是
____________________。
16.(14 分)硫酸锌是重要的化工原料,广泛应用于电镀、医药、农业等领域。
工业上可用菱锌矿(主要成分为 ZnCO ,含少量 SiO 及 Ca、Mg、Fe、Cu 等杂质)
3 2
制备硫酸锌,工艺流程如下:已知:pH=5 时,Fe(OH) 已沉淀完全。
3
回答下列问题:
(1)“焙烧”时,ZnCO 分解的化学方程式为______________________。
3
(2)为提高“浸取”效率,可采取的措施有__________________________(写出
一种)。
(3)调节 pH 时,若使用 NH ·H O 可能引入____________(填离子符号),导致
3 2
产品不纯,故工业上常选用____________[填“Ca(OH) ”或“NaOH”]调节 pH=5。
2
(4)除铁过程中,加入 KMnO 将 Fe2+氧化为 Fe(OH) ,同时生成 MnO 沉淀,
4 3 2
该反应的离子方程式为________________________。检验 Fe2+是否除尽的操作
为________________________。
(5)加入锌粉除杂时,主要除去的金属离子是____________(填化学式),反应
的离子方程式为____________________________。
17.(14 分)2025 年,我国新能源电车销量持续超越传统燃油车。
(1)二甲醚[CHOCH (g)]燃料电池的工作原理示意图如图所示(图中质子交换
3 3
膜只允许 H+通过)。
①该电池工作时,c 口通入的物质是________。
②该电池负极的电极反应式为____________________________。
③工作一段时间,当外电路有 6 mol 电子通过时,理论上负极区质量________
(填“增加”或“减少”)________g(忽略气体的溶解)。
(2)锂离子电池具有比能量大、用途广等特点。如图所示为一种锂离子电池的
结构,电池反应式为 Li
x
C
6
+Li
1-x
CoO
2
KN*放电充电 C
6
+LiCoO
2
(x<1)。
①放电时,b 极发生的电极反应式为______________________。②充电时,a 极接外电源的________极。
③充电时若转移 0.02 mol 电子,理论上 a 电极将减轻________g。
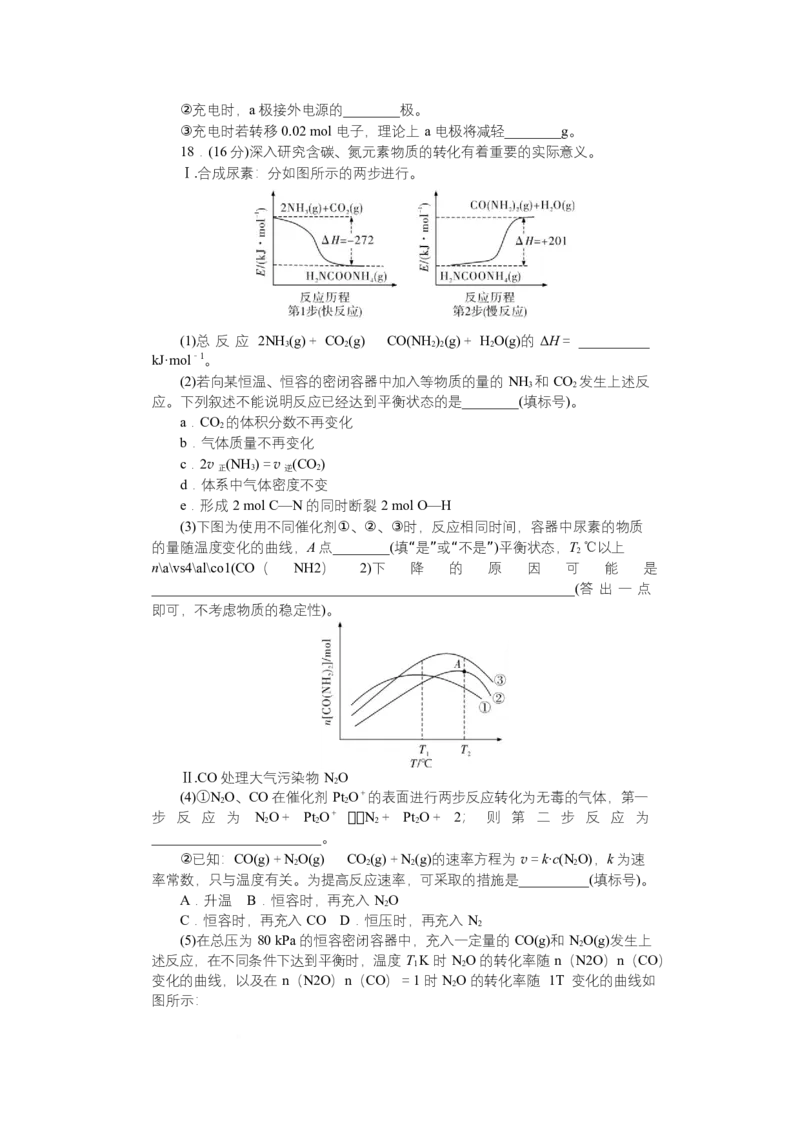
18.(16 分)深入研究含碳、氮元素物质的转化有着重要的实际意义。
Ⅰ.合成尿素:分如图所示的两步进行。
(1)总 反 应 2NH (g)+ CO(g)CO(NH)(g)+ HO(g)的 ΔH= __________
3 2 2 2 2
kJ·mol-1。
(2)若向某恒温、恒容的密闭容器中加入等物质的量的 NH 和 CO 发生上述反
3 2
应。下列叙述不能说明反应已经达到平衡状态的是________(填标号)。
a.CO 的体积分数不再变化
2
b.气体质量不再变化
c.2v (NH )=v (CO)
正 3 逆 2
d.体系中气体密度不变
e.形成 2 mol C—N 的同时断裂 2 mol O—H
(3)下图为使用不同催化剂①、②、③时,反应相同时间,容器中尿素的物质
的量随温度变化的曲线,A 点________(填“是”或“不是”)平衡状态,T ℃以上
2
n\a\vs4\al\co1(CO( NH2) 2)下 降 的 原 因 可 能 是
____________________________________________________________(答 出 一 点
即可,不考虑物质的稳定性)。
Ⅱ.CO 处理大气污染物 NO
2
(4)①NO、CO 在催化剂 Pt O+的表面进行两步反应转化为无毒的气体,第一
2 2
步 反 应 为 NO+ Pt O+ N+ Pt O+ 2; 则 第 二 步 反 应 为
2 2 2 2
________________________。
②已知:CO(g)+NO(g)CO(g)+N(g)的速率方程为 v=k·c(N O),k 为速
2 2 2 2
率常数,只与温度有关。为提高反应速率,可采取的措施是__________(填标号)。
A.升温 B.恒容时,再充入 NO
2
C.恒容时,再充入 CO D.恒压时,再充入 N
2
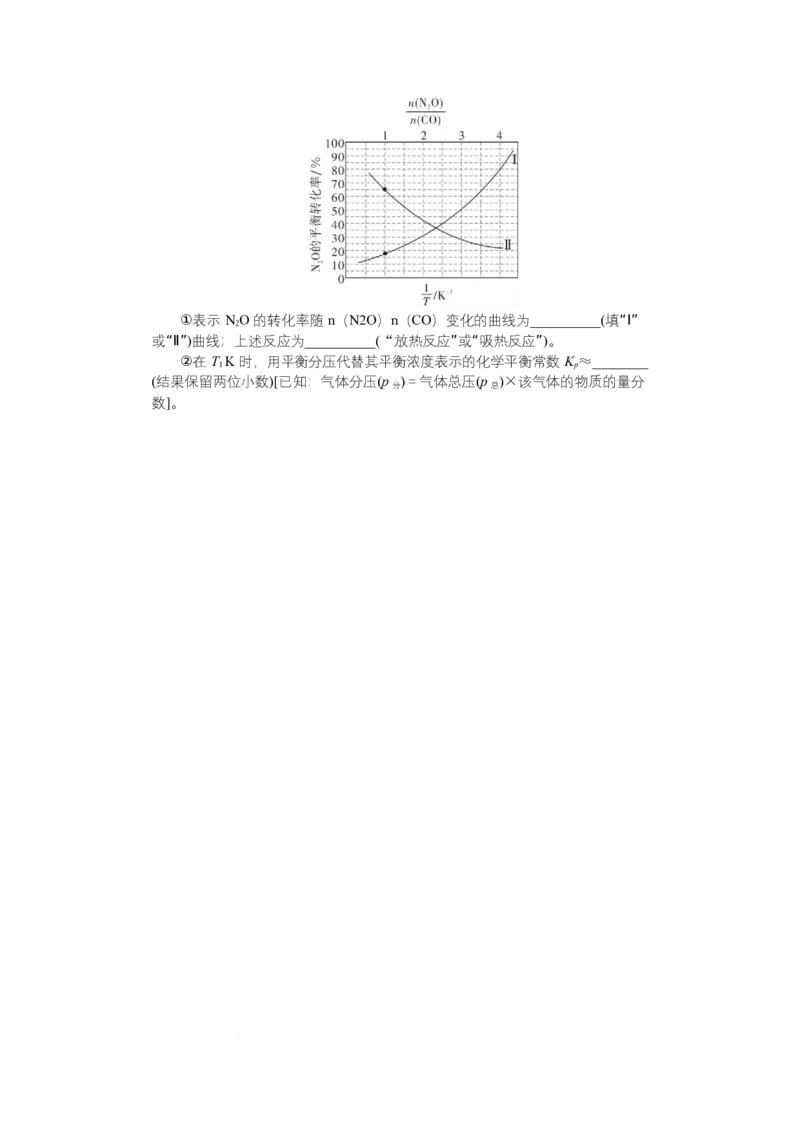
(5)在总压为 80 kPa 的恒容密闭容器中,充入一定量的 CO(g)和 NO(g)发生上
2
述反应,在不同条件下达到平衡时,温度 T K 时 NO 的转化率随 n(N2O)n(CO)
1 2
变化的曲线,以及在 n(N2O)n(CO)=1 时 NO 的转化率随 1T 变化的曲线如
2
图所示:①表示 NO 的转化率随 n(N2O)n(CO)变化的曲线为__________(填“Ⅰ”
2
或“Ⅱ”)曲线;上述反应为__________(“放热反应”或“吸热反应”)。
②在 T K 时,用平衡分压代替其平衡浓度表示的化学平衡常数 K ≈________
1 p
(结果保留两位小数)[已知:气体分压(p )=气体总压(p )×该气体的物质的量分
分 总
数]。