文档内容
高二化学参考答案(附中版)-(这是边文,请据需要手工删加)
湖南师大附中 2025—2026 学年度高二第一学期第一次大练习
化学参考答案
一、选择题(本题包括 14 小题,每小题 3 分,共 42 分。在每小题给出的四个
选项中,只有一项是符合题目要求的)
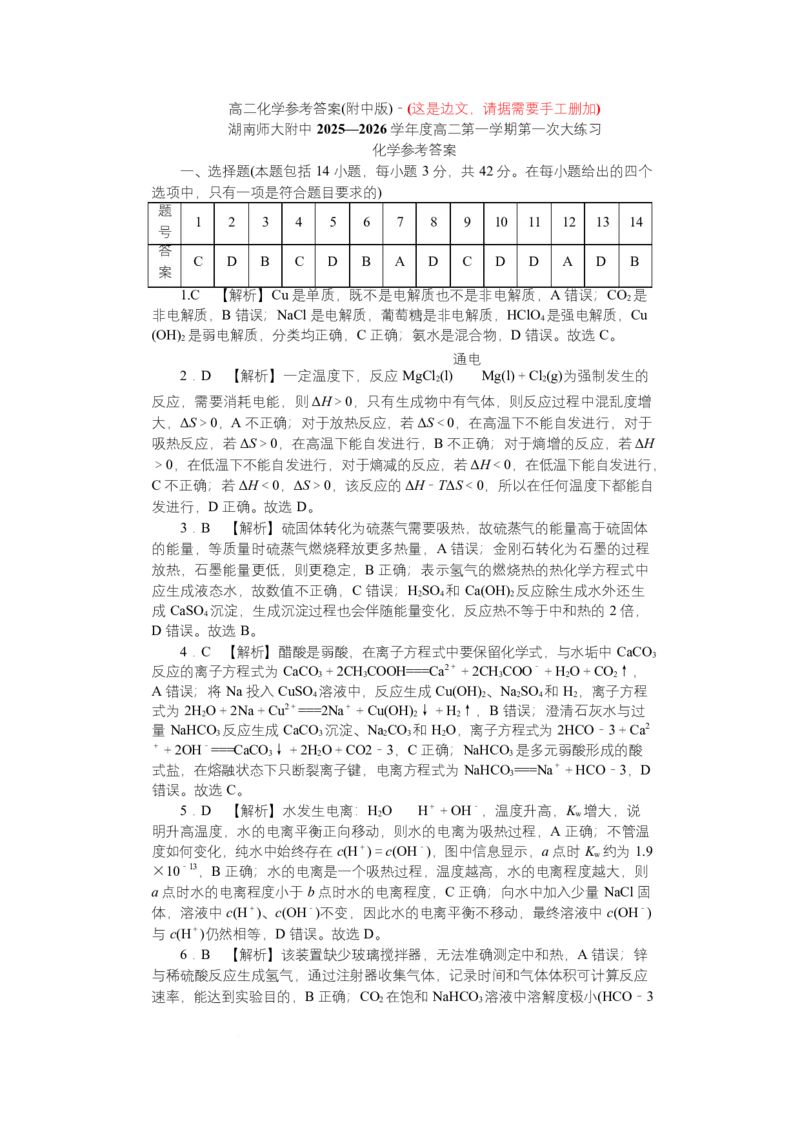
题
1 2 3 4 5 6 7 8 9 10 11 12 13 14
号
答
C D B C D B A D C D D A D B
案
1.C 【解析】Cu 是单质,既不是电解质也不是非电解质,A 错误;CO 是
2
非电解质,B 错误;NaCl 是电解质,葡萄糖是非电解质,HClO 是强电解质,Cu
4
(OH) 是弱电解质,分类均正确,C 正确;氨水是混合物,D 错误。故选 C。
2
通电
2.D 【解析】一定温度下,反应 MgCl (l) Mg(l)+Cl(g)为强制发生的
2 2
反应,需要消耗电能,则ΔH>0,只有生成物中有气体,则反应过程中混乱度增
大,ΔS>0,A 不正确;对于放热反应,若ΔS<0,在高温下不能自发进行,对于
吸热反应,若ΔS>0,在高温下能自发进行,B 不正确;对于熵增的反应,若ΔH
>0,在低温下不能自发进行,对于熵减的反应,若ΔH<0,在低温下能自发进行,
C 不正确;若ΔH<0,ΔS>0,该反应的ΔH-TΔS<0,所以在任何温度下都能自
发进行,D 正确。故选 D。
3.B 【解析】硫固体转化为硫蒸气需要吸热,故硫蒸气的能量高于硫固体
的能量,等质量时硫蒸气燃烧释放更多热量,A 错误;金刚石转化为石墨的过程
放热,石墨能量更低,则更稳定,B 正确;表示氢气的燃烧热的热化学方程式中
应生成液态水,故数值不正确,C 错误;HSO 和 Ca(OH) 反应除生成水外还生
2 4 2
成 CaSO 沉淀,生成沉淀过程也会伴随能量变化,反应热不等于中和热的 2 倍,
4
D 错误。故选 B。
4.C 【解析】醋酸是弱酸,在离子方程式中要保留化学式,与水垢中 CaCO
3
反应的离子方程式为 CaCO +2CHCOOH===Ca2++2CHCOO-+HO+CO↑,
3 3 3 2 2
A 错误;将 Na 投入 CuSO 溶液中,反应生成 Cu(OH) 、NaSO 和 H,离子方程
4 2 2 4 2
式为 2HO+2Na+Cu2+===2Na++Cu(OH) ↓+H↑,B 错误;澄清石灰水与过
2 2 2
量 NaHCO 反应生成 CaCO 沉淀、NaCO 和 HO,离子方程式为 2HCO-3+Ca2
3 3 2 3 2
++2OH-===CaCO ↓+2HO+CO2-3,C 正确;NaHCO 是多元弱酸形成的酸
3 2 3
式盐,在熔融状态下只断裂离子键,电离方程式为 NaHCO ===Na++HCO-3,D
3
错误。故选 C。
5.D 【解析】水发生电离:HO H++OH-,温度升高,K 增大,说
2 w
明升高温度,水的电离平衡正向移动,则水的电离为吸热过程,A 正确;不管温
度如何变化,纯水中始终存在 c(H+)=c(OH-),图中信息显示,a 点时 K 约为 1.9
w
×10-13,B 正确;水的电离是一个吸热过程,温度越高,水的电离程度越大,则
a 点时水的电离程度小于 b 点时水的电离程度,C 正确;向水中加入少量 NaCl 固
体,溶液中 c(H+)、c(OH-)不变,因此水的电离平衡不移动,最终溶液中 c(OH-)
与 c(H+)仍然相等,D 错误。故选 D。
6.B 【解析】该装置缺少玻璃搅拌器,无法准确测定中和热,A 错误;锌
与稀硫酸反应生成氢气,通过注射器收集气体,记录时间和气体体积可计算反应
速率,能达到实验目的,B 正确;CO 在饱和 NaHCO 溶液中溶解度极小(HCO-3
2 3抑制 CO 的溶解),无法形成压强差,不能做喷泉实验,C 错误;验证非金属性需
2
比较最高价氧化物对应水化物的酸性,稀盐酸不是Cl的最高价含氧酸(应为HClO),
4
且盐酸易挥发干扰 CO 与 NaSiO 的反应,无法证明非金属性强弱 Cl>C>Si,D
2 2 3
错误。故选 B。
7.A 【解析】该反应为放热反应,温度升高,平衡向逆反应方向移动,C
的质量分数减小,A 正确;增大压强,平衡向气体体积减小的方向移动,即向正
反应方向移动,则 v >v ,且增大压强,正、逆反应速率都增大,B 错误;催化
正 逆
剂同等程度地改变正、逆反应速率,平衡不发生移动,所以达到平衡时,C 的浓
度相同,C 错误;该反应为放热反应,温度升高,平衡向逆反应方向移动,A 的
转化率降低,D 错误。故选 A。
8.D 【解析】根据反应历程图可知,产物相对能量低于反应物相对能量,
A 正确;根据反应历程图可知,中间产物 Z 转化为产物 P 时活化能最大,为 186.19
2
kJ·mol-1,B 正确;产物能量越低越稳定,P 能量更低,更稳定,C 正确;反应
2
初期,相同条件下反应活化能越小,则反应速率越快,故相同时间内 n(P )>n(P ),
1 2
D 错误。故选 D。
9.C 【解析】因反应放热,温度升高,导致 0~5 s 内的反应速率逐渐增大,
A 正确;10~15 s 内,反应速率逐渐减小,主要是由于随着反应的进行,盐酸的
浓度逐渐减小,B 正确;盐酸的体积未知,故无法计算用盐酸的浓度变化表示的
该反应速率,C 错误;若向反应体系中加入适量氯化钠溶液,盐酸浓度减小,则
反应速率减小,但是 HCl 的物质的量不变,最终生成二氧化碳的体积不变,则曲
线甲可能变成曲线乙,D 正确。
11.D 【解析】稀释前,两种溶液导电能力相同,说明离子浓度相等,由于
一水合氨为弱电解质,不能完全电离,则氨水浓度大于 NaOH 浓度,A 错误;加
水稀释能促进一水合氨的电离,所以氨水中离子浓度大于 NaOH 溶液中离子浓度,
则稀释后导电能力强的为氨水,所以曲线Ⅱ表示的是 NaOH 溶液的导电能力与溶
液体积的变化关系,B 错误;导电能力越强,说明离子浓度越大,c(OH-)越大,
碱性越强,则 a、b、c 三点溶液中的 c(OH-)大小顺序为 c>a>b,C 错误;氨水稀
释过程中,K =+4c(NH)·c(OH-)c(NH3·H2O)不变,而 c(OH-)减小,所
b
以+4c(NH)c(NH3·H2O)不断增大,D 正确。故选 D。
12.A 【解析】由题意可知,平衡时 Y 的浓度为 0.4 mol/L,由方程式可知,
X 的浓度为 1 mol/L-0.4 mol/L=0.6 mol/L,Z 的浓度为 0.4 mol/L,则反应的平衡
常数 K=0.4×0.40.6≈0.27。向真空刚性容器中再充入 1 mol X 和 1 mol Y 时,反应
的浓度商 Q=1.4×0.41.6=0.35>K,则反应向逆反应方向进行,正反应速率小于逆
反应速率,A 正确;向真空刚性容器中再充入 1 mol X,相当于增大压强,该反应
是气体体积增大的反应,增大压强,平衡向逆反应方向移动,则平衡时,Y 的浓
度小于 0.8 mol/L,B 错误;向真空刚性容器中再充入 1 mol 不参与反应的氮气,
反应体系中各物质浓度不变,平衡不移动,C 错误;温度升高,X 的转化率增大,
说明平衡向正反应方向移动,该反应为焓变大于 0 的吸热反应,D 错误。故选 A。
13.D 【解析】根据题意,生成 92 g(2 mol)液态 HCOOH 时放出 62.4 kJ 的
热量,该反应的热化学方程式为 H(g)+CO(g)===HCOOH(l) ΔH=-31.2 kJ·
2 2
mol-1,A 错误;图示中参与循环的物质有催化剂和水,B 错误;62.4 kJ 的热量是
生成 92 g 液态 HCOOH 时反应物与生成物的能量差值,不是反应的活化能,C 错
误;图示中物质Ⅰ为该反应的催化剂,D 正确。故选 D。
14.B 【解析】由图可知,初始生成 M 的速率比 N 的大,则反应①的活化能比反应②的小,A 错误;由图可知,初始生成 M 的速率比 N 的大,则 k>k,
1 2
10 s 时两个反应均达到平衡状态,由于 v =k·c(X)·c(Y)、v =v =k·
1(正) 1 2(逆) 2(正) 2
c(X)·c(Y),则 v >v ,B 正确;反应为等体积气体反应,气体压强始终不变,
1(正) 2(逆)
C 错误;反应①、②中 X、Q 的系数均为 1,则 0~6 s 内,X 的平均反应速率为 v
(X)=v(Q)=Δc(Q)Δt=6 mol·L-16 s=1 mol·L-1·s-1,D 错误。故选 B。
二、非选择题(本题共 4 个小题,除特殊标注,每空 2 分,共 58 分)
15.(14 分)(1)先打开分液漏斗上部的玻璃塞(或将分液漏斗上部的玻璃塞上的
凹槽与漏斗上的小孔对齐),再旋开分液漏斗下端的玻璃旋塞
(2)2MnO-4+10Cl-+16H+===2Mn2++5Cl↑+8HO
2 2
(3)浓硫酸
(4)减少 SO Cl 分解或挥发,提高 SO Cl 的产率
2 2 2 2
(5)a
(6)吸收多余的有毒气体 SO 或 Cl,防止污染大气;防止外界的水蒸气进入
2 2
三颈烧瓶中与 SO Cl 反应
2 2
(7)催化作用
【解析】由实验装置可知,装置 A 是制取 Cl 的装置,装置 A 中生成的氯气
2
中混有氯化氢和水蒸气,因此需要用饱和的食盐水除去氯化氢,再进行干燥,故
装置 B 中盛装饱和食盐水,装置 C 中盛装浓硫酸,最后在装置 D 中与二氧化硫发
催化剂
生反应:SO +Cl SO Cl,结合反应中涉及物质的性质分析解答。
2 2 2 2
(1)用分液漏斗添加试剂要先打开分液漏斗上部的玻璃塞或将分液漏斗上部的
玻璃塞上的凹槽与漏斗上的小孔对齐,再旋开分液漏斗下端的玻璃旋塞。若只旋
开分液漏斗下端的玻璃旋塞,分液漏斗内的浓盐酸不会顺利滴下。
(2)装置 A 是制取 Cl 的装置,高锰酸钾与浓盐酸反应不需要加热即可生成氯
2
气,离子方程式为 2MnO-4+10Cl-+16H+===2Mn2++5Cl↑+8HO。
2 2
(3)由分析可知,装置 C 中装的液体为浓硫酸。
(4)干燥纯净的氯气与干燥纯净的二氧化硫在三颈烧瓶中反应生成 SO Cl,反
2 2
应放出大量的热,故需要将三颈烧瓶放在冷水浴中冷凝,目的是避免 SO Cl 因温
2 2
度高而分解,同时使 SO Cl 液化,减少 SO Cl 的挥发,提高其产率。
2 2 2 2
(5)为了更好地实现冷凝回流,冷却水从球形冷凝管的下口进入,故进水口是
a。
(6)在球形冷凝管的末端连接装有碱石灰的球形干燥管的目的是吸收多余的有
毒气体SO 或 Cl,防止污染大气;同时防止外界的水蒸气进入三颈烧瓶中与SO Cl
2 2 2 2
反应。
(7)三颈烧瓶中装有的活性炭可以明显地使反应更剧烈,说明反应速率明显加
快,则活性炭起的作用是催化作用。
焙烧
16.(14 分)(1)ZnCO ZnO+CO↑
3 2
(2)粉碎矿石(或搅拌、适当加热、适当增加硫酸浓度等)(1 分)
(3)NH+4 Ca(OH)
2
(4)3Fe2++MnO-4+7HO===3Fe(OH)↓+MnO ↓+5H+ 取少许氧化后
2 3 2
的上层溶液于试管中,滴加适量新制氯水,再滴加硫氰化钾溶液,若无明显现象,
则 Fe2+已除尽
(5)Cu2+(1 分) Zn+Cu2+===Zn2++Cu【解析】菱锌矿的主要成分为 ZnCO ,含少量 SiO 及 Ca、Mg、Fe、Cu 等杂
3 2
焙烧 质,结合流程图
分析,焙烧菱锌矿时主要发生反应:ZnCO ZnO+CO↑,再
3 2
加入 HSO 溶液浸取,得到含 Zn2+、Ca2+、Mg2+、Fe2+、Fe3+、Cu2+的溶液及
2 4
沉淀 HSiO、CaSO,加入物质 X 调节 pH=5,过滤得到含 Fe(OH) 的滤渣①,
2 3 4 3
滤液中主要含有 Zn2+、Ca2+、Mg2+、Fe2+、Cu2+,再向滤液中加入 KMnO 氧
4
化 Fe2+,过滤得到含 Fe(OH) 和 MnO 的滤渣②,向滤液中加入锌粉,发生反应:
3 2
Zn+Cu2+===Zn2++Cu,过滤后得到滤渣③为 Cu 和 Zn,再向滤液中加入 HF 脱
钙镁,过滤得到的滤渣④为 CaF 、MgF ,滤液为 ZnSO 溶液,经一系列处理得到
2 2 4
ZnSO•7HO,据此分析解答。
4 2
焙烧
(1)由分析可知,“焙烧”时,ZnCO 分解的化学方程式为 ZnCO ZnO+
3 3
CO↑。
2
(2)为提高酸浸效率,可采取的措施有粉碎矿石(或搅拌、适当加热、适当增加
硫酸浓度等)。
(3)调节 pH 时,若使用 NH ·H O 可能引入 NH+4,结合滤液中含有 Ca2+,
3 2
可以选用 Ca(OH) 。
2
(4)KMnO 将 Fe2+氧化为 Fe(OH) 而自身被还原为 MnO ,反应的离子方程式
4 3 2
为 3Fe2++MnO-4+7HO===3Fe(OH)↓+MnO ↓+5H+;检验 Fe2+是否除尽
2 3 2
的操作为:取少许滤液于试管,滴加适量新制氯水,再滴加硫氰化钾溶液,若无
明显现象,则 Fe2+已除尽。
(5)向滤液中加入锌粉,发生反应:Zn+Cu2+===Zn2++Cu,可以除掉 Cu2+。
17.(14 分)(1)①O(或空气) ②CHOCH -12e-+3HO===2CO+12H+ ③
2 3 3 2 2
减少 27
(2)①LiC -xe-===xLi++C ②正 ③0.14
x 6 6
【解析】(1)①由氢离子移动方向可知,右侧电极为正极,左侧电极为负极;
二甲醚[CHOCH (g)]酸性燃料电池中通入二甲醚的一极为负极,通入氧气的一极
3 3
为正极,故该电池工作时,c 口通入的物质是氧气(或空气)。
②在酸性电解质溶液中,二甲醚燃料电池中通入燃料即二甲醚的一极为负极,
发生氧化反应,故该电池负极的电极反应为 CHOCH -12e-+3HO===2CO+
3 3 2 2
12H+。
③当外电路有 6 mol 电子通过时,理论上消耗 0.5 mol 二甲醚的同时生成 1 mol
CO,通过质子交换膜移出 6 mol H+,因此质量变化为(0.5×46-1×44-6) g=-
2
27 g,故质量减少 27 g。
(2)①电池反应式为 Li
x
C
6
+Li
1-x
CoO
2
KN*放电充电 C
6
+LiCoO
2
(x<1),根据图中
信息可知放电时 b 极为负极,b 极发生的电极反应式为 LiC -xe-===xLi++C 。
x 6 6
②放电时 a 极为正极,充电时 a 极接外电源的正极。
③充电时,a 电极为阳极,LiCoO 发生 Li+脱嵌变为 Li CoO,若转移 0.02
2 1-x 2
mol 电子,a 电极将减轻 0.14 g。
18.(16 分)(1)-71(1 分)
(2)bcd(答错扣全分,少选一个扣一分)
(3)不是(1 分) 随着温度升高,可能是催化剂活性降低(或失去活性),反应速
率降低,单位时间内生成尿素的物质的量减少
(4)①CO+Pt O+2 CO+Pt O+ ②AB(答错扣全分,少选扣一分)
2 2 2(5)①Ⅱ 放热反应 ②3.45
【解析】(2)a.CO 的体积分数不再变化,说明平衡不再移动,正、逆反应速
2
率相等,达到平衡状态,不符合题意;b.根据质量守恒可知气体质量是定值,其
不变不能说明反应达到平衡,符合题意;c.反应速率之比等于系数之比,2v (NH )
正 3
=v (CO),则正、逆反应速率不相等,反应没有达到平衡,符合题意;d.气体质
逆 2
量和气体体积为定值,因此密度为定值,不能据此说明反应达到平衡,符合题意;
e.形成 2 mol C—N 的同时断裂 2 mol O—H,正、逆反应速率相等,不符合题意。
故选 bcd。
(3)A 点尿素的量低于使用催化剂③时的量,则说明没有达到平衡状态;催化
剂需要一定的活化温度,但随着温度升高,催化剂活性可能降低(或失去活性),反
应速率降低,导致单位时间内生成尿素的物质的量减少,故 T ℃以上 n
2
\a\vs4\al\co1(CO(NH2)2)下降。
(4)①NO、CO 在催化剂 Pt O+的表面进行两步反应转化为无毒的气体,结合
2 2
质量守恒可知,生成气体为氮气和二氧化碳,总反应为 NO+CO N+CO,
2 2 2
第一步反应为 NO+Pt O+ N+Pt O+2,则第二步反应为 CO+Pt O+2
2 2 2 2 2
CO+Pt O+。
2 2
②A.升温,速率常数变大,反应速率加快,正确;B.由速率表达式可知,恒
容时,再充入 NO,其浓度变大,反应速率变大,正确;C.由速率表达式可知,
2
恒容时,再充入 CO,不影响反应速率,错误;D.由速率表达式可知,恒压时,再
充入 N,NO 浓度变小,反应速率变小,错误。故选 AB。
2 2
(5)①由化学平衡移动原理可知,n(N2O)n(CO)的值越大,NO 的转化率
2
越小,所以曲线Ⅱ表示 NO 的转化率随 n(N2O)n(CO)变化的曲线,则曲线
2
Ⅰ为 n(N2O)n(CO)=1 时 NO 的转化率随 1T 变化的曲线,由图可知,降低
2
温度,NO 转化率增大,平衡正向移动,则正反应为放热反应,焓变小于 0。
2
②该反应是气体体积不变的反应,平衡前后气体的总压强不变,在总压为 80
kPa、n(N2O)n(CO)=1 的容器中,NO 和 CO 的起始分压都为 40 kPa,由图
2
可知,温度为 T K 时,NO 的转化率为 65%,由方程式可知,平衡时,NO 和
1 2 2
CO的分压都为40 kPa-40 kPa×65%=14 kPa,CO 和 N 的分压都为40 kPa×65%
2 2
=26 kPa,则用平衡分压代替其平衡浓度表示的化学平衡常数为 K =26 kPa×26
p
kPa14 kPa×14 kPa≈3.45。