文档内容
化学试题
考生注意:
1.满分100分,考试时间75分钟.
2.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区
域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效.
3.本卷命题范围:高考范围.
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项
是符合题目要求的.
1.巴黎奥运赛场上中国运动健儿绽放异彩,“中国科技”闪耀赛场内外.下列所涉及的材质为无机非金属的
是( )
A.射击比赛服采用特制帆布和牛皮等材料
B.奥运会场馆中的紫色跑道使用可循环橡胶材料
C.乒乓球比赛用球采用高品质 塑料材料
D.自行车采用航空级纳米碳纤维材料
2.化学与生产、生活息息相关.下列叙述错误的是( )
A.乙醇可作液体燃料,也可作消毒剂
B.葡萄糖溶液可以为运动员补充电解质
C.石灰石是制造玻璃和水泥的主要原料之一
D.工业燃煤中加入生石灰可以减少酸雨的形成
3.下列鉴别或除杂的方法错误的是( )
A.用灼烧法区别蚕丝和人造纤维
B.用水鉴别氢氧化钠和氯化钠两种固体
C.通过灼热的铜丝网除去氮气中的氧气
D.用湿润的淀粉碘化钾试纸鉴别 和
4.物质的转化是化学学习的重要内容,甲、乙、丙所代表的物质符合如图所示转化关系的是(图中的箭头均
表示一步转化)( )
A. B.C. D.
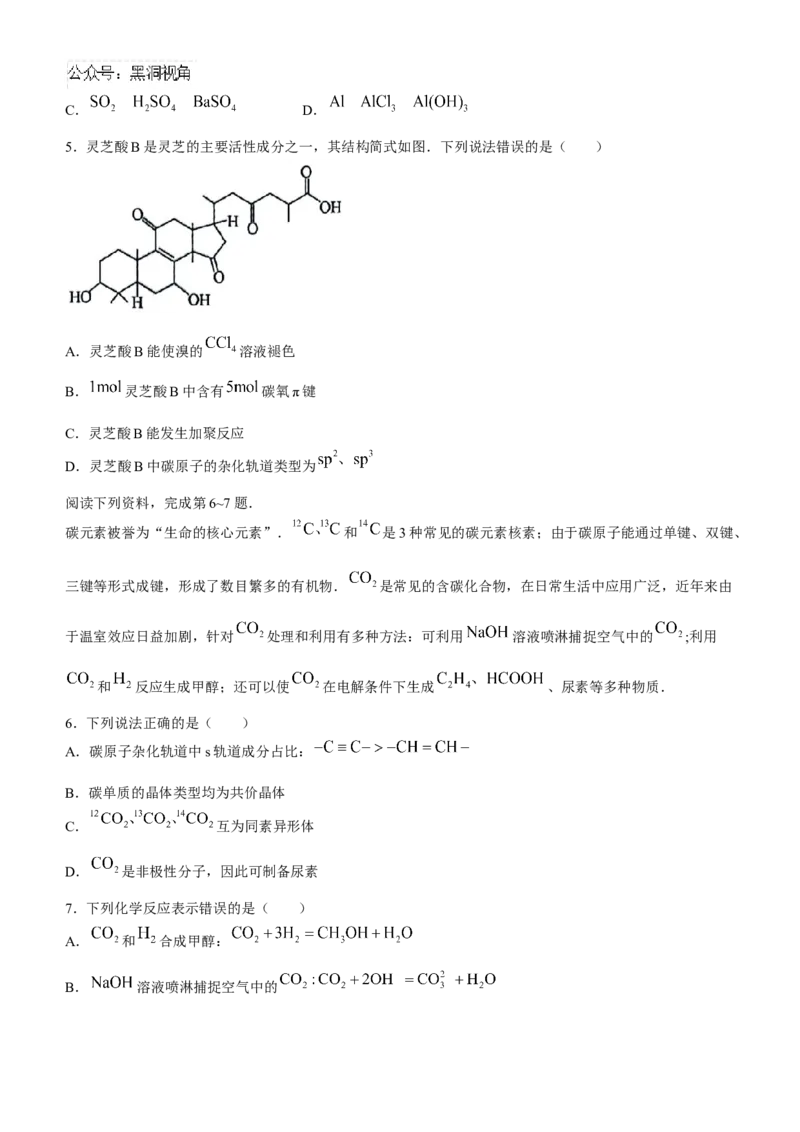
5.灵芝酸B是灵芝的主要活性成分之一,其结构简式如图.下列说法错误的是( )
A.灵芝酸B能使溴的 溶液褪色
B. 灵芝酸B中含有 碳氧π键
C.灵芝酸B能发生加聚反应
D.灵芝酸B中碳原子的杂化轨道类型为
阅读下列资料,完成第6~7题.
碳元素被誉为“生命的核心元素”. 和 是3种常见的碳元素核素;由于碳原子能通过单键、双键、
三键等形式成键,形成了数目繁多的有机物. 是常见的含碳化合物,在日常生活中应用广泛,近年来由
于温室效应日益加剧,针对 处理和利用有多种方法:可利用 溶液喷淋捕捉空气中的 ;利用
和 反应生成甲醇;还可以使 在电解条件下生成 、尿素等多种物质.
6.下列说法正确的是( )
A.碳原子杂化轨道中s轨道成分占比:
B.碳单质的晶体类型均为共价晶体
C. 互为同素异形体
D. 是非极性分子,因此可制备尿素
7.下列化学反应表示错误的是( )
A. 和 合成甲醇:
B. 溶液喷淋捕捉空气中的C.泡沫灭火器原理:
D. 通过电解法转化为
8.设 为阿伏加德罗常数的值.下列叙述错误的是( )
A. 肼 分子中含 键数目为
B. 异丁烷、正丁烷混合物中含共价键的数目为
C. 中氮原子上孤电子对的数目为
D. 的 溶液中 数目为
9.实验室用如图所示装置制备硝酸(加热装置已省略).下列有关说法错误的是( )
A.制得的硝酸可盛装在无色透明的洁净试剂瓶中
B. 换成 即可制备
C.冷却水的作用是促进硝酸蒸气冷凝,避免形成酸雾
D.反应温度如果过高,制得的 可能会呈现黄色
10.下列实验操作及现象与结论一致的是( )
选项 实验操作及现象 结论
A
先将氯水滴入某溶液中,然后滴加 溶液,溶液变红 原溶液中一定含有
B 乙醇发生消去反应生成乙烯
向无水乙醇中加入浓硫酸,加热至 ,将产生的气体通入酸
性 溶液中,紫红色褪去
C
向 浊液中滴入 溶液,浊液变清 结合 的能力比 弱
D 蓝色沉淀为
向 溶液中逐滴加入氨水,得到蓝色沉淀,再继续加入乙
醇,蓝色沉淀不溶解
A.A B.B C.C D.D
11.短周期主族元素X、Y、Z、W的原子序数依次增大.X是密度最小的金属;Y与Z同主族,且基态Y原
子中p能级和s能级上的电子数相同;X和Z形成的化合物的晶体结构如图所示.设阿伏加德罗常数的值为,晶胞边长为 .下列说法正确的是( )
A.原子半径: B.第一电离能:
C.晶胞中Z的配位数为12 D.晶体的密度为
12.在恒温恒容密闭容器中充入一定量 ,发生如下反应:
反应②和③的反应速率分别满足 和 ,其中 分别为反应②和③的速率常
数,反应③的活化能大于反应②.测得 的浓度随时间的变化如下表.
0 1 2 3 4 5
0.160 0.113 0.080 0.056 0.040 0.028
下列说法错误的是( )
A. 内,W的平均反应速率为
B.若增加Y的浓度, 不变
C.若 ,平衡时
D.若升高温度,平衡时 减小
13.间接电解法合成苯甲醛的原理如图所示.下列说法错误的是( )A.c是电源正极
B.电解一段时间后,a极区溶液 降低(忽略溶液体积变化)
C.理论上,电源提供 电子能生成 苯甲醛
D.用有机溶剂分离出苯甲醛,避免其在电解池中放电发生副反应
14. 时,用 溶液滴定 溶液,滴定曲线如图所示.下列
说法错误的是( )
A. 时,若 的电离常数分别为 ,则
B. 的滴定过程中,水的电离程度先增大后减小
C.a点溶液中:
D.c点溶液中:
二、非选择题:本题共4小题,共58分.
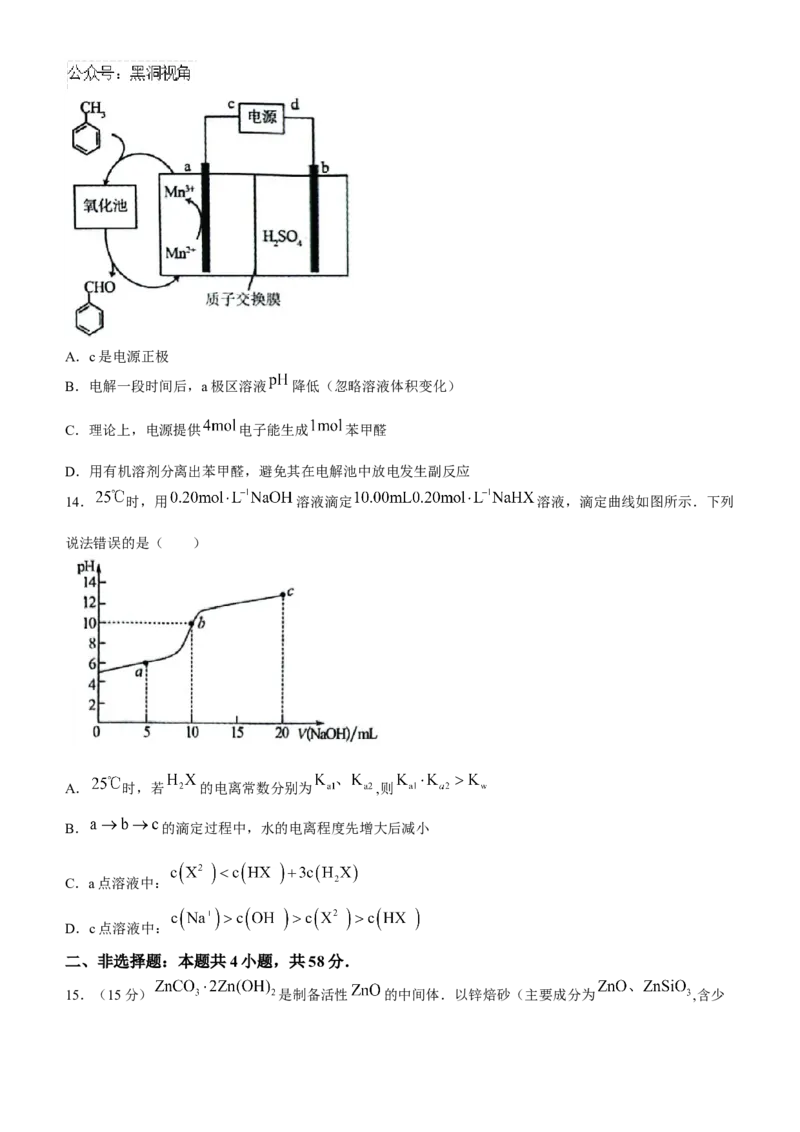
15.(15分) 是制备活性 的中间体.以锌焙砂(主要成分为 ,含少量 等)为原料制备 的流程如下:
回答下列问题:
(1)锌位于元素周期表第_____________周期第_____________族, 属于_____________
(填“纯净物”或“混合物”).
(2)“浸取1”步骤中加入 的目的是__________________________________________________.
(3)“浸取2”步骤中 转化为“浸渣”_____________(填化学式).
(4)“蒸氨”步骤中存在 中 的键角_____________(填
“>”“<”或“=”) 中 的键角.
(5)写出流程中“沉锌”的离子方程式:_______________________________________________.
(6)该流程中可以循环利用的物质是_____________(写出主要成分的化学式).
(7) 经焙烧可得活性 ,反应的化学方程式为_________________________.
16.(14分)清凉茶酸乙酯 是一种消毒杀菌剂,对细菌、霉菌等
有灭活作用.通过酯化反应制备清凉茶酸乙酯的实验步骤如下.
Ⅰ.在三颈烧瓶中加入 清凉茶酸、 乙醇、环己烷、少量浓硫酸等,再加入几粒沸石.
Ⅱ.加热并不断搅拌,一段时间后停止加热和搅拌.
Ⅲ.反应物冷却至室温,进行操作X.
Ⅳ.在滤液中加入试剂Y,洗涤至混合液 为7左右,再用试剂Z洗涤.
Ⅴ.将洗涤后混合液加入分液漏斗,进行分液.
Ⅵ.在分液后的有机层加入干燥剂,振荡,静置,过滤.
Ⅶ.对过滤后产物进行提纯操作,得到 纯净的清凉茶酸乙酯.
沸点/℃ 水溶性 备注
密度/
乙醇 78 0.789 混溶清凉茶酸 228 1.204 易溶
清凉茶酸乙酯 195 0.926 难溶
环己烷 80.7 0.780 难溶 挥发过程中可带出较多的水
(1)步骤Ⅰ中加入环已烷的作用是______________________________________________.
(2)步骤Ⅱ中为了受热均匀和易于控制温度为 ,可采用_____________(填“水浴”或“油浴”)加
热,写出实验中三颈烧瓶内发生的主要反应:___________________________________________.
(3)在步骤Ⅲ中必须用到的下列仪器有_____________(填名称).
(4)在步骤Ⅳ中使用的洗涤试剂Y、Z依次为_____________、_____________(填标号).
a.5%的小苏打溶液 b.乙醇 c. 溶液 d.蒸馏水
(5)在步骤Ⅶ中对清凉茶酸乙酯进行提纯的方法是_____________,本实验的产率为_____________(保留三
位有效数字).
17.(14分)氢能是新能源领域中与油气行业现有业务结合最紧密的一类,而制氢成本过高仍是目前氢能产
业发展的挑战之一.甲烷、水蒸气重整制氢是目前工业制氢最为成熟的方法,涉及的主要反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)①计算 _____________ ,反应Ⅱ的 _____________(填“>”“<”或“=”)0.
②以 和 的混合气体为起始投料( 不参与反应),保持混合气体总物质的量不变,在恒容
的容器中对反应Ⅰ进行研究.下列说法正确的是_____________(填标号).
A.升高温度,正、逆反应速率同时增大
B. 保持恒定时,反应达到化学平衡状态
C.增加起始投料时 的体积分数,单位体积的活化分子数增加
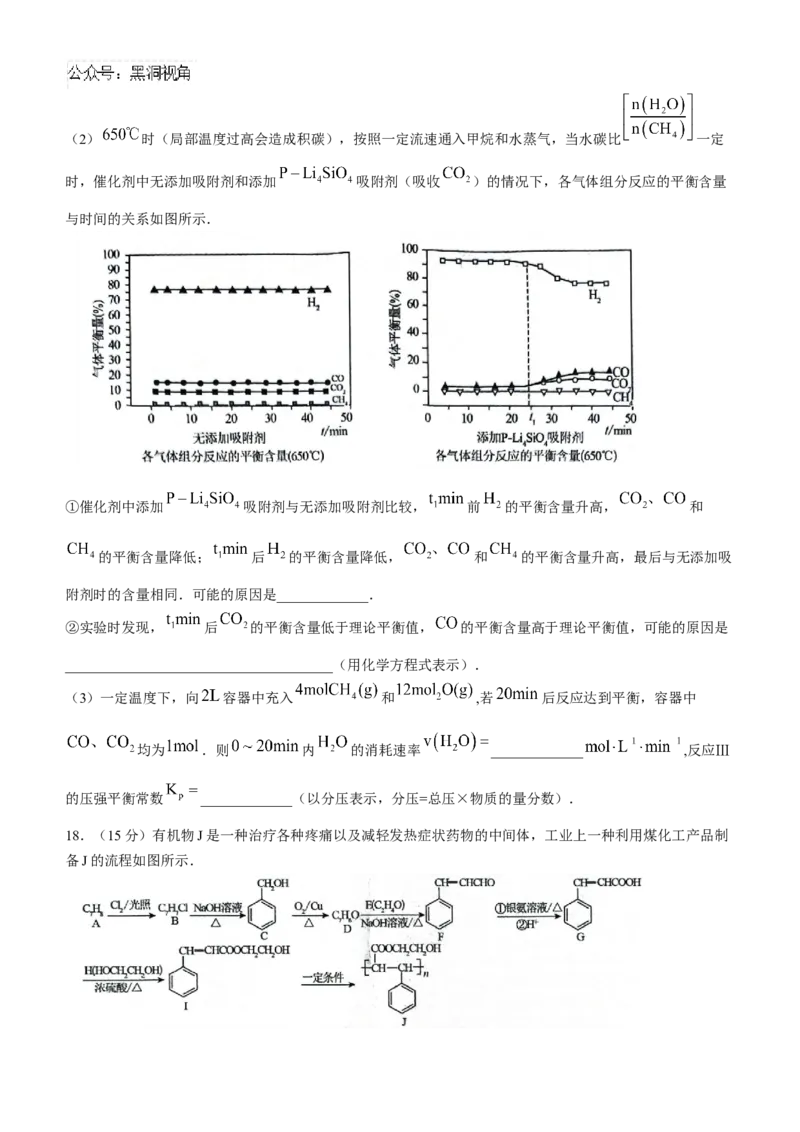
D.增加起始投料时 的体积分数, 平衡转化率增大(2) 时(局部温度过高会造成积碳),按照一定流速通入甲烷和水蒸气,当水碳比 一定
时,催化剂中无添加吸附剂和添加 吸附剂(吸收 )的情况下,各气体组分反应的平衡含量
与时间的关系如图所示.
①催化剂中添加 吸附剂与无添加吸附剂比较, 前 的平衡含量升高, 和
的平衡含量降低; 后 的平衡含量降低, 和 的平衡含量升高,最后与无添加吸
附剂时的含量相同.可能的原因是_____________.
②实验时发现, 后 的平衡含量低于理论平衡值, 的平衡含量高于理论平衡值,可能的原因是
______________________________________(用化学方程式表示).
(3)一定温度下,向 容器中充入 和 ,若 后反应达到平衡,容器中
均为 .则 内 的消耗速率 _____________ ,反应Ⅲ
的压强平衡常数 _____________(以分压表示,分压=总压×物质的量分数).
18.(15分)有机物J是一种治疗各种疼痛以及减轻发热症状药物的中间体,工业上一种利用煤化工产品制
备J的流程如图所示.(1)A的化学名称是_____________,G中含氧官能团的名称为_____________.
(2) 的反应类型为_____________.
(3)J中手性碳原子的数目为_____________.
(4)结合已有知识,写出 的化学方程式:__________________________________________.
(5)有机物M是F的同系物,且相对分子质量比F大14,同时满足下列条件的M的同分异构体共有
_____________种(不考虑立体异构);其中核磁共振氢谱有六组峰且峰面积比为 的结构简式
为________________________________(任写一种).
①苯环上连有两个侧链;②能发生银镜反应;③存在碳碳双键.
(6)设计以 和 为原料制备 的合成路线:_____________(无机试剂任选).