文档内容
南京市 2024~2025 学年度第一学期期中学情调研测试
高二化学
2024.11
本试卷分选择题和非选择题两部分,共100分。考试用时75分钟。
注意事项:
答题前,考生务必将自己的学校、姓名写在答题卡上。考试结束后,交回答题卡。
可能用到的相对原子质量:H 1C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.新型低镍304X奥氏体是具有优良特性的不锈钢,其中掺杂的下列非金属元素位于元素周期表第二周期
的是( )
A.C B.Si C.P D.S
2.反应 可用于潜水艇供氧。下列说法不正确的是( )
A. 中O的化合价为-1 B. 中含有极性键
C.NaOH的电子式为 D. 中O原子中子数为16
3.碳酸氢铵是一种常用氮肥,其制备原理为: ,下列相关原理、装置及
操作正确的是( )
A.制取 (g) B.制取 (g)
C.制备 (aq) D. 获得(s)
4.一氟磷酸钠( )可用于预防龋齿。下列说法正确的是( )
A.半径: B.非金属性:O>P
C.热稳定性: D.碱性:NaOH>KOH阅读下列材料,完成5~7题:
碳族元素及其化合物应用广泛。甲烷是常见燃料,其燃烧热为890.3 ;碳纳米管、石墨烯、
富 勒 烯 、 碳 化 硅 是 一 类 新 型 无 机 非 金 属 材 料 。 Si 、 Ge 是 重 要 的 半 导 体 材 料 ,
用于制备高纯硅;650℃下,氢气还原 可得高纯锗。
是一种透明导电材料,可由 水解制得。 具有强氧化性,能与浓盐酸反应生成 ,也可
用作铅蓄电池的电极材料。
5.下列说法不正确的是( )
A.碳纳米管、石墨烯、富勒烯互为同素异形体
B.用E表示键能,制备纯硅反应的△H=E(Si-Si)+3E(H-Cl)-E(Si-Cl)-E(H-H)
C.由 制备 时,加入大量的水同时加热可促使水解趋于完全
D.利用铅蓄电池可实现电能与化学能循环转化
6.下列化学反应表示正确的是( )
A.甲烷的燃烧: △H=+890.3
B.粗硅的制备:
C.高纯锗的制备:
D. 与盐酸反应生成 :
7.下列物质性质与用途具有对应关系的是( )
A. 硬度大,可用作光导纤维 B.单晶硅熔点高,可用作半导体
C.碳化硅密度小,可用作耐高温材料 D.石墨烯导电性好,可用作电极材料
8.下列选项所示的物质间转化均能实现的是( )
A.
B.
C. 漂白粉(s)
D.
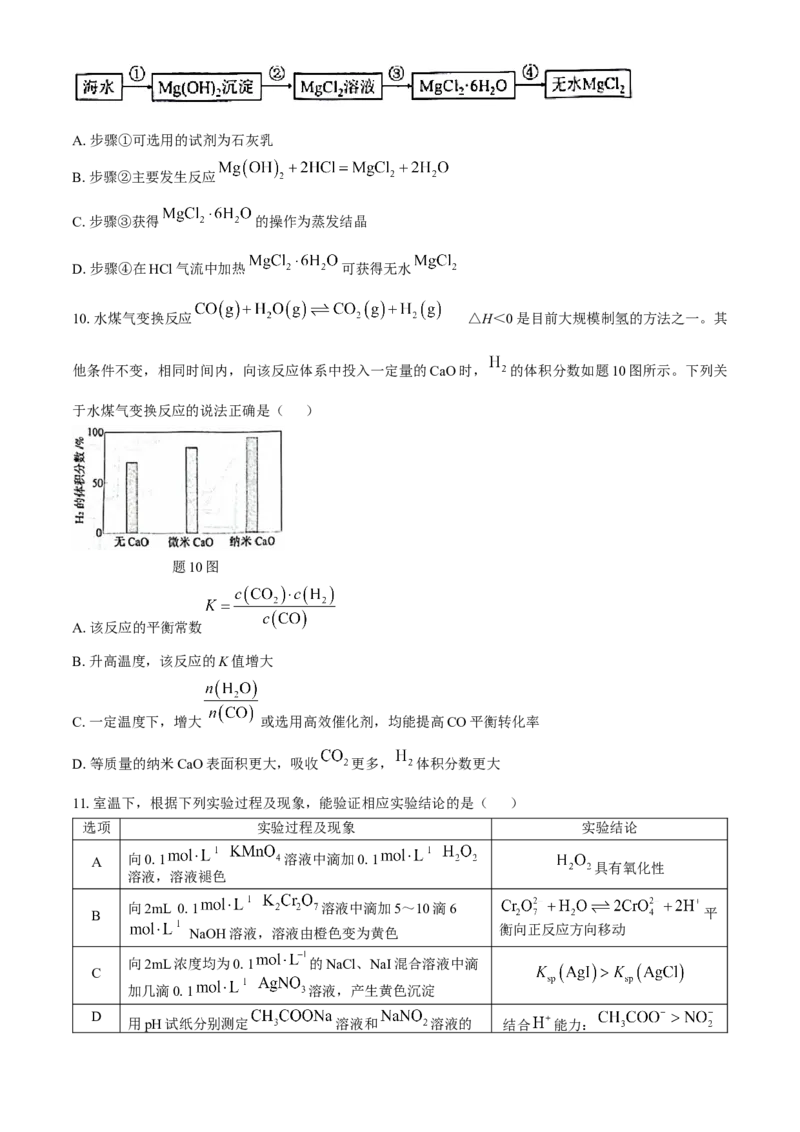
9.开发利用海水化学资源的部分过程如图所示,下列说法不正确的是( )A.步骤①可选用的试剂为石灰乳
B.步骤②主要发生反应
C.步骤③获得 的操作为蒸发结晶
D.步骤④在HCl气流中加热 可获得无水
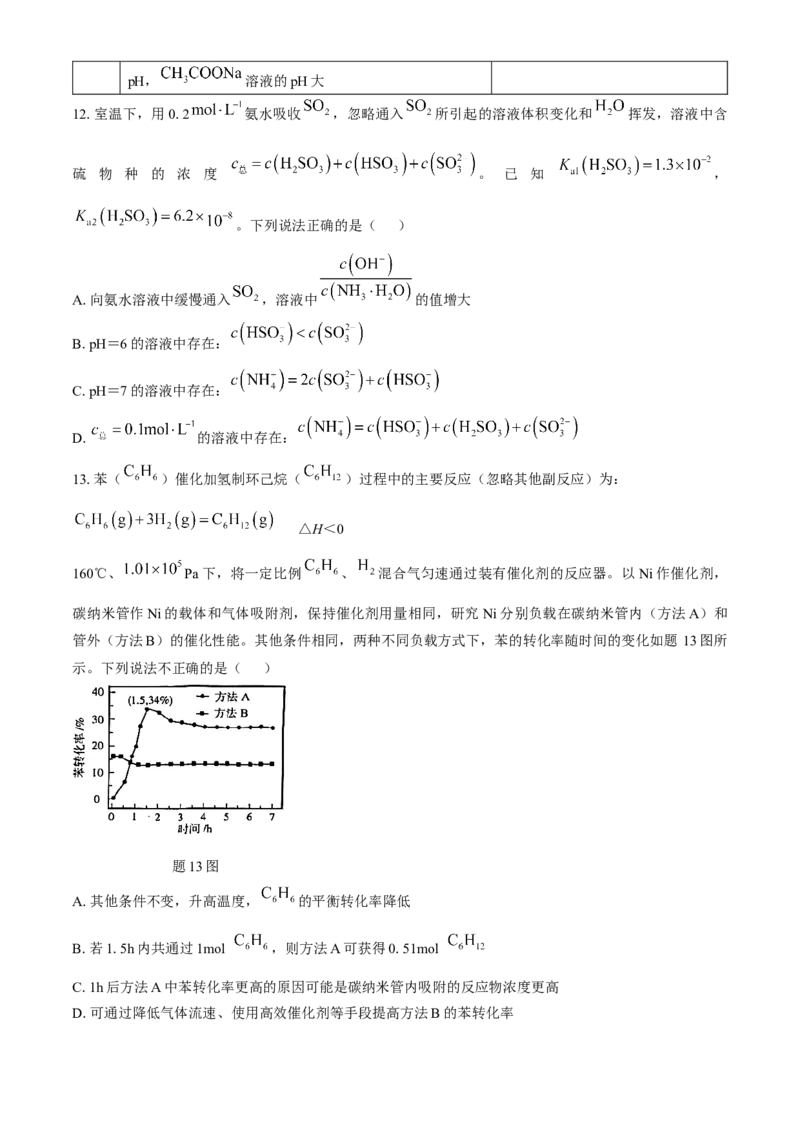
10.水煤气变换反应 △H<0是目前大规模制氢的方法之一。其
他条件不变,相同时间内,向该反应体系中投入一定量的CaO时, 的体积分数如题10图所示。下列关
于水煤气变换反应的说法正确是( )
题10图
A.该反应的平衡常数
B.升高温度,该反应的K值增大
C.一定温度下,增大 或选用高效催化剂,均能提高CO平衡转化率
D.等质量的纳米CaO表面积更大,吸收 更多, 体积分数更大
11.室温下,根据下列实验过程及现象,能验证相应实验结论的是( )
选项 实验过程及现象 实验结论
A 向0.1 溶液中滴加0.1
具有氧化性
溶液,溶液褪色
向2mL 0.1 溶液中滴加5~10滴6
B 平
NaOH溶液,溶液由橙色变为黄色 衡向正反应方向移动
向2mL浓度均为0.1 的NaCl、NaI混合溶液中滴
C
加几滴0.1 溶液,产生黄色沉淀
D
用pH试纸分别测定 溶液和 溶液的 结合 能力:pH, 溶液的pH大
12.室温下,用0.2 氨水吸收 ,忽略通入 所引起的溶液体积变化和 挥发,溶液中含
硫 物 种 的 浓 度 。 已 知 ,
。下列说法正确的是( )
A.向氨水溶液中缓慢通入 ,溶液中 的值增大
B.pH=6的溶液中存在:
C.pH=7的溶液中存在:
D. 的溶液中存在:
13.苯( )催化加氢制环己烷( )过程中的主要反应(忽略其他副反应)为:
△H<0
160℃、 Pa下,将一定比例 、 混合气匀速通过装有催化剂的反应器。以Ni作催化剂,
碳纳米管作Ni的载体和气体吸附剂,保持催化剂用量相同,研究Ni分别负载在碳纳米管内(方法A)和
管外(方法B)的催化性能。其他条件相同,两种不同负载方式下,苯的转化率随时间的变化如题 13图所
示。下列说法不正确的是( )
题13图
A.其他条件不变,升高温度, 的平衡转化率降低
B.若1.5h内共通过1mol ,则方法A可获得0.51mol
C.1h后方法A中苯转化率更高的原因可能是碳纳米管内吸附的反应物浓度更高
D.可通过降低气体流速、使用高效催化剂等手段提高方法B的苯转化率二、非选择题:共4题,共61分。
14.(15分)
碱式硫酸铝[ ]溶液可用于烟气脱硫。
(1)碱式硫酸铝的制备。室温下,边搅拌边向 溶液中分批加入一定量的 粉末,调节溶
液pH为3~4,反应后滤去残渣,得到 溶液。
①制备碱式硫酸铝溶液的过程中生成一种气体,其化学式为 。
②若调节后溶液pH偏高,会导致溶液中铝元素的含量降低,其原因是 。
(2)碱式硫酸铝的应用。碱式硫酸铝溶液吸收 的反应为:
△H<0
用于烟气(含 、 、 等)脱硫,其过程可表示为
①向吸收 后的溶液中通入空气并加热,可得到较纯的 ,同时再生碱式硫酸铝溶液。相同条件下,
再生液的脱硫率始终低于新制碱式硫酸铝溶液,其主要原因是 (用离子方程式表示)。
②为实现 的综合利用,利用 在高温下还原 生成 S 和 ,该反应的化学方程式为
。
(3)脱硫技术比较。石灰石湿法脱硫是应用最广泛的一种技术,其原理是将石灰石粉末加水制成浆液,
由管道输送至吸收塔与烟气充分接触混合,浆液中的 与烟气中的 以及鼓入的空气反应,最终
生成 。
①研究表明,石灰石浆液在进入脱硫装置前,先通一段时间 可提高其脱硫效率,原因是 。
②和石灰石湿法脱硫相比,碱式硫酸铝法脱硫的主要优点 。
15.(15分)
亚硝酸钠( )应用广泛。(1) 的制备。利用NaOH溶液吸收硝酸工业的尾气(含NO、 ),吸收后的溶液经浓缩、结
晶、过滤,得到 固体。
①下列措施能提高尾气中NO和 吸收率的有 (填序号)。
A.采用气、液逆流的方式 B.加快通入尾气的速率 C.定期补加NaOH溶液
②该工艺需控制 ,生成 的反应为 。若
,产品中 含量较高,原因是 (用化学方程式表示)。
(2) 的纯度测定。取 2.50g 样品(杂质为 )配制成 250mL溶液,准确量取
25.00mL待测液于锥形瓶中,加入24.00mL 0.05000 酸性 溶液充分反应,再用0.1000
溶液滴定剩余高锰酸钾至终点。重复上述实验 3 次,平均消耗
溶液10.00mL。
①用 溶液滴定时,达到终点的标志为 。
②滴定时发生的反应有:
试计算样品中 的纯度 (写出计算过程)。
(3) 的应用。 能用于铁制品的防腐处理、制备 。
①将铁制品浸入热的 碱性溶液中,其表面可形成 致密氧化膜,同时有 生成,反应的离
子方程式为 。
②向1.5 溶液中加入等体积1.5 溶液(忽略混合后溶液体积变化),充
分沉淀后溶液中 。[已知 ]16.(16分)
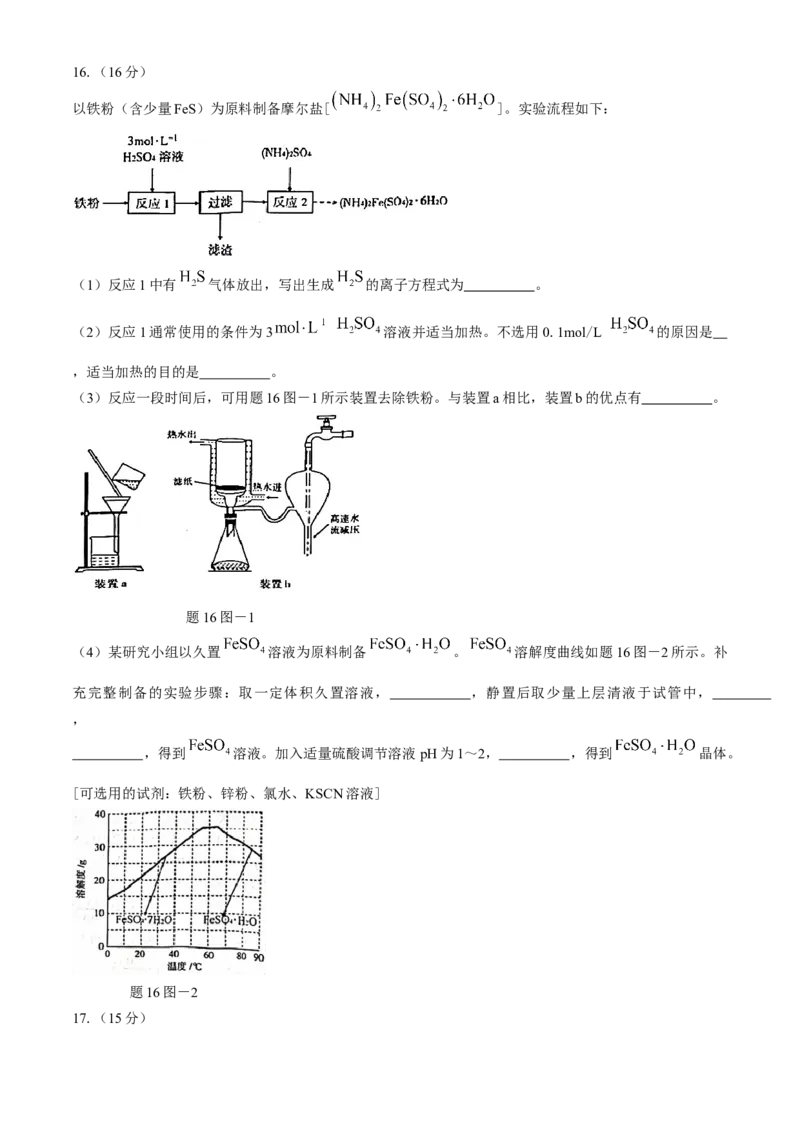
以铁粉(含少量FeS)为原料制备摩尔盐[ ]。实验流程如下:
(1)反应1中有 气体放出,写出生成 的离子方程式为 。
(2)反应1通常使用的条件为3 溶液并适当加热。不选用0.1mol/L 的原因是
,适当加热的目的是 。
(3)反应一段时间后,可用题16图-1所示装置去除铁粉。与装置a相比,装置b的优点有 。
题16图-1
(4)某研究小组以久置 溶液为原料制备 。 溶解度曲线如题16图-2所示。补
充完整制备的实验步骤:取一定体积久置溶液, ,静置后取少量上层清液于试管中,
,
,得到 溶液。加入适量硫酸调节溶液pH为1~2, ,得到 晶体。
[可选用的试剂:铁粉、锌粉、氯水、KSCN溶液]
题16图-2
17.(15分)利用温室气体 制备 、甲醇( )是实现双碳目标的重要方法。
Ⅰ. 加氢制备 。其过程中的主要反应为
反应ⅰ:
反应ⅱ:
(1)反应 的焓变△H= 。
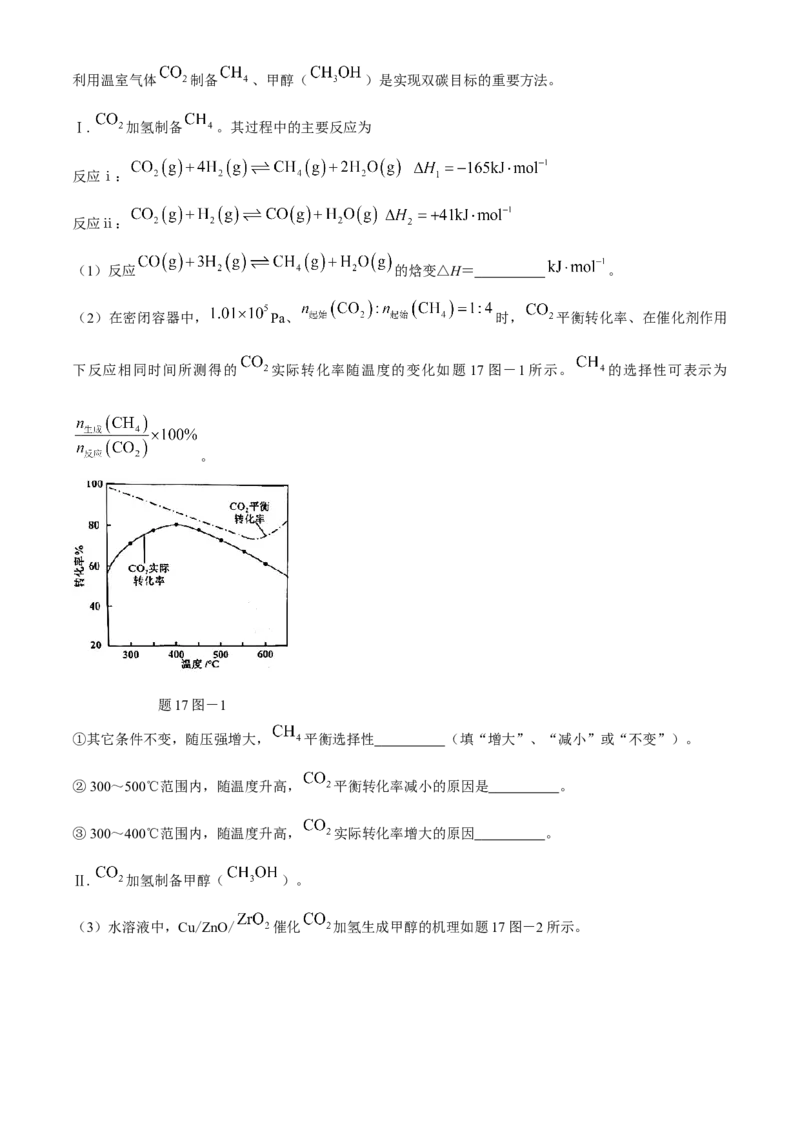
(2)在密闭容器中, Pa、 时, 平衡转化率、在催化剂作用
下反应相同时间所测得的 实际转化率随温度的变化如题 17图-1所示。 的选择性可表示为
。
题17图-1
①其它条件不变,随压强增大, 平衡选择性 (填“增大”、“减小”或“不变”)。
②300~500℃范围内,随温度升高, 平衡转化率减小的原因是 。
③300~400℃范围内,随温度升高, 实际转化率增大的原因 。
Ⅱ. 加氢制备甲醇( )。
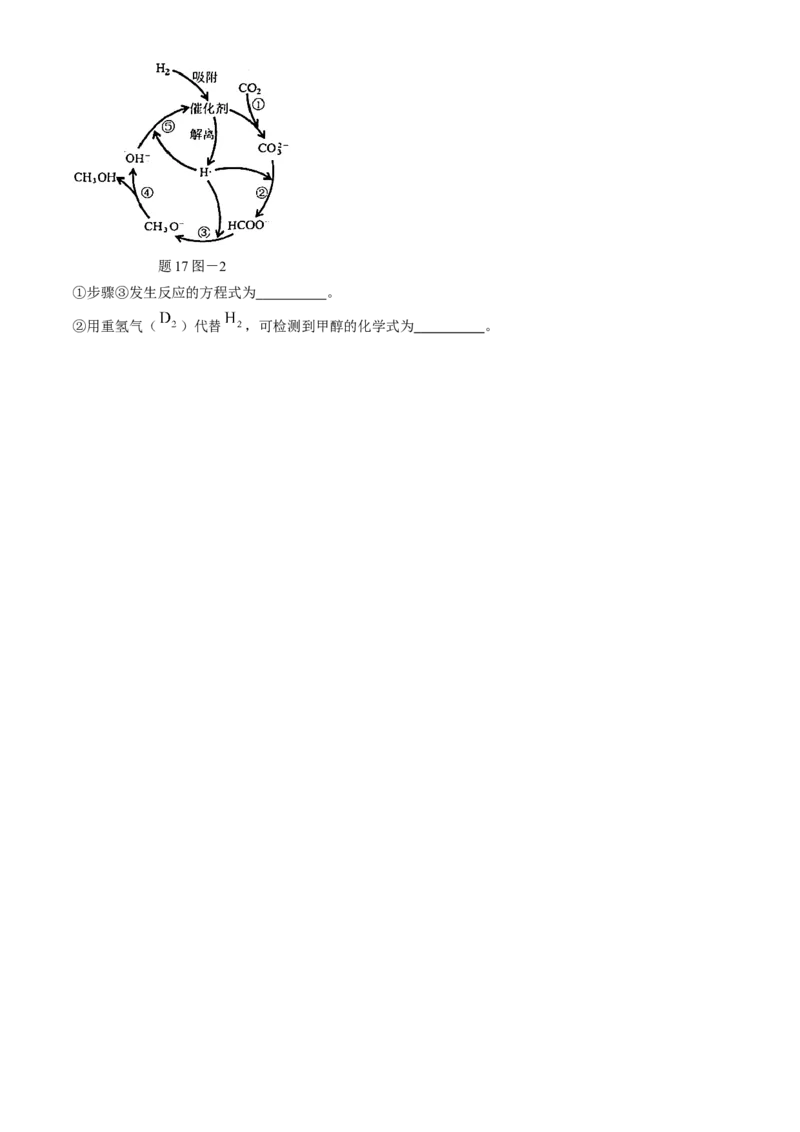
(3)水溶液中,Cu/ZnO/ 催化 加氢生成甲醇的机理如题17图-2所示。题17图-2
①步骤③发生反应的方程式为 。
②用重氢气( )代替 ,可检测到甲醇的化学式为 。