文档内容
石嘴山市第一中学 2025-2026 学年第一学期
高二年级月考 化学试题
一、单选题
1.下列生产、生活等实际应用,能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.用饱和食盐水除去氯气中的少量氯化氢气体
C.对于反应H (g)+I (g)⇌2HI(g),平衡体系加压后颜色变深
2 2
D.在FeSO 溶液中,加入铁粉以防止氧化
4
2.下列图示中,实验操作或方法符合规范的是
B.碱式滴定管排 D.量取15.00 mL
A.调控滴定速度 C.转移溶液
气泡 NaOH溶液
A.A B.B C.C D.D
3.下列有关反应热的说法正确的是
1
A.C(s)+ O (g)=CO(g) ΔH=-110.5kJ/mol是碳单质的燃烧热
2 2
B.已知S(正交,s)=S(单斜,s) ΔH=+0.33kJ/mol,则正交硫比单斜硫稳定
C.H 的燃烧热是285.8kJ/mol,则反应
2
2H O(g)=2H (g)+O (g) ΔH=+571.6kJ/mol
2 2 2
D. 时, ,则含
25℃、101kPa H+(aq)+OH-(aq)=H O(l) ΔH=-57.3kJ/mol
2
0.5molH SO 的稀硫酸与足量氢氧化钡溶液反应放出的热量为57.3kJ
2 4
4.下列关于化学反应与能量的说法正确的是
A.已知正丁烷的燃烧热为2878 kJ·mol-1,则表示正丁烷燃烧热的热化学方程式为
2CHCHCHCH(g)+13O(g)=8CO (g)+10HO(l) ΔH=-2878 kJ·mol-1
3 2 2 3 2 2 2
B.已知在一定条件下,1 mol N 与3 mol H 充分反应生成NH (g),释放出38.6kJ的热
2 2 3
量,则其热化学方程式为N(g)+3H(g)⇌2NH (g) ΔH=-38.6 kJ·mol-1
2 2 3C.已知稀盐酸与稀NaOH溶液发生中和反应的反应热为57.3 kJ·mol-1,则表示稀硫酸
1 1
与稀NaOH溶液反应的热化学方程式为 HSO (aq)+NaOH(aq)= NaSO (aq)
2 4 2 4
2 2
+H O(l) ΔH=-57.3 kJ·mol-1
2
D.已知C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1,则金刚石比石墨稳定
5.下列依据热化学方程式得出的结论正确的是
选
热化学方程式 结论
项
A 2C(s)+2O(g)=2CO (g) ΔH 2C(s)+O(g)=2CO(g) ΔH ΔH>ΔH
2 2 1 2 2 1 2
>13.2°C
Sn(s,灰) ⇌ Sn(s,白) ΔH=+2.1kJ·mol-1(灰锡为粉末 锡制品在炎热的夏天更容
B
<13.2°C 易损坏
状,白锡为块状)
C P(s,白磷)=4P(s,红磷) ΔH=-29.2kJ·mol-1 常温下,红磷比白磷稳定
4
H 的燃烧热
D 2H(g)+O(g)=2HO(g) ΔH=-483.6kJ·mol-1 2
2 2 2 ΔH=-241.8kJ·mol-1
A.A B.B C.C D.D
6.在C(s)+CO (g)=2CO(g)的反应中,采取下列措施能够使反应速率减慢的是
2
①扩大容器体积;②减小CO浓度;③减少碳的量;④恒压下充入He;⑤恒容下充入He;
⑥降低温度;⑦将碳粉碎
A.①②④⑤ B.②③⑤⑥ C.①②④⑥ D.①③⑥
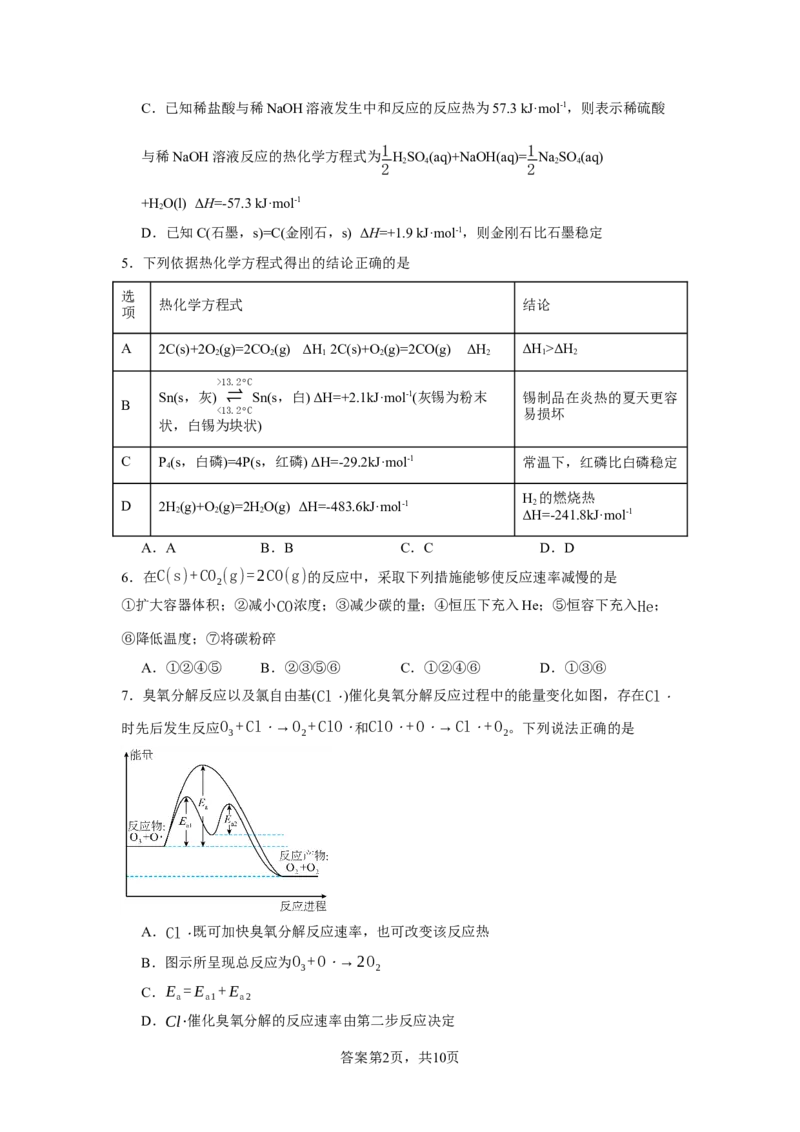
7.臭氧分解反应以及氯自由基(Cl⋅)催化臭氧分解反应过程中的能量变化如图,存在Cl⋅
时先后发生反应O +Cl⋅→O +ClO⋅和ClO⋅+O⋅→Cl⋅+O 。下列说法正确的是
3 2 2
A.Cl⋅既可加快臭氧分解反应速率,也可改变该反应热
B.图示所呈现总反应为O +O⋅→2O
3 2
C.E =E +E
a a1 a2
D.Cl·催化臭氧分解的反应速率由第二步反应决定
答案第2页,共10页8.TiCl 是最重要的钛的卤化物,是生产海绵钛和钛白的重要原料,用TiO 制备TiCl 的
4 2 4
方法有直接氯化法①和碳氯化法②,反应如下:
①
TiO (s)+2Cl (g)=TiCl (g)+O (g) ΔH =+172kJ⋅mol-1K
2 2 4 2 1 1
②
TiO (s)+2Cl (g)+2C(s)=TiCl (g)+2CO(g)ΔH =-51kJ⋅mol-1K
2 2 4 2 2
下列说法正确的是
A.直接氯化法ΔS>0
B.相同温度下2C(s)+O (g)=2CO(g)的平衡常数K=K -K
2 2 1
C.对于反应②,温度升高,平衡转化率增大
D.其他条件不变,反应①平衡时,增加TiO (s)的量平衡正向移动
2
9.利用甲烷可以除去SO ,反应为8SO (g)+6CH (g)⇌S(g)+6CO (g)+12HO(g)。下列说法
3 3 4 8 2 2
正确的是
A.上述反应的 S<0
B.上述反应的化
△
学平衡常数K=
c(S
8
)⋅c6(CO
2
)
c8(SO )⋅c6(CH )
3 4
C.及时分离出HO(g),正反应速率增大,平衡向正反应方向移动
2
D.上述反应中生成lmolS,转移电子的数目约为48×6.02×1023
8
10.N 是阿伏加德罗常数的值,下列说法错误的是
A
A.1 mol乙二醇中采取sp3杂化的原子总数为2N
A
B.标准状况下,11.2 L乙炔中π键的数目为N
A
C.31 g P 分子中孤电子对数为N
4 A
D.1 mol [Cr(NH)(H O) Cl]2+中配位键的数目为6N
3 3 2 2 A
11.下列有关分子结构的说法正确的是
A.根据等电子原理,O 与SO 均具有V型结构,属极性分子,其中心原子均为sp3杂
3 2
化
B.C与O的电负性差比N与O的电负性差大,故CO分子的极性比NO分子强
C.HO的沸点比HF高,但F-H …F氢键键能比O-H …O 氢键键能大
2
D.AlCl 在气态或非极性溶剂中均是通过氯桥键二聚成Al Cl,分子空间构型为四面
3 2 6
体,分子中8个Al-Cl键键长和键能均相同
12.常温下,根据下列实验操作和现象所得到的结论正确的是选
实验操作和现象 结论
项
用pH试纸测得等浓度的CH COONa溶液的pH约为 酸性强弱:
A 3
9,NaNO
2
溶液的pH约为8 CH
3
COOH0
加深 2 2 4
向溶有SO 的BaCl 溶液中通入气体X,出现白色沉
D 2 2 气体X一定具有强氧化性
淀
A.A B.B C.C D.D
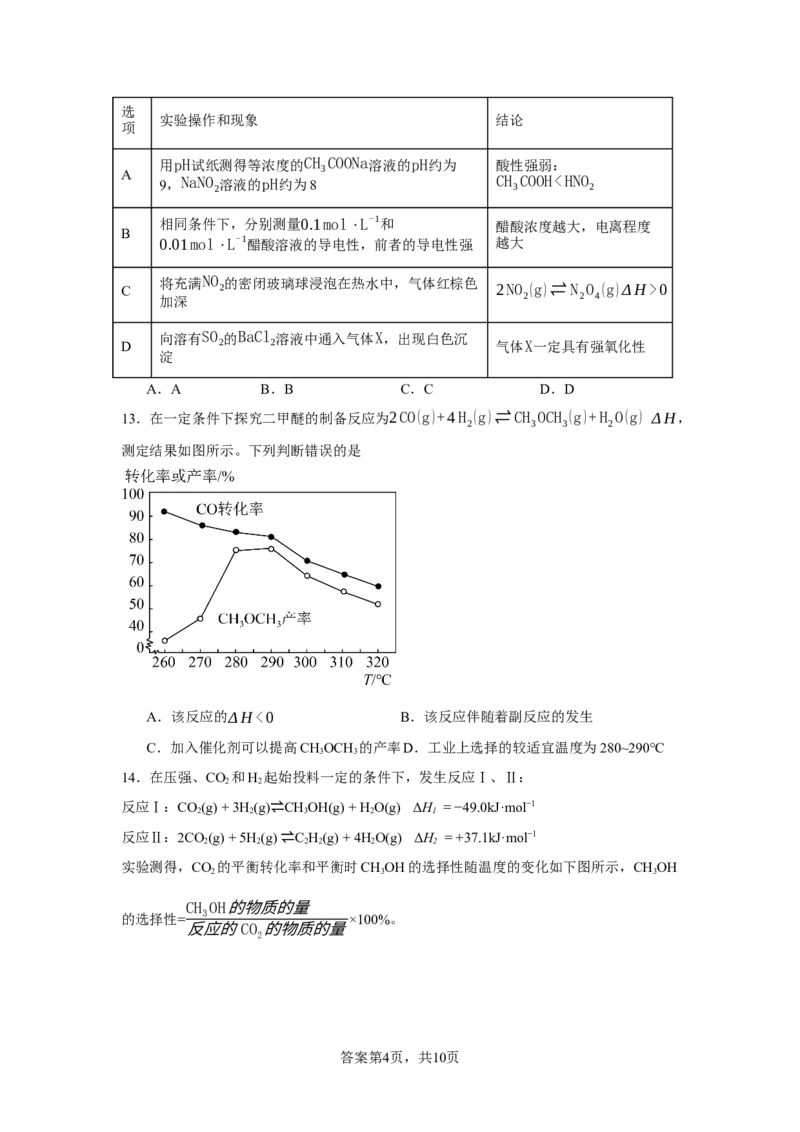
13.在一定条件下探究二甲醚的制备反应为2CO(g)+4H (g)⇌CH OCH (g)+H O(g) ΔH,
2 3 3 2
测定结果如图所示。下列判断错误的是
A.该反应的ΔH<0 B.该反应伴随着副反应的发生
C.加入催化剂可以提高CHOCH 的产率D.工业上选择的较适宜温度为280~290℃
3 3
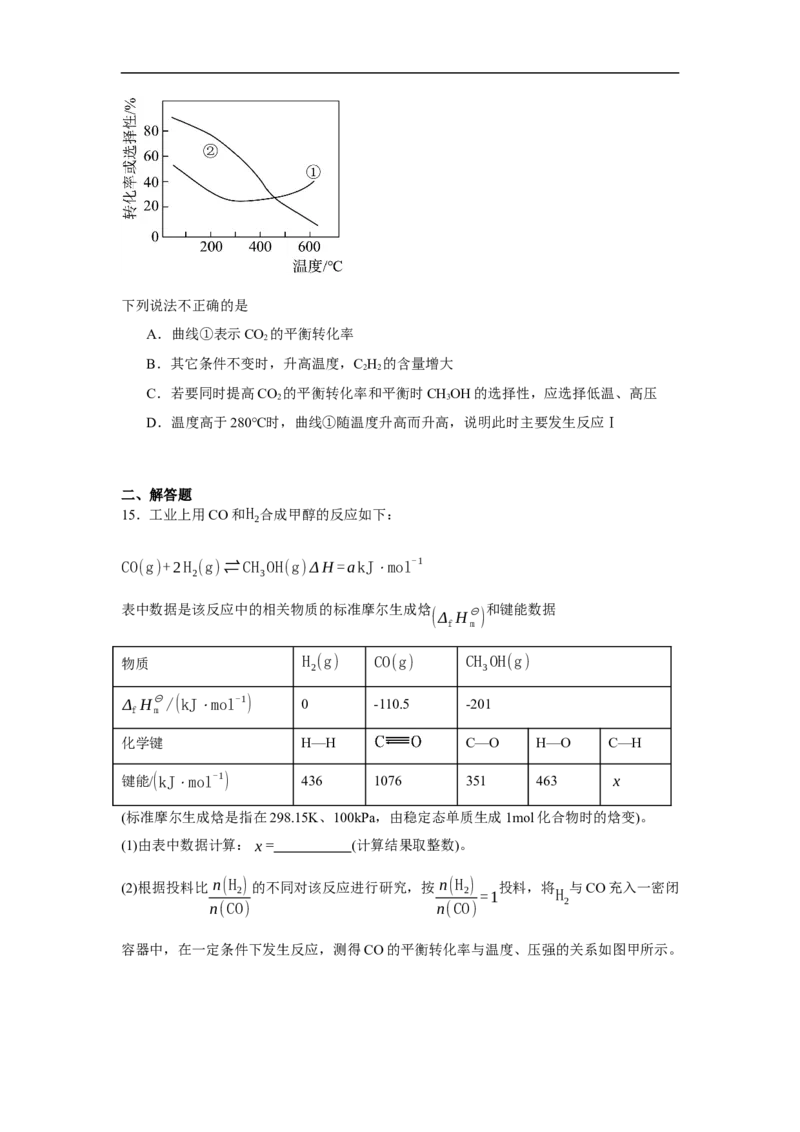
14.在压强、CO 和H 起始投料一定的条件下,发生反应Ⅰ、Ⅱ:
2 2
反应Ⅰ:CO(g) + 3H(g)⇌CH OH(g) + H O(g) ΔH = −49.0kJ·mol−1
2 2 3 2 1
反应Ⅱ:2CO(g) + 5H(g) ⇌C H(g) + 4HO(g) ΔH = +37.1kJ·mol−1
2 2 2 2 2 2
实验测得,CO 的平衡转化率和平衡时CHOH的选择性随温度的变化如下图所示,CHOH
2 3 3
CH OH的物质的量
的选择性= 3 ×100%。
反应的CO 的物质的量
2
答案第4页,共10页下列说法不正确的是
A.曲线①表示CO 的平衡转化率
2
B.其它条件不变时,升高温度,C H 的含量增大
2 2
C.若要同时提高CO 的平衡转化率和平衡时CHOH的选择性,应选择低温、高压
2 3
D.温度高于280℃时,曲线①随温度升高而升高,说明此时主要发生反应Ⅰ
二、解答题
15.工业上用CO和H 合成甲醇的反应如下:
2
CO(g)+2H (g)⇌CH OH(g)ΔH=akJ⋅mol-1
2 3
表中数据是该反应中的相关物质的标准摩尔生成焓 和键能数据
(Δ H⊖)
f m
物质 H (g) CO(g) CH OH(g)
2 3
Δ H⊖/(kJ⋅mol-1) 0 -110.5 -201
f m
化学键 H—H C—O H—O C—H
键能/(kJ⋅mol-1) 436 1076 351 463 x
(标准摩尔生成焓是指在298.15K、100kPa,由稳定态单质生成1mol化合物时的焓变)。
(1)由表中数据计算: x = (计算结果取整数)。
(2)根据投料比 n(H ) 的不同对该反应进行研究,按 n(H ) 投料,将 与CO充入一密闭
2 2 =1 H
n(CO) n(CO) 2
容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图甲所示。① 、压强为 时,若密闭容器容积为 ,向其中充入3mol 和3molCO发生反应,
T °C p V L H
1 3 2
5min后反应达到平衡,则0~5min内, 。
v(H )= mol⋅L-1 ⋅min-1
2
②若 N 点对应的压强为p ,则反应处于该点时v v (填“>”“<”或“=”)。
3 正 逆
(3)T°C时,向恒容容器中充入物质的量之和恒定的H 和CO,达到平衡时CH OH的体积分数
2 3
与起始时 n(H ) 的关系如图乙所示。
2
n(CO)
答案第6页,共10页①若起始时 n(H
2
)
=3
,反应达到平衡状态后,
CH OH
的体积分数可能对应图乙中的
n(CO) 3
(填“ D”“ E ”或“ F ”)点。
②起始时 n(H ) ,维持体系初始态和终态温度为 ,体系总压强 与时间 的关
2 =1.5 T°C (p) (t)
n(CO)
系如图丙中曲线I所示,曲线Ⅱ为只改变某一条件的变化曲线,该条件可能为 ,
判断的理由是 。T°C该反应的K = (用含p 的表达式表示,用平衡
p 0
分压代替平衡浓度计算,分压=总压×物质的量分数)。
16.按要求作答
(1)25℃、101kPa条件下充分燃烧一定量的丁烷气体生成0.25moLCO 和液态水时,放出的
2
热量为Q kJ,写出表示丁烷标准燃烧热的热化学方程式: 。
(2)已知下列热化学方程式:
①
CH COOH(l)+2O (g)=2CO (g)+2H O(l)ΔH =-870.3kJ⋅mol-1
3 2 2 2 1
②
C(s)+O (g)=CO (g) ΔH =-393.5kJ⋅mol-1
2 2 2
③
2H (g)+O (g)=2H O(1)ΔH =-571.6kJ⋅mol-1
2 2 2 3
写出由C(s)、H (g)和O (g)化合生成CH COOH(l)的热化学方程式: 。
2 2 3
(3)写出铅蓄电池放电过程正极的电极反应式为: ;铅蓄电池充电过程中与电源负
极相连的电极的电极反应式为: 。
(4)某燃料电池是以氢氧化钠为电解质、甲醇为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。该燃料电池负极的电极反应式为 。
17.某化学兴趣小组的同学,组装了如下电化学装置。
(1)已知:电极a、b、c、d、e、f均为石墨电极,g和h电极是粗银或纯银电极。
已知:电解一段时间电极f附近溶液变为红色,铁钉k附近溶液也变为红色。
回答下列问题:
①接线柱m连接直流电源的 (填“正极”“负极”“阳极”或“阴极”,下同),
电极c是 。
②写出电极a上发生的电极反应 。写出铁钉k上发生的电极反应 。
写出检验电极e上生成的气体的方法 。
③若D装置为电解精炼银,则g电极是 。
④若电解一段时间后,若b电极质量增重5.4g,则装置B中产生标准状况下的气体总体积
为 L。
(2)某无隔膜流动海水电解法制H 的装置如下图所示,其中高选择性催化剂PRT可抑制O 产
2 2
生,催化剂MnO 可抑制HClO进一步反应。
x
①b电极是 (填“正极”“负极”“阳极”或“阴极”)。
②写出放电时钛网上发生的电极反应 。
③电解一段时间后,海水的pH将 (填“增大”“减小”或“不变”)。
18.为了缓解温室效应与能源供应之间的冲突,从空气中捕集CO 并将其转化为燃料或增
2
值化学品成为了新的研究热点。
(1)电解法转化CO 可实现CO 资源化利用。电解CO 制HCOOH的原理示意图如图1。
2 2 2
答案第8页,共10页①写出阴极CO 还原为HCOO-的电极反应式: 。
2
②电解一段时间后,阳极区的KHCO 溶液浓度降低,其原因是 。
3
(2)CO 催化加氢合成二甲醚是一种CO 转化方法,其过程中主要发生下列反应:
2 2
反应I:CO(g)+H(g)=CO(g)+HO(g) ΔH=41.2kJ/mol
2 2 2
反应Ⅱ:2CO(g)+6H(g)=CH OCH (g)+3HO(g) ΔH=-122.5kJ/mol
2 2 3 3 2
在恒压、CO 和H 的起始量一定的条件下,CO 平衡转化率和平衡时CHOCH 的选择性随
2 2 2 3 3
2×CH OCH 的物质的量
温度的变化如图2。其中:CHOCH 的选择性= 3 3 ×100%
3 3 反应的CO 的物质的量
2
①温度高于300℃,CO 平衡转化率随温度升高而上升的原因是 。
2
②220℃时,在催化剂作用下CO 与H 反应一段时间后,测得CHOCH 的选择性为48%(图
2 2 3 3
中A点)。不改变反应时间和温度,一定能提高CHOCH 选择性的措施有 。
3 3
(3)用光电化学法将CO 还原为有机物实现碳资源的再生利用,其装置如图3所示。其他条
2
件一定时,含碳还原产物的法拉第效率[FE(X)= n (生成X得到的电子) ×100%]随电
X
n (通过电极的总的电子)
总压的变化如图4所示。
①当电解电压为0.7V,阴极发生的电极反应式为 。
答案第10页,共10页