文档内容
泰安一中新校区 2024-2025 学年第一学期高三第二次教学质量检测
化学试题
2024年11月
相对原子质量:H-1 N-14 O-16 P-31 S-32 Cl-35.5 Fe-56 Co-59 I-127
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 2024年中国“硬核科技”凸显中国新质生产力。下列说法正确的是
A. 中国003航母外壳使用的镍铬钢是一种陶瓷材料
B. 我国在月球表面成功展开的五星红旗使用的材料芳纶属于合成纤维
C. 颗粒直径1~100nm的纳米氧化锌粉末是一种胶体
D. 一种高性能涂料的主要成分石墨烯属于不饱和有机物
2. 化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是
A. 进行焰色试验时,可用玻璃棒替代铂丝
B. 氢氟酸溶液应盛放在细口玻璃瓶中
C. 容量瓶、滴定管、分液漏斗使用前均需要检验是否漏液
D. 制备金属镁的电解装置失火时,可以使用二氧化碳灭火器灭火
3. 关于元素及其化合物的性质,下列说法正确的是
A. 漂白粉和洁厕净可混合使用以提高消毒效果
B. 浓硫酸具有吸水性,所以用浓硫酸在纸上书写时字迹变黑
C. 硝酸见光、受热易分解,一般保存在棕色试剂瓶中,并放置在阴凉处
D. La-Ni储氢合金在加热条件下可与氢气反应生成稳定的金属氢化物
4. 宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式书写错误的是
A. 溶液与少量的 溶液混合:
B. 向“84”消毒液中通入过量 :
C. 固体与氢碘酸反应:
D. 向 溶液中滴加足量NaOH溶液:5. X、Y、Z、W是原子半径依次增大的短周期主族元素,其中X元素与其他元素不在同一周期,Y的一
种核素常用于测定文物年代,基态Z原子的最外层电子数是次外层电子数的 。下列说法错误的是
A. W单质可以与水反应生成气体
B. 最高价氧化物的水化物的碱性Z大于W
C. X与Y组成的化合物沸点可能比水的高
D. X、Y、Z、W的单质均可以在空气中燃烧
6. 钠和钠的化合物有许多重要的用途,如碳酸钠可用于从海水中提取溴,涉及的反应为
。下列说法错误的是
A. 用双线桥法标出电子的转移:
B. 该反应中氧化剂与还原剂的物质的量之比是5∶1
C. 等物质的量的 和 分别与足量的盐酸反应,在相同条件下 产生 的体积
小于 产生的
D. 碳酸氢钠溶于水显碱性,可用于去除油污
的
7. 下列选项中 物质按图示路径不能一步转化的是
选
A B C D
项
X CO Cu O Al O Fe
2 2 2 3
Cu(NO ) Na[Al(OH)
Y NaCO 3 4 Fe O
2 3 ] 2 3
2
NaHCO Fe(OH)
Z Cu(OH) Al(OH)
2 3
3 3A. A B. B C. C D. D
8. 一种生成高铁酸钠的反应为 。设 为阿
伏加德罗常数的值,下列说法正确的是
A. 常温下, 的 溶液中,水电离出的 数为
B. 该反应中每生成2.24 L(标准状况下)的O,转移的电子数为
2
C. 等物质的量的 和 分别与水反应,生成的NaOH分子数均为
D. 浓度均为 的 溶液和 溶液中, 数目均为
9. 下列实验仪器或装置的选择正确的是
A.稀释浓硫酸 B.除去 中的HCl
D.盛装氢氟酸的试剂
C.蒸馏用冷凝管
瓶
A. A B. B C. C D. D
10. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案 现象 结论
A 往FeCl 溶液中加入Cu片 溶液逐渐变蓝 Fe2+的氧化能力比Cu2+强
2
往FeCl 溶液中滴加KSCN溶液,再 溶液先变成红色,后红色
B 3 KCl稀释了溶液,红色变浅
加入少量KCl固体 变浅
有特征蓝色沉淀 铁锈的主要成分为FeO
C 用盐酸浸泡带有铁锈的铁钉,滴加K[Fe(CN) ]溶液
3 6
向沸水中逐滴加5~6滴饱和FeCl 溶 液体先变成红褐色,然后 Fe3+先水解得Fe(OH) 胶体,再聚
D 3 3
液,持续煮沸 析出红褐色沉淀 集成Fe(OH) 沉淀
3
A. A B. B C. C D. D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全
部选对得4分,选对但不全的得2分,有选错的得0分。
11. 某同学按图示装置进行实验,将溶液a滴入锥形瓶中与固体b发生反应,生成的气体通入c中至过量。
下列所选物质组合及现象均符合要求的是
a b c C中现象
A 饱和 溶液 溶液 黑色沉淀
B 浓硫酸 Cu 溶液 溶液变浑浊
饱和 溶
C 稀硫酸 白色沉淀
液
D 浓氨水 碱石灰 溶液 白色沉淀
A. A B. B C. C D. D
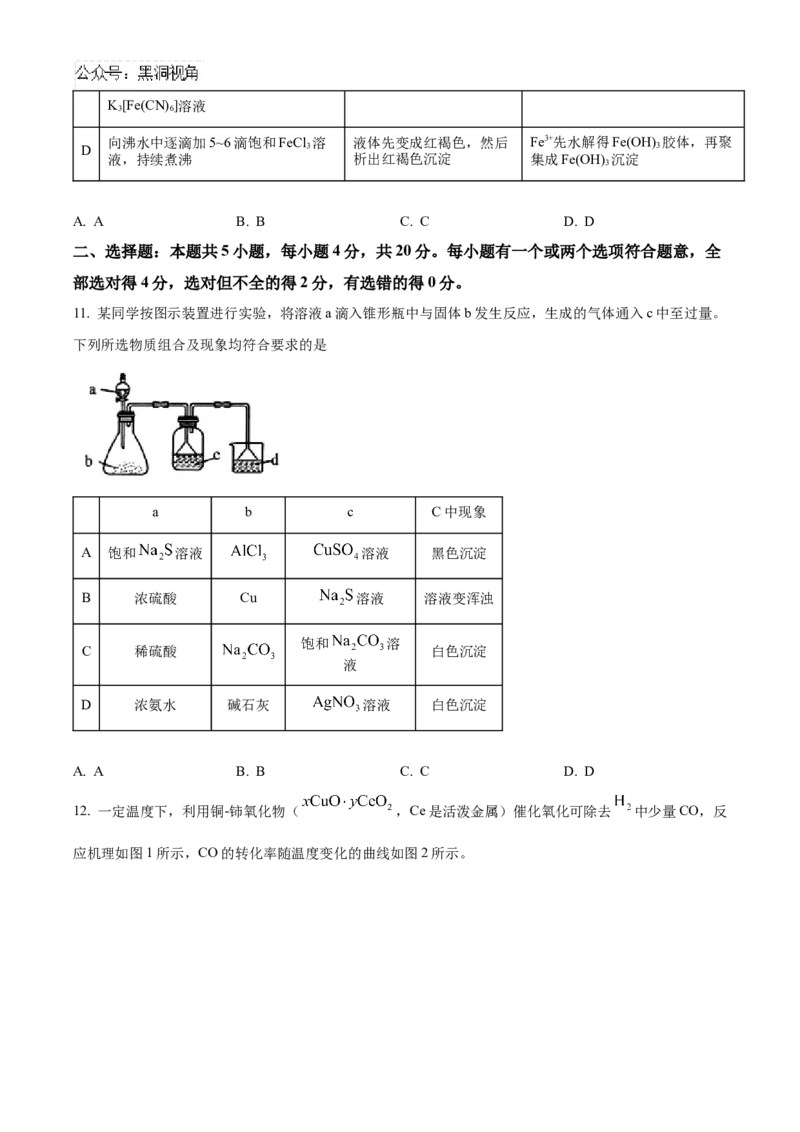
12. 一定温度下,利用铜-铈氧化物( ,Ce是活泼金属)催化氧化可除去 中少量CO,反
应机理如图1所示,CO的转化率随温度变化的曲线如图2所示。下列说法错误的是
A. 步骤(ⅰ)中,元素Cu、Ce化合价均不变
B. 图2中超过150℃时,CO的转化率下降可能是因为高温下催化剂被 还原
C. 若用 参与反应,一段时间后, 一定会出现在铜-铈氧化物中
D. 步骤(ⅲ)中有极性键的断裂和形成
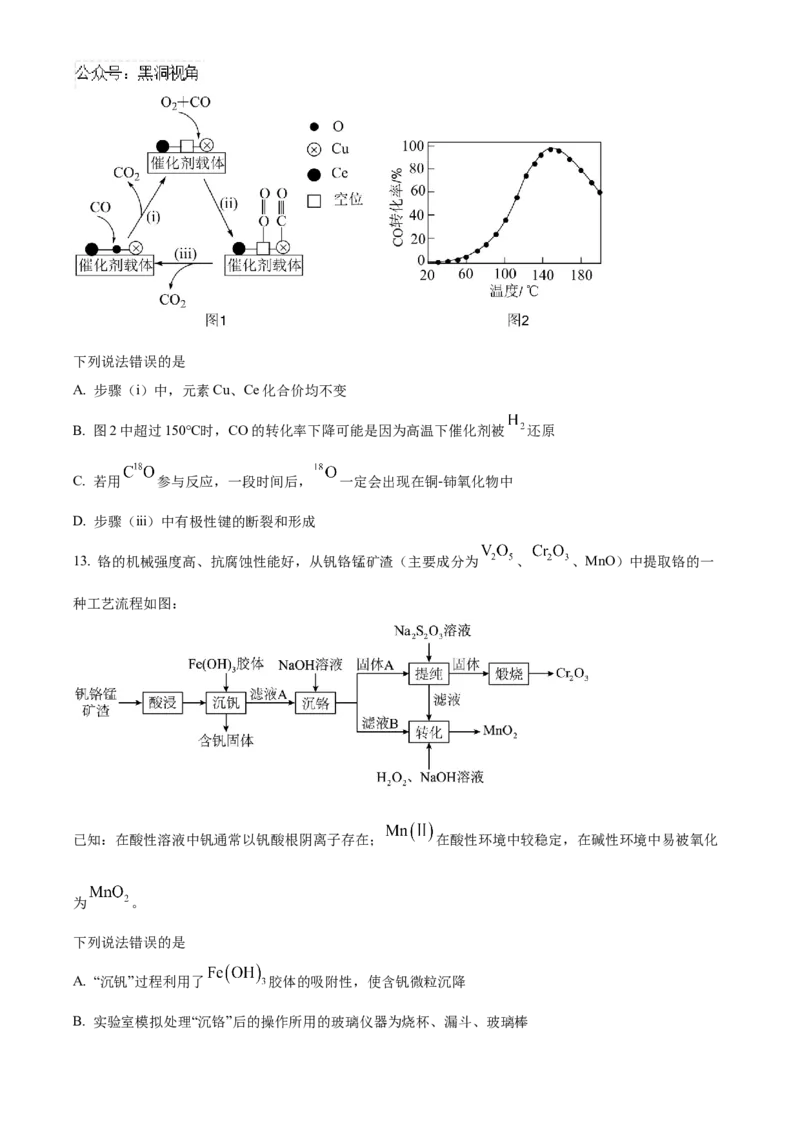
13. 铬的机械强度高、抗腐蚀性能好,从钒铬锰矿渣(主要成分为 、 、MnO)中提取铬的一
种工艺流程如图:
已知:在酸性溶液中钒通常以钒酸根阴离子存在; 在酸性环境中较稳定,在碱性环境中易被氧化
为 。
下列说法错误的是
A. “沉钒”过程利用了 胶体的吸附性,使含钒微粒沉降
B. 实验室模拟处理“沉铬”后的操作所用的玻璃仪器为烧杯、漏斗、玻璃棒C. “提纯”过程中使用 溶液,原因是 有还原性,将锰元素还原,实现与铬元素的分离
D. “转化”过程中发生反应为
14. CuCl常用作有机合成的催化剂,实验室用 混合液与 溶液反应制取CuCl(装置
如图),已知溶液 时产率最高,CuCl难溶于水,可发生反应: ,
。
下列说法正确的是
A. 仪器1中的试剂应为 溶液
的
B. 仪器2中 试剂滴入仪器1中开始反应的离子方程式为
C. 用 混合溶液代替 溶液可维持pH稳定,保证CuCl产率较高
D. 反应完成后需将仪器1中混合物经稀释、过滤、洗涤、干燥后才可获得产品
15. 某小组同学向 的 的 溶液中分别加入过量的Mg粉、Zn粉和Cu粉,探究溶液
中的氧化剂及其还原产物,实验记录如下表所示。
实
金属 操作、现象及产物
验
过量 有大量气泡产生,pH逐渐增大,产生大量红褐色沉淀后,持续产生大量气泡,当溶液pH
Ⅰ
Mg 为3~4时,取出固体,检测到Fe单质
Ⅱ 过量 一段时间后有少量气泡产生,pH逐渐增大,产生大量红褐色沉淀后,无气泡冒出,此时溶Zn 液pH为3~4,取出固体,未检测到Fe单质
过量
Ⅲ 一段时间后,溶液逐渐变为蓝绿色,固体中未检测到Fe单质
Cu
下列说法错误的是
A. 实验Ⅰ中检测到Fe单质的原因是实验中产生大量气泡使镁粉不易被沉淀包裹
B. 实验Ⅱ中Zn与溶液中的 反应使pH升高,生成红褐色沉淀
C. 实验Ⅲ中蓝绿色溶液为 溶液
D. Cu和Zn都不能将 还原为Fe
三、非选择题:本题共5小题,共60分。
16. 短周期主族元素X、Y、Z、M、W的原子序数依次增大,由X元素和Z元素组成的化合物P能用作潜
艇的供氧剂,在一定条件下 与 能通过反应 转化( 与
离子中各原子最外层均满足8电子稳定结构)。请回答下列问题:
(1)M单质与Z的最高价氧化物的水化物反应的离子方程式为_______。
(2)上述非金属元素中,原子得电子能力最强的是_______(填元素名称)。
(3) 的结构式为_______。
(4)实验室制取W元素单质的离子方程式为_______;用排空气法收集W元素单质时验满的方法是
_______。
17. 复盐A的结晶水合物(摩尔质量为392 )有如图转化关系,回答下列问题:
已知:
①A中含两种阳离子和一种阴离子,三种离子的物质的量之比为2:1:2;
②1mol G失去3mol电子转化成H,H是一种绿色净水剂和消毒剂;③J是空气的主要成分之一。
(1)A的结晶水合物是_______(填化学式,下同);I是_______。
(2)E的电子式为_______。
(3)反应④的离子方程式为_______。
(4)标准状况下,反应⑥生成11.2L气体J时转移_______mol电子 。
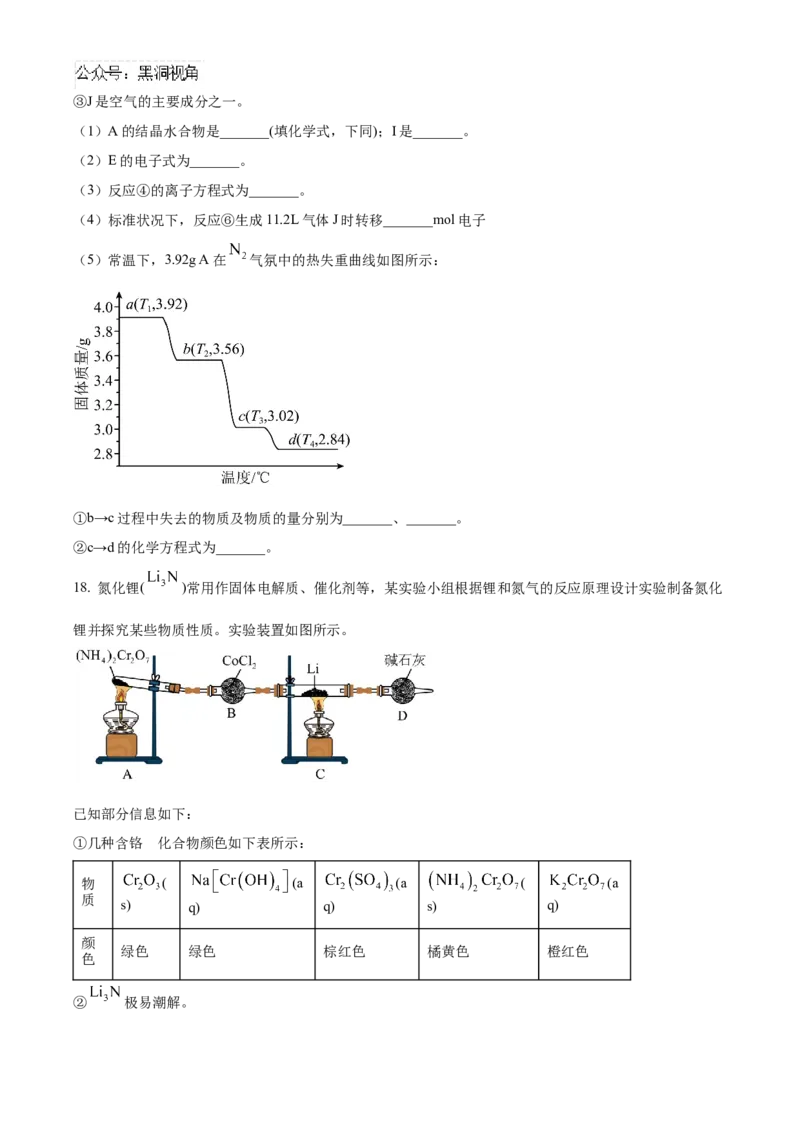
(5)常温下,3.92g A在 气氛中的热失重曲线如图所示:
①b→c过程中失去的物质及物质的量分别为_______、_______。
②c→d的化学方程式为_______。
18. 氮化锂( )常用作固体电解质、催化剂等,某实验小组根据锂和氮气的反应原理设计实验制备氮化
锂并探究某些物质性质。实验装置如图所示。
已知部分信息如下:
①几种含铬 的化合物颜色如下表所示:
物 ( (a (a ( (a
质
s) q) q) s) q)
颜
绿色 绿色 棕红色 橘黄色 橙红色
色
② 极易潮解。回答下列问题:
在
(1)实验室将锂贮存于_______中,锂 空气中加热会生成_______(填化学式)。
(2)实验时,先点燃_______(填“A”或“C”)处酒精灯,后点燃另一处酒精灯。
(3)当A装置中黄色粉末全部变为绿色时熄灭A处酒精灯,写出该反应的化学方程式:_______。
(4)实验完毕后,取A装置中绿色粉末X进行如下实验:
序
操作 现象
号
I 向X中加入稀硫酸,振荡 溶液变为棕红色
II 向X中加入NaOH溶液,振荡 溶液变为绿色
向X中加入 ₄溶液,煮 绿色粉末溶解,产生黑色沉淀Y,溶液变为橙
III
红色
沸
①根据上述实验推知, 性质与下列物质最相似的是_______(填字母)。
a. b. c.MgO d.
②已知:黑色固体Y常用于实验室制备 和 。写出实验Ⅲ中反应的离子方程式:_______,由此推知,
该反应中氧化性; _______ (填“>”“<”或“=”)。
(5)设计实验探究C装置残留固体中是否有锂:_______。
(6)为了测定实验后B中固体( )组成,进行如下实验:取2.38gB中固体溶于去离子水,配
制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶,用0.1 溶液滴定,测得消耗
溶液体积为20.00mL。已知 见光易分解,为了减少实验误差,实验中 溶液应盛放
在棕色酸式滴定管中,x=_______。
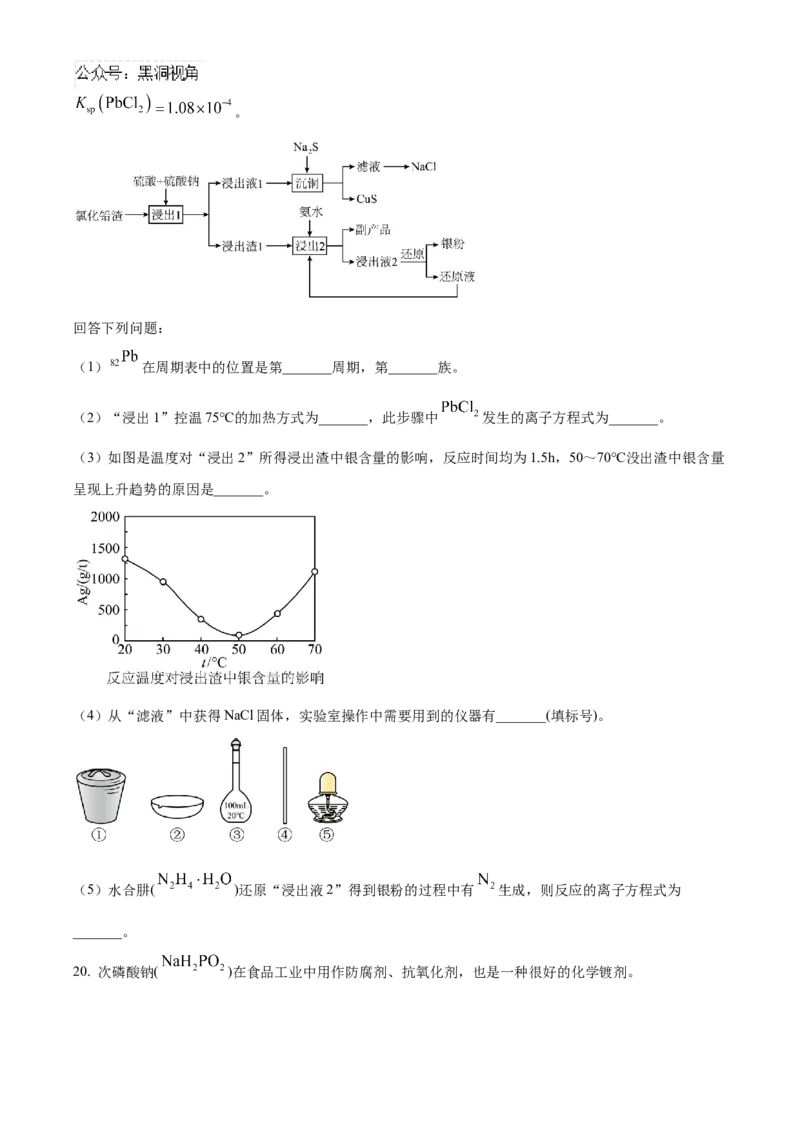
19. 以精铋生产过程中产生的氯化铅渣(含 、 及AgCl)为原料回收铜、银、铅的工艺流程如下
图。已知, , , ,。
回答下列问题:
(1) 在周期表中的位置是第_______周期,第_______族。
(2)“浸出1”控温75℃的加热方式为_______,此步骤中 发生的离子方程式为_______。
(3)如图是温度对“浸出2”所得浸出渣中银含量的影响,反应时间均为1.5h,50~70℃没出渣中银含量
呈现上升趋势的原因是_______。
(4)从“滤液”中获得NaCl固体,实验室操作中需要用到的仪器有_______(填标号)。
(5)水合肼( )还原“浸出液2”得到银粉的过程中有 生成,则反应的离子方程式为
_______。
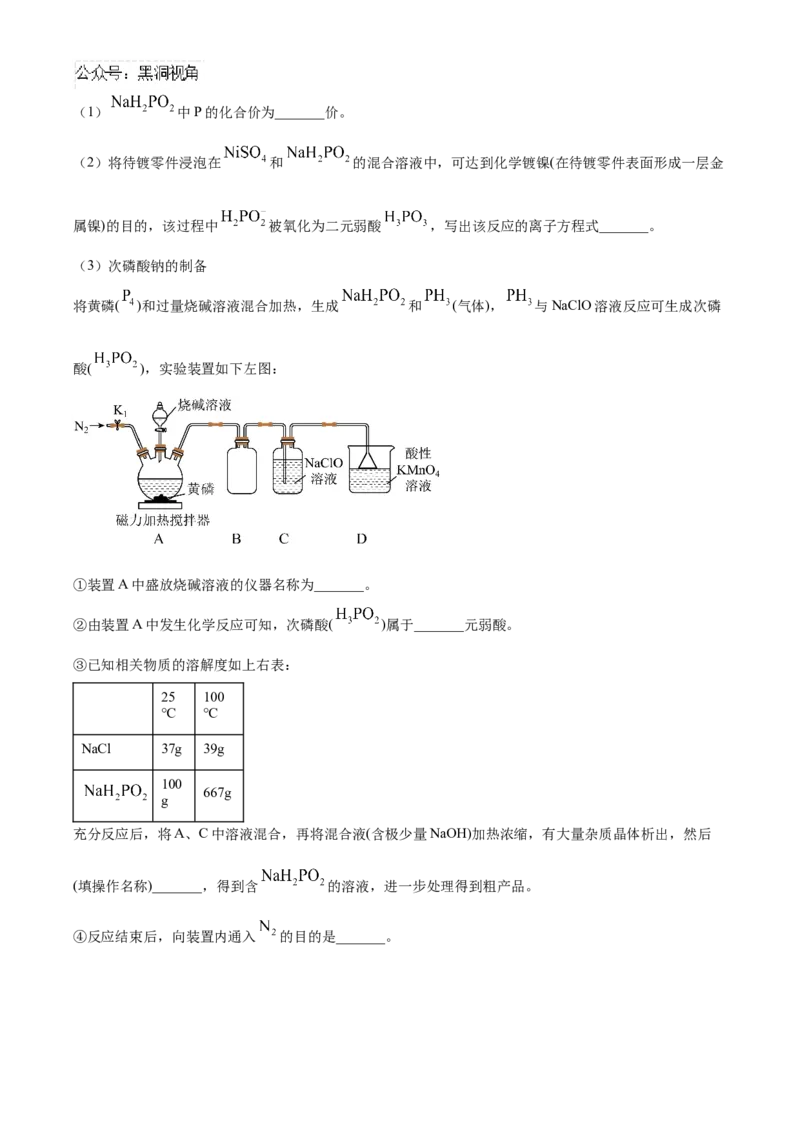
20. 次磷酸钠( )在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。(1) 中P的化合价为_______价。
(2)将待镀零件浸泡在 和 的混合溶液中,可达到化学镀镍(在待镀零件表面形成一层金
属镍)的目的,该过程中 被氧化为二元弱酸 ,写出该反应的离子方程式_______。
(3)次磷酸钠的制备
将黄磷( )和过量烧碱溶液混合加热,生成 和 (气体), 与NaClO溶液反应可生成次磷
酸( ),实验装置如下左图:
①装置A中盛放烧碱溶液的仪器名称为_______。
②由装置A中发生化学反应可知,次磷酸( )属于_______元弱酸。
③已知相关物质的溶解度如上右表:
25 100
℃ ℃
NaCl 37g 39g
100
667g
g
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后
(填操作名称)_______,得到含 的溶液,进一步处理得到粗产品。
④反应结束后,向装置内通入 的目的是_______。