文档内容
高二化学试题
可能用到的相对原子质量:H-1 C-12 N-14 O-16 F-19 Na-23 S-32 K-39 Ca-40
Ni-59 Se-79
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1. 化学与生产、生活和科研密切相关,下列说法错误的是( )
A. 质谱可用于快速、微量、精确测定有机物的相对分子质量
B. 维生素C具有还原性,有抗氧化的作用
C. 医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于烃
D. 我国研制垂直结构“硅-石墨烯-锗晶体管”中所含C、Si、Ge均为主族元素
2. 下列化学用语或图示表达正确的是( )
A. HClO分子的VSEPR模型为直线形
B. 苯分子的空间填充模型:
C. 邻羟基苯甲醛分子内氢键示意图:
D. 过程中形成的是发射光谱
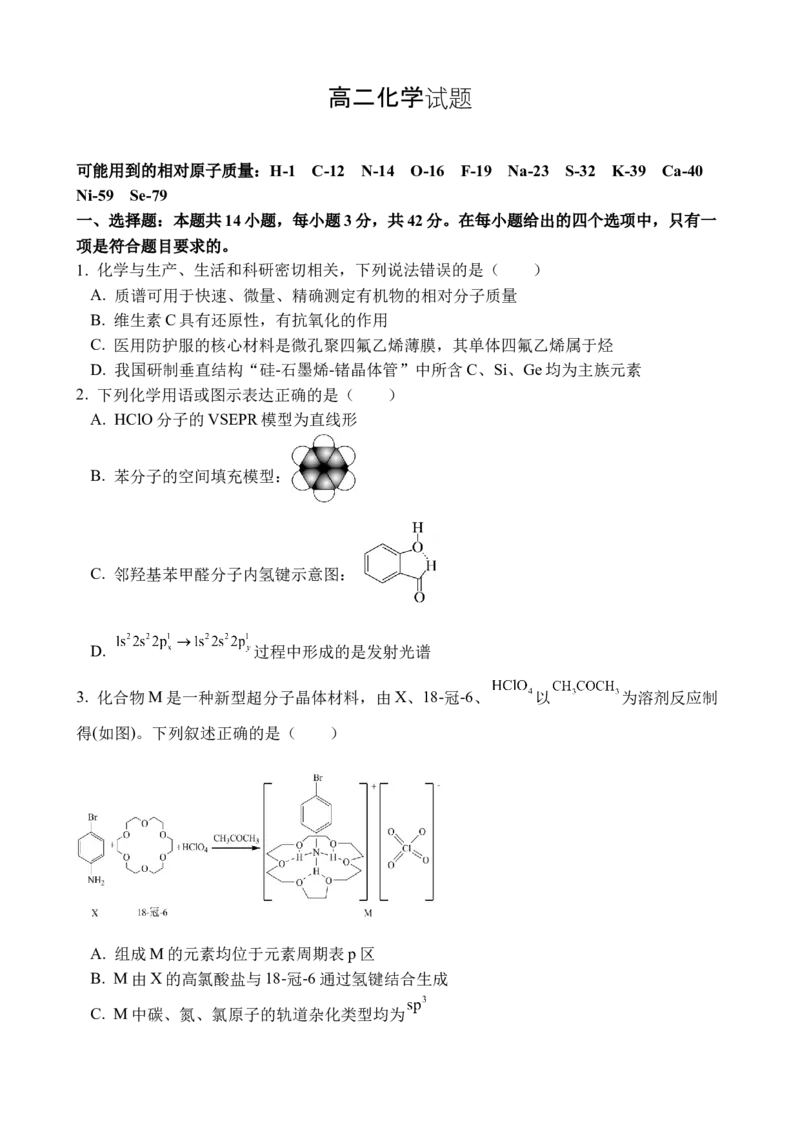
3. 化合物M是一种新型超分子晶体材料,由X、18-冠-6、 以 为溶剂反应制
得(如图)。下列叙述正确的是( )
A. 组成M的元素均位于元素周期表p区
B. M由X的高氯酸盐与18-冠-6通过氢键结合生成
C. M中碳、氮、氯原子的轨道杂化类型均为D. M的晶体类型为分子晶体
4.设 为阿伏加德罗常数的值。下列说法正确的是( )
A. 羟基 所含的电子数为
B. 溶液中, 的数目为
C. 中共价键的数目为
D. 标准状况下, 分子中含有的分子数目为
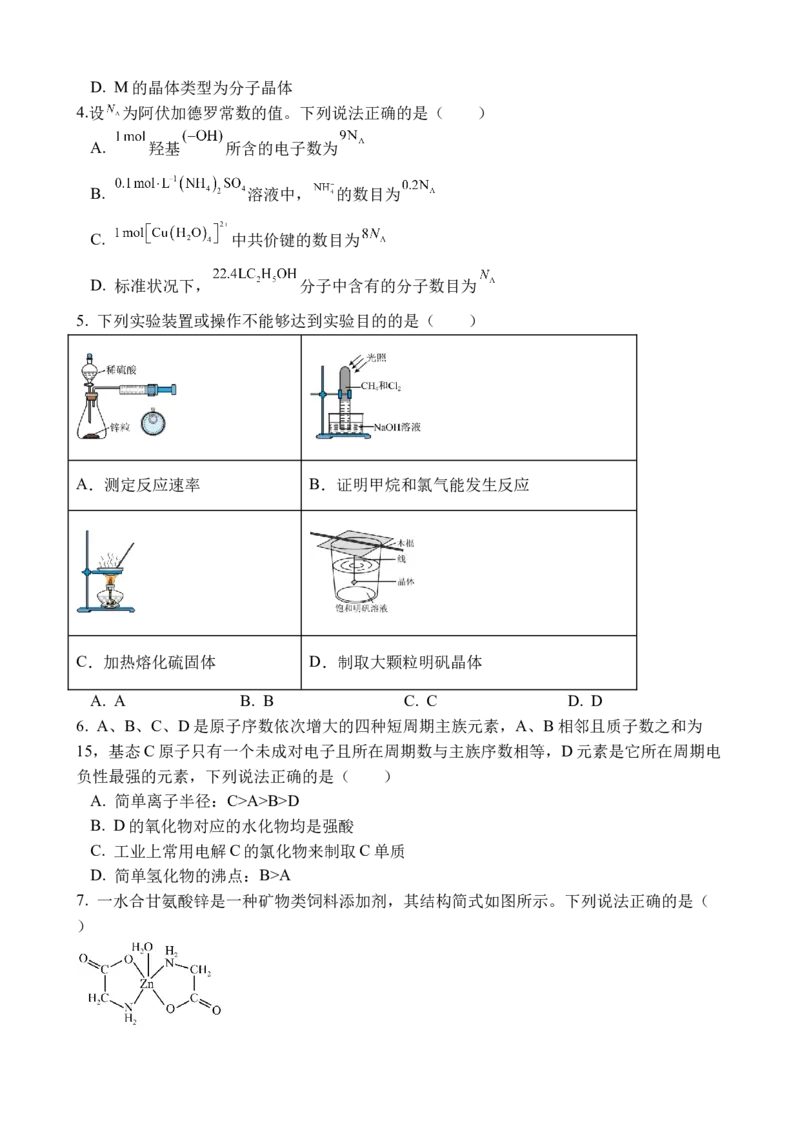
5. 下列实验装置或操作不能够达到实验目的的是( )
A.测定反应速率 B.证明甲烷和氯气能发生反应
C.加热熔化硫固体 D.制取大颗粒明矾晶体
A. A B. B C. C D. D
6. A、B、C、D是原子序数依次增大的四种短周期主族元素,A、B相邻且质子数之和为
15,基态C原子只有一个未成对电子且所在周期数与主族序数相等,D元素是它所在周期电
负性最强的元素,下列说法正确的是( )
A. 简单离子半径:C>A>B>D
B. D的氧化物对应的水化物均是强酸
C. 工业上常用电解C的氯化物来制取C单质
D. 简单氢化物的沸点:B>A
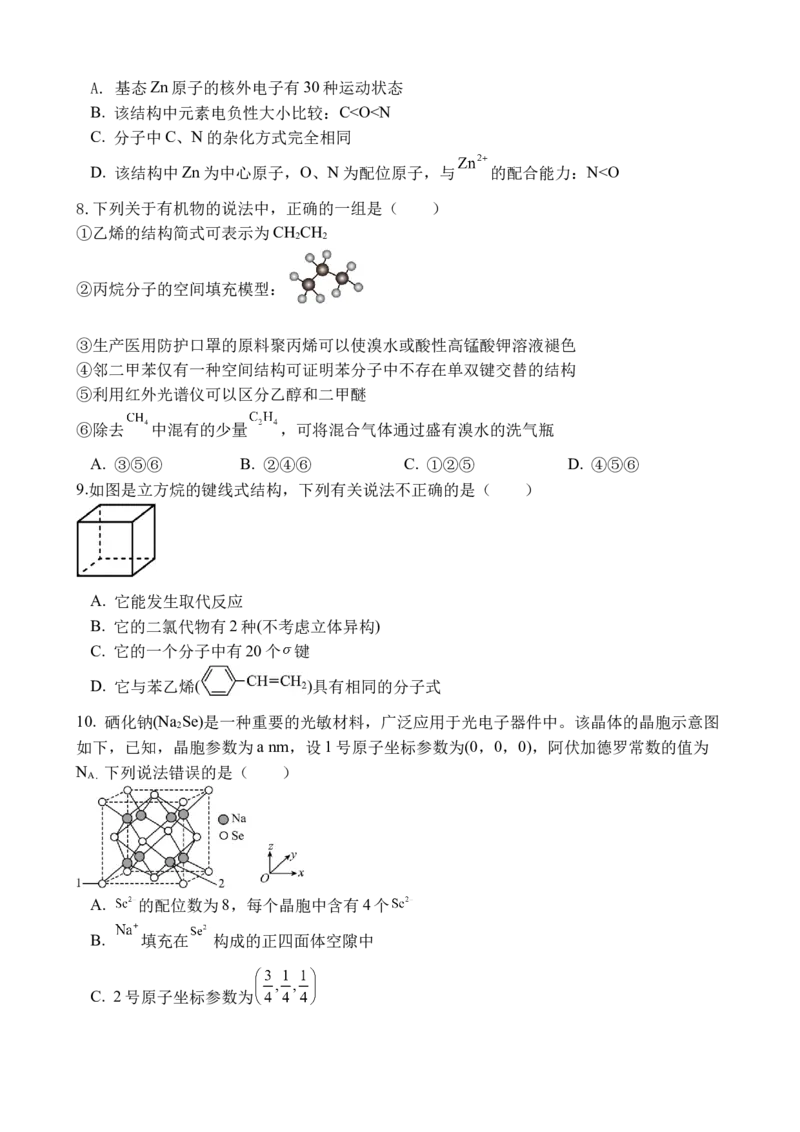
7. 一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法正确的是(
)A. 基态Zn原子的核外电子有30种运动状态
B. 该结构中元素电负性大小比较:C”“<”
1 1 1
或“=”)I (Cu)。
1
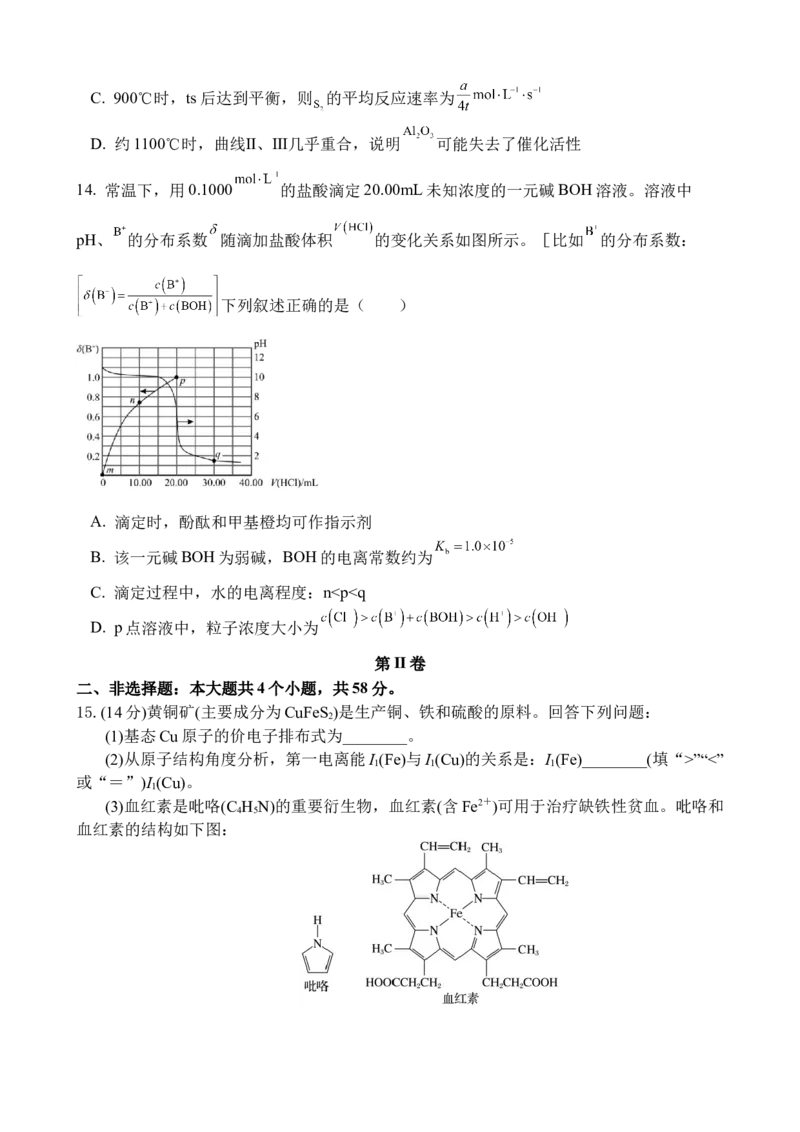
(3)血红素是吡咯(C H N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和
4 5
血红素的结构如下图:①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为________。
②1 mol吡咯分子中所含的σ键总数为________个。分子中的大π键可用Π表示,其中m
代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表
示为________。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
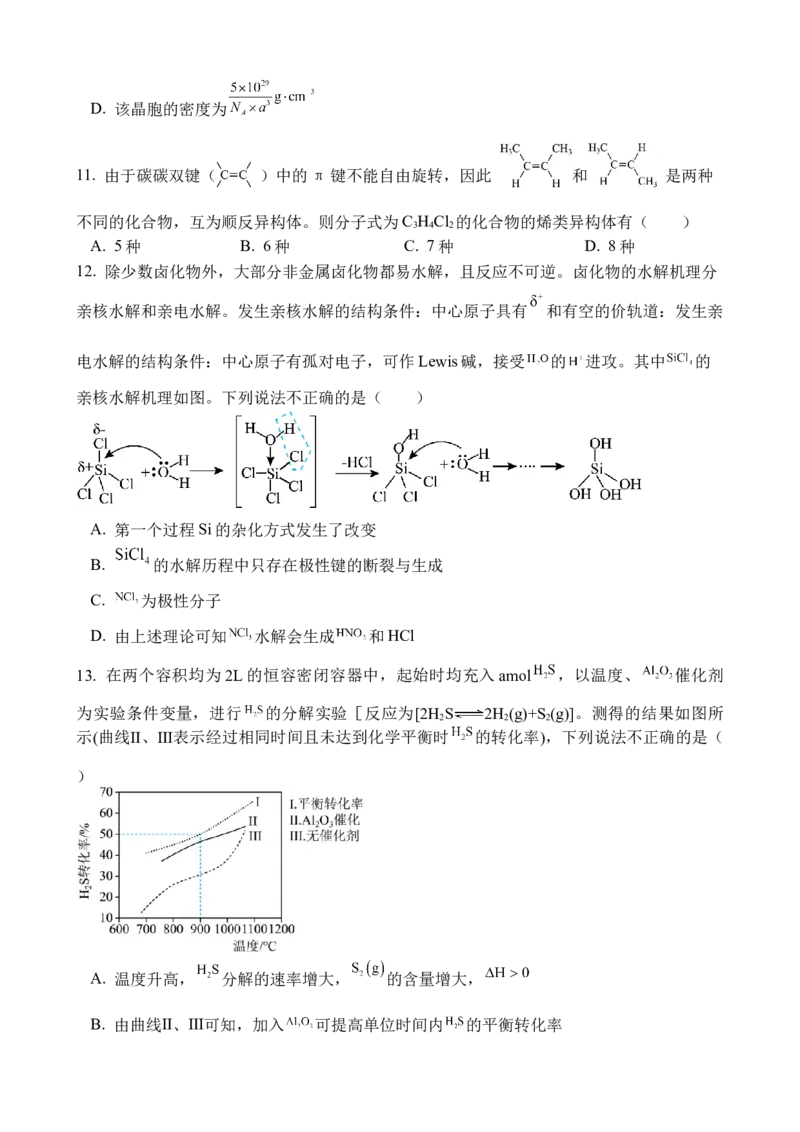
(4)黄铜矿冶炼铜时产生的 SO 可经过SO →SO →H SO 途径形成酸雨。SO 的空间构型
2 2 3 2 4 2
为________。H SO 的酸性强于H SO 的原因是________________________________。
2 4 2 3
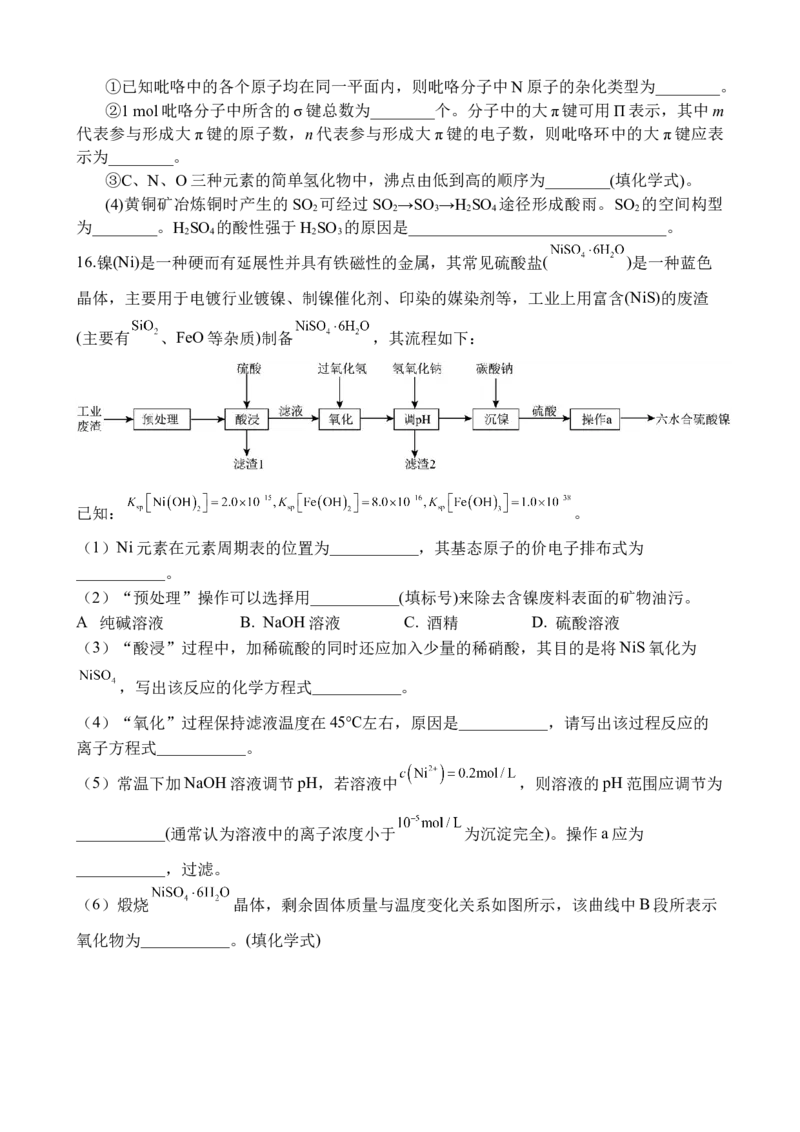
16.镍(Ni)是一种硬而有延展性并具有铁磁性的金属,其常见硫酸盐( )是一种蓝色
晶体,主要用于电镀行业镀镍、制镍催化剂、印染的媒染剂等,工业上用富含(NiS)的废渣
(主要有 、FeO等杂质)制备 ,其流程如下:
已知: 。
(1)Ni元素在元素周期表的位置为___________,其基态原子的价电子排布式为
___________。
(2)“预处理”操作可以选择用___________(填标号)来除去含镍废料表面的矿物油污。
.
A 纯碱溶液 B. NaOH溶液 C. 酒精 D. 硫酸溶液
(3)“酸浸”过程中,加稀硫酸的同时还应加入少量的稀硝酸,其目的是将NiS氧化为
,写出该反应的化学方程式___________。
(4)“氧化”过程保持滤液温度在45℃左右,原因是___________,请写出该过程反应的
离子方程式___________。
(5)常温下加NaOH溶液调节pH,若溶液中 ,则溶液的pH范围应调节为
___________(通常认为溶液中的离子浓度小于 为沉淀完全)。操作a应为
___________,过滤。
(6)煅烧 晶体,剩余固体质量与温度变化关系如图所示,该曲线中B段所表示
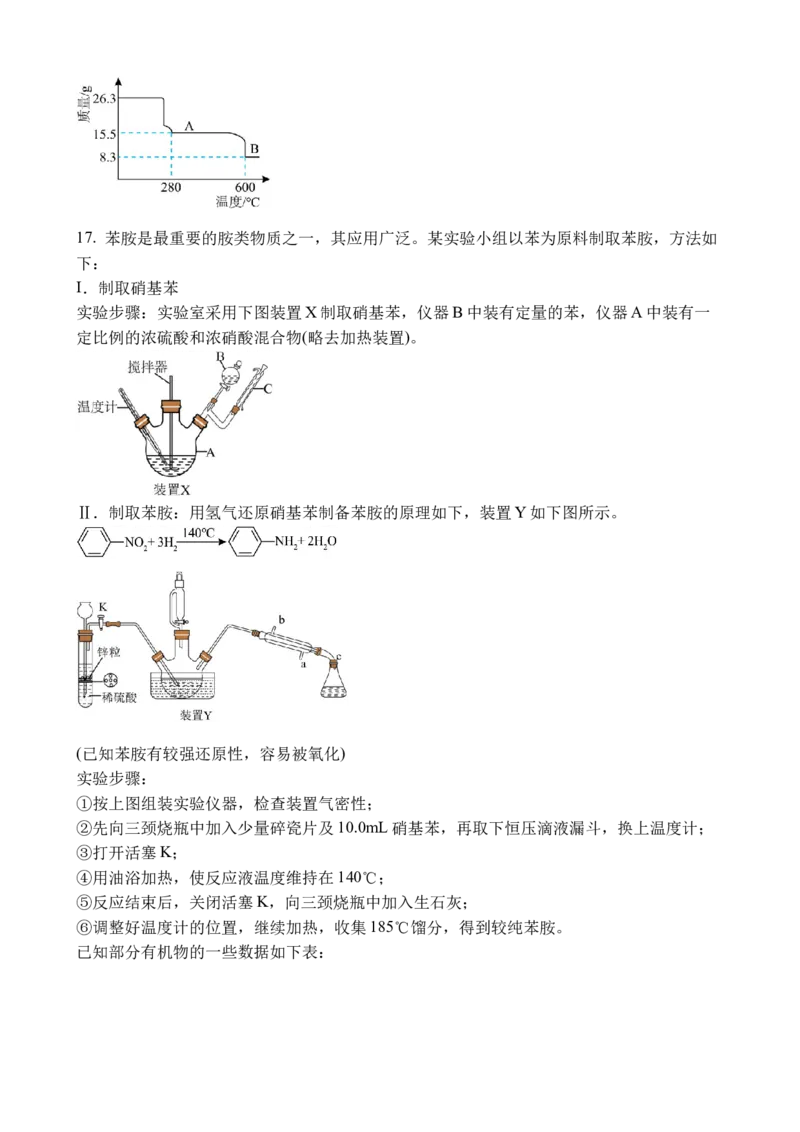
氧化物为___________。(填化学式)17. 苯胺是最重要的胺类物质之一,其应用广泛。某实验小组以苯为原料制取苯胺,方法如
下:
I.制取硝基苯
实验步骤:实验室采用下图装置X制取硝基苯,仪器B中装有定量的苯,仪器A中装有一
定比例的浓硫酸和浓硝酸混合物(略去加热装置)。
Ⅱ.制取苯胺:用氢气还原硝基苯制备苯胺的原理如下,装置Y如下图所示。
(已知苯胺有较强还原性,容易被氧化)
实验步骤:
①按上图组装实验仪器,检查装置气密性;
②先向三颈烧瓶中加入少量碎瓷片及10.0mL硝基苯,再取下恒压滴液漏斗,换上温度计;
③打开活塞K;
④用油浴加热,使反应液温度维持在140℃;
⑤反应结束后,关闭活塞K,向三颈烧瓶中加入生石灰;
⑥调整好温度计的位置,继续加热,收集185℃馏分,得到较纯苯胺。
已知部分有机物的一些数据如下表:名称 相对分子质量 密度( ) 沸点(℃)
硝基苯 123 1.23 210.8
苯胺 93 1.02 184.4
请回答下列问题:
(1)装置X中仪器C的名称是___________,其作用是___________。
(2)请写出该实验制取硝基苯的化学方程式:___________。
(3)制得的粗硝基苯不纯,用 溶液洗涤可除去___________。
(4)装置Y有一个明显的缺点是___________。
(5)步骤②中温度计水银球的位置位于___________(填序号,下同),步骤⑥中位于
___________。
A.烧瓶内溶液液面以下 B.贴近烧瓶内液面处 C.三颈烧瓶出气口附近
(6)若实验中步骤③和④的顺序颠倒,则实验中可能产生的不良后果是___________。
(7)实验结束得到7.44g产物,则苯胺的产率为___________。
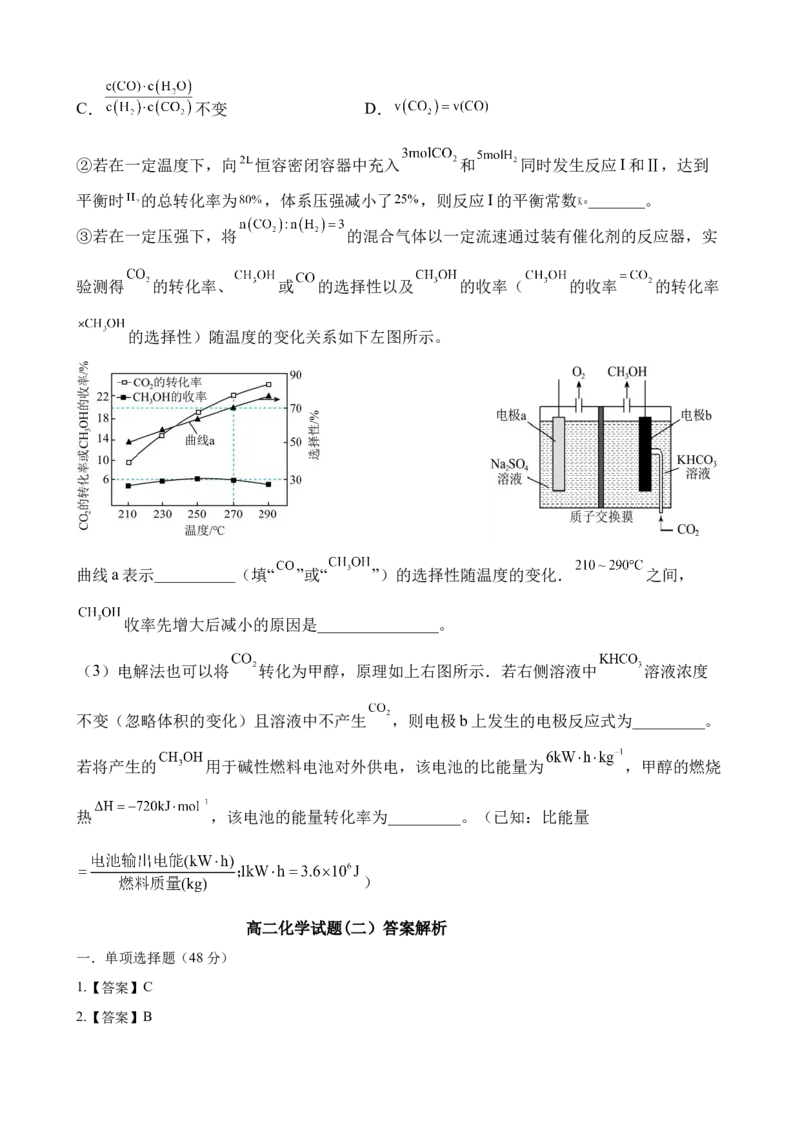
18. 的转化利用对化解全球环境生态危机,实现全球碳达峰和碳中和有着重要的意义。
(1)以 为催化剂的光热化学循环可以分解 .已知气态分子化学键完全断裂时的能量
变化如图所示,则 分解生成 和 的热化学方程式为_______________ 。
(2) 催化加氢可以合成甲醇,该过程主要发生下列反应:
I.CO (g)+3H (g) CH OH(g)+H O(g) ∆H =-58.6kJ·mol-1
2 2 3 2 1
Ⅱ.CO (g)+H (g) CO(g)+H O(g) ∆H =+41.2kJ·mol-1
2 2 2 2
①若在绝热条件下,将 按体积比 充入恒容密闭容器中只发生反应Ⅱ,下列能
判断反应Ⅱ达到平衡状态的是_________。
A.容器内混合气体的密度不变 B.容器内混合气体的压强不变C. 不变 D.
②若在一定温度下,向 恒容密闭容器中充入 和 同时发生反应I和Ⅱ,达到
平衡时 的总转化率为 ,体系压强减小了 ,则反应I的平衡常数 _______。
③若在一定压强下,将 的混合气体以一定流速通过装有催化剂的反应器,实
验测得 的转化率、 或 的选择性以及 的收率( 的收率 的转化率
的选择性)随温度的变化关系如下左图所示。
曲线a表示__________(填“ ”或“ ”)的选择性随温度的变化. 之间,
收率先增大后减小的原因是_______________。
(3)电解法也可以将 转化为甲醇,原理如上右图所示.若右侧溶液中 溶液浓度
不变(忽略体积的变化)且溶液中不产生 ,则电极b上发生的电极反应式为_________。
若将产生的 用于碱性燃料电池对外供电,该电池的比能量为 ,甲醇的燃烧
热 ,该电池的能量转化率为_________。(已知:比能量
)
高二化学试题(二)答案解析
一.单项选择题(48分)
1.【答案】C
2.【答案】B3.【答案】B
4.【答案】A
5. 【答案】B
6. 【解析】
7. 【答案】A
8.【答案】D
9.【答案】B
10. 【答案】D
11. 【答案】C
12. 【答案】D
13. 【答案】C
14. 【答案】B
15. (14分)【答案】(1)3d104s1 (2分) (2)> (2分)
(3)①sp2 (1分) ②10N (2分) Π (2分) ③CH