文档内容
南阳一中高二年级 2025 年秋期第一次月考
化学学科试题
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cu 64 Fe 56 Cl 35.5
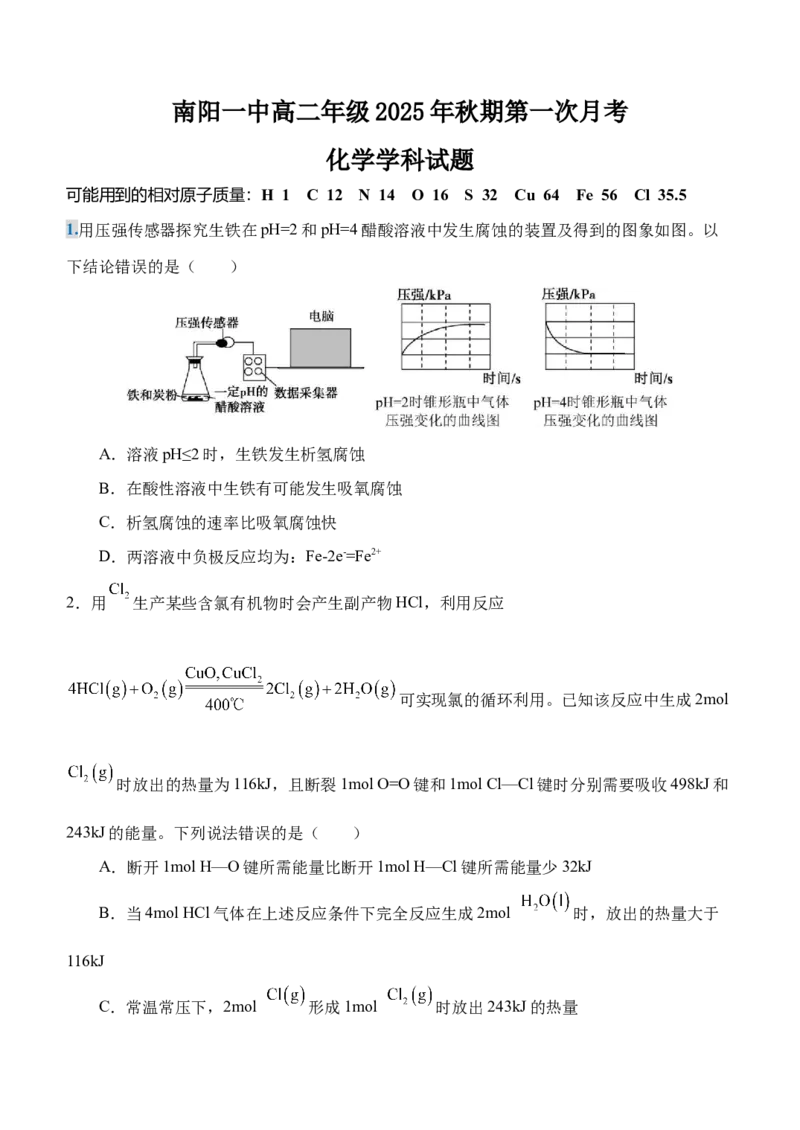
1.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如图。以
下结论错误的是( )
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁有可能发生吸氧腐蚀
C.析氢腐蚀的速率比吸氧腐蚀快
D.两溶液中负极反应均为:Fe-2e-=Fe2+
2.用 生产某些含氯有机物时会产生副产物HCl,利用反应
可实现氯的循环利用。已知该反应中生成2mol
时放出的热量为116kJ,且断裂1mol O=O键和1mol Cl—Cl键时分别需要吸收498kJ和
243kJ的能量。下列说法错误的是( )
A.断开1mol H—O键所需能量比断开1mol H—Cl键所需能量少32kJ
B.当4mol HCl气体在上述反应条件下完全反应生成2mol 时,放出的热量大于
116kJ
C.常温常压下,2mol 形成1mol 时放出243kJ的热量D.上述反应条件下,4mol 和1mol 的总能量高于2mol 和2mol
的总能量
3.下列实验操作、现象和解释或结论都正确的是
选
实验操作 现象 解释或结论
项
密闭容器中氢气和碘蒸气等物质
A 颜色加深 平衡右移
的量反应,压缩容器容积
向两支盛有等浓度、等体积
的催化效果比
B 的试管中分别加入等浓度、等体 前者产生气泡的速率快
好
积的 溶液和 溶液
等体积、等物质的量浓度的
温度高的溶液中先出现浑 温度升高,该反应
C 与 溶液在不同温
浊 速率加快
度下反应
向两份5mL0.1 草酸溶液
加入0.2 的酸性高 反应物浓度越大,
D 中,分别滴加0.1 和0.2
锰酸钾溶液褪色快 反应速率越快
的酸性高锰酸钾溶液2mL
4.已知分解 放出热量98kJ,在含少量 的溶液中, 的分解分两步:
i. 慢反应 ii. 快反应
下列有关反应的说法正确的是( )
A.
B.反应i比反应ii的活化能小
C. 分解速率与 的浓度无关 D.
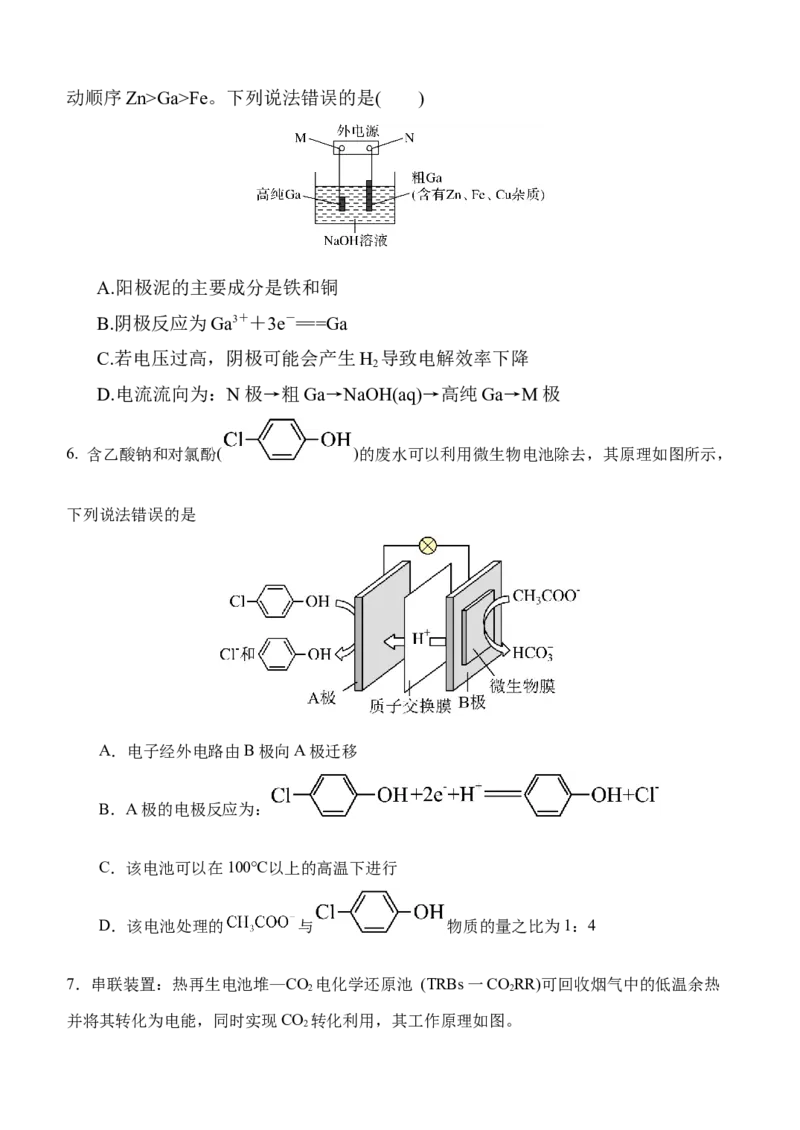
5.镓的化学性质与铝相似,电解精炼法提纯镓(Ga)的原理如图所示。已知:金属活动顺序Zn>Ga>Fe。下列说法错误的是( )
A.阳极泥的主要成分是铁和铜
B.阴极反应为Ga3++3e-===Ga
C.若电压过高,阴极可能会产生H 导致电解效率下降
2
D.电流流向为:N极→粗Ga→NaOH(aq)→高纯Ga→M极
6. 含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如图所示,
下列说法错误的是
A.电子经外电路由B极向A极迁移
B.A极的电极反应为:
C.该电池可以在100℃以上的高温下进行
D.该电池处理的 与 物质的量之比为1:4
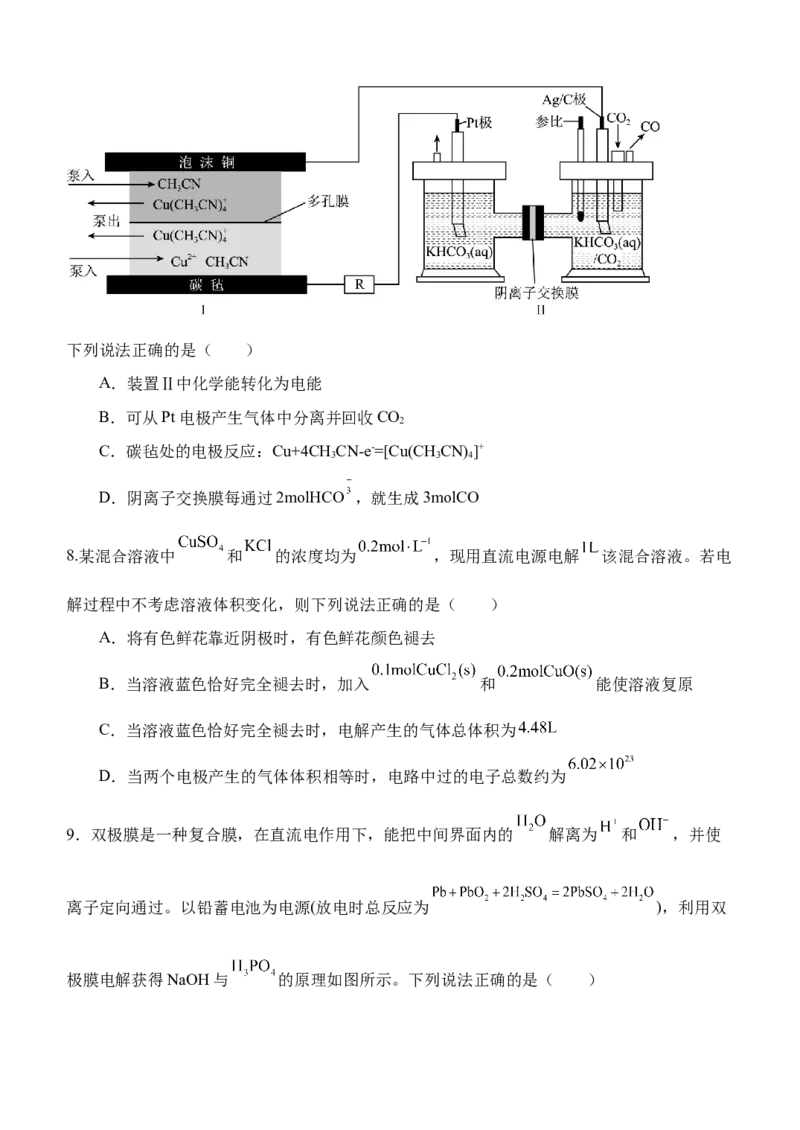
7.串联装置:热再生电池堆—CO 电化学还原池 (TRBs一CORR)可回收烟气中的低温余热
2 2
并将其转化为电能,同时实现CO 转化利用,其工作原理如图。
2下列说法正确的是( )
A.装置Ⅱ中化学能转化为电能
B.可从Pt电极产生气体中分离并回收CO
2
C.碳毡处的电极反应:Cu+4CH CN-e-=[Cu(CH CN) ]+
3 3 4
D.阴离子交换膜每通过2molHCO ,就生成3molCO
8.某混合溶液中 和 的浓度均为 ,现用直流电源电解 该混合溶液。若电
解过程中不考虑溶液体积变化,则下列说法正确的是( )
A.将有色鲜花靠近阴极时,有色鲜花颜色褪去
B.当溶液蓝色恰好完全褪去时,加入 和 能使溶液复原
C.当溶液蓝色恰好完全褪去时,电解产生的气体总体积为
D.当两个电极产生的气体体积相等时,电路中过的电子总数约为
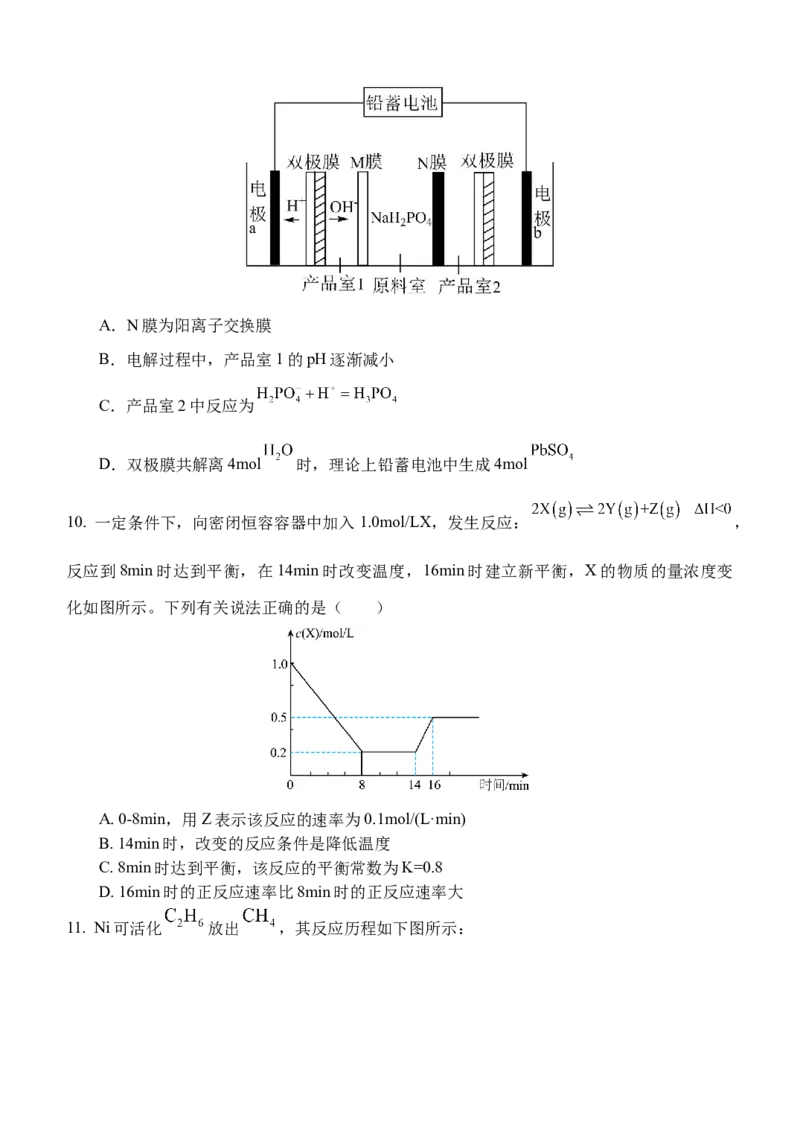
9.双极膜是一种复合膜,在直流电作用下,能把中间界面内的 解离为 和 ,并使
离子定向通过。以铅蓄电池为电源(放电时总反应为 ),利用双
极膜电解获得NaOH与 的原理如图所示。下列说法正确的是( )A.N膜为阳离子交换膜
B.电解过程中,产品室1的pH逐渐减小
C.产品室2中反应为
D.双极膜共解离4mol 时,理论上铅蓄电池中生成4mol
10. 一定条件下,向密闭恒容容器中加入1.0mol/LX,发生反应: ,
反应到8min时达到平衡,在14min时改变温度,16min时建立新平衡,X的物质的量浓度变
化如图所示。下列有关说法正确的是( )
A. 0-8min,用Z表示该反应的速率为0.1mol/(L·min)
B. 14min时,改变的反应条件是降低温度
C. 8min时达到平衡,该反应的平衡常数为K=0.8
D. 16min时的正反应速率比8min时的正反应速率大
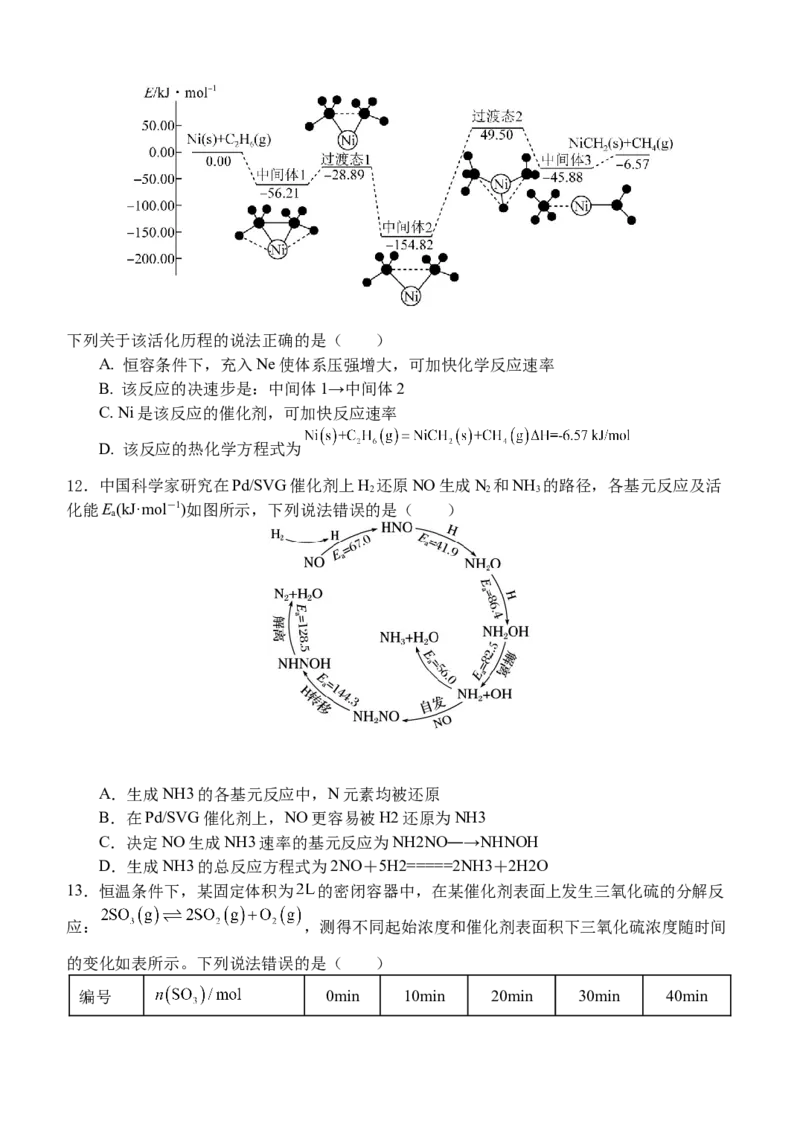
11. Ni可活化 放出 ,其反应历程如下图所示:下列关于该活化历程的说法正确的是( )
A. 恒容条件下,充入Ne使体系压强增大,可加快化学反应速率
B. 该反应的决速步是:中间体1→中间体2
C. Ni是该反应的催化剂,可加快反应速率
D. 该反应的热化学方程式为
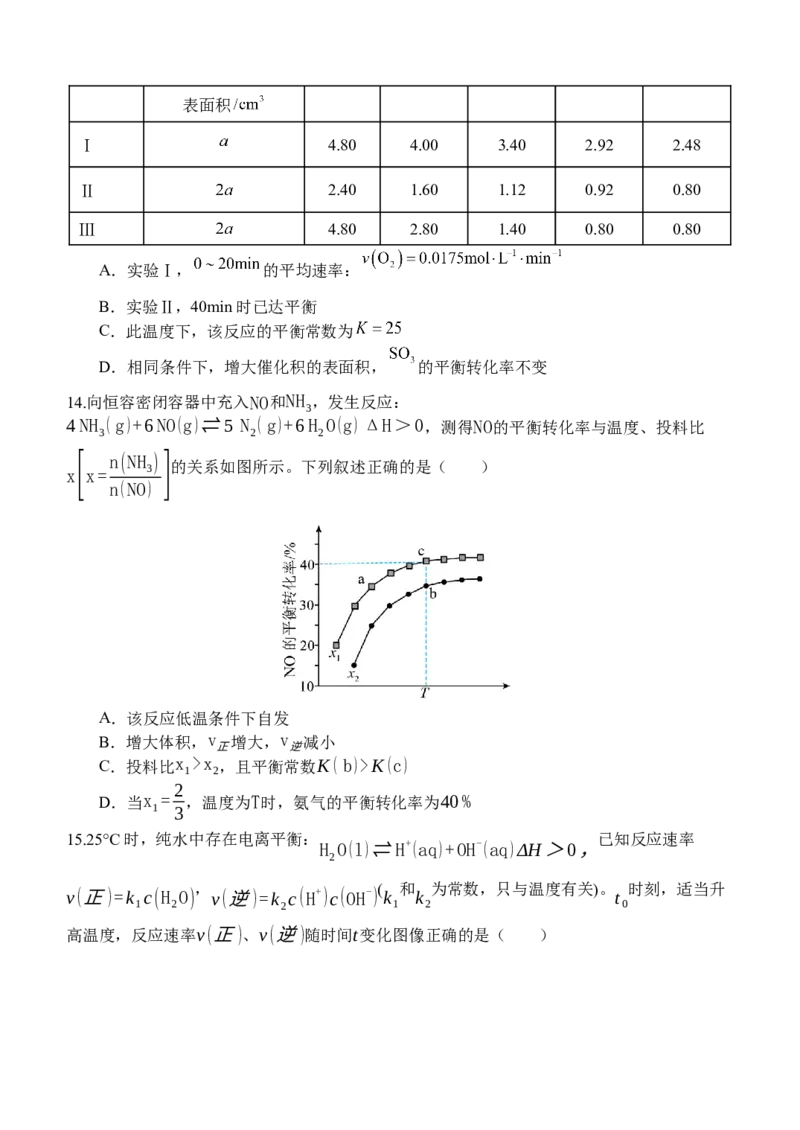
12.中国科学家研究在Pd/SVG催化剂上H 还原NO生成N 和NH 的路径,各基元反应及活
2 2 3
化能E(kJ·mol-1)如图所示,下列说法错误的是( )
a
A.生成NH3的各基元反应中,N元素均被还原
B.在Pd/SVG催化剂上,NO更容易被H2还原为NH3
C.决定NO生成NH3速率的基元反应为NH2NO―→NHNOH
D.生成NH3的总反应方程式为2NO+5H2=====2NH3+2H2O
13.恒温条件下,某固定体积为 的密闭容器中,在某催化剂表面上发生三氧化硫的分解反
应: ,测得不同起始浓度和催化剂表面积下三氧化硫浓度随时间
的变化如表所示。下列说法错误的是( )
编号 0min 10min 20min 30min 40min表面积
Ⅰ 4.80 4.00 3.40 2.92 2.48
Ⅱ 2.40 1.60 1.12 0.92 0.80
Ⅲ 4.80 2.80 1.40 0.80 0.80
A.实验Ⅰ, 的平均速率:
B.实验Ⅱ,40min时已达平衡
C.此温度下,该反应的平衡常数为
D.相同条件下,增大催化积的表面积, 的平衡转化率不变
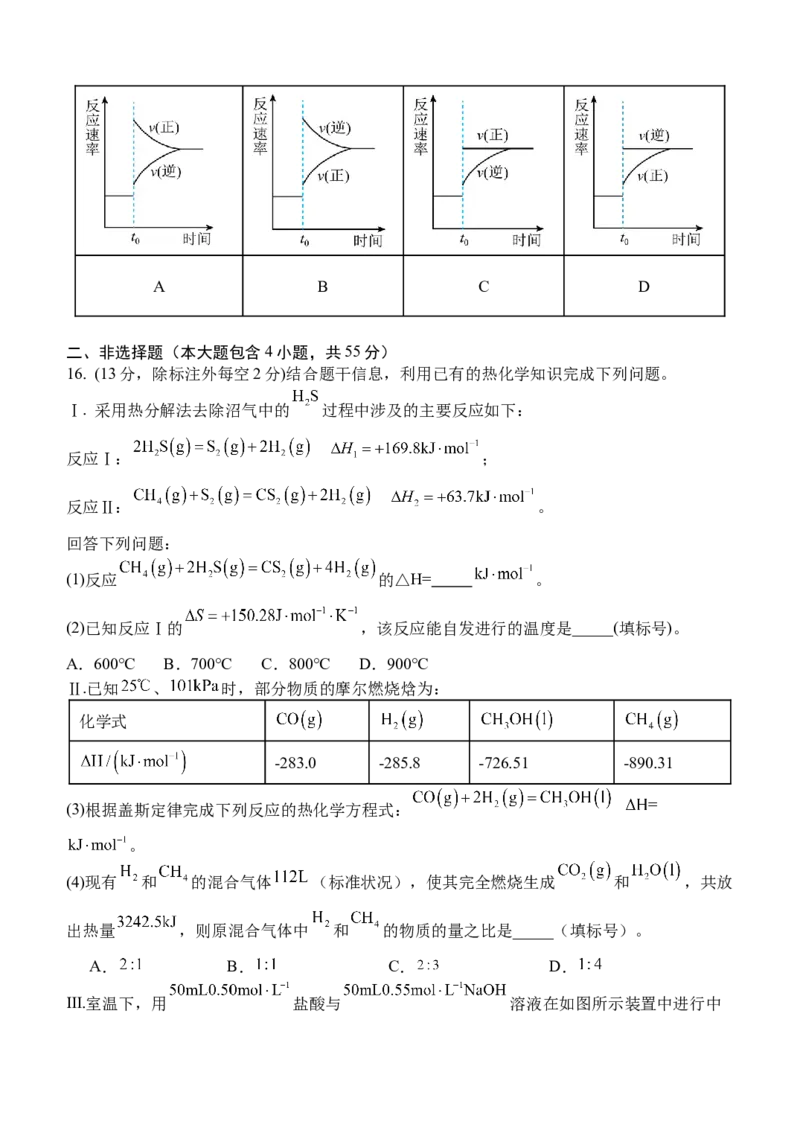
14.向恒容密闭容器中充入NO和NH ,发生反应:
3
4NH ( g)+6NO(g)⇌5 N ( g)+6H O(g) ΔH>0,测得NO的平衡转化率与温度、投料比
3 2 2
[ n(NH )]的关系如图所示。下列叙述正确的是( )
x x= 3
n(NO)
A.该反应低温条件下自发
B.增大体积,v 增大,v 减小
正 逆
C.投料比x >x ,且平衡常数K( b)>K(c)
1 2
2
D.当x = ,温度为T时,氨气的平衡转化率为40%
1 3
15.25°C时,纯水中存在电离平衡: 已知反应速率
H O(l)⇌H+ (aq)+OH- (aq)ΔH>0,
2
v(正)=k c(H O) , v(逆)=k c(H+)c(OH-) ( k 和 k 为常数,只与温度有关)。 t 时刻,适当升
1 2 2 1 2 0
高温度,反应速率v(正)、v(逆)随时间t变化图像正确的是( )A B C D
二、非选择题(本大题包含4小题,共55分)
16. (13分,除标注外每空2分)结合题干信息,利用已有的热化学知识完成下列问题。
Ⅰ. 采用热分解法去除沼气中的 过程中涉及的主要反应如下:
反应Ⅰ: ;
反应Ⅱ: 。
回答下列问题:
(1)反应 的△H= 。
(2)已知反应Ⅰ的 ,该反应能自发进行的温度是_____(填标号)。
A.600℃ B.700℃ C.800℃ D.900℃
Ⅱ.已知 、 时,部分物质的摩尔燃烧焓为:
化学式
-283.0 -285.8 -726.51 -890.31
(3)根据盖斯定律完成下列反应的热化学方程式:
。
(4)现有 和 的混合气体 (标准状况),使其完全燃烧生成 和 ,共放
出热量 ,则原混合气体中 和 的物质的量之比是_____(填标号)。
A. B. C. D.
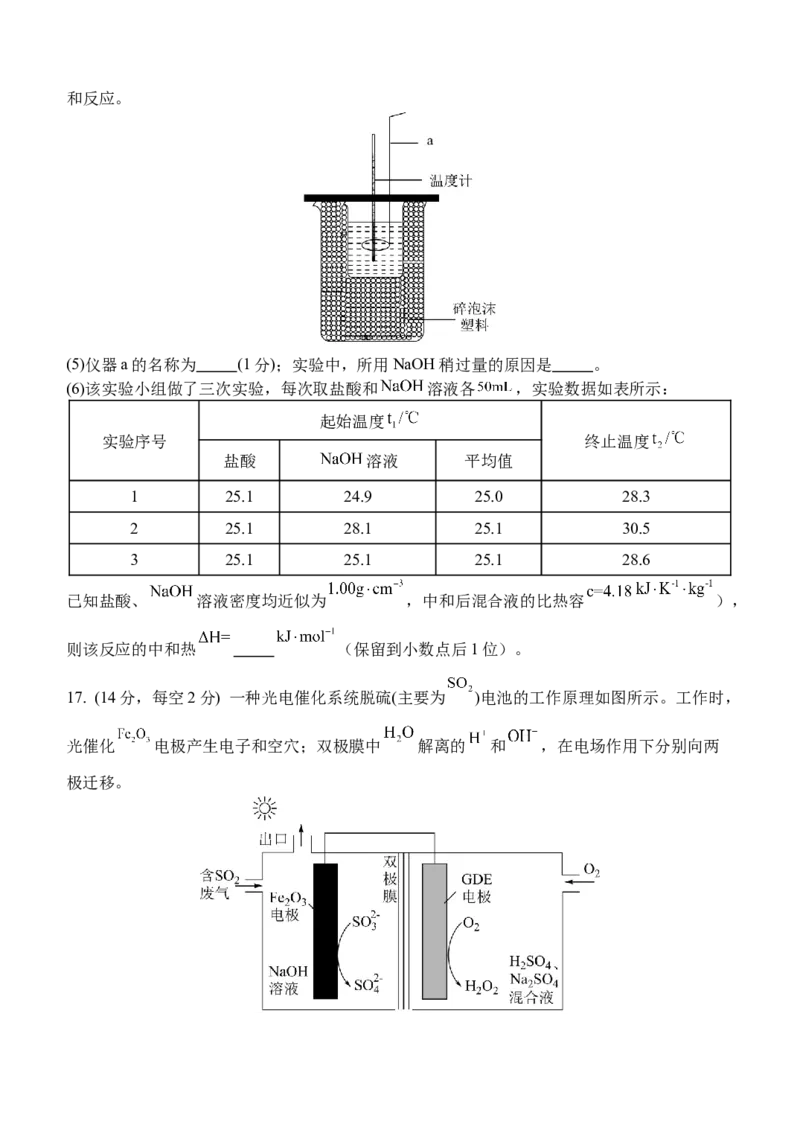
Ⅲ.室温下,用 盐酸与 溶液在如图所示装置中进行中和反应。
(5)仪器a的名称为 (1分);实验中,所用NaOH稍过量的原因是 。
(6)该实验小组做了三次实验,每次取盐酸和 溶液各 ,实验数据如表所示:
起始温度
实验序号 终止温度
盐酸 溶液 平均值
1 25.1 24.9 25.0 28.3
2 25.1 28.1 25.1 30.5
3 25.1 25.1 25.1 28.6
已知盐酸、 溶液密度均近似为 ,中和后混合液的比热容 ),
则该反应的中和热 (保留到小数点后1位)。
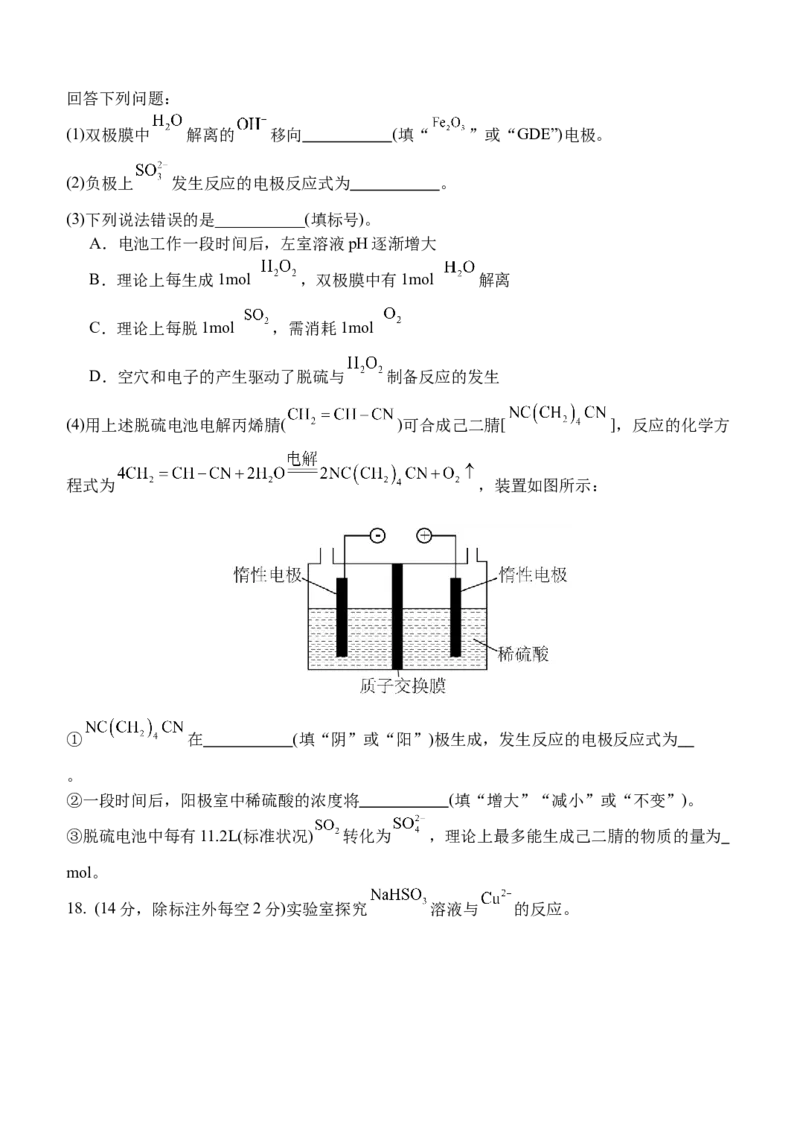
17. (14分,每空2分) 一种光电催化系统脱硫(主要为 )电池的工作原理如图所示。工作时,
光催化 电极产生电子和空穴;双极膜中 解离的 和 ,在电场作用下分别向两
极迁移。回答下列问题:
(1)双极膜中 解离的 移向 (填“ ”或“GDE”)电极。
(2)负极上 发生反应的电极反应式为 。
(3)下列说法错误的是___________(填标号)。
A.电池工作一段时间后,左室溶液pH逐渐增大
B.理论上每生成1mol ,双极膜中有1mol 解离
C.理论上每脱1mol ,需消耗1mol
D.空穴和电子的产生驱动了脱硫与 制备反应的发生
(4)用上述脱硫电池电解丙烯腈( )可合成己二腈[ ],反应的化学方
程式为 ,装置如图所示:
① 在 (填“阴”或“阳”)极生成,发生反应的电极反应式为
。
②一段时间后,阳极室中稀硫酸的浓度将 (填“增大”“减小”或“不变”)。
③脱硫电池中每有11.2L(标准状况) 转化为 ,理论上最多能生成己二腈的物质的量为
mol。
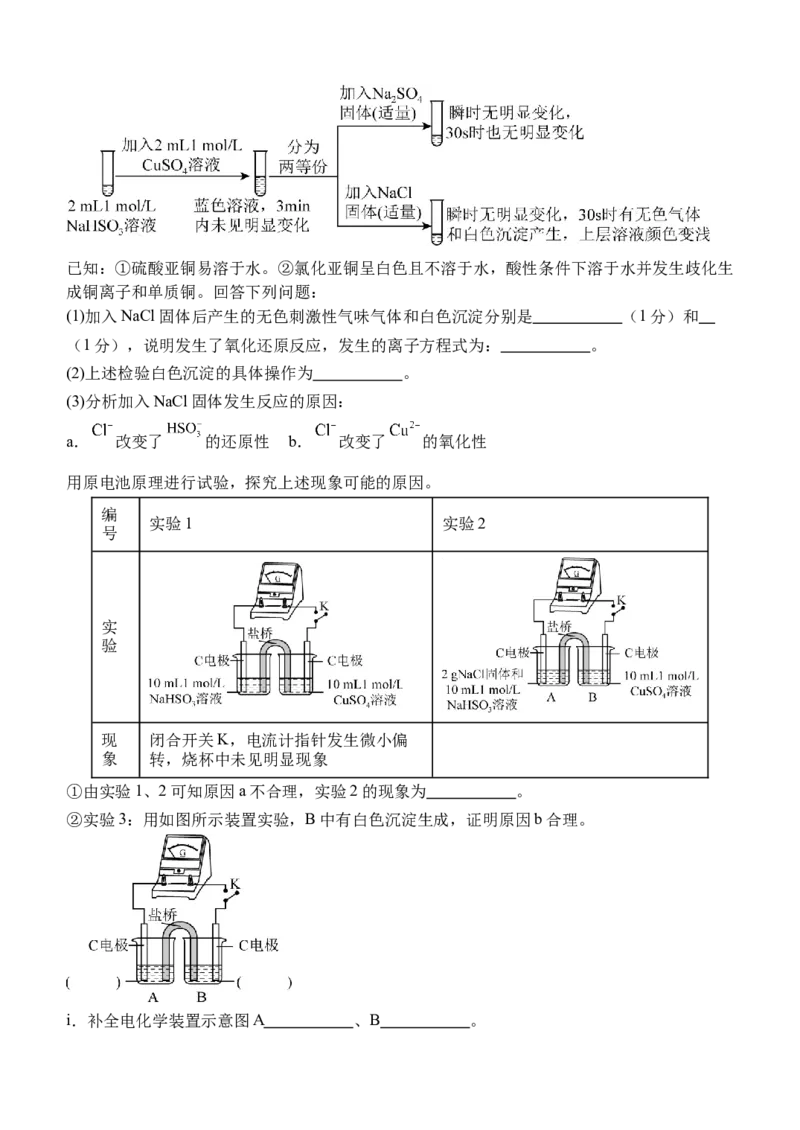
18. (14分,除标注外每空2分)实验室探究 溶液与 的反应。已知:①硫酸亚铜易溶于水。②氯化亚铜呈白色且不溶于水,酸性条件下溶于水并发生歧化生
成铜离子和单质铜。回答下列问题:
(1)加入NaCl固体后产生的无色刺激性气味气体和白色沉淀分别是 (1分)和
(1分),说明发生了氧化还原反应,发生的离子方程式为: 。
(2)上述检验白色沉淀的具体操作为 。
(3)分析加入NaCl固体发生反应的原因:
a. 改变了 的还原性 b. 改变了 的氧化性
用原电池原理进行试验,探究上述现象可能的原因。
编
实验1 实验2
号
实
验
现 闭合开关K,电流计指针发生微小偏
象 转,烧杯中未见明显现象
①由实验1、2可知原因a不合理,实验2的现象为 。
②实验3:用如图所示装置实验,B中有白色沉淀生成,证明原因b合理。
i.补全电化学装置示意图A 、B 。ii.写出B中的电极反应方程式 。
19.(14分,每空2分)SO 是形成酸雨的主要气体,减少SO 的排放和研究SO 综合利用意
2 2 2
义重大。回答下列问题:
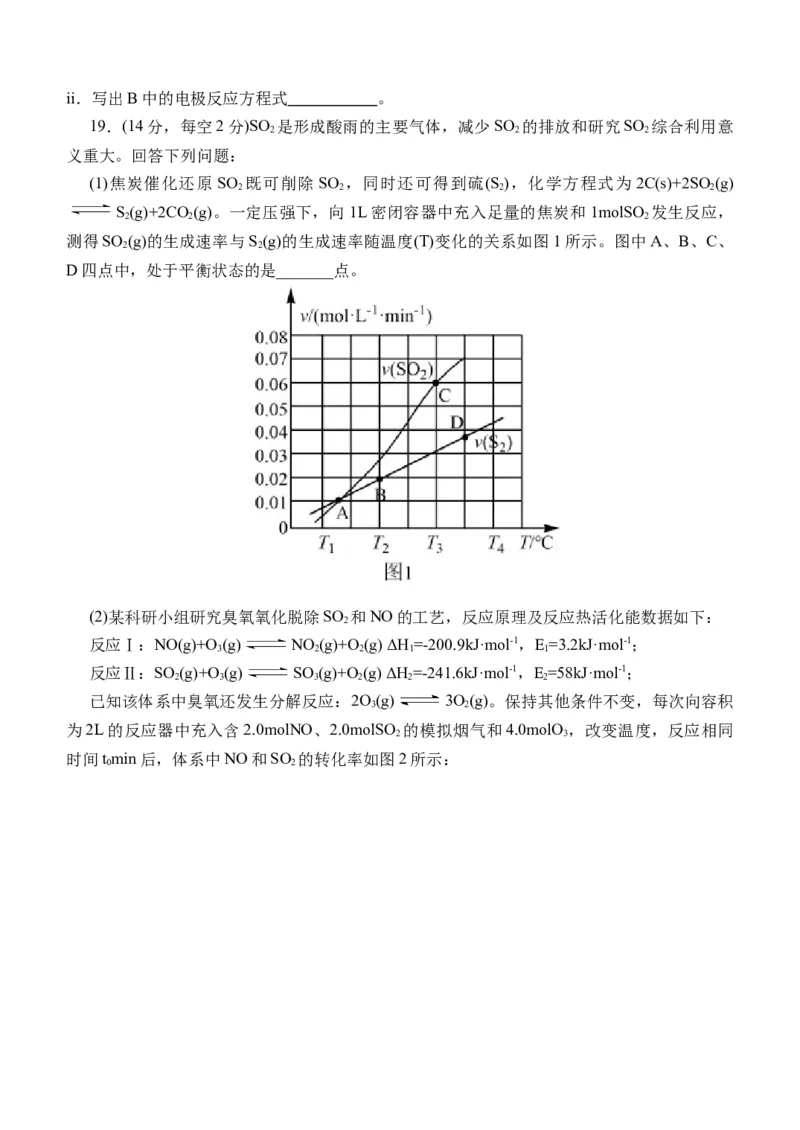
(1)焦炭催化还原SO 既可削除SO ,同时还可得到硫(S ),化学方程式为2C(s)+2SO (g)
2 2 2 2
S(g)+2CO (g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO 发生反应,
2 2 2
测得SO (g)的生成速率与S(g)的生成速率随温度(T)变化的关系如图1所示。图中A、B、C、
2 2
D四点中,处于平衡状态的是_______点。
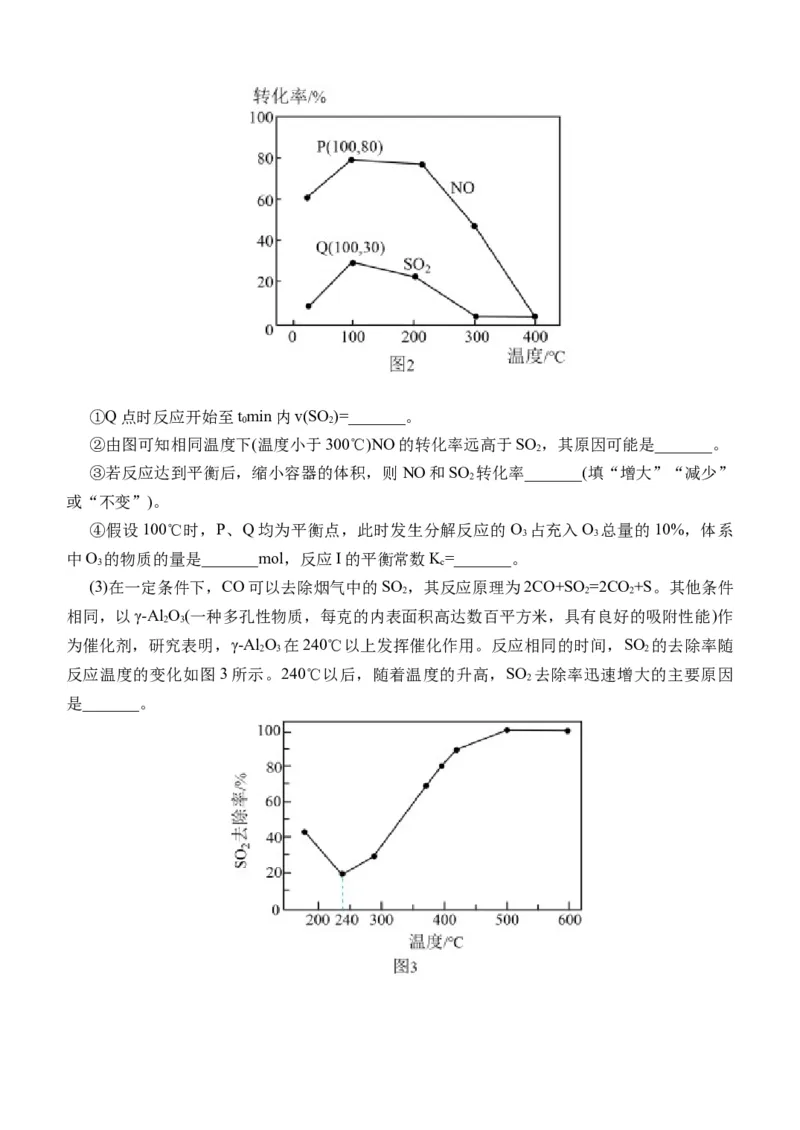
(2)某科研小组研究臭氧氧化脱除SO 和NO的工艺,反应原理及反应热活化能数据如下:
2
反应Ⅰ:NO(g)+O (g) NO (g)+O(g) ΔH =-200.9kJ·mol-1,E=3.2kJ·mol-1;
3 2 2 1 1
反应Ⅱ:SO (g)+O(g) SO (g)+O(g) ΔH =-241.6kJ·mol-1,E=58kJ·mol-1;
2 3 3 2 2 2
已知该体系中臭氧还发生分解反应:2O(g) 3O(g)。保持其他条件不变,每次向容积
3 2
为2L的反应器中充入含2.0molNO、2.0molSO 的模拟烟气和4.0molO ,改变温度,反应相同
2 3
时间tmin后,体系中NO和SO 的转化率如图2所示:
0 2①Q点时反应开始至tmin内v(SO )=_______。
0 2
②由图可知相同温度下(温度小于300℃)NO的转化率远高于SO ,其原因可能是_______。
2
③若反应达到平衡后,缩小容器的体积,则NO和SO 转化率_______(填“增大”“减少”
2
或“不变”)。
④假设100℃时,P、Q均为平衡点,此时发生分解反应的O 占充入O 总量的10%,体系
3 3
中O 的物质的量是_______mol,反应I的平衡常数K=_______。
3 c
(3)在一定条件下,CO可以去除烟气中的SO ,其反应原理为2CO+SO =2CO +S。其他条件
2 2 2
相同,以γ-Al O(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作
2 3
为催化剂,研究表明,γ-Al O 在240℃以上发挥催化作用。反应相同的时间,SO 的去除率随
2 3 2
反应温度的变化如图3所示。240℃以后,随着温度的升高,SO 去除率迅速增大的主要原因
2
是_______。